Efficacité et sécurité de l’aspirine en prévention primaire d’événements cardiovasculaires pour les patients diabétiques : Étude ASCEND
Isabelle Baron1,2,3*, Pharm.D., M.Sc., Anik Henderson1,4,5*, Pharm.D., M.Sc., Laurence Loiselle1,6,7*, Pharm.D., M.Sc., Julie Méthot8,9,10, B.Pharm., Ph.D.
1Candidate à la maîtrise en pharmacothérapie avancée au moment de la rédaction, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
2Résidente en pharmacie au moment de la rédaction, Centre intégré de santé et de services sociaux de la Montérégie-Centre, Hôpital Charles-LeMoyne, Greenfield Park (Québec) Canada;
3Pharmacienne, Centre intégré de santé et des services sociaux Montérégie-Centre, Hôpital Charles-LeMoyne, Greenfield Park (Québec) Canada;
4Résidente en pharmacie au moment de la rédaction, Centre intégré universitaire de santé et de services sociaux de l’Est-de-l’Île-de-Montréal, Hôpital Maisonneuve-Rosemont, Montréal (Québec) Canada;
5Pharmacienne, Centre intégré de santé et des services sociaux Montérégie-Ouest, Hôpital du Suroît, Salaberry-de-Valleyfield (Québec) Canada;
6Résidente en pharmacie au moment de la rédaction, Centre universitaire de santé McGill, Montréal (Québec) Canada;
7Pharmacienne, Centre universitaire de santé McGill, Montréal (Québec) Canada;
8Professeure agrégée, Faculté de pharmacie, Université Laval, Québec (Québec) Canada;
9Pharmacienne et chercheure associée, Institut universitaire de cardiologie et de pneumologie de Québec-Université Laval, Québec (Québec) Canada;
10Rédactrice adjointe, Pharmactuel, Montréal (Québec) Canada
Reçu le 13 mai 2019: Accepté après révision par les pairs le 22 novembre 2019
Titre de l’article : Effects of aspirin for primary prevention in persons with diabetes mellitus, the ASCEND study collaborative group. N Engl J Med 2018;379:1529-391.
Auteurs : Bowman L, Mafham M, Wallendszus K, Stevens W, Buck G, Barton J et coll. pour le groupe collaboratif ASCEND.
Commanditaires: Cette étude a été financée par la British Heart Foundation. Bayer a fourni l’acide acétylsalicylique (AAS), le placebo et une compensation pour l’emballage. Solvay, Abbott et Mylan ont aussi participé au financement du second volet de cette étude factorielle. Bayer et Mylan ont émis leurs commentaires sur la première ébauche du manuscrit, mais n’ont pas participé à la collecte, à l’analyse, à l’interprétation des données ni à la soumission pour publication.
Cadre de l’étude : Le diabète s’accompagne d’une augmentation du risque cardiovasculaire. Le risque d’hospitalisation pour cause cardiovasculaire d’une personne diabétique est trois fois plus élevé que celui d’une personne non diabétique2. L’AAS a démontré des avantages clairs en prévention secondaire d’événements cardiovasculaires3. Toutefois, en prévention primaire, il n’est pas certain si l’avantage surpasse le risque associé aux saignements. Dans une méta-analyse portant sur 95 000 patients exposés à risque cardiovasculaire faible, l’Antithrombotic Trialist’s Collaboration (ATC) a montré une réduction de 12 % des événements cardiovasculaires (infarctus du myocarde, accident vasculaire cérébral [AVC] ou mort vasculaire) ainsi qu’une augmentation de 50 % du risque de saignements majeurs4. Il existe aussi une hypothèse voulant que les patients diabétiques aient développé une résistance aux antiplaquettaires, ce qui conduit à une diminution des avantages sans diminution du risque de saignements5. Par ailleurs, une autre méta-analyse conclut à une réduction du risque de cancer ou de décès par cancer de 15 à 20 % avec de faibles doses d’AAS et à une réduction de 30 à 40 % des cancers gastro-intestinaux pendant un suivi allant jusqu’à 20 ans6,7.
En raison du peu de données sur les avantages de l’AAS pour une population exposée à un risque cardiovasculaire faible à modéré, la résistance possible aux antiplaquettaires, le risque de saignements et la possible réduction de risque de cancer, un doute est toujours présent quant à la balance entre les risques et les avantages liés à ce traitement.
Protocole de recherche : L’étude ASCEND est prospective, à répartition aléatoire, contrôlée contre placebo et à double insu. À la suite de la publication de l’ATC, le protocole initial a été modifié pour augmenter la taille de l’échantillon de 10 000 à 15 000 patients et le suivi de 5 à 7,5 ans afin de pouvoir mesurer l’objectif principal d’efficacité. Les participants potentiels ont été déterminés à partir de registres régionaux de diabète et auprès de médecins de famille. Un questionnaire leur a été acheminé pour évaluer leur admissibilité. Ceux répondant aux critères d’inclusion et d’exclusion qui désiraient participer à l’étude ont rempli et retourné le questionnaire. Des stratifications ont été réalisées en fonction de l’âge, du sexe, de la durée depuis le diagnostic de diabète, des antécédents d’hypertension, du statut tabagique, de l’origine ethnique et, quand elles étaient disponibles, des mesures de la pression artérielle, du cholestérol total, de l’hémoglobine glyquée (HbA1c) et du ratio urinaire albumine/créatinine. L’analyse de l’objectif primaire a été réalisée en intention de traiter et en analyse de survie.
Patients : Les patients devaient être âgés d’au moins 40 ans et répondre aux critères d’inclusion suivants: diagnostic de diabète type I ou II, aucune maladie cardiovasculaire connue, incertitude substantielle sur l’avantage associé à l’utilisation de l’AAS. Les principaux critères d’exclusion étaient une indication claire de prendre de l’AAS, une contre-indication à l’AAS ou une condition clinique significative pouvant limiter l’adhésion.
Interventions : Les participants ont été répartis aléatoirement selon un ratio 1:1 en deux groupes parallèles, soit le groupe traité avec l’AAS à 100 mg et le groupe placebo. Une évaluation de l’admissibilité a été effectuée auprès de 121 254 personnes. Refus de participer (66 498), non-admissibilité (14 451), questionnaire incomplet (2465) et cible de recrutement atteinte (11 378) sont les raisons d’exclusion. Une période d’essai avant la répartition aléatoire a ensuite été effectuée avec 26 242 sujets durant huit à dix semaines. Après cette période, 10 982 sujets ont été exclus, principalement en raison de leur refus de poursuivre (5345) ou du questionnaire qu’ils n’avaient pas retourné (2832). Ensuite, les 15 480 personnes admissibles ont été réparties aléatoirement à un des groupes suivants (3870 patients chacun) : AAS active et oméga-3 actif, AAS actif et oméga-3 placebo, AAS placebo et oméga-3 actif, AAS placebo et oméga-3 placebo. Des analyses pour les patients sous AAS actif ou placebo ont été effectuées dans le cadre de cette publication. L’intervention avec les oméga-3 est discutée dans un autre article8.
Points évalués : L’objectif primaire d’efficacité était la survenue du premier événement vasculaire grave (infarctus du myocarde non fatal, AVC non fatal, accident ischémique transitoire [AIT], élément ajouté après un amendement au protocole ou mort de cause vasculaire, excluant les saignements intracrâniens confirmés). L’objectif primaire de sécurité était la survenue du premier saignement majeur (hémorragie intracrânienne, saignement oculaire menaçant la vision, saignement gastro-intestinal ou tout autre saignement nécessitant une hospitalisation, une transfusion ou ayant causé la mort). Les objectifs secondaires étaient la survenue d’événement vasculaire sérieux ou une intervention de revascularisation artérielle ainsi que la survenue de cancer gastro-intestinal. La confirmation des événements était faite à l’aveugle.
Résultats : L’étude a été réalisée sur 15 480 participants au Royaume-Uni entre juin 2005 et juillet 2011. Le suivi de 99,1 % des participants de l’étude a été mené à terme et a duré en moyenne 7,4 ans. Deux groupes similaires ont été obtenus au moyen de la répartition aléatoire. Les participants étaient majoritairement des hommes (63 %), dont l’âge moyen était de 63 ans et un indice de masse corporelle moyen de 30 kg/m2. Il faut noter que 5508 participants (35,6 %) prenaient activement de l’AAS avant de participer à l’étude. Ces patients ont été admis à la répartition aléatoire vu l’incertitude de leur médecin traitant au sujet des avantages qu’ils retiraient de ce traitement. De plus, environ 75 % des patients utilisaient une statine. L’HbA1c au début de l’étude était de 7,2 ± 1,2 % et le risque cardiovasculaire, c’est-à-dire le risque d’événement vasculaire grave prédit à cinq ans et déterminé par les auteurs à partir d’une régression Poisson, était faible, soit inférieur à 5 % (40 %) ou modéré entre 5 et 10 % (42 %) pour plus de 80 % des participants9. Finalement, 94,1 % des participants souffraient de diabète de type II depuis en moyenne sept ans.
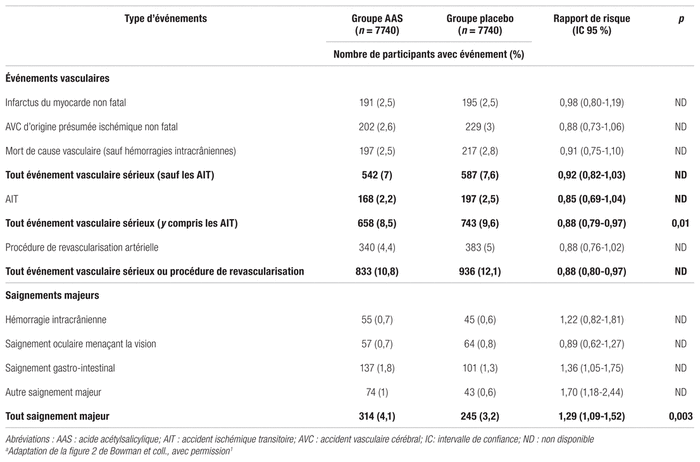
Concernant l’objectif primaire d’efficacité, la survenue d’évènements vasculaires était significativement moindre dans le groupe AAS par rapport au groupe placebo (rapport de risques [RR]: 0,88; intervalle de confiance à 95 % [IC 95 %]: 0,79–0,97, p = 0,01). Quant à l’objectif primaire de sécurité, on remarque une augmentation significative du risque absolu de saignement majeur de 0,9 % parmi les participants du groupe AAS comparativement au groupe placebo (RR: 1,29; IC 95 %: 1,09–1,52, p = 0,003). Le nombre de sujets à traiter pour prévenir un événement cardiovasculaire majeur est de 91 et le nombre de sujets à traiter pour causer un saignement est de 111. Les analyses exploratoires n’ont pas montré de différences significatives pour les objectifs secondaires. Les résultats sont présentés au tableau I.
Tableau I Effets de l’AAS sur les événements vasculaires et les saignements majeursa
Grille d’évaluation critique


Discussion
L’étude ASCEND a démontré que l’AAS en prévention primaire pour les diabétiques de 40 ans et plus sans antécédents cardiovasculaires diminue les événements cardiovasculaires et augmente le risque de saignements. Avec les résultats obtenus, il est possible d’observer une légère baisse du risque d’événements cardiovasculaires avec l’usage d’AAS en prévention primaire pour les diabétiques. Ces avantages avaient été observés dans l’étude ARRIVE dans une cohorte de patients exposés à un risque cardiovasculaire modéré et ils s’expliquent en partie par les multiples mesures pharmacologiques et non pharmacologiques qui sont prises10. Les avantages observés dans ASCEND sont contrebalancés par l’augmentation du risque de saignements, comme cela a été démontré dans ASPREE où aucun avantage cardiovasculaire significatif de l’AAS n’a été démontré pour les patients de 70 ans ou plus11.
La prise d’anti-inflammatoires non stéroïdiens et l’usage d’inhibiteurs de la pompe à protons (IPP) ont été pris en compte, sans précision sur la posologie et l’observance1. Les différences entre les groupes ont été limitées par la répatition aléatoire. À noter qu’environ un quart des participants seulement recevaient un IPP. Une utilisation plus importante d’IPP aurait pu diminuer le nombre de saignements répertoriés dans l’étude. Les antécédents de saignements, facteur important de risque de saignements, n’ont pas été comptabilisés. Quant à l’objectif secondaire concernant le risque de cancer, les résultats concordent avec ceux de la littérature scientifique. Dans une récente étude évaluant l’effet protecteur de l’AAS sur le cancer du poumon, les investigateurs concluent à une diminution du risque après cinq ans pour deux sous-populations, soit les personnes âgées et les personnes non diabétiques12.
Les résultats ne seraient pas applicables aux diabétiques de type I, ceux-ci étant peu représentés (5,8 %). Ils souffrent aussi généralement de la maladie depuis plus longtemps par rapport aux diabétiques de type II et ont donc un risque cardiovasculaire associé plus important13. De plus, l’usage concomitant d’autres classes de médicaments a seulement été évalué avant le début de l’étude et en moyenne après 6,7 ans de suivi. Comme plusieurs classes de médicaments peuvent diminuer le risque d’événements vasculaires parmi les patients diabétiques, il aurait été pertinent d’avoir une évaluation plus rigoureuse de l’usage concomitant de médicaments. Malgré tout, nous pouvons observer qu’environ 75 % des patients de chacun des groupes prenaient une statine autant au début de l’étude qu’après 6,7 ans. Environ 58 % des patients avaient un inhibiteur de l’enzyme de conversion de l’angiotensine ou un antagoniste des récepteurs de l’angiotensine II prescrit au début de l’étude comparativement à 63 % après 6,7 ans de suivi. Comme ces médicaments permettent de diminuer le risque d’événements cardiovasculaires, les patients de l’étude ASCEND étaient probablement exposés à un risque de base plus faible comparativement à des patients sans aucune comédication, ce qui limite la généralisation des résultats14. Par ailleurs, jusqu’à 10 % des patients du groupe placebo prenaient un antiplaquettaire après sept ans de suivi, ce qui pourrait diminuer la différence mesurée entre les groupes. L’arrêt de l’AAS par ceux qui en prenaient avant la répartition aléatoire pourrait avoir comme effet d’augmenter le nombre d’événements cardiovasculaires dans le groupe placebo de 28 % par rapport à ceux qui n’en auraient jamais pris, ce qui amplifierait les résultats d’efficacité de l’AAS15. L’avantage observé demeure donc faible, vu la réduction du risque cardiovasculaire potentiellement obtenue par le contrôle des autres facteurs de risque.
Il est également intéressant de mettre les résultats en perspective avec d’autres interventions en prévention primaire auprès des patients diabétiques. Par exemple, le nombre de patients à traiter pour prévenir un événement cardiovasculaire avec une statine est de 1516. Ce nombre est largement inférieur à celui observé dans l’étude ASCEND, soit 911. Ceci renforce l’intérêt à contrôler les autres facteurs de risque plutôt que d’utiliser l’AAS.
L’analyse des résultats de cette étude a été réalisée en intention de traiter. Ceci permet d’inclure tous les patients dans l’analyse des résultats. Toutefois, l’observance de chacun des groupes de l’étude a été estimée à 70 %. Cette méthode d’analyse a probablement sous-estimé les avantages et les risques liés à l’AAS, mais permet de prendre en considération l’observance réelle des patients.
La puissance de 60 % retenue des cancers gastro-intestinaux est faible par rapport à la puissance standard de 80 %17. Les cancers gastro-intestinaux étant assez prévalents, ceci n’explique pas la taille d’échantillon insuffisante pour une puissance de 80 %. En effet, environ 25 000 nouveaux cas ont été recensés au Canada, excluant le Québec, en 201618.
La validité interne de cette étude est plutôt bonne. Le nombre élevé de patients inclus ainsi que la longue durée de suivi a permis de détecter de petites différences entre les groupes. Les objectifs primaires composites mesurés étaient comparables aux autres études sur le sujet, et l’importance clinique de chaque élément des composites était comparable19,20. Les auteurs ont aussi évalué la diminution de cancers gastrointestinaux associés à l’AAS. Par contre, la durée du suivi relatif à cet objectif était trop courte, étant donné que les avantages de l’AAS pourraient apparaître et même augmenter après plusieurs années, soit pendant une vingtaine d’années6,7.
La validité externe de cette étude semble applicable au Canada avec une population caucasienne semblable à celle de l’étude. La dose étudiée dans l’étude ASCEND était de 100 mg par jour. Bien que la dose prescrite au Canada soit de 80 mg par jour, les résultats demeurent tout de même applicables étant donné qu’il s’agit de doses faibles avec un effet antiplaquettaire uniquement3. Il est donc possible d’extrapoler les résultats de cette étude à la dose d’AAS de 80 mg. Par contre, les patients inclus semblent avoir été sursélectionnés. La participation à cette étude se faisait sur une base volontaire et seuls les patients motivés et observants au traitement ont été inclus. Cette sursélection est constatée par le nombre de patients inclus dans l’étude (15 000) comparativement au nombre de patients contactés (120 000).
Les résultats donnent une meilleure idée des risques et des avantages de l’AAS, mais leur individualisation à chaque patient est importante et doit être associée à la prise en compte des risques de thrombose et de saignement. Une question demeure cependant, à savoir si un évènement thrombotique équivaut à un saignement en terme de gravité. Contrairement aux événements cardiovasculaires, les saignements peuvent habituellement être traités sans séquelle à long terme, mais ils peuvent aussi être fatals dans certains cas21.
Conclusion
L’étude ASCEND ne permet pas de recommander l’utilisation d’AAS à faible dose en prévention primaire d’événements cardiovasculaires à toutes les personnes diabétiques sans antécédents cardiaques connus. En effet, les faibles avantages de l’utilisation d’AAS pour cette population sont contre-balancés par les risques de saignements majeurs.
Financement
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Conflits d’intérêts
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Julie Méthot est rédactrice adjointe de Pharmactuel. Les autres auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Remerciements
Cet article a été rédigé dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université de Montréal. Les auteurs en remercient les responsables. Une autorisation écrite a été obtenue de ces personnes.
Références
1. Bowman L, Mafham M, Wallendszus K, Stevens W, Buck G, Barton J et coll. Effects of aspirin for primary prevention in persons with diabetes mellitus. N Engl J Med 2018;379:1529–39.


2. Diabetes Canada, 2019. Statistiques sur le diabète au Canada. [en ligne] https://www.diabetes.ca/how-you-can-help/advocate/pourquoi-un-leadership-federal-est-essentiel/statistiques-sur-le-diabete-au-canada (site visité le 4 janvier 2019).
3. Antithrombotic Trialists’ Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002;324:71–86.



4. Antithrombotic Trialists’ Collaboration. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet 2009;373:1849–60.



5. Eskandarian R, Razavi M, Fattah A, Ghods K, Forozeshfard M. Prevalence of aspirin resistance in patients with type II diabetes: a descriptive-analytical study. Int J Clin Pharmacol Ther 2017; 55:493–7.

6. Rothwell PM, Price JF, Fowkes FG, Zanchetti A, Roncaglioni MC, Tognoni G et coll. Short-term effects of daily aspirin on cancer incidence, mortality, and non-vascular death: analysis of the time course of risks and benefits in 51 randomised controlled trials. Lancet 2012;379: 1602–12.


7. Flossmann E, Rothwell PM. Effect of aspirin on long-term risk of colorectal cancer: consistent evidence from randomised and observational studies. Lancet 2007;369:1603–13.


8. The ASCEND Study Collaborative Group. Effects of n−3 fatty acid supplements in diabetes mellitus. N Engl J Med 2018;379:1540–50.

9. Bowman L, Mafham M, Stevens W, Haynes R, Aung T, Chen F et coll. ASCEND: A study of cardiovascular events in diabetes: characteristics of a randomized trial of aspirin and of omega-3 fatty acid supplementation in 15,480 people with diabetes. Am Heart J 2018;198:135–44.



10. Gaziano JM, Brotons C, Coppolecchia R, Cricelli C, Darius H, Gorelick PB et coll. Use of aspirin to reduce risk of initial vascular event in patients at moderate risk of cardiovascular disease (ARRIVE): a randomnised, double-blind, placebo-controlled trial. Lancet 2018;392: 1036–146.



11. McNeil JJ, Wolfe R, Woods RL, Tonkin AM, Donnan GA, Nelson MR et coll. Effect of aspirin on cardiovascular events and bleeding in the healthy elderly. N Engl J Med 2018;379:1509–18.



12. Ye S, Lee M, Lee D, Ha E, Chun E. Association of long-term use of low-dose aspirin as chemoprevention with risk of lung cancer. JAMA Network Open 2019;2:1–13.

13. de Ferranti S, de Boer I, Fonseca V, Fox C, Golden S, Lavie C et coll. Type 1 diabetes mellitus and cardiovascular disease. Circulation 2014;130:1110–30.


14. Anderson TJ, Gregoire J, Pearson GJ, Barry AR, Couture P, Dawes M et coll. 2016 Canadian cardiovascular society guidelines for the management of dyslipidemia for the prevention of cardiovascular disease in the adult. Can J Cardiol 2016;32:1263–82.


15. Sundstrom J, Hedberg J, Thuresson M, Aarskog P, Johanessen KM, Oldgren J. Low-dose aspirin discontinuation and risk of cardiovascular events: a Swedish a nationwide, population-based study. Circulation 2017;136:1183–92.

16. Colhoun HM, Betteridge J, Durrington PN, Hitman GA, Neil AW, Livingstone SJ et coll. Primary prevention of cardiovascular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicentre randomised placebo-controlled trial. Lancet 2004;364:685–96.


17. Baron J, Cole B, Sandler R, Haile R, Ahnen D, Bresalier R et coll. A randomized trial of aspirin to prevent colorectal adenomas. N Engl J Med 2003;348:891–9.


18. Statistics Canada. Table 13-10-0111-0: Number and rates of new cases of primary cancer, by cancer type, age group and sex. [en ligne] https://www150.statcan.gc.ca/t1/tbl1/en/cv.action?pid=1310011101#timeframe (site visité le 26 avril 2019).
19. Guirguis-Blake JM, Evans CV, Senger CA, O’Connor EA, Whitlock EP. Aspirin for the primary prevention of cardiovascular events: a systematic evidence review for the U.S. Preventive Services Task Force. Ann Intern Med 2016; 164:804–13.


20. Whitlock EP, Burda BU, Williams SB, Guirguis-Blake JM, Evans CV. Bleeding risks with aspirin use for primary prevention in adults: a systematic review for the U.S. Preventive Services Task Force. Ann Intern Med 2016;164:826–35.


21. Aoki T, Nagata N, Niikura R, Shimbo T, Tanaka S, Sekine K et coll. Recurrence and mortality among patients hospitalized for acute lower gastrointestinal bleeding. Clin Gastroenterol Hepatol 2015;13:488–94.

Pour toute correspondance: Anik Henderson, Centre intégré de santé et des services sociaux Montérégie-Ouest, Hôpital du Suroît, 150, rue St-Thomas, Salaberry-de-Valleyfield (Québec) J6T 6C1, CANADA; Téléphone: 450 601-2146; Courriel: anik_henderson@hotmail.com
*Isabelle Baron, Anik Henderson et Laurence Loiselle ont contribué de façon équivalente à la rédaction de cet article (
Return to Text
)
(Return to Top)
PHARMACTUEL, Vol. 53, No. 2, 2020





