
Raphaëlle Boutin1,2,3, Pharm.D., M.Sc., Vincent Leclerc4,5, B.Pharm, M.Sc., Nathalie Châteauvert6,7, B.Sc., B.Pharm, M.Sc.
Reçu le 23 juillet 2019: Accepté après révision le 17 octobre 2019
Résumé
Objectif : Vérifier l’efficacité et la sécurité à court terme du passage du PrografMD au Sandoz TacrolimusMD pour les patients ayant subi une greffe cardiaque.
Mise en contexte : À l’Institut universitaire de cardiologie et de pneumologie de Québec, la médication de 10 patients greffés cardiaques est passée du PrografMD au Sandoz TacrolimusMD. Un suivi hebdomadaire de la fonction rénale et du dosage de tacrolimus a été effectué pendant trois semaines après cette conversion. Une fois le changement effectué, on a procédé à une comparaison des dosages de tacrolimus et de la fonction rénale. Les données ont été recueillies de façon rétrospective.
Résultats : Le creux moyen de tacrolimus était de 8,3 ± 2,5 μg/L avant la conversion et de 8,8 ± 2,0 μg/L après la conversion, soit une augmentation de 10,6 ± 31,5 % (p = 0,80). Le creux moyen a augmenté chez six patients et diminué chez quatre patients. Ces variations ont entrainé deux hausses et deux diminutions de dose. Le débit de filtration glomérulaire estimé est resté stable, puisqu’il est passé de 65 ± 14 mL/min/1,73 m2 à 67 ± 19 mL/min/1,73m2. Le débit de filtration de deux patients a augmenté de plus de 5 % et celui de deux autres patients a diminué de plus de 5 %.
Conclusion : Le passage du PrografMD au Sandoz TacrolimusMD est sécuritaire à court terme et efficace pour maintenir des dosages de tacrolimus adéquats. Puisque des variations importantes existent, à la hausse comme à la baisse, un suivi des dosages de tacrolimus est nécessaire afin de s’assurer de l’efficacité et de la sécurité de cette conversion.
Mots clés : Bioéquivalence, générique, greffe cardiaque, PrografMD, Sandoz TacrolimusMD
Abstract
Objective : To verify the short-term efficacy and safety of switching from Prograf® to Sandoz Tacrolimus® in heart transplant patients.
Background : Ten heart transplant patients at the Quebec Heart and Lung Institute were switched from Prograf® to Sandoz Tacrolimus®. The renal function and tacrolimus concentration were monitored weekly for three weeks after the switch. Once the switch was made, we compared their tacrolimus concentration and renal function. Data were gathered retrospectively.
Results : The mean tacrolimus trough was 8.3 ± 2.5 μg/L before the switch and 8.8 ± 2.0 μg/L after the switch, an increase of 10.6 ± 31.5 % (p = 0.80). The mean trough increased in six patients and decreased in four patients. These variations resulted in two dose increases and two dose decreases. The estimated glomerular filtration rate remained stable, increasing from 65 ± 14 mL/min/1.73 m2 to 67 ± 19 mL/min/1.73 m2. The filtration rate in two patients increased by more than 5% and decreased by more than 5 % in two other patients.
Conclusion : Switching from Prograf® to Sandoz Tacrolimus® is safe in the short term and effective in maintaining adequate tacrolimus concentrations. Since significant variations occur, both upward and downward, tacrolimus concentrations should be monitored to ensure the effectiveness and safety of the switch.
Keywords : Bioequivalence, generic, heart transplant, Prograf®, Sandoz Tacrolimus®
Le tacrolimus, connu sous le nom commercial PrografMD, est un médicament appartenant à la classe des inhibiteurs de la calcineurine. Le tacrolimus fait partie de la thérapie immunosuppressive prescrite à de nombreux patients qui ont subi une greffe cardiaque, en association avec d’autres médicaments ayant des propriétés antirejet1. Au cours des dernières années, de nombreux professionnels de la santé ont émis des doutes quant à la bioéquivalence de certaines formulations génériques de médicaments à index thérapeutique étroit, comme le tacrolimus, par rapport au médicament novateur, ou entre deux formulations génériques différentes. Plusieurs études se sont penchées sur le tacrolimus générique de marque Sandoz en le comparant au médicament d’origine PrografMD2–7. Ces études avaient plusieurs objectifs, notamment celui de comparer la pharmacocinétique des deux formulations ainsi que d’évaluer l’efficacité et la sécurité de la conversion. Pour ce faire, elles ont documenté les rejets, les infections et les effets indésirables apparus sous la formulation générique2–7.
Au Canada, le tacrolimus fait partie de la catégorie des médicaments à dose critique soumis aux normes de bioéquivalence de Santé Canada8. Une faible variation des concentrations sériques à la baisse ou à la hausse de ces médicaments peut mener à l’inefficacité du médicament, par exemple au rejet du greffon ou à l’apparition de toxicités, comme une infection opportuniste ou une insuffisance rénale dans le cas du tacrolimus. Lorsque les compagnies génériques font des études de bioéquivalence, les critères régissant les médicaments à dose critique sont plus stricts que ceux élaborés pour les médicaments sans mention particulière. Elles doivent démontrer, sur une population in vivo, que l’intervalle de confiance à 90 % (IC 90 %) de l’aire sous la courbe moyenne relative (ASC) se situe entre 90 et 112 % par rapport au médicament d’origine et que l’IC 90 % de la concentration maximale moyenne relative (Cmax) soit compris entre 80 et 125 %8.
Les valeurs de l’IC 90 % pour l’ASC et la Cmax d’un médicament qui n’est pas inclus dans cette catégorie doivent se situer entre 80 et 125 %8. De plus, les médicaments à dose critique doivent démontrer leur bioéquivalence tant chez le sujet à jeun que chez celui qui ne l’est pas8. Les critères de bioéquivalence varient d’un pays à l’autre et sont détaillés au tableau I9–11. Le Sandoz TacrolimusMD est le seul générique du tacrolimus qui réponde aux critères plus stricts au niveau de l’ASC de l’European Medicine Agency (EMA) et de Santé Canada, ce qui fait de Sandoz la seule compagnie qui commercialise actuellement une version générique du tacrolimus au Canada12. Le Sandoz TacrolimusMD est inscrit à la Liste des médicaments de la Régie d’assurance maladie du Québec (RAMQ) depuis le 24 avril 201513. Cette inscription a été accompagnée de l’application de la méthode du prix le plus bas pour le remboursement du PrografMD par le Régime général d’assurance médicaments, entrainant une augmentation des coûts assumés par le patient si celui-ci désire prendre le PrografMD plutôt que la version générique14.
Tableau I Critères de bioéquivalence selon les différentes exigences réglementaires pour les médicaments à dose critique
Les patients prenant le PrografMD avant cette date pouvaient cependant continuer à l’utiliser sans devoir assumer les coûts excédentaires. Plusieurs compagnies privées d’assurance médicaments ont aussi choisi de ne payer que le coût du tacrolimus générique. À la suite de cette décision, de nombreux patients ont remplacé le PrografMD par le Sandoz TacrolimusMD.
Cette étude vise à décrire les conséquences du passage du PrografMD au Sandoz TacrolimusMD sur les concentrations sanguines et les doses du médicament. Elle permet également de vérifier la sécurité et l’efficacité à court terme de cette conversion pour les patients greffés cardiaques suivis à l’Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval (IUCPQ-UL).
Les patients inclus dans l’étude sont tous les patients greffés cardiaques de la clinique de transplantation cardiaque de l’IUCPQ-UL qui ont passé du PrografMD au Sandoz TacrolimusMD depuis le 24 avril 2015. Les données ont été recueillies de façon rétrospective, à partir de six mois avant la conversion, ou à partir du moment de la greffe si elle avait été effectuée moins de six mois avant la conversion, jusqu’au 2 mars 2018. Toutes les données recueillies proviennent des logiciels de gestion de la clinique et des dossiers-patients électroniques de l’établissement. Une approbation du directeur des services professionnels a été préalablement obtenue pour la colligation des données. Les dossiers des patients ont également été analysés dans le but de déterminer si des interactions avec d’autres médicaments pouvaient influencer les concentrations de tacrolimus ou son efficacité et sa toxicité.
La variation des concentrations sériques a été évaluée par les creux 12 heures après la dose, soit le prélèvement du matin, avec la prise en compte du dernier creux disponible avant la conversion et de la moyenne de trois creux après la conversion. Selon la pratique locale, les patients passant du PrografMD au Sandoz TacrolimusMD ont trois dosages des creux, soit environ 7, 14 et 21 jours après le changement. La méthode utilisée est le dosage par spectrométrie de masse. Ces dosages permettent de déterminer s’il est nécessaire d’ajuster la dose du médicament pour rester dans l’intervalle visé. Cet intervalle cible est variable d’un patient à l’autre et dépend entre autres du laps de temps après la greffe, des antécédents de rejets ou de toxicités et de la médication concomitante. La dose quotidienne de PrografMD avant le changement a été comparée avec la dose de Sandoz TacrolimusMD à la fin de la période de suivi des creux. L’efficacité à court terme, soit durant la période de suivi des dosages, a été vérifiée et définie comme l’absence de rejet du greffon. La variation de la créatinine sérique et du débit de filtration glomérulaire estimé (DFGe), déterminé selon la formule Chronic kidney disease – epidemiology collaboration (CKD-EPI), a été évaluée pour vérifier la sécurité du traitement à l’aide de la dernière valeur avant la conversion et de la moyenne des valeurs obtenues aux mêmes moments que les dosages de tacrolimus après la conversion.
L’hypothèse de départ postulait que l’évaluation de chacun des points ne devrait globalement pas révéler de différence statistiquement significative entre le Sandoz TacrolimusMD et le PrografMD. On s’attendait néanmoins à des variations de chacun des paramètres chez un même patient.
L’analyse en mesures répétées des variables présentant plusieurs mesures dans le temps (creux de tacrolimus, créatinine sérique et DFGe) a été faite selon une matrice de variance-covariance à structure généralisée. Les analyses ont été réalisées avec le système SASMD (version 9.4).
En date du 2 mars 2018, 10 patients, quatre femmes et six hommes, prenant du PrografMD depuis leur greffe l’ont remplacé par le Sandoz TacrolimusMD, à un ratio de dose de 1:1. L’âge moyen des patients est de 53,1 ± 9,6 ans et le poids moyen de 74,9 ± 13,5 kg. Lors du passage au tacrolimus générique, les patients étaient greffés en moyenne depuis 45,2 ± 56,3 mois. Les autres traitements immunosuppresseurs des patients sont restés stables pendant la conversion. Aucune interaction médicamenteuse pouvant influencer les dosages n’a été détectée.
Le dernier dosage effectué durant la période précédant la conversion datait en moyenne de 73 ± 54 jours avant la conversion. Les trois dosages suivant la conversion ont été faits en moyenne 4 ± 2 jours, 12 ± 4 jours et 20 ± 4 jours après la conversion. La valeur moyenne du creux de tacrolimus est restée stable, puisqu’elle est passée de 8,3 ± 2,5 μg/L avant la conversion à 8,8 ± 2,0 μg/L au courant des trois semaines qui ont suivi la conversion. La variation moyenne correspond à une augmentation de 0,4 ± 2,3 μg/L, soit une variation moyenne de 10,6 ± 31,5 % entre la valeur précédant la conversion et la moyenne des valeurs après la conversion (p = 0,80). La plus faible ampleur de la variation, à la hausse comme à la baisse, est de 8,2 %. Une variation de moins de 20 % a été observée chez sept des 10 patients alors que trois patients ont subi des changements plus marqués, allant d’une diminution de 34,3 % à des hausses de 43,6 % et 75,3 %. La moyenne des creux de tacrolimus mesurés après la conversion a augmenté chez six patients et a diminué chez quatre patients. Les données concernant les creux moyens de tacrolimus sont présentées au tableau I. La figure 1 illustre les variations des creux de tacrolimus de chaque patient selon le temps qui suit la conversion.
|
|
||
|
Figure 1 Évolution des dosages de tacrolimus de chaque patient |
||
La dose quot idienne moyenne de Prograf MD était de 6,7 ± 5,0 mg/jour avant la conversion. La dose quotidienne moyenne de Sandoz TacrolimusMD était quant à elle de 6,7 ± 4,8 mg/jour après la conversion. Quatre patients sur 10 ont vu leur dose de tacrolimus ajustée à la hausse (n = 2) ou à la baisse (n = 2).
Aucun patient n’a subi de rejet prouvé par biopsie dans les trois semaines après le passage au Sandoz TacrolimusMD. Aucun patient n’a cessé de prendre le Sandoz TacrolimusMD pour revenir au PrografMD.
La créatinine moyenne est restée stable à la suite de la conversion, puisqu’elle est passée de 106 ± 18 μmol/L à 105 ± 22 μmol/L (diminution moyenne de −1 ± 11, p = 0,59) dans les trois semaines qui ont suivi la conversion. Le DFGe moyen est aussi resté stable, puisqu’ il est passé de 65 ± 14 mL/min/1,73 m2 avant la conversion à 67 ± 19 mL/min/1,73m2 (augmentation de 2 ± 9,1 mL/min/1,73m2, p = 0,71) pendant la période de suivi de trois semaines après la conversion. La fonction rénale de six des 10 patients est demeurée stable. Le DFGe moyen de deux patients a augmenté de plus de 5 % (23 % et 25 %) et a diminué de plus de 5 % chez deux autres patients (−10 % et −16 %). Le patient ayant subi la plus forte diminution du DFGe a aussi eu la plus forte augmentation de son dosage de tacrolimus, qui est passé de 5,8 μg/L à 10,2 μg/L durant la même période. Le deuxième patient ayant eu la plus forte augmentation de son dosage de tacrolimus a aussi été le deuxième à obtenir une plus grande amélioration du DFGe. D’un autre côté, le patient ayant obtenu la plus grande amélioration du DFGe pendant le suivi a aussi eu la plus grande baisse de son dosage, qui est passé de 10,2 μg/L à 6,7 μg/L. D’autres patients ont eu des résultats de dosages supérieurs à 10,0 μg/L sans variation notable de leur DFGe. L’âge du patient ne semblait pas influencer la variation de la fonction rénale ou des dosages de tacrolimus. Les résultats concernant les paramètres de suivi et d’estimation de la fonction rénale sont présentés au tableau II. La figure 2 résume les variations des valeurs de créatinine sérique de chaque patient.
Tableau II Creux de tacrolimus et paramètres de suivi de la fonction rénale selon le moment avant et après le passage du PrografMD au Sandoz TacrolimusMD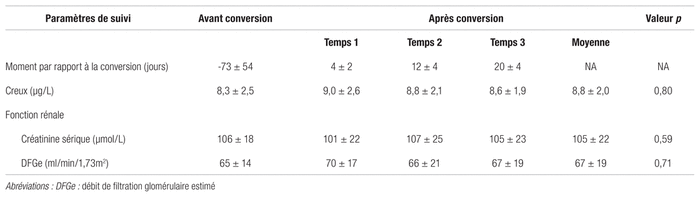
|
|
||
|
Figure 2 Évolution de la créatinine sérique de chaque patient |
||
Des 10 patients étudiés, aucun n’est revenu au PrografMD pour une raison de toxicité ou pour une autre raison. Les deux patients qui ont vu les creux de tacrolimus augmenter le plus fortement après la conversion n’ont rapporté aucun effet indésirable supplémentaire par rapport aux six mois qui ont précédé la conversion.
La présente étude permet de constater que la conversion du PrografMD au Sandoz TacrolimusMD ne fait pas varier de façon statistiquement significative les valeurs moyennes des creux de tacrolimus, les doses quotidiennes de tacrolimus, la créatinine sérique et le DFGe. Ces valeurs restent donc globalement constantes. Cependant, comme on le voit à la figure 1, sur le plan individuel, tous les patients présentent une variation plus ou moins marquée du creux de tacrolimus. C’est également le cas des valeurs de la fonction rénale, comme le montre la figure 2. Le suivi tel que le propose l’IUCPQ-UL, c’est-à-dire un dosage hebdomadaire du tacrolimus et de la créatinine sérique pendant les trois semaines qui suivent la conversion, a permis de détecter de nombreuses variations dans ces paramètres. L’ampleur des variations de plusieurs patients montre qu’un suivi est nécessaire pour assurer à la fois l’efficacité et la sécurité du traitement. En effet, 30 % des patients ont subi une variation de plus de 20 % des valeurs moyennes de creux de tacrolimus. Ceci a entraîné une modif ication de la dose chez 40 % des patients. Les paramètres du suivi ont varié tant à la hausse qu’à la baisse. Il n’est donc pas possible de prévoir comment ces valeurs vont varier après une conversion sans faire de dosages des creux et de créatinine sérique. Une conversion sans dosage de suivi pourrait amener à une toxicité rénale ou à des dosages plus faibles pouvant augmenter le risque de rejet.
Ces conclusions diffèrent de celles émises par l’Institut national d’excellence en santé et services sociaux (INESSS). En effet, l’INESS mentionnait, dans un communiqué publié en 2014, que le monitorage intensif après le passage du PrografMD au générique explique à lui seul les variations des creux plasmatiques14. Il précise que plusieurs facteurs influencent les concentrations plasmatiques de tacrolimus, et l’obtention de creux non thérapeutiques ne serait donc pas une conséquence du passage du PrografMD au générique14. Il conclut en disant que les données disponibles ne permettent pas de penser que la conversion à une version générique de tacrolimus, démontrée bioéquivalente à PrografMD selon les normes de Santé Canada pour les médicaments à dose critique, puisse accroître la variabilité des concentrations plasmatiques de tacrolimus et donc procurer des avantages différents ou des complications plus fréquentes qu’avec le médicament novateur.
Plusieurs auteurs ont étudié les variations des creux de tacrolimus après le passage du PrografMD au générique. Söderlund et Radegran ont conduit une étude rétrospective sur 17 greffés cardiaques en Suède et ils en viennent à la conclusion suivante : il n’y a pas de changement significatif dans les creux de tacrolimus après le passage au générique de marque Sandoz, ni de différence sur le plan de l’efficacité et de la sécurité6. Dans cette étude publiée en 2015, les patients ont été suivis pendant six mois après le changement. Spence et coll. rapportent par ailleurs que 97 % des 234 patients qu’ils ont étudiés ont vu un changement moyen dans les creux de tacrolimus de 5,63 ± 32,95 %. Ce faisant, 36 patients (15,4 %) ont vu leur dose être ajustée après le passage du PrografMD au tacrolimus générique de marque Sandoz, la moitié à la hausse et la moitié à la baisse7. Les auteurs recommandent un suivi plus serré des creux de tacrolimus étant donné qu’il est parfois nécessaire d’ajuster les doses après un changement de compagnie. Ils mentionnent clairement que les concentrations restent cependant comparables et que la conversion est sécuritaire et bénéfique, dans l’optique où elle permet de diminuer les coûts de la thérapie7.
Dans l’étude prospective de McDevitt-Potter et coll., publiée en 2011, 21 % des 70 patients qui sont passés du PrografMD au Sandoz TacrolimusMD ont dû subir un ajustement de dose, tandis que 7 % des patients du groupe témoin sous PrografMD ont aussi dû ajuster leur dose3. Dans l’étude de Rosenborg et coll. de 2014, 22 % des 63 patients greffés rénaux ayant procédé à la conversion ont subi une variation de plus de 20 % des creux de tacrolimus, malgré une absence de différence statistiquement significative lorsque les dosages avaient été analysés ensemble5. Huit des 14 patients ont dû modif ier leur dose5. Globalement, de nombreux auteurs ayant étudié le tacrolimus administré à des patients greffés concluent que les creux avant et après la conversion sont similaires, mais qu’un monitorage est nécessaire2,3,5–7,15.
Plusieurs auteurs recommandent de sensibiliser les patients au fait d’aviser leur clinicien de tout changement de compagnie de tacrolimus utilisée15,16. Les patients devraient également être maintenus sous le même générique après la conversion et ils devraient éviter les changements de compagnie non supervisés15. Ce risque est somme toute limité à l’heure actuelle, puisque seule la compagnie Sandoz commercialise une version générique, mais il reste présent dans le futur12. Les données fournies dans le présent article suggèrent qu’il convient d’adopter la même conduite.
Certains auteurs rapportent une augmentation de la créatinine sérique après le passage du PrografMD au générique, alors que d’autres ne rapportent pas de variation significative2,4,5. La fonction rénale de la majorité des patients de la présente étude est restée stable. Un nombre égal de patients ont subi une hausse ou une baisse de leur créatinine sérique. La conversion semble donc sans danger pour la fonction rénale des patients greffés cardiaques. Il faut néanmoins faire preuve de prudence et suivre la fonction rénale après une conversion, comme le recommandent la plupart des auteurs2,5.
Au Québec, le Sandoz TacrolimusMD se vend à environ 75 % du prix du PrografMD, selon la Liste des médicaments publiée par la RAMQ17. Par exemple, pour un patient recevant une dose quotidienne de 7 mg de PrografMD, le coût mensuel avant les honoraires professionnels du pharmacien et le remboursement par les assurances est de 524,90 $. Le prix mensuel d’une même dose de Sandoz TacrolimusMD, est de 396,90 $. L’utilisation du générique permet donc une économie mensuelle de 128 $ pour la même dose des deux produits. Il est clair que les prix varient en fonction la dose quotidienne du patient. Plusieurs auteurs affirment que le passage au tacrolimus générique permet de générer des économies3,5,7. D’ailleurs, malgré le monitorage plus fréquent que nécessite le passage au Sandoz TacrolimusMD, Rosenborg et coll. estiment que les coûts sont finalement moins élevés de 23 % que pour les patients qui conservent le PrografMD5. Les coûts pour les patients varient d’un pays à l’autre selon différents facteurs, notamment le fonctionnement du système de santé et des assurances.
Cette étude présente plusieurs limites. Tout d’abord, le nombre de patients est faible. Il n’est donc pas possible de généraliser l’information obtenue à partir de cette cohorte de dix patients. De plus, du fait que cette étude est rétrospective, certaines données n’ont pas été colligées de façon aussi organisée que si la collecte avait eu lieu au moment des évènements. Par exemple, les moments des dosages de tacrolimus ont varié d’un patient à un autre et les patients n’avaient pas systématiquement de dosage tout juste avant la conversion. Le dernier dosage sous PrografMD pouvait donc remonter à plusieurs mois avant la conversion.
Certaines variables modifiant la pharmacocinétique et les concentrations sériques du tacrolimus, telles que le taux d’hématocrite et l’albumine n’ont pas été prises en compte, puisque, normalement, on ne les mesure pas à chaque dosage18. De plus, les dosages ayant été réalisés auprès de patients ambulatoires, il est possible que le moment du dosage et les conditions de prise du médicament (à jeun ou non) n’aient pas été similaires à chaque prélèvement, ce qui aurait pu influencer les valeurs des creux18. Par ailleurs, certaines données prises en compte par quelques auteurs, notamment l’évolution de la tension artérielle, des lipides et de l’hémoglobine glyquée, n’ont pas été prises en compte dans notre étude6. Finalement, la durée du suivi de nos patients après la conversion étant courte, des recommandations sur la durée et le nombre de suivis nécessaires après la conversion ne peuvent être émises.
Il est important de noter que si de nouveaux génériques arrivent sur le marché canadien, d’autres études seront nécessaires pour déterminer la bioéquivalence entre ces molécules et le PrografMD, mais également entre les divers génériques (bioéquivalence générique-générique). Les données actuelles ne s’appliquent pas à la conversion d’un générique à un autre. Elles ne s’appliquent pas non plus à la population pédiatrique ni aux personnes âgées. Finalement, les données présentées ici concernent uniquement des patients ayant subi une greffe cardiaque, dont l’état est stable depuis quelques mois. Les autres types de transplantations n’ont pas été évalués dans cet te étude et les résultats présentés ici ne sont donc pas extrapolables à d’autres types de greffe.
À l’IUCPQ-UL, après le passage de 10 patients du PrografMD au générique de marque Sandoz, la moyenne des dosages des creux de tacrolimus n’a pas varié de manière statistiquement significative. Cependant, sur le plan individuel, il existe des variations importantes, tant à la hausse qu’à la baisse, qui ont entrainé des changements de doses chez 40 % des patients. La fonction rénale moyenne n’a pas non plus varié de manière statistiquement significative. Sur le plan individuel, 40 % des patients ont vu leur fonction rénale varier de plus de 10 %. Aucun patient n’a subi d’effet indésirable majeur nécessitant le retour au médicament innovateur, ni n’a vécu de rejet du greffon prouvé par biopsie. La thérapie au Sandoz TacrolimusMD semble donc à la fois efficace et sans danger pour les patients adultes transplantés cardiaques, dont l’état est stable. Les variations individuelles observées, tant à la hausse qu’à la baisse, nous indiquent toutefois qu’un suivi hebdomadaire des creux pendant les trois premières semaines après la conversion semble approprié. Le schéma de suivi optimal n’est cependant pas connu.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Vincent Leclerc est rédacteur associé de Pharmactuel. Les autres auteurs n’ont déclaré aucun autre conflit d’intérêts en relation avec le présent article.
1. Costanzo MR, Dipchand A, Starling R, Anderson A, Chan M, Desei S et coll. The International Society of heart and lung transplantation guidelines for the care of heart transplant recipients. J Heart Lung Transplant 2010;29:914–56.
2. González F, López R, Arriagada E, Carrasco R, Gallrdo N, Lorca E. Switching stable kidney transplant recipients to a generic tacrolimus is feasible and safe, but it must be monitored. J Transplant 2017;2017:5646858.

3. McDevitt-Potter LM, Sadaka B, Trichy EM, Rogers CC, Cabardi S. A multicenter experience with generic tacrolimus conversion. Transplantation 2011;92:653–7.
4. Momper JD, Ridenour TA, Schonder KS, Shapiro R, Humar A, Venkataramanan R. The impact of conversion from Prograf to generic tacrolimus in liver and kidney transplant recipients with stable graft function. Am J Transplant 2011;11: 1861–7.
5. Rosenborg S, Nordström A, Almquist T, Wennberg L, Bárány P. Systematic conversion to generic tacrolimus in stable kidney transplant recipients. Clin Kidney J 2014;7:151–5.

6. Söderlund C, Rådegran G. Safety and efficacy of the switch to generic mycophenolate mofetil and tacrolimus in heart transplant patients. Clin Transplant 2015;29:619–28.
7. Spence MM, Nguyen L, Hui RL, Chan J. Evaluation of clinical and safety outcomes associated with conversion from brand-name to generic tacrolimus in transplant recipients enrolled in an integrated health care system. Pharmacotherapy 2012;32:981–7.
8. Gouvernement du Canada. Ligne directrice – Normes en matière d’études de biodisponibilité comparatives : Formes pharmaceutiques de médicaments à effets systémiques(1er septembre 2018). [en ligne] https://www.canada.ca/fr/santecanada/services/medicaments-produits-sante/medicaments/demandes-presentations/lignes-directrices/biodisponibilite-bioequivalence/normes-matiere-etudes-biodisponibilite-comparatives-formes-pharmaceutiques-medicaments-effets-systemiques.html (site visité le 28 février 2019).
9. U. S. Food and Drug Administration. Guidance for industry : Bioavailability and bioequivalence studies for orally administered drug products – General considerations (27 octobre 2000). [en ligne] https://www.fda.gov/downloads/Drugs/Guidances/ucm154838 (site visité le 6 mars 2019).
10. U. S. Food and Drug Administration. Draft guidance on tacrolimus (Novembre 2013). [en ligne] https://www.fda.gov/ucm/groups/fdagov-public/@fdagov-drugs-gen/documents/document/ucm181006.pdf ( site visité le 6 mars 2019).
11. European Medicines Agency. Questions and answers : positions on specific questions addressed to the pharmacokinetics working party (PKWP)(19 novembre 2015). [en ligne] ht tp://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500002963.pdf (site visité le 6 mars 2019).
12. Santé Canada. Base de données sur les produits pharmaceutiques (19 mars 2019). [en ligne] https://produits-sante.canada.ca/dpd-bdpp/dispatch-repartition.do;jsessionid=C460BDF43FB84F0A4BBC57422B4249DB (site visité le 17 octobre 2019).
13. Régie de l’assurance maladie du Québec. Liste des médicaments : dernière mise à jour le 24 avril 2015. [en ligne] https://www.prod.ramq.gouv.qc.ca/DPI/PO/Commun/PDF/Liste_Med/Liste_Med/liste_med_2015_04_24_fr.pdf (site visité le 13 mars 2018).
14. Institut national d’excellence en santé et en services sociaux. Exemption de l’application de la méthode du prix le plus bas – Avis de refus. [en ligne] https://www.inesss.qc.ca/fileadmin/doc/INESSS/Inscription_medicaments/Avis_au_ministre/Juin_2014/Prograf_demande-exemption-PPB_2014_06_CAV.pdf (site visité le 28 février 2018).
15. Taube D, Jones G, O’Beirne J, Wennberg L, Connor A, Rasmussen A et coll. Generic tacrolimus in solid organ transplantation. Clin Transplant 2014;28:623–32.
16. Uber PA, Ross HJ, Zuckermann AO, Sweet SC, Corris PA, McNeil K et coll. Generic drug immunosuppression in thoracic transplantation : An ISHLT educational advisory. J Heart Lung Transplant 2009;27:655–60.
17. Régie de l’assurance maladie du Québec. Liste des médicaments : mise à jour le 23 mai 2019. [en ligne] http://www.ramq.gouv.qc.ca/SiteCollectionDocuments/liste_med/2019/liste_med_2019_05_23_fr.pdf (site visité le 30 mai 2019).
18. Vanhove T, Annaert P, Kuypers DR. Clinical determinants of calcineurin inhibitor disposition: a mechanistic review. Drug Metab Rev 2016; 48:88–112.
PHARMACTUEL, Vol. 53, No. 1, 2020