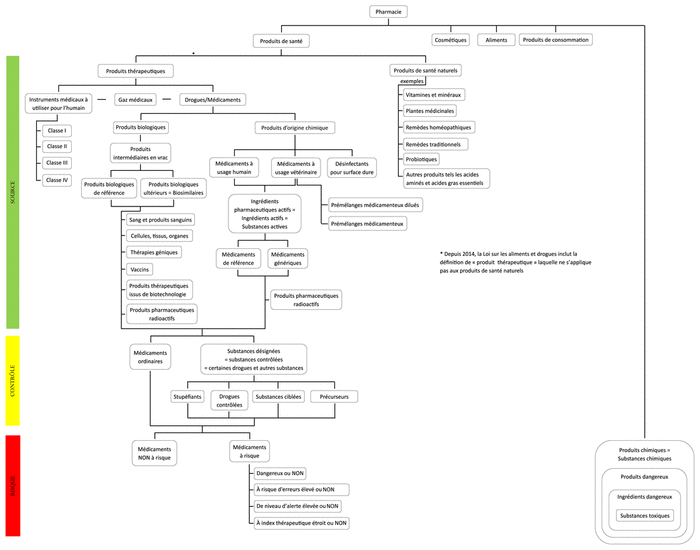
Figure 1 Cartographie des termes servant à décrire les produits utilisés dans la pratique pharmaceutique
Marie Palamini1,2, Jean-François Bussières3,4, B.Pharm., M.Sc., MBA, FCSHP, FOPQ
Reçu le 14 août 2019: Accepté après révision le 1er juillet 2020
Résumé
Objectif : Encadrer le bon usage des termes de produits utilisés en pratique pharmaceutique à l’aide d’une cartographie de ces termes.
Mise en contexte : En consultant les différents sites web gouvernementaux et d’autres organismes, on note qu’il n’y a pas de cartographie détaillée situant l’ensemble des produits et des termes utilisés ainsi que leur relation hiérarchique.
Résultats : Au total, 42 termes liés à des produits utilisés en pratique pharmaceutique ont été retenus pour la réalisation de la cartographie. Quatre-vingt-un pour cent (34/42) sont définis par un organisme de compétence fédérale contre 12 % (5/42) par un organisme de compétence provinciale. Nous avons été en mesure d’estimer le nombre de produits applicables à un groupe de termes dans seulement 33 % des cas (14/42). Au total, ces termes découlent de lois (26 %, 11/42), de règlements (40 %, 17/42) ou d’autres textes (31 %, 13/42). La revue comporte une cartographie synthèse et une annexe détaillée constituées de chaque groupe de termes en français et en anglais, de quelques exemples de produits utilisés en pratique pharmaceutique, de la définition commentée et, lorsqu’elle existe, d’une estimation du nombre de produits sur le marché canadien.
Conclusion : Cette revue documentaire propose une cartographie de 42 termes décrivant les produits utilisés en pratique pharmaceutique. Cette cartographie aide à situer l’ensemble des termes, leur hiérarchie et peut contribuer à un meilleur encadrement de leur utilisation en pratique pharmaceutique. Le pharmacien ou l’assistant technique capable de comprendre correctement chacun de ces termes sera davantage en mesure de respecter les balises juridiques et normatives applicables à ces dénominations.
Mots clés : Cartographie, instruments, médicaments, pratique pharmaceutique, produits
Abstract
Objective : To guide the proper use of terms for products used in pharmaceutical practice by mapping these terms.
Background : Upon consulting the various government websites and the websites of different organizations, we note that there is no detailed map situating all the products and terms used and their hierarchical relationship.
Results : A total of 42 terms pertaining to products used in pharmaceutical practice were selected for the mapping. Eighty-one percent (34/42) are defined by a body under federal jurisdiction versus 12% (5/42) by a body under provincial jurisdiction. We were able to estimate the number of products applicable to a group of terms in only 33% of the cases (14/42). These terms are from statutes (26%, 11/42), regulations (40%, 17/42) and other texts (31%, 13/42). The review includes a summary map and a detailed appendix consisting of each group of terms in French and English, a few examples of products used in pharmaceutical practice, the definitions with commentary and, where available, an estimate of the number of products on the Canadian market.
Conclusion : This literature review led to a map of 42 terms for products used in pharmaceutical practice. This map helps situate all the terms and shows their hierarchy, It can contribute to better guidance for their use in pharmaceutical practice. The pharmacist or technical assistant with a proper understanding of all these terms will be better able to comply with the legal and normative guidelines applicable to these names.
Keywords : Drugs, instruments, map, pharmaceutical practice, products
Depuis plusieurs millénaires, les médecins, chirurgiens et apothicaires utilisent de nombreux produits de santé dans l’exercice de leur profession1. On n’a qu’à penser au Sushruta Samhita, traité indien ayurvédique du VIIe siècle avant Jésus-Christ (J.-C.), aux Papyrus d’Ebers et d’Edwin Smith de l’Égypte ancienne rédigés vers 1500 avant J.-C., ou encore au traité De Materia Medica publié en Grèce par Discoride vers 60 après J-C.2–4.
En Nouvelle-France, on rapporte que les peuples autochtones « utilisaient plus d’un millier de plantes différentes pour se nourrir, se soigner, fabriquer des produits et pratiquer des rites ou rituels »5–7. Avec l’arrivée des Européens en Nouvelle-France au 16e siècle, de nouvelles approches thérapeutiques s’ajoutent à la pratique traditionnelle autochtone. Les apothicaireries de l’époque (p. ex. Apothicairerie des Jésuites) témoignent de cet essor et de l’émergence de différentes pharmacopées8,9.
Il faut attendre le 20e siècle pour que se développe le médicament, non seulement comme produit de santé issu de la nature, mais également comme produit chimique de synthèse. Des sociétés pharmaceutiques s’établissent notamment en Europe et en Amérique du Nord afin de découvrir, de développer, de fabriquer et de commercialiser des médicaments10. Avec la déclaration d’Helsinki, un encadrement de la recherche clinique se met progressivement en place dans les années 196011. Avec le nombre croissant de produits utilisés en pratique pharmaceutique, le législateur rédige différents textes juridiques afin d’encadrer la mise en marché de tous ces produits12.
En 2019, le pharmacien utilise une panoplie de produits pour soigner les patients, tant en officine qu’en établissement de santé. En vertu du cadre juridique canadien, le gouvernement du Canada, Santé Canada et d’autres ministères règlementent la mise en marché de ces produits. Ce cadre juridique définit un certain nombre de termes décrivant les produits disponibles sur le marché canadien. En sus du cadre établi par le gouvernement canadien, différents organismes (p. ex. des ordres professionnels, comme l’Ordre des pharmaciens du Québec [OPQ], des sociétés savantes, des associations professionnelles) proposent également des termes et des définitions afin de préciser la nature des produits utilisés en pharmacie. On pourrait penser, à tort, qu’il n’y a que des médicaments. En pharmacie d’officine, on vend des médicaments, des instruments, des produits dangereux, des cosmétiques et des aliments. En officine ou en établissement de santé, les produits utilisés peuvent prêter à des erreurs, être de niveau d’alerte élevée et à index thérapeutique étroit ou dangereux. Tous ces termes sont associés à un encadrement juridique particulier.
En consultant les différents sites web de ces organismes, on note qu’il n’y a pas de cartographie détaillée situant l’ensemble des produits, les termes utilisés et leur relation hiérarchique. L’absence de cartographie nuit à l’utilisation appropriée de tous ces termes par les différentes parties prenantes. L’objectif principal de cette étude est d’encadrer le bon usage des termes de produits utilisés en pratique pharmaceutique grâce à une cartographie de ces termes.
Il s’agit d’une revue documentaire. À partir de l’ouvrage Législation et système de soins, nous avons déterminé tous les termes en français décrivant les produits utilisés en pratique pharmaceutique13. Par la suite, à partir des sites gouvernementaux et paragouvernementaux canadiens et québécois (c.-à-d. gouvernement du Canada, Santé Canada, ministère de la Santé et des Services sociaux, Ordre des pharmaciens du Québec, Association pour la santé et la sécurité au travail – secteur affaires sociales [ASSTSAS]), nous avons recherché les termes décrivant les produits utilisés en pratique pharmaceutique, leur définition et, lorsqu’il existait, l’équivalent en anglais14–18. Nous avons fait nos recherches dans les textes de lois et de règlements, dans les lignes directrices, les normes, les lexiques, les glossaires et à l’aide du moteur de recherche de chaque site. Tous les termes découverts et en vigueur en date du 14 août 2019 ont été pris en considération. Des termes intermédiaires ont également été retenus. Ils renvoient à des termes utiles à la hiérarchisation des dénominations (c.-à-d. permettant d’établir un lien entre un terme plus général et un terme plus spécifique).
Pour chaque terme retenu, nous avons noté le niveau de juridiction, l’organisme responsable du terme, la définition et, lorsqu’elle existe, une estimation du nombre de produits disponibles sur le marché canadien. De plus, nous avons intégré à la cartographie la notion de risque lié aux produits, en tenant compte des risques pour le patient (c.-à-d. utilisation personnelle) et pour le pharmacien (c.-à-d. exposition professionnelle). Concernant le patient, il existe un risque d’inefficacité, de réactions indésirables et d’erreurs médicamenteuses. Quant au pharmacien, le risque porte sur l’exposition professionnelle et les erreurs médicamenteuses.
Chaque terme ou groupe de termes retenu a été ajouté successivement à la cartographie, conçue pour aller du général au spécifique. La cartographie proposée a été améliorée par itération successive. Finalement, elle a été communiquée à un représentant de Santé Canada et de l’Ordre des pharmaciens du Québec pour qu’ils livrent leurs commentaires. La version présentée ici intègre les suggestions reçues dans le cadre de ces relectures.
Au total, 42 termes liés à des produits utilisés en pratique pharmaceutique ont été retenus pour la réalisation de la cartographie. Quatre-vingt-un pour cent (34/42) sont définis par un organisme de compétence fédérale et 12 % (5/42) par un organisme de compétence provinciale. Nous avons été en mesure d’estimer le nombre de produits applicables à un groupe de termes dans seulement 33 % des cas (14/42). En définitive, ces termes découlent de lois (26 %, 11/42), de règlements (40 %, 17/42) ou d’autres textes (31 %, 13/42).
La figure 1 illustre la cartographie des termes servant à décrire les produits utilisés en pratique pharmaceutique. Elle met en évidence cinq groupes de termes (c.-à-d. produits de santé, produits cosmétiques, aliments, produits de consommation et produits chimiques) et trois niveaux conceptuels (c.-à-d. source des produits [vert], contrôle des produits [jaune], risques pour les travailleurs de la santé [p. ex. pharmaciens, infirmières, médecins, assistants techniques en pharmacie] en établissement de santé et en milieu ambulatoire et les patients [rouge]).
|
|
||
|
Figure 1 Cartographie des termes servant à décrire les produits utilisés dans la pratique pharmaceutique |
||
En ce qui concerne les produits de santé, on note deux termes principaux, soit les produits thérapeutiques (y compris notamment les instruments et les drogues ou médicaments) et les produits de santé naturels. Le législateur fédéral utilise le terme « drogue » dans la version française de ses textes législatifs tandis que le législateur québécois préfère le terme « médicament ». Il est raisonnable de penser que le terme « médicament » serait également utilisé au niveau fédéral si l’on amorçait la traduction des textes juridiques en 2019 plutôt que dans les années soixante-dix. Dans le langage courant, le terme drogue renvoie généralement à la consommation de drogues illégales. Afin de pallier cette confusion, le terme « drogue » demeure utilisé dans les lois et règlements de compétence fédérale, mais Santé Canada préfère souvent le terme « médicament » dans son portail web.
En matière de produits de santé, la cartographie met en évidence trois niveaux d’encadrement. Le premier renvoie à la source des produits (p. ex. chimique contre biologique), le second renvoie aux besoins de contrôle de la distribution des produits (p. ex. stupéfiants, drogues contrôlées, benzodiazépines) pour éviter le chapardage tandis que le troisième renvoie aux risques pour le patient ou le travailleur de la santé.
L’annexe présente le profil des termes, définitions et autres renseignements relatifs aux produits utilisés en pratique pharmaceutique au Canada. Cette annexe précise le terme en français et son équivalent en anglais, quelques exemples de produits utilisés en pratique pharmaceutique, la définition commentée et, lorsqu’elle existe, une estimation du nombre de produits sur le marché canadien. Les termes sont présentés par ordre alphabétique croissant.
Le pharmacien recourt à un arsenal imposant et diversifié de produits dans sa pratique pharmaceutique, tant à l’officine qu’à l’hôpital. Une bonne compréhension des termes est importante pour assurer le bon usage et le respect du cadre juridique et normatif en vigueur. La méconnaissance des termes peut amener le pharmacien ou l’assistant technique en pharmacie à ne pas respecter toutes les balises juridiques ou normatives en vigueur. Par exemple, toutes les substances désignées (c.-à-d. stupéfiants, drogues contrôlées, benzodiazépines, substances ciblées) ne sont pas soumises aux mêmes exigences en termes de prise d’ordonnance par téléphone ou de possibilité de renouvellement. Certains termes sont mal compris et il est possible de confondre un médicament dangereux avec un produit dangereux ou avec un médicament associé à un risque d’erreur élevé ou encore avec un médicament de niveau d’alerte élevé. La cartographie proposée met en évidence la variété des termes et de leur hiérarchie. L’annexe présente les définitions et les sources permettant d’interpréter adéquatement la cartographie.
À notre connaissance, il s’agit de la première cartographie complète publiée sur le sujet au Canada. La majorité des termes décrits dans cette cartographie est de compétence fédérale et un texte juridique encadre la mise en marché de ces produits selon des exigences qui varient en fonction de l’efficacité, de l’innocuité et des risques. Toutefois, certains termes sont de compétence provinciale, parce qu’ils sont proposés par des organismes provinciaux (p. ex. ordre professionnel, association professionnelle).
Cette cartographie peut être pertinente pour la pratique pharmaceutique, notamment pour les motifs suivants : 1) elle met en évidence la variété des termes utilisés (n = 42 termes); 2) elle illustre la hiérarchie qui existe entre ces termes et les groupes de termes; 3) elle peut clarifier le partage des responsabilités entre les comités et les personnes responsables de sélectionner ces produits au sein d’un organisme (p. ex. à qui revient la sélection d’un médicament, d’un instrument, d’un produit de santé naturel); 4) elle peut également éclairer les utilisateurs sur les ressources impliquées dans la gestion, le remboursement et le bon usage de ces produits; 5) elle peut alimenter la réflexion et les discussions entourant les exigences de mise en marché et de vigilance.
Bien que cette cartographie soit explicite, elle ne règle pas certaines confusions observées sur le terrain. Par exemple, les termes « produit dangereux » sont définis dans la Loi sur les produits dangereux sous la gouverne de Santé Canada. Pour être qualifié de dangereux, le produit doit être présent dans au moins une des 20 classes de dangers physiques ou une des 12 classes de dangers pour la santé prévues à l’annexe 2 de la Loi. Le gouvernement du Canada ne publie pas de liste des produits dangereux commercialisés au Canada; toutefois, certains organismes provinciaux (p. ex. Commission des normes, de l’équité, de la santé et de la sécurité au travail [CNESST]) alimente une liste (p. ex. Répertoire toxicologique conforme à la définition de produits dangereux de la loi fédérale ainsi qu’à la classification du système d’information des matières dangereuses utilisées au travail 2015 [SIMDUT])19. Le répertoire toxicologique comporte un nombre très limité de médicaments dits dangereux, c’est pourquoi il ne peut être utilisé en pharmacie pour déterminer les « médicaments dangereux ».
Ainsi, la seule liste complète de médicaments dangereux publiée et mise à jour périodiquement est celle du National Institute for Occupational Safety and Health (NIOSH); elle est notamment utilisée par l’ASSTSAS et l’OPQ pour déterminer et encadrer l’utilisation des médicaments dangereux en pratique pharmaceutique et protéger les travailleurs de la santé du Québec d’une exposition professionnelle. Afin de se conformer aux termes en vigueur, l’OPQ utilise les termes « produits dangereux » dans sa norme de préparation de produits stériles dangereux en pharmacie, mais elle évoque également le concept de « médicament dangereux » dans le texte de la norme20. Dans la cartographie, les termes « médicaments dangereux » ont été regroupés au bas du schéma dans la zone à RISQUE (rouge), sous les termes « médicaments à risque » proposés par l’OPQ. On note la présence des produits dangereux à l’extrême droite de la cartographie, dans la même zone à RISQUE. L’absence de reconnaissance du concept de « médicament dangereux » dans la Loi sur les aliments et drogues, pose problème.
Outre la confusion décrite précédemment, les pharmaciens ne peuvent exiger des fabricants et des grossistes un étiquetage explicite des « médicaments dangereux » du groupe 1 (antinéoplasiques), 2 (immunosuppresseurs et autres) et 3 (médicaments comportant un risque pour la reproduction uniquement). Ces fabricants considèrent que les termes « médicaments dangereux » n’existent pas au Canada et qu’il n’est pas nécessaire de modifier la catégorie de risque de façon uniforme et explicite sur les emballages. La cartographie proposée et cette discussion mettent en évidence cette incohérence qui nuit au bon usage des produits et à la réduction des risques associés à la manipulation des « médicaments dangereux » en pratique pharmaceutique.
Un autre exemple découle des exigences entourant l’évaluation préalable à l’autorisation de mise en marché de différents produits. Santé Canada a amorcé des travaux afin de revoir l’encadrement réglementaire des « produits d’autosoins », regroupant les cosmétiques, les produits de santé naturels (PSN) et les médicaments vendus sans ordonnance. Santé Canada rappelle que la réglementation entourant les médicaments vendus sans ordonnance date de plus de 50 ans tandis que celle entourant les PSN date de 200421.
Santé Canada a publié un plan prospectif de révision de la réglementation pour 2019–2021, qui comporte trois phases22. Les changements envisagés visent une harmonisation par rapport aux pratiques en Europe, en Australie et aux États-Unis et une « approche proportionnelle fondée sur le risque pour l’ensemble de ces produits ». Dans la cartographie, on note que les cosmétiques, les PSN et les médicaments vendus sans ordonnance relèvent actuellement de trois éléments hiérarchiques distincts. Cette harmonisation n’est également pas étrangère au débat entourant les exigences pour la commercialisation des PSN.
Dans un reportage de La Presse publié en avril 2017, on rapporte que la « consultation lancée par Santé Canada sur la réglementation des produits de santé naturels et des médicaments sans ordonnance a conduit à de bien curieux résultats […]; la raison : des groupes de pression liés à l’industrie des produits de santé naturels ont incité les participants à répondre en masse en utilisant des réponses toutes faites et ainsi à s’opposer à tout resserrement des règles »23.
En réponse à ce constat, Santé Canada a poursuivi ses consultations. En juillet 2019, Radio-Canada rapporte que « des partisans de l’industrie des produits de santé naturels lancent une pétition qui demande au gouvernement canadien de ne pas imposer d’essais cliniques aux produits de santé naturels. Santé Canada souhaiterait mettre en place de nouvelles règles qui soumettraient les PSN aux mêmes essais cliniques que les médicaments, affirment les signataires de la pétition [...] lancée lundi à Vancouver. Ottawa chercherait ainsi à s’assurer que ces produits aient les effets promis sans effets secondaires néfastes »24.
Dans la cartographie actuelle, les PSN se retrouvent sous les produits de santé mais pas sous les produits thérapeutiques. Santé Canada a précisé ceci en amendant la Loi sur les aliments et drogues afin d’exclure les PSN des produits thérapeutiques. En outre, la controverse entourant l’efficacité réelle des PSN (y compris les remèdes homéopathiques) montre l’importance d’une cartographie explicite des différents produits utilisés. Dans l’attente d’une adoption du concept de « produits d’autosoins », les cosmétiques, les PSN et les médicaments vendus sans ordonnance restent traités séparément selon trois règlements distincts et la cartographie demeure valide.
Un dernier exemple porte sur les risques associés aux produits utilisés en pratique pharmaceutique. Les produits utilisés comportent des risques d’inefficacité, de réactions indésirables, d’erreurs médicamenteuses, d’exposition professionnelle ou de chapardage. Ces risques s’appliquent à tous les produits utilisés, peu importe l’usage qui en est fait, et ces risques peuvent affecter le travailleur de la santé ou le patient (p. ex. 1) un médicament peut causer une réaction indésirable, 2) un PSN peut être inefficace, 3) un produit dangereux peut causer une irritation cutanée, 4) un instrument peut être contaminé, 5) une substance désignée peut être volée ce qui entraîne le sous-traitement d’un patient, 6) un médicament dangereux peut augmenter le risque d’avortement spontané chez une travailleuse).
La cartographie met en évidence deux catégories de produits dit à risque, soit les médicaments à risque et les produits dangereux. En ce qui concerne les médicaments à risque, la cartographie met en évidence quatre termes, soit les médicaments dangereux (qui présentent certaines caractéristiques des produits dangereux), les médicaments pour lesquels le risque d’erreurs est élevé, les médicaments de niveau d’alerte élevé et les médicaments à index thérapeutique étroit.
La Direction de cancérologie du Québec et l’ASSTSAS utilisent l’expression « médicament dangereux » pour assurer la protection des travailleurs de la santé exposés aux médicaments décrits dans une liste publiée périodiquement par le NIOSH américain25,26. L’expression « médicament comportant un risque d’erreurs élevé » est utilisé par l’OPQ pour cibler des médicaments qui ont un potentiel d’erreurs plus élevé27. Bien qu’il n’existe pas de liste de ces médicaments, l’OPQ en mentionne certains dans ses communications, ces médicaments étant probablement liés à des plaintes déposées aux services du syndic (p. ex. lévothyroxine, lamivudine et lamotrigine)27. Le terme « médicament de niveau d’alerte élevé » est issu de l’organisme américain Institute for Safe Medication Practice28. Le pendant canadien de cet organisme (Institute for Safe Medication Practice – Canada) relaie également une liste similaire29. Enfin, le terme « médicament à index thérapeutique étroit » est utilisé depuis les années quatre-vingt-dix lors de la publication du Guide sur la substitution en pharmacie30.
En somme, nous pensons qu’il est utile de publier une cartographie des termes utilisés pour décrire les produits utilisés en pratique pharmaceutique et les risques qui leur sont associés, non seulement pour les professionnels de la santé mais également pour les autres parties prenantes et les patients. Elle illustre la complexité du marché et peut contribuer à une meilleure utilisation des termes et à une évolution cohérente du cadre juridique. Dans le futur, il serait peut-être intéressant de mener une étude descriptive auprès d’un panel de pharmaciens et d’assistants techniques en pharmacie pour vérifier leur compréhension de la cartographie et améliorer les modalités de représentation graphique.
Cette étude comporte des limites. La cartographie proposée et l’annexe des définitions commentées reposent sur différentes sources13–22, 25–30. Les lois et les règlements ont été rédigés au cours des dernières décennies et il n’y a pas d’uniformité et pas toujours de cohérence entre toutes les sources consultées. La confusion entourant le terme « drogue » et « médicament » est nuisible et il serait souhaitable d’utiliser le terme « médicament » dans tous les textes de compétence fédérale. La cartographie proposée ne distingue pas les produits sur ordonnance de ceux sans ordonnance. Il s’agit d’une dimension importante que nous avons choisi de ne pas intégrer à la cartographie, parce qu’elle est difficile à illustrer de façon cohérente. Par exemple, certains médicaments peuvent être vendus sur ou sans ordonnance, selon la volonté du prescripteur. Les vaccins ne requièrent pas forcément d’ordonnance sur le plan des exigences fédérales, mais ils font partie d’une annexe requérant une ordonnance dans certaines provinces. De plus, la cartographie ne précise pas la localisation permise de chacun de ces produits. Par exemple, l’OPQ précise dans ses communications la liste des produits qui peuvent être vendus en pharmacie (p. ex. médicaments, produits de santé naturels, dentifrices, laits maternisés, produits pour lentilles cornéennes et soins de la peau) et ceux qui doivent être vendus à l’extérieur de la pharmacie (p. ex. de nombreux produits de consommation, tels les bains moussants, les fixatifs à cheveux, les vêtements d’incontinence)13.
Cette revue documentaire propose une cartographie de 42 termes décrivant les produits utilisés en pratique pharmaceutique. À notre connaissance, il n’y a pas de cartographie similaire et complète publiée au Canada. Cette cartographie aide à situer l’ensemble des termes, leur hiérarchie et peut contribuer à un meilleur encadrement de leur utilisation en pratique pharmaceutique. Le pharmacien ou l’assistant technique capable de comprendre correctement chacun de ces termes sera davantage en mesure de respecter les balises juridiques et normatives applicables à ces dénominations.
Cet article comporte une annexe; elle est disponible sur le site de Pharmactuel (www.pharmactuel.com).
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Jean-François Bussières est membre du comité de rédaction de Pharmactuel. Les auteurs ne déclarent aucun autre conflit d’intérêts en relation avec le présent article.
1. Dousset JF. Histoire des médicaments, des origines à nos jours. 1ère édition. Paris : Payot; 1985. 405 p.
2. Mark JJ. « Sushruta», Ancient history encyclopedia. [en ligne] https://www.ancient.eu/sushruta/ (site visité le 14 août 2019).
3. Gachelin G. Découverte du papyrus Ebers, Encyclopædia Universalis. [en ligne] http://www.universalis.fr/encyclopedie/decouverte-du-papyrus-ebers/ (site visité le 14 août 2019).
4. Anonyme. Bibliothèque numérique mondiale. De Materia Medica de Dioscoride. [en ligne] https://www.wdl.org/fr/item/10632/ (site visité le 14 août 2019).
5. Turner NJ, Arnason JT, Hebda RJ, Johns T, Parrott Z. Encyclopédie canadienne. Utilisation des plantes par les Autochtones. [en ligne] https://www.thecanadianencyclopedia.ca/fr/article/utilisation-des-plantes-par-les-autochtones (site visité le 14 août 2019).
6. Lanthier A. Les plantes médicinales canadiennes. 2ème édition. Édition Paulines, 1980, 92 pages. [en ligne] https://cap.banq.qc.ca/notice?id=p%3A%3Ausmarcdef_0000122968&locale=fr (site visité le 14 août 2019).
7. Lamarre D. La roue de médecine des indiens d’Amérique : recettes de remèdes traditionnels. Montréal, Édition Québécor. 2011, 153 p.
8. Lessard R. Pratique et praticiens en contexte colonial : le corps médical canadien aux 17ème et 18ème siècle, thèse présentée à la faculté des études supérieures de l’université Laval. [en ligne] https://corpus.ulaval.ca/jspui/handle/20.500.11794/17833 (site visité le 14 août 2019).
9. Tésio S. Histoire de la pharmacie en France et en Nouvelle-France au XVIIIème siècle. Québec, Presse de l’Université Laval, 2009, 331 p. [en ligne] https://cap.banq.qc.ca/notice?id=p%3A%3Ausmarcdef_0003773883&locale=fr (site visité le 14 août 2019).
10. Chast F. Histoire contemporaine des médicaments. 1ère édition. Paris : La Découverte; 2002 : 416 p.
11. Association médicale mondiale. Déclaration d’Helsinki de l’AMM – principes éthiques applicables à la recherche médicale impliquant des humains. [en ligne] https://www.wma.net/fr/policies-post/declaration-dhelsinki-de-lamm-principes-ethiques-applicables-a-la-recherche-medicale-impliquant-des-etres-humains/ (site visité le 14 août 2019).
12. Labrosse P, Porteils C, Bussières J. Historique du cadre juridique fédéral applicable à l’exercice de la pharmacie. Annales de l’Unité de recherche en pratique pharmaceutique 2017; 12 Jan:1–25. [en ligne] http://indicible.ca/urpp/20150414_STUDIUM6_Annales.pdf (site visité le 14 août 2019).
13. Bussières JF. Législation et systèmes de soins, 14ème édition. À compte d’auteur. 2018. 1084 pages.
14. Gouvernement du Canada. [en ligne] https://www.canada.ca/fr.html (site visité le 1er juillet 2020).
15. Santé Canada. [en ligne] https://www.canada.ca/fr/sante-canada.html (site visité le 1er juilllet 2020).
16. Ministère de la santé et des services sociaux – Québec. [en ligne] https://www.msss.gouv.qc.ca/ (site visité le 1er juillet 2020).
17. Ordre des pharmaciens du Québec. [en ligne] https://opq.org/ (site visité le 1er juillet 2020).
18. Association pour la santé et la sécurité au travail – secteur affaires sociales – ASSTSAS. [en ligne] http://asstsas.qc.ca/ (site visité le 1er juillet 2020).
19. CNESSST. Répertoire toxicologique. [en ligne] https://www.csst.qc.ca/prevention/reptox/Pages/liste-simdut-2015-a.aspx (site visité le 14 août 2019).
20. Ordre des pharmaciens du Québec. Préparation de produits stériles dangereux en pharmacie. 2014.02. [en ligne] https://www.opq.org/doc/media/1847_38_fr-ca_0_norme201402_prod_striles_dang_oct2017.pdf (site visité le 14 août 2019).
21. Gouvernement du Canada. Prochaines étapes sur l’initiative de produits d’autosoins. [en ligne] https://www.canada.ca/fr/sante-canada/services/cadre-produits-autosoins.html (site visité le 14 août 2019).
22. Gouvernement du Canada. Plan prospectif de la réglementation 2019–2021 : cadre pour les produits d’autosoins. [en ligne] https://www.canada.ca/fr/sante-canada/organisation/a-propos-sante-canada/legislation-lignes-directrices/lois-reglements/plan-prospectif-reglementation/plan/cadre-produits-autosoins.html (site visité le 14 août 2019).
23. Mercure P. Consultation de Santé Canada. Des partisans des produits naturels « biaisent » les résultats. 1er avril 2017. [en ligne] http://plus.lapresse.ca/screens/26aa2b0c-1227-4670-ab65-93193e18e33e__7C___0.html (site visité le 14 août 2019).
24. Radio-Canada. Les opposants à de nouvelles règles pour les produits de santé naturels s’organisent. 15 juillet 2019. [en ligne] https://ici.radio-canada.ca/nouvelle/1224151/psn-npd-ottawa-medicaments-vitamines (site visité le 14 août 2019).
25. Direction générale de cancérologie. Recommandations et outils concernant l’usage sécuritaire des médicaments en cancérologie. [en ligne] https://www.msss.gouv.qc.ca/ministere/lutte-contre-le-cancer/assurer-la-qualite-des-soins-et-des-services/#recommandations-medicaments (site visité le 1er juillet 2020).
26. Association pour la santé et la sécurité au travail – secteur affaires sociales. Guide de prévention – manipulation sécuritaire des médicaments dangereux. [en ligne] http://asstsas.qc.ca/publication/guide-de-prevention-manipulation-securitaire-des-medicaments-dangereux-gp65 (site visité le 1er juillet 2020).
27. Ordre des pharmaciens du Québec. Guide d’application des standards de pratique. Médicaments à risque. [en ligne] http://guide.standards.opq.org/guides/medicaments-a-risque (site visité le 1er juillet 2020).
28. Institute for safe medication practice. High-alert medications. [en ligne] https://www.ismp.org/sites/default/files/attachments/2018-08/highAlert2018-Acute-Final.pdf (site visité le 1er juillet 2020).
29. Institute for safe medication practice – Canada. Liste de medicaments de niveau d’alerte élevé de l’ISMP. [en ligne] https://www.ismp-canada.org/fr/dossiers/HighAlertMedications2012_FR_3.pdf (site visité le 1er juillet 2020).
30. Ordre des pharmaciens du Québec. Guide sur la substitution en pharmacie, 1994. [en ligne] https://www.opq.org/doc/media/596_38_fr-ca_0_guide_substitution.pdf (site visité le 14 août 2019).
PHARMACTUEL, Vol. 53, No. 4, 2020