Efficacité et innocuité du passage d’un antibiotique intraveineux à la voie orale pour traiter l’endocardite infectieuse
Carolann Bolduc1,2,3, Pharm.D., M.Sc., Hubert Bouchard1,2,4, Pharm.D., M.Sc., Charles Bouffard1,2,5, Pharm.D., M.Sc., Aurélie Plante-Proulx1,6,7, Pharm.D., M.Sc.
1Candidat à la maîtrise en pharmacothérapie avancée au moment de la rédaction, Faculté de pharmacie, Université Laval, Québec (Québec) Canada;
2Résident en pharmacie au moment de la rédaction, Centre hospitalier universitaire de Québec-Université Laval, Hôpital Saint-François d’Assise, Québec (Québec) Canada;
3Pharmacienne, Centre intégré de santé et de services sociaux de Chaudière-Appalaches, Hôpital de Saint-Georges, Saint-Georges (Québec), Canada;
4Pharmacien, Centre hospitalier universitaire de Québec-Université Laval, Hôpital Saint-François d’Assise, Québec (Québec) Canada;
5Pharmacien, Centre intégré universitaire de santé et de services sociaux de la Capitale-Nationale, Hôpital de Baie-Saint-Paul, Baie-Saint-Paul (Québec) Canada;
6Résidente en pharmacie au moment de la rédaction, Institut universitaire de cardiologie et de pneumologie de Québec-Université Laval, Québec (Québec) Canada;
7Pharmacienne, Centre intégré universitaire de santé et des services sociaux de la Mauricie-et-du-Centre-du-Québec, Hôtel-Dieu d’Arthabaska, Victoriaville (Québec) Canada
Reçu le 30 septembre 2019: Accepté après révision par les pairs le 21 janvier 2020
Titre de l’article : Partial oral versus intravenous antibiotic treatment of endocarditis. N Eng J Med 2019;380:415-241.
Auteurs : Iversen K, Ihlemann N, Gill SU, Madsen T, Elming H, Jensen KT et coll., pour les collaborateurs de d’étude POET.
Commanditaires : Cette étude a été financée par la Danish Heart Foundation, le Capital Regions Research Council, la Hartmann’s Foundation, la Svend Aage Andersens Foundation et la Novo Nordisk Foundation. Les coûts engendrés par l’embauche du personnel de recherche ont été partiellement couverts par la Danish Heart Foundation. Les auteurs ne précisent pas la nature de la contribution des autres instances.
Cadre de l’étude : La pierre angulaire actuelle du traitement de l’endocardite infectieuse repose sur une antibiothérapie intraveineuse. En effet, selon les dernières lignes directrices de l’European Society of Cardiology (ESC) et de l’American Heart Association (AHA), un traitement antibiotique intraveineux est requis pour une durée pouvant aller jusqu’à six semaines2,3. Plusieurs complications sont associées à de tels traitements intraveineux prolongés, dont les extravasations, les thromboses ainsi que les infections locales et systémiques4. Ils peuvent également alourdir le quotidien des patients et occasionner des difficultés logistiques en contexte ambulatoire. Au cours des dernières années, ces différentes barrières ont été à l’origine d’un intérêt grandissant pour un passage à la voie orale une fois la période critique franchie, c’est-à-dire dans les deux semaines qui suivent le début de l’antibiothérapie3,4.
Toutefois, peu de données sont disponibles dans la littérature scientifique concernant la possibilité de passer à une antibiothérapie par voie orale en cours de traitement pour des sujets atteints d’endocardite. La majorité des études ayant abordé cette question de recherche s’intéressaient à un créneau très précis, soit les endocardites du cœur droit à Staphylococcus aureus pour les utilisateurs de drogues intraveineuses5,8. Alors que quelques études comportaient également des patients atteints d’endocardite du cœur gauche, aucune étude contrôlée à répartition aléatoire ne s’était attardée à examiner l’efficacité et l’innocuité du passage à la voie orale pour cette dernière patientèle spécifique8,9. C’est précisément cet aspect que l’étude POET a tenté de clarifier.
Protocole de recherche : Il s’agit d’une étude de non-infériorité, ouverte, multicentrique et à répartition aléatoire avec deux groupes de traitement parallèles en endocardite infectieuse, soit le passage d’une antibiothérapie intraveineuse à une antibiothérapie par voie orale (groupe oral) ou une antibiothérapie exclusivement intraveineuse (groupe IV). La répartition aléatoire des patients a été effectuée de manière informatique à l’aide de blocs permutés par stratification en fonction des centres. L’analyse primaire était réalisée en intention de traiter. Une analyse per protocole et une analyse de sensibilité (du type pire scénario), qui considérait que tous les patients ayant dû passer de la voie orale à la voie intraveineuse avaient eu un échec au traitement, ont également été menées. Les investigateurs ont aussi procédé à des analyses de sous-groupes pour les différents éléments évalués. Les sous-groupes étaient notamment constitués en fonction de la localisation anatomique de l’atteinte infectieuse (aortique ou mitrale), de la nature de la valve atteinte (native ou prothétique), de la bactérie impliquée et de la procédure chirurgicale de remplacement valvulaire précédant la répartition aléatoire. L’étude s’est déroulée au Danemark.
Patients : Les sujets admissibles devaient respecter les critères d’inclusion suivants : avoir au moins 18 ans, être atteints d’une endocardite du cœur gauche (sur une valve native ou prothétique) sur la base des critères de Duke modifiés, recevoir une antibiothérapie intraveineuse depuis au moins 10 jours (au moins sept jours après la chirurgie pour les patients ayant subi une chirurgie valvulaire), être cliniquement stables (sur la base de la température corporelle, du niveau de protéine C réactive et des globules blancs), présenter une infection à streptocoque, Enterococcus fæcalis, Staphylococcus aureus ou à staphylocoque à coagulase négative selon les hémocultures et ne présenter aucun abcès ou aucune anomalie valvulaire nécessitant une chirurgie selon l’échographie transœsophagienne (ETO) antérieure au recrutement. Par ailleurs, parmi les sujets exclus, on retrouvait entre autres ceux présentant des conditions pouvant affecter l’efficacité de l’antibiothérapie orale (par exemple une absorption problématique par voie entérale) ou une infection concomitante nécessitant une antibiothérapie intraveineuse2. Le suivi des patients pouvait durer jusqu’à six mois après la fin du traitement antibiotique.
Interventions : Les patients répartis dans le groupe IV devaient demeurer hospitalisés jusqu’à la fin du traitement, tandis que ceux du groupe oral pouvaient être traités ambulatoirement avec un suivi externe deux ou trois fois par semaine pendant toute la durée du traitement antibiotique.
Dans le cas du groupe IV, la sélection de l’antibiotique à privilégier était réalisée conformément aux lignes directrices de l’ESC3. Quant au groupe oral, l’emploi de deux agents concomitants était recommandé d’emblée aux cliniciens pour leurs patients. Différents régimes thérapeutiques, présentés au tableau I étaient proposés. Ces molécules devaient présenter une biodisponibilité modérée à élevée, provenir de classes pharmacologiques différentes et impliquer des mécanismes d’action et procédés de biotransformation distincts.
Tableau I Antibiotiques par voie orale recommandés dans l’étudea

Comparativement au groupe IV, l’encadrement de l’antibiothérapie orale a nécessité deux précautions supplémentaires. D’une part, des tests de sensibilité antimicrobienne par concentration minimale inhibitrice permettaient d’individualiser le choix de l’antibiotique. D’autre part, un suivi pharmacocinétique plus étroit était réalisé. Les concentrations plasmatiques des antibiotiques de l’ensemble des patients ont été mesurées à cinq reprises après l’administration de la première dose, soit après 30 minutes, une, deux, quatre et six heures. Les patients du groupe oral ont été soumis à une mesure supplémentaire des concentrations plasmatiques à l’équilibre (au cinquième jour de traitement). Un à trois jours avant la fin de l’antibiothérapie, l’ensemble des participants ont également été soumis à une ETO afin de confirmer la réponse satisfaisante au traitement. Ensuite, les patients étaient suivis en clinique externe une semaine ainsi qu’un, trois et six mois après la fin des antibiotiques.
Points évalués : L’objectif primaire regroupait la mortalité toutes causes confondues, les chirurgies cardiaques non prévues, les événements emboliques cliniquement évidents et les rechutes de bactériémie du pathogène primaire. La collecte des données commençait à la répartition aléatoire et durait jusqu’à six mois après la fin du traitement antibiotique. Un comité indépendant composé de spécialistes (un infectiologue et des cardiologues) devait confirmer à l’aveugle l’ensemble des événements préalablement déterminés par les investigateurs locaux. Par ailleurs, dans les deux groupes, les investigateurs ont colligé les données relatives aux dosages plasmatiques des antibiotiques oraux et aux manifestations indésirables ayant nécessité un changement d’antibiotique.
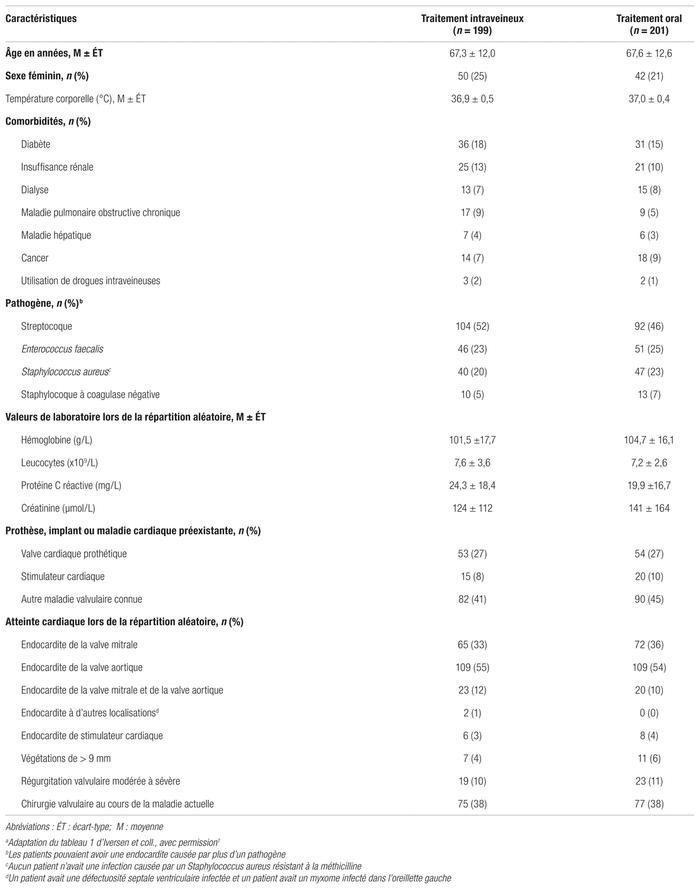
Résultats : Les participants ont été recrutés entre le 15 juillet 2011 et le 30 août 2017 dans six centres de cardiologie danois. Les chercheurs ont évalué 1954 patients pour constituer l’échantillon à l’étude. De ce nombre, 1554 ont été exclus, dont 22 % en raison d’un diagnostic non confirmé. Après une durée de traitement antibiotique médiane de 17 jours, 400 patients ont été répartis aléatoirement entre les deux groupes, soit 199 patients dans le groupe IV et 201 dans le groupe oral. La durée médiane du traitement après la répartition aléatoire était de 19 jours pour le groupe IV et de 17 jours pour le groupe oral. Le tableau II présente les caractéristiques de base des patients inclus dans l’étude. Globalement, la population avait un âge moyen de 67 ans et était majoritairement masculine (77 %). La valve aortique représentait la région anatomique la plus fréquemment atteinte (54,5 %). Une proportion appréciable (26,8 %) des sujets avaient une valve prothétique. Il faut noter que 38 % des participants avaient subi une chirurgie valvulaire avant la répartition aléatoire. Quant au pathogène le plus fréquemment impliqué, il s’agissait du streptocoque (49 %). Les caractéristiques de base étaient similaires entre les deux groupes. Le seul élément qui les distinguait de façon statistiquement significative était le niveau de la protéine C réactive, avec une valeur moyenne de 24,3 mg/L dans le groupe IV, comparativement à 19,9 mg/L dans l’autre groupe.
Tableau II Caractéristiques de base des patients inclusa
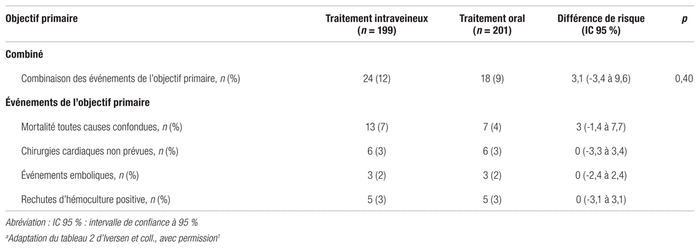
Les résultats principaux se rapportant à l’objectif primaire sont présentés au tableau III. Cet objectif comportait les éléments suivants : mortalité toutes causes confondues, chirurgies cardiaques non prévues, événements emboliques ou rechutes de bactériémie au pathogène primaire. Il s’est produit chez 12,1 % des patients sous traitement intraveineux, comparativement à 9 % des patients sous traitement oral (rapport de cotes [RC] : 0,72, intervalle de confiance à 95 % [IC 95 %] : 0,37–1,36). Le critère de non-infériorité relatif à l’objectif primaire a été atteint. Il correspondait à une marge maximale de 10 % sur la différence des risques, alors que la différence entre les deux groupes était de 3,1 % (IC 95 % : −3,4 à 9,6, p = 0,40). Les analyses de sous-groupes portant sur l’objectif primaire ont également révélé l’absence de différence statistiquement significative entre les deux groupes. Par ailleurs, aucune différence statistiquement significative n’a pu être établie entre les deux groupes en ce qui concerne les éléments individuels formant l’objectif primaire six mois après la fin de l’antibiothérapie.
Tableau III Principaux résultats d’efficacité de l’étudea
Quant aux données d’innocuité, sept patients du groupe oral ont eu des dosages plasmatiques sous-optimaux pour l’une des molécules constituant la bithérapie antibiotique. Toutefois, aucun changement lié à l’antibiothérapie n’a découlé de cette observation et aucun événement d’intérêt n’est survenu chez ces sujets. Dans tous les cas, des dosages plasmatiques adéquats étaient observés avec le deuxième antibiotique. Concernant les manifestations indésirables ayant nécessité un changement d’antibiotique, aucune différence statistiquement significative n’a été observée entre les deux groupes. Au total, 22 des 400 participants ont présenté un effet indésirable important (6 %), dont 12 (6 %) sous traitement intraveineux et 10 (5 %) sous traitement oral. Les effets indésirables rapportés incluaient les symptômes gastro-intestinaux (13,6 %), l’insuffisance rénale (4,5 %), l’insuffisance hépatique (4,5 %), la myélosuppression (27,2 %) et les réactions allergiques (50 %). Quatre patients du groupe oral sont passés au groupe IV en cours d’étude, principalement pour des motifs de tolérance et non en raison d’un échec du traitement.
Grille d’évaluation critique


Discussion
L’étude POET a mis en évidence la non-infériorité de la transition à l’antibiothérapie par voie orale dans la population étudiée, après une stabilisation initiale par voie intraveineuse comparativement à l’antibiothérapie exclusivement intraveineuse dans le cadre du traitement de l’endocardite bactérienne du cœur gauche, que ce soit sur le plan de l’efficacité ou de la sécurité.
Différentes forces de l’étude peuvent être relevées. Contrairement à l’étude POET, la plupart des études précédentes qui s’étaient intéressées au passage à une antibiothérapie orale pour traiter l’endocardite bactérienne se concentraient sur l’endocardite du cœur droit. Toutefois, puisque 90 % des endocardites atteignent le cœur gauche, la présente étude répondait à un besoin12,13. Par ailleurs, la population de POET comprenait à la fois des patients présentant une endocardite des valves natives et des patients avec une endocardite des valves prothétiques, quoique dans une proportion relativement faible (26,8 %), ce qui améliore la validité externe de l’étude. Le protocole de recherche contrôlé à répartition aléatoire et la nature multicentrique de l’étude sont d’autres forces à souligner. De son côté, l’absence de pertes au suivi limite le biais de sélection. De plus, comme les cliniciens évaluant les éléments de l’objectif primaire n’étaient pas au courant du traitement attribué aux patients, le risque de biais d’information était réduit. Par ailleurs, les critères d’inclusion microbiologiques de cette étude englobaient la majeure partie des germes usuels, le staphylocoque et le streptocoque étant impliqués dans environ 80 % des endocardites bactériennes14. Enfin, les raisons pour lesquelles certains candidats à cette étude n’ont pas été intégrés à l’échantillon sont détaillées adéquatement.
En revanche, on peut noter quelques faiblesses de l’étude. Tout d’abord, la population étudiée était exclusivement danoise. Cet élément limite probablement la généralisation des résultats à la population nord-américaine, d’autant plus que l’origine ethnique des participants n’était pas spécifiée. Des divergences sont également présentes entre les pratiques cliniques de l’étude et la prise en charge québécoise usuelle de l’endocardite. Les auteurs insistent notamment sur l’allongement marqué du séjour hospitalier associé au traitement exclusivement intraveineux, une situation moins présente au Québec avec la mise en œuvre bien établie des programmes d’antibiothérapie intraveineuse à domicile. De plus, l’acide fusidique, employé pour 13 des 201 patients du groupe oral, n’est pas disponible au Canada. L’emploi très libéral du linézolide dans le cadre de cette étude, pour des sujets présentant des endocardites à Staphylococcus aureus sensibles à la pénicilline et à la méthicilline est également à souligner. Cette pratique ne cadre pas avec la réalité québécoise, le linézolide étant un médicament d’exception remboursé par la Régie de l’assurance maladie du Québec uniquement pour les infections à Staphylococcus aureus résistant à la méthicilline ou à entérocoque résistant à la vancomycine15. De surcroît, des divergences inhérentes aux profils de susceptibilité locaux des bactéries doivent être relevées. S’il est vrai que l’amoxicilline employée pour 16 des 45 patients souffrant d’une endocardite à Staphylococcus aureus sensible à la pénicilline était une option de traitement valable pour la population à l’étude, la sensibilité du Staphylococcus aureus à l’amoxicilline est très limitée, voire inexistante, au Québec16,17. En somme, l’extrapolation des résultats à la population québécoise est restreinte. De manière plus générale, le fait que seuls 400 des 1954 patients évalués initialement pour participer à l’étude (20,5 %) aient été inclus dans l’échantillon laisse supposer que les résultats ne seront applicables qu’à une faible proportion des patients rencontrés en clinique.
Une autre faiblesse découle du fait que seuls les effets indésirables suffisants pour justifier une modification du traitement ont été signalés en cours d’étude. Les auteurs n’ont pas non plus rapporté leurs observations concernant les complications associées aux cathéters intraveineux. Tirer des conclusions quant aux différences en matière d’innocuité entre les deux groupes est donc difficile. De plus, seuls quatre germes impliqués dans les endocardites infectieuses ont été intégrés à l’échantillon et aucun patient ne présentait une atteinte à bactérie résistante (par exemple Staphylococcus aureus résistant à la méthicilline). Il est donc impossible de se prononcer sur le passage antibiotique à la voie orale dans ces circonstances ou en présence d’un pathogène différent de ceux étudiés. Par ailleurs, la faible proportion de patients âgés et fragiles dans l’échantillon peut induire un biais de sélection. L’âge avancé constituant un facteur de mauvais pronostic en endocardite, cela peut moduler modestement les résultats18. En outre, bien que le dosage sanguin des antibiotiques oraux réalisé était intéressant, un suivi aussi étroit n’est pas réaliste en pratique tant d’un point de vue logistique qu’économique. Puisqu’aucun ajustement de l’antibiothérapie n’a résulté de ces dosages, les auteurs estiment cependant qu’un tel suivi n’est pas requis lors du recours au passage à la voie orale. Il faut souligner également la différence de suivi entre les deux groupes (essentiellement en clinique externe pour le groupe oral et en milieu hospitalier pour le groupe IV), qui aurait pu jouer en faveur du groupe IV. Il est par ailleurs possible de remettre en question la faisabilité d’un suivi du groupe oral deux ou trois fois par semaine en clinique externe. Finalement, la marge de non-infériorité déterminée par les auteurs peut être remise en question. En effet, le critère de non-infériorité pouvait être atteint malgré une différence non négligeable entre les deux groupes. Si l’on compare à d’autres études en infectiologie de grande ampleur, une marge plus restreinte (donc un échantillon plus grand) aurait probablement été plus adéquate pour atteindre les objectifs de l’étude19.
POET n’est pas la première étude révélant une efficacité et une innocuité comparables du traitement oral par rapport au traitement intraveineux en contexte d’endocardite infectieuse. L’une des premières publications s’étant intéressée au passage à la voie orale dans ce contexte, l’étude de Parker et coll., remonte à 1980. Elle avait révélé que les 33 patients traités pour une endocardite à Staphylococcus aureus et ayant passé à la voie orale après la stabilisation initiale par antibiothérapie intraveineuse avaient tous obtenu une guérison complète de l’infection. Vingt-neuf des 33 patients recrutés étaient des utilisateurs de drogues intraveineuses9.
Par la suite, deux autres études, publiées respectivement en 1989 et 1996, ont évalué le traitement oral dans un contexte d’endocardite infectieuse du cœur droit chez des utilisateurs de drogues intraveineuses hospitalisés. La première, par Dworkin et coll., qui comptait 14 patients, a expérimenté un traitement oral à base de rifampicine et de ciprofloxacine en présence d’endocardite à Staphylococcus aureus des valves natives. Les patients étaient initialement traités pendant sept jours avec de la ciprofloxacine intraveineuse, après quoi ils passaient à la voie orale. Le traitement s’est traduit par une résolution de l’infection des 14 patients et un très bon profil d’innocuité6. La seconde étude, très similaire à la première, publiée par Heldman et coll., se concentrait elle aussi sur les endocardites du cœur droit à Staphylococcus aureus chez les utilisateurs de drogue intraveineuse hospitalisés. Cette fois-ci, l’échantillon comportait 93 patients, la moitié d’entre eux recevaient un traitement exclusivement intraveineux et l’autre moitié, un traitement entièrement oral à base de rifampicine et de ciprofloxacine. Le traitement oral s’est révélé non seulement aussi efficace que le traitement intraveineux, mais le profil d’innocuité était également plus favorable dans ce groupe5.
Jusqu’à tout récemment, les données de la littérature scientifique ayant trait aux endocardites du cœur gauche ou à celles contractées par la population en général étaient très limitées. En 2016, l’étude de Mzabi et coll. a mis de l’avant l’intérêt de la voie orale dans les cas d’endocardite du cœur gauche (soit 79 % de l’échantillon étudié). Après un traitement intraveineux initial, la moitié des participants de cette étude a bénéficié d’un traitement oral à base d’amoxicilline seule ou d’une combinaison d’une fluoroquinolone avec de la rifampicine et/ou de l’amoxicilline. Les pathogènes les plus fréquents étaient le streptocoque et le staphylocoque. Il est ressorti de cette étude que la fréquence de récurrence et de rechutes d’endocardite n’était pas significativement distincte entre les deux groupes8.
POET s’inscrit dans la même lignée que ces publications en ajoutant un argument supplémentaire en faveur de la transition de l’antibiothérapie IV à la voie orale pour traiter l’endocardite infectieuse5,6,8,9. Cette étude se démarque par sa nature prospective et multicentrique permettant de faire un pas de plus vers la clarification du rôle de l’antibiothérapie par voie orale dans ce contexte8. Au même titre que les autres études mentionnées, aucune différence en matière d’efficacité ou d’innocuité n’est ressortie du régime par voie orale dans l’étude POET, constat propre à entretenir l’intérêt pour cette voie d’administration lors d’endocardite infectieuse5,6,8,9.
À la lumière des résultats de POET, le passage d’une antibiothérapie intraveineuse à une antibiothérapie orale pourrait représenter une option de traitement valable pour traiter l’endocardite infectieuse du cœur gauche.
Toutefois, les candidats à une telle option thérapeutique devraient être préalablement stabilisés et présenter des caractéristiques concordant avec les nombreux critères d’inclusion et d’exclusion de cette étude. Pour le moment, étant donné la faible validité externe de POET, il est peu probable que les cliniciens considèrent d’emblée un passage de la voie d’administration IV de l’antibiotique à la voie orale dans ce contexte pour leurs patients, à l’exception de ceux pour lesquels l’antibiothérapie exclusivement intraveineuse serait impossible ou non souhaitable. À ce jour, l’antibiothérapie exclusivement intraveineuse demeure la première ligne de traitement en endocardite infectieuse du cœur gauche, mais d’autres études sur ce sujet clarifieront probablement la voie d’administration à privilégier selon divers scénarios cliniques2.
Conclusion
L’étude POET a démontré qu’un passage à une antibiothérapie par voie orale est non inférieur à une antibiothérapie exclusivement intraveineuse pour des patients danois atteints d’endocardite du cœur gauche préalablement stabilisés. Alors qu’un passage à une antibiothérapie orale pourrait constituer une solution intéressante pour certains patients ne pouvant recevoir une antibiothérapie exclusivement intraveineuse, des études supplémentaires seront nécessaires avant d’envisager un changement de la prise en charge des endocardites infectieuses du cœur gauche et d’intégrer à la pratique courante l’antibiothérapie orale.
Financement
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Conflits d’intérêts
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Remerciements
Cet article a été réalisé dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université Laval. Les auteurs en remercient la responsable Julie Méthot. Une autorisation écrite a été obtenue de cette personne
Références
1. Iversen K, Ihlemann N, Gill SU, Madsen T, Elming H, Jensen KT et coll. Partial oral versus intravenous antibiotic treatment of endocarditis. N Engl J Med 2019;380:415–24.

2. Baddour LM, Wilson WR, Bayer AS, Fowler VG, Tleyjeh IM, Rybak MJ et coll. Infective endocarditis in adults: Diagnosis, antimicrobial therapy, and management of complications: A scientific statement for healthcare professionals from the American Heart Association. Circulation 2015; 132:1435–86.

3. Habib G, Lancellotti P, Antunes MJ, Bongiorni MG, Casalta JP, Del Zotti F et coll. 2015 ESC guidelines for the management of infective endocarditis: The task force for the management of infective endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J 2015; 36:3075–128.

4. Li HK, Agweyu A, English M, Bejon P. An unsupported preference for intravenous antibiotics. PLoS Med 2015;12:e1001825.


5. Heldman AW, Hartert TV, Ray SC, Daoud EG, Kowalski TE, Pompili VJ et coll. Oral antibiotic treatment of right-sided staphylococcal endocarditis in injection drug users: prospective randomized comparison with parenteral therapy. Am J Med 1996;101:68–76.

6. Dworkin RJ, Lee BL, Sande MA, Chambers HF. Treatment of right-sided staphylococcus aureus endocarditis in intravenous drug users with ciprofloxacin and rifampicin. Lancet 1989; 2:1071–3.

7. Al-Omari A, Cameron DW, Lee C, Corrales-Medina VF. Oral antibiotic therapy for the treatment of infective endocarditis: a systematic review. BMC Infect Dis 2014;14:140.


8. Mzabi A, Kerneis S, Richaud C, Podglajen I, Fernandez-Gerlinger MP, Mainardi JL. Switch to oral antibiotics in the treatment of infective endocarditis is not associated with increased risk of mortality in non-severely ill patients. Clin Microbiol Infect 2016;22:607–12.

9. Parker RH, Fossieck BE Jr. Intravenous followed by oral antimicrobial therapy for staphylococcal endocarditis. Ann Intern Med 1980;93:832–4.

10. Sproston NR, Ashworth JJ. Role of c-reactive protein at sites of inflammation and infection. Front Immunol 2018;9:754.


11. Clyne B, Olshaker JS. The c-reactive protein. J Emerg Med 1999;17:1019–25.

12. Frontera JA, Gradon JD. Right-side endocarditis in injection drug users: review of proposed mechanisms of pathogenesis. Clin Infect Dis 2000;30:374–9.

13. Chan P, Ogilby JD, Segal B. Tricuspid valve endocarditis. Am Heart J 1989;117:1140–6.

14. Hoen B, Duval X. Clinical practice. Infective endocarditis. N Engl J Med 2013;368:1425–33.

15. Régie de l’assurance maladie du Québec. Liste des médicaments en vigueur le 18 décembre 2019. [en ligne] http://www.ramq.gouv.qc.ca/SiteCollectionDocuments/liste_med/2019/liste_med_2019_12_18_fr.pdf (site visité le 31 décembre 2019).
16. Comité de surveillance des antibiotiques. Bulletin Numéro 8: Profil de sensibilité aux antibiotiques des principales bactéries retrouvées dans les spécimens cliniques à l’Hôtel-Dieu de Québec. [en ligne] https://www.chudequebec.ca/getmedia/f0c9582e-2cf9-4cec-a7a2-7813b5dd6d3a/bulletin_08_profil_sensibilite_antibio_princip_bacteries.aspx (site visité le 16 mai 2019).
17. Ministère de la Santé et des Services sociaux du Québec. Les infections nosocomiales: Mesures de contrôle et de prévention des infections à Staphylococcus aureus ayant une sensibilité réduite à la vancomycine au Québec. [en ligne] https://publications.msss.gouv.qc.ca/msss/fichiers/2002/02-284-01.pdf (site visité le 16 mai 2019).
18. Cahill TJ, Prendergast BD. Infective endocarditis. Lancet 2016;387:882–93.

19. Li HK, Rombach I, Zambellas R, Walker AS, McNally MA, Atkins BL et coll. Oral versus intravenous antibiotics for bone and joint infection. N Engl J Med 2019;380:425–36.


Pour toute correspondance : Aurélie Plante-Proulx, Centre intégré universitaire de santé et de services sociaux de la Mauricie-et-du-Centre-du-Québec, Hôtel-Dieu d’Arthabaska, 5, rue des Hospitalières, Victoriaville (Québec) G6P 6N2, CANADA; Téléphone: 819 357-2030; Courriel: aurelie.plante-proulx@ssss.gouv.qc.ca
(Return to Top)
PHARMACTUEL, Vol. 53, No. 3, 2020