Pierre Lemieux1, B.Pharm., M.Sc., BCOP
Reçu le 5 décembre 2019: Accepté après révision par les pairs le 17 mai 2020
Résumé
Objectif : Le présent article vise à décrire l’algorithme de l’évaluation et de la prise en charge d’un patient soupçonné de souffrir d’une thrombocytopénie induite par l’héparine et à discuter des caractéristiques des anticoagulants utilisés pour le traitement de cette affection.
Sources des données et sélections des études : Les lignes directrices de 2018 de l’American Society of Hematology ainsi que les références qui y sont incluses constituent la source principale d’information pour la rédaction de cet article.
Revue du sujet traité : L’évaluation initiale d’un patient suspecté de présenter une thrombocytopénie induite par l’héparine débute par le calcul du score 4T, qui doit être confirmé par un dosage immunologique et un test fonctionnel. La prise en charge nécessite l’arrêt de l’héparine et l’initiation d’une anticoagulation sans héparine dès qu’une probabilité modérée à élevée de thrombocytopénie induite par l’héparine est établie. Les choix possibles en remplacement de l’héparine sont l’argatroban, la bivalirudine, le danaparoïde, le fondaparinux et les anticoagulants oraux directs. Les données d’efficacité et d’innocuité sont grandement variables et difficilement comparables en raison des différents types d’études, des populations et des principaux paramètres d’évaluation. Un relais pour une thérapie orale avec un antagoniste de la vitamine K ou un anticoagulant oral direct est possible si on respecte certaines directives. La durée de l’anticoagulation pour une thrombocytopénie isolée induite par l’héparine doit s’étendre au moins jusqu’à la récupération des plaquettes et peut se prolonger jusqu’à trois mois.
Conclusion : De nouvelles avenues thérapeutiques sont incluses dans les plus récentes recommandations de l’American Society of Hematology. Ces agents possèdent des propriétés pharmacologiques distinctes qui permettront aux cliniciens d’adapter plus facilement leur choix thérapeutique au regard des caractéristiques de leurs patients.
Mots clés : Anticoagulants oraux directs, argatroban, bivalirudine, danaparoïde, fondaparinux, thrombocytopénie induite par l’héparine
Abstract
Objective : The purpose of this article is to describe the algorithm for evaluating and managing a patient suspected of having heparin-induced thrombocytopenia and to discuss the characteristics of the anticoagulants used to treat this condition.
Data sources and study selection : The 2018 American Society of Hematology guidelines along with the references constituted the main source of information for writing this article.
Review of the topic : The initial evaluation of a patient suspected of having heparin-induced thrombocytopenia begins by calculating the 4T score, which must be confirmed by an immunological assay and a function test. Management requires discontinuing the heparin and initiating heparin-free anticoagulation as soon as it is determined that there is a moderate to high probability of heparin-induced thrombocytopenia. The possible alternatives to heparin are argatroban, bivalirudin, danaparoid, fondaparinux, and direct oral anticoagulants. Efficacy and safety data are highly variable and difficult to compare because of the different study types, the populations, and the primary endpoints. Relaying oral therapy with a vitamin K antagonist or a direct oral anticoagulant is an option if certain guidelines are followed. The duration of anticoagulation for isolated heparin-induced thrombocytopenia should extend at least until platelet recovery and may continue up to 3 months.
Conclusion : The American Society of Hematology’s latest recommendations contain new treatment options. These agents have distinct pharmacological properties that will make it easier for clinicians to tailor their choice of treatment to the characteristics of their patients.
Keywords : Argatroban, bivalirudin, danaparoid, direct oral anticoagulants, fondaparinux, heparin-induced thrombocytopenia
La publication des lignes directrices sur la thrombocytopénie induite par l’héparine (TIH) de l’American Society of Hematology (ASH) en 2018 s’inscrit dans le cadre d’un travail concerté pour la mise à jour des recommandations sur les thromboembolies veineuses (TEV)1. Pour arriver à ses fins, l’ASH a réuni plus de 200 experts afin de produire dix lignes directrices portant sur différents aspects de la TEV. Au moment d’écrire ces lignes, sept lignes directrices ont été publiées. Elles portent sur la prophylaxie pour les patients médicaux et chirurgicaux, le diagnostic, le traitement anticoagulant, la TIH, la grossesse et la pédiatrie, alors que trois autres concernant le traitement, le cancer et la thrombophilie sont en cours de préparation.
Ces lignes directrices ont été élaborées à l’aide de l’approche GRADE2,3. Cette approche permet d’évaluer la qualité des preuves en considérant chacun des résultats séparément ainsi que l’amplitude de l’effet mesuré. Elle assure un processus systématique et transparent. La préparation d’une recommandation sur chacune des interventions dans ce type de démarche implique également un jugement sur les ressources utilisées, la faisabilité, l’acceptabilité, l’équité et les valeurs et préférences du patient. Il en résulte deux principaux types de recommandations, fortes ou conditionnelles, sur lesquelles les cliniciens peuvent se baser pour prendre leur décision.
Basé principalement sur lignes directrices de 2018 de l’ASH, le présent article vise à décrire l’algorithme de l’évaluation et de la prise en charge d’un patient qui semble présenter une TIH et à discuter des caractéristiques des anticoagulants utilisés pour le traitement de cette affection1.
La TIH affecte moins de 0,1 % à 7 % des personnes exposées à l’héparine. Les proportions diffèrent en fonction du type d’héparine, de la durée de l’exposition à l’héparine et du type de patient. En effet, le risque de TIH est dix fois plus élevé en présence d’héparine non fractionnée (HNF) par rapport à une héparine de faible poids moléculaire (HFPM). La TIH survient également chez 2 à 3 % des patients recevant une héparine durant au moins six jours alors qu’elle est significativement moins fréquente avec un traitement de plus courte durée. Les patients chirurgicaux sont aussi trois fois plus exposés à ce risque que les patients médicaux. La thrombose (veineuse, artérielle ou microvasculaire) est la complication la plus fréquente et touchera un tiers et même la moitié des patients présentant une TIH. Sans traitement, la TIH est associée à un risque quotidien de 5 à 10 % de TEV, d’amputation et de décès1.
La pathogenèse des TIH débute lorsque des plaquettes activées, par exemple par une infection ou une chirurgie, relâchent des facteurs plaquettaires 4 (platelet factor 4 [PF4]). Les PF4 sont positivement chargés et forment des complexes avec la structure polyanionique de l’héparine. Les complexes ainsi formés peuvent être ensuite reconnus par des anticorps Immunoglobuline G (IgG) qui activent des monocytes et d’autres plaquettes au moyen respectivement des récepteurs FCγ RI et FCγ RIIa. L’activation et l’agrégation plaquettaire générées de cette façon sont responsables de la diminution de plus de 50 % des plaquettes caractéristiques d’une TIH. La production de thrombine par les plaquettes et les monocytes activés est responsable de l’état prothrombotique et des complications liées à la TIH4. Cette production est également accentuée par l’altération des cellules endothéliales.
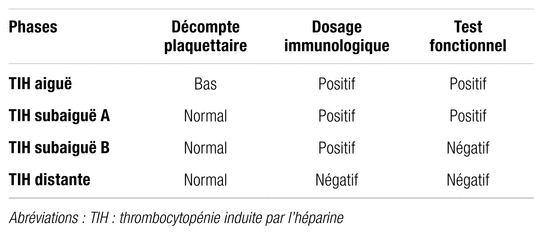
L’évolution d’une TIH se déroule en quatre phases (tableau I)5. La phase aiguë débute au moment du diagnostic et se poursuit jusqu’à la récupération plaquettaire. Dans 90 % des cas, cette récupération se produit durant les sept jours qui suivent l’arrêt de l’héparine6. La phase subaiguë A se déroule entre la récupération plaquettaire et le moment où le test fonctionnel devient négatif, soit une médiane de 50 jours après la cessation de l’agent en cause. La phase subaiguë B survient ensuite et prend fin lorsque le dosage immunologique devient négatif, soit une médiane de 85 jours à partir de l’arrêt de l’héparine7. Finalement, la dernière phase qui apparait est celle de la TIH distante.
Tableau I Phases d’une thrombocytopénie induite par l’héparine
À des fins de clarté, l’expression « TIH confirmée » dans les recommandations de l’ASH désigne un diagnostic validé par la présence d’un dosage immunologique et d’un test fonctionnel positifs ou alors d’un dosage immunologique fortement positif (p. ex. > 2 unités de densité optique). Le dosage immunologique détecte la présence d’anticorps anti-PF4/héparine circulants alors que le test fonctionnel mesure la capacité de ces anticorps à se lier et à activer les plaquettes. Il faut toutefois noter que la définition d’une TIH confirmée peut varier selon les études évaluant les différents anticoagulants non héparinés. Une TIH suspectée renvoie à une situation pour laquelle on redoute une TIH, par exemple par la présence d’un score 4T élevé, qui n’est pas confirmé ou infirmé par un dosage immunologique ou un test fonctionnel. Enfin, la TIH isolée fait référence à un diagnostic de TIH confirmée sans qu’il y ait présence d’un événement thromboembolique artériel ou veineux, à l’opposé d’une TIH avec thrombose.
Les lignes directrices de l’ASH définissent trois catégories de risque pour les patients : faible (risque de TIH de moins de 0,1 %), intermédiaire (risque de TIH de 0,1 à 1 %) et élevé (risque de TIH de plus de 1 %)1. Dans la catégorie de risque faible, on retrouve les patients médicaux et obstétricaux recevant une HFPM, les patients recevant une HFPM après une chirurgie mineure ou un trauma mineur et les patients recevant du fondaparinux. Les patients médicaux et obstétricaux recevant une HNF et ceux recevant une HFPM après une chirurgie majeure ou un trauma majeur se situent dans la catégorie de risque intermédiaire. Enfin, dans la catégorie de risque élevé se retrouvent les patients chirurgicaux et traumatiques recevant une HNF.
La surveillance des plaquettes varie donc en fonction des catégories de risque. On ne propose aucune surveillance des patients exposés à un risque faible alors qu’on conseille une surveillance tous les deux ou trois jours et au moins tous les deux jours des patients exposés à un risque intermédiaire et élevé. La période où cette surveillance est nécessaire doit être modulée en fonction de l’exposition récente ou non à l’héparine. La surveillance des patients n’ayant pas été exposés dans les 30 jours précédents est nécessaire des jours quatre à 14. Ceux préalablement exposés à l’héparine durant les 30 derniers jours doivent être monitorés à partir du jour zéro, soit la journée du début de l’administration de l’héparine.
Ces recommandations diffèrent de celles de l’American College of Chest Physician (ACCP) de 2012, qui définissent seulement deux catégories de risque : faible, soit moins de 1 %, et élevé, soit plus de 1 %8. La principale différence concerne certaines populations de patients autrefois classées dans une catégorie de risque faible, et donc sans surveillance des plaquettes, qui se trouvent maintenant dans une catégorie de risque intermédiaire, et donc avec un monitorage des plaquettes. Par exemple, les patients médicaux à qui on administre une HNF à dose thérapeutique ou prophylactique ou encore les patients recevant une HFPM en période postopératoire d’une chirurgie ou après un trauma majeur se retrouvent dans cette situation.
La prise en charge initiale d’un patient qui semble présenter une TIH est décrite à la figure 1. Elle débute par l’évaluation du score 4T (tableau II). Il est pertinent de noter que la période d’observation de la chute des plaquettes s’étend des jours cinq à 14 selon les lignes directrices de l’ASH alors qu’elle se situait des jours cinq à dix selon les recommandations antérieures8,9. Lorsque le score 4T se situe à un niveau intermédiaire (4 ou 5) ou élevé (6 à 8), on recommande un dosage immunologique en raison de la valeur prédictive positive, qui est respectivement de 14 % et de 64 %10. Si le dosage immunologique s’avère positif, un test fonctionnel est alors nécessaire en raison de la spécificité plus faible du dosage immunologique, 87 % pour les méthodes immuno-enzymatiques (ELISA) spécifiques aux IgG et 82 % pour les polyspécifiques. Une proportion significative de faux positifs peut donc en découler11. Toutefois, l’accessibilité limitée et les délais pour l’obtention du résultat d’un test fonctionnel ne nous permettent pas d’utiliser ce test pour la prise de décision initiale. Par ailleurs, ce test peut ne pas être nécessaire si le dosage immunologique est fortement positif. On ne recommande pas de tests de laboratoires pour le dépistage de la TIH ni de traitements empiriques pour les patients dont le score 4T est faible (0 à 3). Enfin, des informations incomplètes ou manquantes peuvent mener à une évaluation erronée du score 4T. Si une incertitude pèse sur les résultats du score 4T, il est prudent de procéder à des réévaluations régulières.
|
|
||
|
Figure 1 Prise en charge initiale d’un patient qui semble présenter une TIHa |
||
Tableau II Évaluation de la probabilité clinique d’une TIH selon le score 4Ta
Il faut préciser que le seuil de positivité du dosage immunologique a fait l’objet de plusieurs publications. On reconnait la relation directe entre la densité optique et la probabilité d’obtenir un test fonctionnel positif12. Bien que le résultat de laboratoire soit considéré comme positif lorsque la densité optique est supérieure à 0,4 unité, le compromis nécessaire entre la sensibilité et la spécificité pour les valeurs situées entre 0,1 et 0,4 a alimenté le débat, à savoir quelle valeur constitue le seuil le plus approprié cliniquement8,13–15. Il semble donc judicieux de souligner l’importance de prendre en considération la valeur du score 4T ainsi que la présentation clinique pour l’interprétation du dosage immunologique8,14,16.
On recommande l’arrêt du traitement à l’héparine sous toutes ses formes, y compris les HFPM, l’héparine utilisée pour la perméabilité des cathéters veineux et pour l’anticoagulation des circuits d’hémodialyse des patients qui semblent souffrir de TIH et dont le score 4T est à un niveau intermédiaire. On entreprend alors pour ces patients une anticoagulation sans héparine. Elle peut être d’intensité prophylactique pour les patients dont le risque de saignement est élevé et qui ne présentent pas d’autre indication d’anticoagulation alors qu’elle devrait être d’intensité thérapeutique pour les autres patients. Lorsqu’on pense qu’un patient ayant un score 4T élevé (6 à 8) présente une TIH, il faut cesser l’administration de l’héparine et entreprendre une anticoagulation sans héparine à intensité thérapeutique.
Quand les patients présentent un score de probabilité 4T intermédiaire ou élevé et un dosage immunologique négatif, on recommande de cesser l’anticoagulation sans héparine et de reprendre l’héparine si cela est indiqué. Cette recommandation se base notamment sur la grande sensibilité (plus de 98 %) des dosages immunologiques. Il pourrait être adéquat de répéter un dosage immunologique selon l’évaluation clinique d’un patient avec un score 4T élevé1. Lorsque le dosage immunologique se révèle positif, peu importe la valeur du score 4T, il est alors nécessaire de continuer à éviter l’héparine et de poursuivre l’administration d’un anticoagulant autre que l’héparine à une intensité thérapeutique. Dans ce cas, les patients qui recevaient une anticoagulation à intensité prophylactique doivent passer à une anticoagulation à intensité thérapeutique.
Les lignes directrices de l’ASH mentionnent également que la plupart des patients dont le test fonctionnel est négatif n’ont pas de TIH et peuvent être traités en conséquence. Cependant, selon le type d’essai fonctionnel et l’expertise technique du laboratoire, des résultats faussement négatifs sont possibles. Par conséquent, on peut envisager un diagnostic présumé de TIH pour certains patients ayant un dosage fonctionnel négatif, surtout s’ils ont un score de 4T élevé et un dosage immunologique fortement positif (trait pointillé sur la figure 1).
La prise en charge d’un patient avec un diagnostic confirmé de TIH, avec ou sans thrombose, implique nécessairement l’arrêt de l’héparine, si ce n’est déjà fait, et l’instauration d’un traitement anticoagulant sans héparine. Différents agents peuvent être utilisés dans ce contexte, soit l’argatroban, le danaparoïde, la bivalirudine, le fondaparinux et les anticoagulants oraux directs (AOD). Ces choix diffèrent significativement de ceux proposés par l’ACCP en 2012, qui proposait l’argatroban, le danaparoïde et la lépirudine. Notons que cette dernière n’est plus commercialisée au Canada.
L’argatroban est l’un des premiers agents étudiés spécifiquement pour la prise en charge de la phase aigüe d’une TIH. Cet inhibiteur direct de la thrombine a été étudié au cours de deux études similaires dont les résultats ont d’ailleurs été combinés au sein d’une analyse rétrospective19–21.
Ces deux études prospectives, multicentriques, sans répartition aléatoire, ouvertes, avec un groupe comparateur historique avaient pour objectif d’évaluer la sécurité et l’innocuité d’une anticoagulation à l’argatroban pour des patients présentant une TIH. La population à l’étude était constituée de sujets thrombocytopéniques (plaquettes < 100) ou ayant une diminution d’au moins 50 % des plaquettes sans autre explication qu’une TIH. De plus, les patients avec un antécédent de dosage immunologique positif et nécessitant une anticoagulation étaient également admissibles. Il faut souligner que la définition de la population à l’étude correspondait à des patients dont on pouvait supposer qu’ils avaient une TIH basée uniquement sur le décompte plaquettaire en l’absence d’autres causes probables. Cette définition a certainement eu pour effet d’inclure des patients sans réelle TIH, donc qui ne couraient pas de risque thrombotique aussi élevé que les autres sujets à l’étude.
Le traitement à l’argatroban était ajusté pour obtenir un temps de céphaline activée (TCA) de 1,5 à trois fois la valeur de base jusqu’à ce que la condition clinique sous-jacente soit résolue, qu’une anticoagulation appropriée avec un autre agent soit instaurée ou jusqu’à un maximum de 14 jours. Le groupe comparateur historique était généralement traité par l’arrêt de l’héparine ou de la thérapie antiplaquettaire ou encore de la warfarine. Au cours de l’analyse rétrospective, l’objectif primaire combiné a été modifié pour inclure la mortalité liée à une thrombose, l’amputation liée à une thrombose et une nouvelle thrombose dans les 37 jours après le début de l’étude.
Un total de 697 patients ayant reçu l’argatroban pour le traitement d’une TIH suspectée a été comparé à 185 contrôles historiques au cours de ces deux études. Les sujets ont été classés en deux sous-groupes selon leur présentation initiale avec ou sans thrombose (respectivement 422 et 460 sujets). Parmi les sujets sans thrombose initiale, 91 % de ceux traités à l’argatroban sont demeurés exempts d’évènements thrombotiques contrairement à 73 % des contrôles historiques (rapport de risque instantané [RRI] : 0,33, p < 0,001). Du côté des sujets présentant initialement une thrombose, 72 % n’ont pas développé d’autres évènements thrombotiques comparativement à 50 % dans le groupe témoin (RRI : 0,39, p < 0,001). Par ailleurs, l’analyse rétrospective n’a pas démontré de différence significative dans le risque de saignement majeur entre les groupes (6 % contre 7 %, p = 0,74)21.
L’administration intraveineuse de l’argatroban et sa courte demi-vie d’action en font un choix idéal pour un patient présentant une condition critique, un risque de saignement accru ou un besoin potentiel d’interventions urgentes. Son élimination par métabolisme hépatique incite à utiliser un autre agent anticoagulant en contexte de dysfonction hépatique modéré ou grave, bien que des ajustements de doses soient possibles. La posologie recommandée ainsi que les ajustements possibles dans certaines situations se trouvent au tableau III. L’utilisation de l’argatroban nécessite toutefois un suivi régulier et fréquent de l’intensité de l’anticoagulation par la mesure du TCA.
Tableau III Anticoagulants non héparinés pour la prise en charge de la phase aigüe d’une TIHa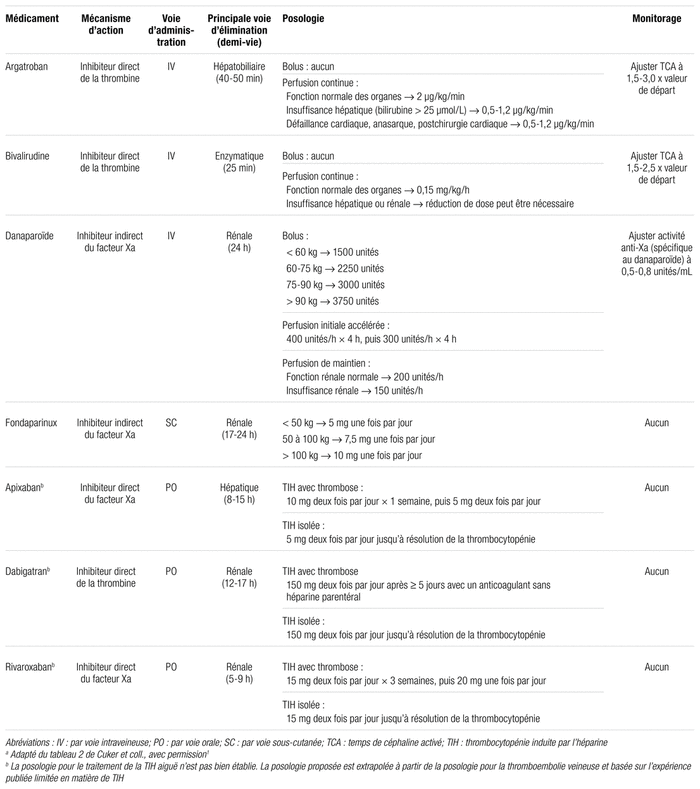
L’argatroban a la caractéristique d’augmenter le ratio normalisé international (RNI)22,23. Il n’est toutefois pas le seul inhibiteur direct de la thrombine à posséder cet effet, mais l’argatroban est celui pour lequel l’impact sur le RNI est le plus significatif. La concentration molaire nécessaire pour atteindre les niveaux visés de TCA est beaucoup plus grande avec l’argatroban qu’avec les autres inhibiteurs directs de la thrombine. À cette concentration, l’argatroban provoque une suppression de l’activité de la thrombine et par conséquent une élévation du RNI22. Cette élévation du RNI n’est toutefois pas associée à une augmentation de l’anticoagulation et du risque de saignements majeurs24.
Le danaparoïde est un glycosaminoglycan qui tire son origine de la muqueuse intestinale du porc. Il agit principalement en inactivant le facteur Xa à l’aide de l’antithrombine, ce qui prévient la génération de thrombine. L’inhibition de l’activité du cofacteur II de l’héparine et de l’activation du facteur IX contribue également à l’action anticoagulante du danaparoïde25,26.
Peu d’études prospectives à répartition aléatoire ont mesuré l’efficacité et l’innocuité du danaparoïde pour la prise en charge d’une TIH, si bien que l’information la plus substantielle sur le sujet provient d’une revue de la littérature25. Celle-ci, qui s’est étendue sur plus de vingt ans, rapporte l’impact de 1478 épisodes de traitement au danaparoïde, dont 1283 (86,8 %) TIH actives (current HIT). Une TIH active était définie par la présence d’anticorps induits par l’héparine ou une manifestation clinique de TIH durant les trois mois précédant l’utilisation du danaparoïde. La TIH était elle-même définie de trois façons différentes. On suspectait une TIH quand les plaquettes des patients diminuaient de façon inexplicable ou qu’un évènement thromboembolique se déclenchait durant un traitement à l’héparine. La présence d’un test sérologique positif, soit par dosage immunologique ou fonctionnel, caractérisait les patients ayant une TIH confirmée. Enfin, une TIH confirmée cliniquement était décrite par une nouvelle diminution des plaquettes ou une réaction locale ou systémique lors d’un nouvel essai de traitement à l’héparine, malgré l’absence de test sérologique positif. Plusieurs schémas thérapeutiques ont été utilisés, notamment en raison de l’évolution des connaissances à ce sujet au cours des deux décennies couvertes par l’étude, ainsi que différentes indications initiales de l’anticoagulation.
Un nouvel événement thromboembolique a été observé dans 162 des 1478 épisodes de traitement (11 %). Trente-huit amputations (2,6 %) ont été nécessaires durant la période à l’étude. Les saignements majeurs ont également été présents dans 120 épisodes de traitement (8,1 %). La présentation des résultats dans la publication de l’étude ne permet toutefois pas de discriminer les résultats pour le sous-groupe de patient souffrant de TIH confirmée. Il est également pertinent de noter que la mesure de l’activité anti-Xa n’était pas faite ni rapportée de façon constante, la calibration spécifique au danaparoïde de la mesure de l’anti-Xa n’étant pas accessible dans tous les hôpitaux. Il n’est donc pas possible d’établir de corrélation entre l’activité anti-Xa du danaparoïde et l’impact clinique.
Cette étude rétrospective fait également état d’un taux de réactivité croisée entre les anticorps dirigés contre le complexe PF4-héparine et le danaparoïde. Soixante-dix-huit (78) patients ont eu une réactivité croisée, comportant des conséquences cliniques, telles que la réduction ou l’échec de la récupération des plaquettes ou un évènement thromboembolique. Parmi eux, 45 (3,2 %) ont eu une confirmation sérologique de la réactivité croisée, alors qu’elle était suspectée mais non confirmée sérologiquement chez 33 patients (2,3 %). La corrélation entre une réactivité croisée in vitro et in vivo n’a pu être effectuée avec les données actuelles8,27,28. Autrement dit, un résultat positif à un test de réaction croisée entre le danaparoïde et l’héparine ne prédit pas nécessairement des conséquences cliniques. Par conséquent, on ne recommande pas de procéder à un test de détection de réactivité croisée avant l’utilisation du danaparoïde8. On devrait suspecter une réactivité croisée en l’absence d’augmentation des plaquettes après trois à cinq jours ou en présence d’un nouvel évènement thrombotique27.
Le suivi de l’efficacité du danaparoïde se fait par la mesure de l’activité anti-Xa. Une longue demi-vie rend cet agent moins pratique lorsqu’un arrêt rapide de l’anticoagulation est nécessaire. Le danaparoïde, contrairement à l’argatroban, n’affecte pas la mesure du RNI. L’ASH présente les doses utilisées lorsque le danaparoïde est administré par voie intraveineuse (tableau III). La monographie du produit stipule également qu’il est possible de l’administrer par voie sous-cutanée aux patients présentant une TIH isolée29. Toutefois, des doutes ont été soulevés quant à une efficacité moindre de ces doses prophylactiques en injections sous-cutanées30,31. Ces doutes sont suffisamment grands face à des impacts cliniques importants pour que l’ASH émette une recommandation forte à l’effet d’utiliser une anticoagulation à dose thérapeutique plutôt que prophylactique lorsque la TIH est confirmée1.
La bivalirudine est un inhibiteur direct de la thrombine administré par voie intraveineuse32. Tout comme l’argatroban, sa courte demi-vie en fait un choix optimal pour une condition critique ou en vue d’une intervention urgente. Son activité doit être évaluée et suivie par la mesure du TCA. La bivalirudine est éliminée par un métabolisme enzymatique et peut nécessiter un ajustement de doses en présence d’insuffisance rénale ou hépatique (tableau III).
L’efficacité et l’innocuité de la bivalirudine dans la prise en charge de la phase aiguë d’un TIH étaient basées principalement sur des rapports de cas jusqu’à la publication en 2014 d’une étude rétrospective portant sur 461 sujets33. Dans cette étude, les sujets ont été séparés en trois groupes. Lorsqu’un sujet présentait à la fois des tests immunologiques et fonctionnels positifs, il était classé dans le groupe TIH confirmé. Les patients dont la probabilité de TIH était modérée à élevée selon un des trois différents scores cliniques, mais qui ne pouvaient pas être inclus dans le groupe TIH confirmée, étaient alors catégorisés comme ayant une TIH suspectée9,34,35. Le dernier groupe était composé de patients ayant un antécédent de TIH, qui nécessitaient une anticoagulation parentérale. Tous ces patients ont reçu de la bivalirudine ajustée pour obtenir un TCA de 1,5 à 3 fois la valeur de base. Une transition vers la warfarine était possible après la récupération des plaquettes si la présence d’une TIH était confirmée ou indéterminée.
Parmi les sujets à l’étude, 4,6 % ont eu une nouvelle thrombose. Au sein du groupe avec une TIH confirmée, ce taux s’élève à 7,3 %. Aucune amputation secondaire à une TIH n’a été observée durant l’étude. Un saignement majeur a affecté 7,6% des sujets alors qu’un saignement non majeur, mais cliniquement significatif, en a touché 2,4 % de plus. Après 30 jours d’observation, huit décès liés à la TIH (1,7 %) sont survenus parmi les sujets à l’étude.
L’inhibition indirecte du facteur Xa par la potentialisation de l’antithrombine III est le mécanisme par lequel agit le fondaparinux36. Aucune étude prospective à répartition aléatoire ne permet d’attester l’efficacité et l’innocuité du fondaparinux pour la prise en charge d’une TIH. Deux études se démarquent toutefois. La première est une étude rétrospective comparant le fondaparinux à l’argatroban et au danaparoïde alors que la deuxième est une revue systématique publiée récemment37,38.
Une analyse rétrospective monocentrique ajustée par score de propension a procédé à une comparaison entre le fondaparinux, l’argatroban et le danaparoïde37. Les auteurs ont ainsi voulu réduire le risque de biais par surreprésentation de certains types de patients dans un groupe par rapport à l’autre. Les facteurs considérés pour le score de propension étaient l’âge, le sexe, la créatinine, le score 4T et l’index de comorbidité. La population à l’étude était composée de tous les patients ayant reçu le fondaparinux, l’argatroban ou le danaparoïde, et qui ont nécessité un dosage immunologique pour la TIH durant la période à l’étude. Notons que les patients ayant reçu plus d’un anticoagulant non hépariné étaient exclus de l’étude. L’objectif primaire de cette étude était composé des nouveaux évènements thrombotiques, tels que l’amputation, la gangrène, le décès lié à une thrombose ou tout décès pour lequel un évènement thrombotique ne peut être exclu.
Les résultats ont porté sur 133 patients ayant reçu le fondaparinux ainsi que 106 autres ayant reçu l’argatroban ou le danaparoïde. Au sein de cette cohorte non appariée, 22 patients (16,5 %) du groupe à l’étude ont subi des évènements liés à l’objectif primaire par rapport à 21 (19,8 %) du groupe comparateur (p = 0,392). Après appariement pour le score de propension, le taux d’évènements liés à l’objectif n’était toujours pas différent entre les deux groupes (16,5 % contre 21,4 %, p = 0,424). Les groupes à l’étude n’étaient pas non plus différents en ce qui a trait aux saignements majeurs, tant dans la cohorte non appariée que celle appariée (respectivement 21,1 % contre 25,5 %, p = 0,420 et 21,1 % contre 20,0 %, p = 0,867). Un hématologue a également procédé à la stratification des résultats en fonction de la présence d’une TIH confirmée par un test fonctionnel ou d’un diagnostic de TIH confirmée. Parmi les 44 patients avec une TIH confirmée et ayant reçu du fondaparinux, sept (15,9 %) ont développé un évènement lié à l’objectif primaire contre dix des 38 patients (26,3 %) avec une TIH confirmée, ayant reçu de l’argatroban ou du danaparoïde dans la cohorte non appariée (p = 0,246). Encore une fois, ces résultats concordent avec ceux de la cohorte appariée (15,9 % contre 25,0 %, p = 0,492).
Le fondaparinux a aussi fait l’objet d’une revue de la littérature38. Elle présente les résultats de neuf études portant sur les impacts cliniquement significatifs d’une TIH (thrombose et saignements majeurs) sur des patients ayant reçu un diagnostic de TIH confirmée par un test sérologique ou fonctionnel avec des critères cliniques d’une TIH bien définis (score 4T). Parmi les 154 patients inclus dans les neuf études, dix (6,5 %) ont présenté un nouvel évènement thrombotique durant le traitement au fondaparinux. Vingt-six (16,9 %) épisodes de saignements majeurs ont également été constatés, bien que la définition de saignements majeurs différait d’une étude à l’autre. Il est important de noter que sept des dix évènements thrombotiques proviennent de la même étude, soit celle décrite précédemment37. Les auteurs de la revue systématique soulignent que, dans cette étude, 59,4 % des patients ont reçu une dose prophylactique de fondaparinux (2,5 mg). Ce taux semble plus élevé que ceux observés par les autres études39–44. Cette analyse indirecte ne peut en aucun cas permettre d’établir un lien de causalité entre la dose prophylactique de fondaparinux et une moins grande efficacité de la prise en charge d’un TIH, mais conforte tout de même la recommandation de l’ASH à l’effet d’utiliser une dose thérapeutique plutôt que prophylactique dans ce contexte.
L’administration sous-cutanée de doses thérapeutiques est une des caractéristiques qui distinguent le fondaparinux des autres anticoagulants (tableau III). Sa demi-vie assez longue, de 17 à 25 heures, permet une administration uniquotidienne. D’un autre côté, sa longue demi-vie favorise son emploi pour les patients cliniquement stables, qui présentent un risque hémorragique faible à modéré. Contrairement aux inhibiteurs de la thrombine et au danaparoïde, aucune analyse de laboratoire n’est nécessaire pour le suivi du niveau d’anticoagulation. Bien qu’il soit éliminé par le système rénal, le fondaparinux ne nécessite pas d’ajustement en cas d’insuffisance rénale. Il est généralement contre-indiqué lorsque la clairance de la créatinine est inférieure à 30 mL/min.
On rapporte quelques rares cas de TIH associés au fondaparinux45. À l’instar du danaparoïde, quelques cas de réactivité croisée entre les anticorps anti-héparine et le fondaparinux ont aussi été décrits, bien que la fréquence de la réactivité avec cette molécule semble inférieure à celle qui a lieu en présence du danaparoïde38,44–48. Ces considérations concernant les rares cas de TIH associés au fondaparinux et la faible possibilité de réactivité croisée n’ont pas empêché l’ASH de situer le fondaparinux comme traitement possible au même titre que les autres anticoagulants non héparinés, y compris l’argatroban et le danaparoïde.
Les AOD font partie d’une famille hétérogène de médicaments. Les membres de la classe des « gatran » (p. ex. dabigatran) agissent en inhibant directement la thrombine. Ceux faisant partie des « xaban » (p. ex. rivaroxaban, apixaban et édoxaban) agissent en inhibant le facteur Xa. Leur utilisation de plus en plus courante pour la prévention et le traitement de différents types d’évènements thromboemboliques s’étend maintenant jusqu’aux TIH. Les principales données d’efficacité et d’innocuité des AOD dans ce contexte proviennent d’une publication qui comporte à la fois les résultats d’une étude prospective, d’une étude rétrospective ainsi que d’une revue systématique de la littérature49. Une seconde étude de cohorte rétrospective vient également appuyer les résultats de la première50.
Une équipe de recherche de Hamilton, en Ontario, a tout d’abord procédé à une évaluation du rivaroxaban pour le traitement des TIH dans le contexte d’une analyse prospective observationnelle51. Confrontés à une étude cessée prématurément en raison du faible recrutement, ces chercheurs ont poursuivi leurs travaux en combinant les résultats obtenus à ceux d’une analyse de cohorte rétrospective ainsi qu’à ceux d’une revue systématique de la littérature. Pour être inclus dans les cohortes rétrospectives et prospectives, les sujets devaient avoir un test immunologique positif et un test fonctionnel positif en plus d’avoir un tableau clinique compatible avec une TIH sans avoir d’autres diagnostics plus probables. Les critères d’inclusion de la revue de la littérature étaient moins stricts, puisqu’il était possible pour un patient d’être inclus sur la base d’un score clinique intermédiaire (score 4T ≥ 4) et d’un test immunologique positif ou encore en fonction d’un score clinique élevé (score 4T ≥ 6) sans diagnostic probable autre qu’une TIH.
Au cours de l’étude prospective, les sujets ont reçu du rivaroxaban à raison de 15 mg par voie orale deux fois par jour jusqu’à récupération des plaquettes (≥ 150 × 109/L) ou jusqu’au jour 21 en présence d’une TIH avec thrombose. Par la suite, on diminuait la dose de rivaroxaban à 20 mg par voie orale une fois par jour jusqu’au jour 30. Dans le cas de l’analyse rétrospective et de la revue systématique de la littérature, plusieurs schémas posologiques ont été utilisés. Les plus courants étaient 15 mg par voie orale deux fois par jour pendant trois semaines puis 20 mg par voie orale une fois par jour, 20 mg par voie orale une fois par jour tout au long de la période de traitement ou encore identique à celle de l’analyse prospective. La revue systématique fait aussi état de l’utilisation d’apixaban et de dabigatran en phase aiguë de TIH, sans préciser les posologies utilisées. L’objectif primaire de l’étude portait sur l’incidence de nouvelles thromboses symptomatiques à 30 jours.
Quarante-six (46) patients qui ont reçu du rivaroxaban pour le traitement de la phase aiguë d’une TIH ont été inclus dans cette analyse. Parmi eux, 25 ont reçu uniquement le rivaroxaban en traitement anticoagulant alors que les 21 ont reçu au moins une dose d’un autre anticoagulant parentéral non hépariné. Un seul évènement thrombotique a été répertorié au cours de ces 46 épisodes de traitements (2,2 %). Aucun saignement majeur n’a été constaté au cours de cette étude. La revue de la littérature dans cette publication fait également état de 12 patients traités à l’apixaban et 11 au dabigatran. Aucun cas traité à l’apixaban n’a connu d’aggravation par une nouvelle thrombose alors qu’un patient sur les 11 (9,1 %) traités au dabigatran a été affecté par un nouvel évènement thrombotique. Aucun saignement majeur n’a été noté non plus avec ces deux autres anticoagulants oraux directs.
Une seconde revue de la littérature plus récente rapporte également les résultats de 12 patients traités à un anticoagulant oral direct, neuf à l’apixaban et trois au rivaroxaban50. Les cas inclus devaient présenter un score 4T égal ou supérieur à 4. Sept patients ont reçu l’apixaban à raison de 5 mg par voie orale deux fois par jour, un autre 10 mg par voie orale deux fois par jour et un dernier 2,5 mg par voie orale deux fois par jour. Les patients recevant le rivaroxaban ont tous reçu 15 mg par voie orale une fois par jour. Soulignons qu’aucun patient n’a subi de nouvel évènement thrombotique ni de saignements majeurs.
Les doses d’AOD recommandées par les experts de l’ASH se trouvent au tableau III. Il est important de noter que les mêmes contre-indications des AOD pour le traitement des thromboembolies veineuses (obésité, fonction rénale, interactions, etc.) s’appliquent à la TIH. Comme pour le fondaparinux, l’usage d’un AOD ne nécessite pas d’analyse de laboratoire pour le suivi. Les lignes directrices de l’ASH recommandent aussi d’éviter les AOD pour les patients qui présentent une thromboembolie menaçant la vie ou un membre en raison de la faible représentativité de ce type de patients dans les études s’étant intéressées à ce sujet.
Le passage à une anticoagulation orale, fortement utile pour la réduction de l’intensité du suivi et la transition vers un traitement ambulatoire, représente un point clé dans la prise en charge d’une TIH. Deux options sont possibles : les antagonistes de la vitamine K (AVK) et les anticoagulants oraux directs. Les recommandations propres à la transition vers ces classes d’anticoagulants sont résumées au tableau IV.
Tableau IV Recommandations pour la transition d’un anticoagulant non hépariné parentéral vers un anticoagulant oral29,67–69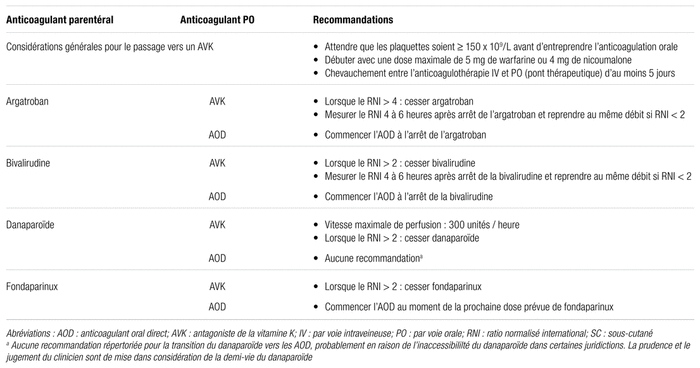
La sélection d’un AVK s’accompagne de plusieurs contraintes particulièrement importantes à considérer dans le contexte d’une TIH. La première consiste à attendre la récupération des plaquettes (≥ 150 × 109/L) avant d’instaurer un médicament de cette famille1. Cette restriction vise à prévenir la gangrène veineuse ou une progression de la thrombose provoquée par l’administration trop hâtive d’un AVK52,53. En effet, l’activité anticoagulante de la protéine C dépend de la vitamine K. La demi-vie de cette dernière, soit sept heures, est plus courte que celle des facteurs II, IX et X de sorte que l’action d’un AVK provoque une période procoagulante initiale transitoire. Cette période peut être délétère si elle est surajoutée au contexte prothrombotique de la phase aiguë d’une TIH.
Les experts s’entendent également pour recommander l’administration de la vitamine K aux patients recevant déjà un AVK au déclenchement d’une TIH en raison de cette préoccupation par rapport à l’inhibition de l’activité de la protéine C1,8. La même justification sous-tend les recommandations d’effectuer un pont thérapeutique d’au moins cinq jours avec l’anticoagulant parentéral au début d’un traitement à un AVK et d’utiliser une dose quotidienne maximale de 5 mg d’AVK.
Une dernière contrainte associée aux AVK concerne spécifiquement la situation du passage de l’argatroban à un AVK. L’argatroban se distingue par son impact significatif sur le temps de prothrombine. Il en résulte une augmentation significative du RNI en plus du TCA durant son emploi. Par conséquent, le RNI thérapeutique visé est supérieur à quatre durant l’utilisation simultanée de l’argatroban et d’un AVK1. Un suivi étroit du RNI doit ensuite être effectué lors de l’arrêt de l’argatroban afin que celui-ci se maintienne à un niveau thérapeutique. Dans le cas contraire, l’administration d’argatroban doit être reprise pour maintenir une anticoagulation efficace. Il est important de respecter cette procédure unique à l’argatroban afin d’éviter des complications, telles qu’une nouvelle thrombose ou une progression de la thrombose initiale54–56.
Les recommandations de l’ACCP et celles de l’ASH concernant la durée de l’anticoagulation divergent. Dans ses lignes directrices de 2012, l’ACCP suggère d’anticoaguler durant quatre semaines dans le cas d’une TIH isolée et durant trois mois pour une TIH avec thrombose. Par ailleurs, les recommandations de l’ASH suggèrent une anticoagulation au moins jusqu’à la récupération des plaquettes sans dépasser trois mois de traitement pour les TIH isolées. Les données soutenant cette recommandation de l’ASH proviennent d’une seule étude de cohorte portant sur 62 patients atteints de TIH isolée et non traitée57. Dans le cadre de cette étude, 52 % des sujets ont vécu un évènement thromboembolique, dont la majorité est survenue durant les dix premiers jours. Les experts de l’ASH soulignent que cette période correspond au temps nécessaire à la récupération des plaquettes et donc à la période la plus à risque. La durée de l’anticoagulation lors de TIH avec thrombose n’a toutefois pas été abordée par ces dernières lignes directrices. Les recommandations de l’ACCP concernant les TIH avec thrombose sont quant à elle extrapolées à partir des recommandations portant sur les thromboembolies veineuses en présence d’un facteur de risque transitoire58.
La présentation d’un algorithme bien structuré sur la prise en charge d’un patient suspecté de souffrir d’une TIH représente une avancée par rapport aux précédentes recommandations de l’ACCP, bien que d’autres experts aient déjà présenté des algorithmes similaires59,60.
Dans leurs lignes directrices de 2018, les experts de l’ASH recommandent l’utilisation de doses thérapeutiques plutôt que prophylactiques en présence d’une TIH confirmée en se basant sur un faible niveau de preuve. L’examen de la démarche GRADE pour cette question, disponible en ligne, nous permet de comprendre que les experts accordent une plus grande importance à la prévention des thromboses plutôt qu’au risque de saignements majeurs si ceux-ci sont adéquatement surveillés et corrigés61. On constate également que les experts jugent que l’augmentation du risque de saignement avec les doses thérapeutiques par rapport à celles prophylactiques est probablement faible, bien qu’il n’y ait aucune étude à ce sujet.
La publication des lignes directrices de l’ASH 2018 se distingue notamment par l’augmentation des agents disponibles pour la prise en charge de la phase aiguë d’un TIH. En effet, l’ajout de la bivalirudine, du fondaparinux et des AOD diversifie les options thérapeutiques pour cette affection par rapport aux recommandations de l’ACCP de 2012. Il est donc plus aisé de sélectionner un médicament adapté à une situation clinique particulière, étant donné que l’éventail des options disponibles possède des caractéristiques bien distinctes, notamment en ce qui a trait à la voie d’administration, aux voies d’élimination, au début et à la durée d’action.
L’évaluation de l’efficacité relative des agents anticoagulants est néanmoins un élément qui complique la prise en charge d’une TIH. Elle est particulièrement difficile à effectuer en raison des différentes définitions du diagnostic ou même de la suspicion de TIH ainsi que des objectifs primaires d’évaluation que donnent les principales études répertoriées. On constate que l’évolution des connaissances en la matière a permis de raffiner grandement l’approche initiale d’un patient dont on suspecte une TIH. Il en résulte que les données plus récentes décrivent une population de patients clairement définie et hautement reproductible, comme c’est le cas avec les AOD. D’autre part, à l’exception des données portant sur l’argatroban, la plus grande partie des données d’efficacité et d’innocuité proviennent d’analyses rétrospectives qui, parfois, n’avaient pas de groupes comparateurs. En conséquence, l’ASH n’émet pas de préférence quant au choix de l’anticoagulant en phase aiguë d’une TIH.
Bien qu’il soit possible de les utiliser en phase aiguë, les AOD sont recommandés pour des patients cliniquement stables et sans risque hémorragique élevé. Il est également nécessaire de souligner la faiblesse des données justifiant les recommandations sur la posologie des AOD, celle-ci étant grandement variable dans les études répertoriées, particulièrement celle du rivaroxaban49,51,62,63.
Les AOD se démarquent toutefois pour la transition d’une anticoagulation intraveineuse à orale en phase subaiguë. Les avantages des AOD par rapport aux AVK sont bien connus, mais dans le contexte des TIH, il faut également ajouter la réduction du risque d’erreur durant la période de transition. En conséquence, la préférence des AOD en phase subaiguë constitue une recommandation forte de l’ASH. La réalité québécoise nous impose toutefois de porter attention aux considérations de couverture des assurances.
Il est surprenant de constater que les experts de l’ASH fassent un pas en arrière en diminuant la précision de leurs recommandations sur la durée de l’anticoagulation alors qu’ils se basent sur les mêmes données que celles qui étaient disponibles en 2012. En examinant les recommandations de l’ACCP, on constate qu’elles se basaient sur un avis d’experts affirmant que le risque thromboembolique s’étend de deux à quatre semaines après le début d’un traitement pour une TIH63. Cet avis d’experts se base sur l’étude de cohorte de 62 patients atteints de TIH isolée, non traitée, mentionnée précédemment ainsi que sur deux séries de cas57,65,66. Dans la première série de cas portant sur 12 patients, les évènements thromboemboliques sont apparus en moyenne 9,2 jours après l’arrêt de l’héparine avec une étendue allant de cinq à 19 jours. Dans la deuxième série de cas portant sur 14 patients, les évènements thromboemboliques sont apparus avec une médiane de 13 jours après le début de l’exposition à l’héparine, et non à l’arrêt du médicament, avec une étendue allant de neuf à 40 jours. Il semble donc raisonnable d’affirmer qu’il est impossible de statuer sur la durée optimale de l’anticoagulation dans le cas d’une TIH isolée, comme le font les experts de l’ASH. Toutefois, il est possible de se questionner à savoir si le raisonnement utilisé pour les doses prophylactiques pourrait également s’appliquer ici. Autrement dit, si une importance supérieure est accordée à la prévention des thromboses plutôt qu’au risque de saignements majeurs si ceux-ci sont adéquatement surveillés et corrigés, il serait également raisonnable d’appliquer la recommandation de l’ACCP sur l’anticoagulation lors d’une TIH isolée durant quatre semaines.
De nouvelles avenues thérapeutiques sont incluses dans les plus récentes recommandations de l’ASH. Les agents examinés possèdent des propriétés pharmacologiques distinctes qui permettront aux cliniciens d’adapter plus facilement leur choix thérapeutique aux caractéristiques de leurs patients. Les experts de l’ASH émettent des priorités sur les recherches à effectuer concernant la prise en charge des TIH. Parmi celles-ci figurent la comparaison directe des anticoagulants non héparinés, les AOD pour la prise en charge en phase aiguë de même que la durée optimale de traitement d’une TIH isolée. Ils recommandent également le développement de nouvelles thérapies ciblant les voies de signalisation impliquées dans la pathogénèse de la TIH de façon à réduire le risque de thrombose sans augmenter le risque de saignements.
Aucun financement en relation avec le présent article n’a été déclaré par l’auteur.
L’auteur a rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. L’auteur a donné des conférences pour Janssen et pour Abbvie dans le domaine de l’oncologie et a été consultant pour Lundbeck et Merck dans le domaine de l’oncologie.
L’auteur tient à remercier la docteure Johanne Caron pour la révision du présent article. Une autorisation écrite a été obtenue de cette personne.
1. Cuker A, Arepally GM, Chong BH, Cines DB, Greinacher A, Gruel Y et coll. American Society of Hematology 2018 guidelines for management of venous thromboembolism: heparin-induced thrombocytopenia. Blood Adv 2018;2: 3360–92.


2. Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P et coll. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ 2008;336:924–6.


3. Guyatt G, Oxman AD, Akl EA, Kunz R, Vist G, Brozek J et coll. GRADE guidelines: 1. Introduction-GRADE evidence profiles and summary of findings tables. J Clin Epidemiol 2011; 64:383–94.

4. Greinacher A. Clinical Practice. Heparin-induced thrombocytopenia. N Engl J Med 2015;373:252–61.

5. Cuker A. Management of the multiple phases of heparin-induced thrombocytopenia. Thromb Haemost 2016;116:835–42.

6. Warkentin TE. Think of HIT. Hematology Am Soc Hematol Educ Program 2006:408–14.

7. Warkentin TE, Kelton JG. Temporal aspects of heparin-induced thrombocytopenia. N Engl J Med 2001;344:1286–92.

8. Linkins LA, Dans AL, Moores LK, Bona R, Davidson BL, Schulman S et coll. Treatment and prevention of heparin-induced thrombocytopenia: Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice Guidelines. Chest 2012;141(2 Suppl.): e495S–e530S.


9. Lo GK, Juhl D, Warkentin TE, Sigouin CS, Eichler P, Greinacher A. Evaluation of pretest clinical score (4 T’s) for the diagnosis of heparin-induced thrombocytopenia in two clinical settings. J Thromb Haemost 2006;4:759–65.

10. Cuker A, Gimotty PA, Crowther MA, Warkentin TE. Predictive value of the 4Ts scoring system for heparin-induced thrombocytopenia: a systematic review and meta-analysis. Blood 2012;120:4160–7.


11. Husseinzadeh HD, Gimotty PA, Pishko AM, Buckley M, Warkentin TE, Cuker A. Diagnostic accuracy of IgG-specific versus polyspecific enzyme-linked immunoassays in heparin-induced thrombocytopenia: a systematic review and meta-analysis. J Thromb Haemost 2017;15:1203–12.


12. Warkentin TE, Sheppard JI, Moore JC, Sigouin CS, Kelton JG. Quantitative interpretation of optical density measurements using PF4-dependent enzyme-immunoassays. J Thromb Haemost 2008;6:1304–12.

13. Althaus K, Strobel U, Warkentin TE, Greinacher A. Combined use of the high heparin step and optical density to optimize diagnostic sensitivity and specificity of an anti-PF4/heparin enzyme-immunoassay. Thromb Res 2011;128:256–60.

14. Raschke RA, Curry SC, Warkentin TE, Gerkin RD. Improving clinical interpretation of the anti-platelet factor 4/heparin enzyme-linked immunosorbent assay for the diagnosis of heparin-induced thrombocytopenia through the use of receiver operating characteristic analysis, stratum-specific likelihood ratios, and Bayes theorem. Chest 2013;144:1269–75.

15. Zwicker JI, Uhl L, Huang WY, Shaz BH, Bauer KA. Thrombosis and ELISA optical density values in hospitalized patients with heparin-induced thrombocytopenia. J Thromb Haemost 2004;2:2133–7.

16. Nagler M, Bachmann LM, ten Cate H, ten Cate-Hoek A. Diagnostic value of immunoassays for heparin-induced thrombocytopenia: a systematic review and meta-analysis. Blood 2016; 127:546–57.
17. American Society of Hematology. Diagnosis and Management of Heparin-Induced Thrombocytopenia (HIT). A pocket guide for the clinician. [en ligne] https://www.hematology.org/-/media/Hematology/Files/Clinicians/Guidelines/VTE/ASH-VTE-PREG-Pocket-Guide.pdf (site visité le 2 avril 2020).
18. Warkentin TE, Linkins LA. Non-necrotizing heparin-induced skin lesions and the 4T’s score. J Thromb Haemost. 2010;8:1483–5.

19. Lewis BE, Wallis DE, Berkowitz SD, Matthai WH, Fareed J, Walenga JM et coll. Argatroban anticoagulant therapy in patients with heparin-induced thrombocytopenia. Circulation 2001; 103:1838–43.

20. Lewis BE, Wallis DE, Leya F, Hursting MJ, Kelton JG. Argatroban anticoagulation in patients with heparin-induced thrombocytopenia. Arch Intern Med 2003;163:1849–56.

21. Lewis BE, Wallis DE, Hursting MJ, Levine RL, Leya F. Effects of argatroban therapy, demographic variables, and platelet count on thrombotic risks in heparin-induced thrombocytopenia. Chest 2006;129:1407–16.

22. Warkentin TE, Greinacher A, Craven S, Dewar L, Sheppard JA, Ofosu FA. Differences in the clinically effective molar concentrations of four direct thrombin inhibitors explain their variable prothrombin time prolongation. Thromb Haemost 2005;94:958–64.

23. Gosselin RC, Dager WE, King JH, Janatpour K, Mahackian K, Larkin EC et coll. Effect of direct thrombin inhibitors, bivalirudin, lepirudin, and argatroban, on prothrombin time and INR values. Am J Clin Pathol 2004;121:593–9.

24. Brown PM, Hursting MJ. Lack of pharmacokinetic interactions between argatroban and warfarin. Am J Health Syst Pharm 2002;59:2078–83.

25. Magnani HN, Gallus A. Heparin-induced thrombocytopenia (HIT). A report of 1,478 clinical outcomes of patients treated with danaparoid (Orgaran) from 1982 to mid-2004. Thromb Haemost 2006;95:967–81.

26. Chong BH, Gallus AS, Cade JF, Magnani H, Manoharan A, Oldmeadow M et coll. Prospective randomised open-label comparison of danaparoid with dextran 70 in the treatment of heparin-induced thrombocytopaenia with thrombosis: a clinical outcome study. Thromb Haemost 2001;86:1170–5.
27. Tardy-Poncet B, Wolf M, Lasne D, Bauters A, Ffrench P, Elalamy I et coll. Danaparoid cross-reactivity with heparin-induced thrombocytopenia antibodies: report of 12 cases. Intensive Care Med 2009;35:1449–53.

28. Greinacher A, Althaus K, Krauel K, Selleng S. Heparin-induced thrombocytopenia. Hamostaseologie 2010;30:17–8, 20–8.
29. Aspen Pharmacare Canada Inc. Monographie du danaparoïde (Orgaran). Toronto, Ontario, Canada. Février 2018.
30. Farner B, Eichler P, Kroll H, Greinacher A. A comparison of danaparoid and lepirudin in heparin-induced thrombocytopenia. Thromb Haemost 2001;85:950–7.

31. Kodityal S, Manhas AH, Udden M, Rice L. Danaparoid for heparin-induced thrombocytopenia: an analysis of treatment failures. Eur J Haematol 2003;71:109–13.

32. Sandoz Canada Inc. Monographie de produit de la bivalirudine (Angiomax). Boucherville, Québec, Canada. Septembre 2016.
33. Joseph L, Casanegra AI, Dhariwal M, Smith MA, Raju MG, Militello MA et coll. Bivalirudin for the treatment of patients with confirmed or suspected heparin-induced thrombocytopenia. J Thromb Haemost 2014;12:1044–53.

34. Cuker A, Arepally G, Crowther MA, Rice L, Datko F, Hook K, et coll. The HIT Expert Probability (HEP) Score: a novel pre-test probability model for heparin-induced thrombocytopenia based on broad expert opinion. J Thromb Haemost 2010;8:2642–50.

35. Lillo-Le Louet A, Boutouyrie P, Alhenc-Gelas M, Le Beller C, Gautier I, Aiach M et coll. Diagnostic score for heparin-induced thrombocytopenia after cardiopulmonary bypass. J Thromb Haemost 2004;2:1882–8.

36. Aspen Pharmacare Canada Inc. Monographie de produit du fondaparinux (Arixtra). Oakville, Ontario, Canada. Juillet 2019.
37. Kang M, Alahmadi M, Sawh S, Kovacs MJ, Lazo-Langner A. Fondaparinux for the treatment of suspected heparin-induced thrombocytopenia: a propensity score-matched study. Blood 2015;125:924–9.
38. Linkins LA, Hu G, Warkentin TE. Systematic review of fondaparinux for heparin-induced thrombocytopenia: When there are no randomized controlled trials. Res Pract Thromb Haemost 2018;2:678–83.


39. Warkentin TE, Pai M, Sheppard JI, Schulman S, Spyropoulos AC, Eikelboom JW. Fondaparinux treatment of acute heparin-induced thrombocytopenia confirmed by the serotonin-release assay: a 30-month, 16-patient case series. J Thromb Haemost 2011;9:2389–96.

40. Linkins LA, Bates SM, Lee AY, Heddle NM, Wang G, Warkentin TE. Combination of 4Ts score and PF4/H-PaGIA for diagnosis and management of heparin-induced thrombocytopenia: prospective cohort study. Blood 2015; 126:597–603.

41. Lobo B, Finch C, Howard A, Minhas S. Fondaparinux for the treatment of patients with acute heparin-induced thrombocytopenia. Thromb Haemost 2008;99:208–14.

42. Grouzi E, Kyriakou E, Panagou I, Spiliotopoulou I. Fondaparinux for the treatment of acute heparin-induced thrombocytopenia: a single-center experience. Clin Appl Thromb Hemost 2010;16:663–7.
43. Goldfarb MJ, Blostein MD. Fondaparinux in acute heparin-induced thrombocytopenia: a case series. J Thromb Haemost 2011;9:2501–3.

44. Snodgrass MN, Shields J, Rai H. Efficacy and safety of fondaparinux in patients with suspected heparin-induced thrombocytopenia. Clin Appl Thromb Hemost 2016;22:712–7.

45. Bhatt VR, Aryal MR, Shrestha R, Armitage JO. Fondaparinux-associated heparin-induced thrombocytopenia. Eur J Haematol 2013;91: 437–41.

46. Manji F, Warkentin TE, Sheppard JI, Lee A. Fondaparinux cross-reactivity in heparin-induced thrombocytopenia successfully treated with high-dose intravenous immunoglobulin and rivaroxaban. Platelets 2020;31:124–7.
47. Poudel DR, Ghimire S, Dhital R, Forman DA, Warkentin TE. Spontaneous HIT syndrome post-knee replacement surgery with delayed recovery of thrombocytopenia: a case report and literature review. Platelets 2017;28:614–20.

48. Tvito A, Bakchoul T, Rowe JM, Greinacher A, Ganzel C. Severe and persistent heparin-induced thrombocytopenia despite fondaparinux treatment. Am J Hematol 2015;90:675–8.

49. Warkentin TE, Pai M, Linkins LA. Direct oral anticoagulants for treatment of HIT: update of Hamilton experience and literature review. Blood 2017;130:1104–13.

50. Davis KA, Davis DO. Direct acting oral anticoagulants for the treatment of suspected heparin-induced thrombocytopenia. Eur J Haematol 2017;99:332–5.

51. Linkins LA, Warkentin TE, Pai M, Shivakumar S, Manji RA, Wells PS et coll. Rivaroxaban for treatment of suspected or confirmed heparin-induced thrombocytopenia study. J Thromb Haemost 2016;14:1206–10.

52. Warkentin TE, Elavathil LJ, Hayward CP, Johnston MA, Russett JI, Kelton JG. The pathogenesis of venous limb gangrene associated with heparin-induced thrombocytopenia. Ann Intern Med 1997;127:804–12.
53. Srinivasan AF, Rice L, Bartholomew JR, Rangaswamy C, La Perna L, Thompson JE et coll. Warfarin-induced skin necrosis and venous limb gangrene in the setting of heparin-induced thrombocytopenia. Arch Intern Med 2004;164: 66–70.

54. Bartholomew JR, Hursting MJ. Transitioning from argatroban to warfarin in heparin-induced thrombocytopenia: an analysis of outcomes in patients with elevated international normalized ratio (INR). J Thromb Thrombolysis 2005;19: 183–8.

55. Hursting MJ, Lewis BE, Macfarlane DE. Transitioning from argatroban to warfarin therapy in patients with heparin-induced thrombocytopenia. Clin Appl Thromb Hemost 2005;11:279–87.

56. Warkentin TE. Anticoagulant failure in coagulopathic patients: PTT confounding and other pitfalls. Expert Opin Drug Saf 2014;13:25–43.
57. Warkentin TE, Kelton JG. A 14-year study of heparin-induced thrombocytopenia. Am J Med 1996;101:502–7.

58. Kearon C, Akl EA, Comerota AJ, Prandoni P, Bounameaux H, Goldhaber SZ et coll. Antithrombotic therapy for VTE disease: Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2012;141(2 Suppl.):e419S-e96S.


59. Cuker A, Cines DB. How I treat heparin-induced thrombocytopenia. Blood 2012;119: 2209–18.

60. Thrombosis Canada. Heparin-induced throbocytopenia (HIT). [en ligne] https://thrombosiscanada.ca/wp-content/uploads/2019/01/37.-Heparin-Induced-Thrombocytopenia-16Nov2018.pdf. (site visité le 6 octobre 2019).
61. American Society of Hematology 2018 guidelines for management of venous thromboembolism: heparin-induced thrombocytopenia. GRADE Evidence-to-Decision (EtD) framework. [en ligne] https://dbep.gradepro.org/profile/D1230F84-C07C-BBF8-9214-2AB5D71750A3 (site visité le 1er avril 2020).
62. Ng HJ, Than H, Teo EC. First experiences with the use of rivaroxaban in the treatment of heparin-induced thrombocytopenia. Thromb Res 2015;135:205–7.
63. Sharifi M, Bay C, Vajo Z, Freeman W, Schwartz F. New oral anticoagulants in the treatment of heparin-induced thrombocytopenia. Thromb Res 2015;135:607–9.

64. Arepally GM, Ortel TL. Clinical practice. Heparin-induced thrombocytopenia. N Engl J Med 2006;355:809–17.

65. Warkentin TE, Kelton JG. Delayed-onset heparin-induced thrombocytopenia and thrombosis. Ann Intern Med 2001;135:502–6.

66. Rice L, Attisha WK, Drexler A, Francis JL. Delayed-onset heparin-induced thrombocytopenia. Ann Intern Med 2002;136:210–5.

67. Thrombophilia and Anticoagulation Clinic, Minneapolis Heart Institute. Switching to and from various anticoagulants. [en ligne] https://www.mplsheart.com/wp-content/uploads/2017/07/Switching%20To-From%20Anticoagulants.pdf (site visité le 3 avril 2020).
68. Thomas Land Publishers, Inc. Transition of anticoagulants 2019. [en ligne] https://store.thomasland.com/AnticoagTransitions_2019%20FINAL.pdf (site visité le 3 avril 2020).
69. The University of Texas MD Anderson Cancer Center. Heparin induced thrombocytopenia (HIT) treatment. [en ligne] https://www.mdanderson.org/content/dam/mdanderson/documents/for-physicians/algorithms/clinical-management/clin-management-heparin-it-web-algorithm.pdf (site visité le 3 avril 2020).
PHARMACTUEL, Vol. 53, No. 4, 2020