Marie-Ange Audet1, Félix Thompson-Desormeaux2, Pharm.D., M.Sc., Jean-Marc Forest2, B.Pharm., DPH, M.Sc., Grégoire Leclair3, B.Pharm., Ph.D.
Reçu le 11 mars 2020: Accepté après révision par les pairs le 25 août 2020
Résumé
Objectif : Établir la compatibilité du soluté Plasmalyte-AMD avec 99 autres médicaments lors d’administrations en Y.
Méthode : Le Plasmalyte-AMD a été combiné (ratio 1:1) séquentiellement à 99 médicaments injectables non dilués à la température ambiante. Chaque préparation a été réalisée deux fois. La première a subi une évaluation visuelle et un test de dénombrement des particules par obstruction de lumière, immédiatement après le mélange. Ces tests ont été répétés quatre heures après le mélange initial en utilisant la seconde préparation. Pour être considérés comme compatibles, les mélanges ne devaient pas présenter de précipitation ou tout autre changement observable (turbidité, cristaux, formation de gaz, changement de couleur) et devaient respecter la spécification établie par la norme USP <788> 1.B, à la fois au temps zéro et quatre heures après le mélange.
Résultats : Au total, 87 des 99 médicaments injectables testés avec le Plasmalyte-AMD se sont révélés compatibles à la fois visuellement à l’œil nu et à l’aide du compteur de particules selon la norme USP <788>.
Conclusion : Un certain nombre de médicaments se sont révélés compatibles lorsqu’ils étaient mélangés selon un ratio de 1:1 avec le Plasmalyte-AMD. Il faut cependant prendre en considération le fait que seuls les critères physiques ont été évalués dans cette étude.
Mots clés : Administration en Y, compatibilité, Plasmalyte-AMD
Abstract
Objective : To determine the compatibility of Plasmalyte-A® with 99 other drugs during Y-site administration.
Method : Plasmalyte-A® was combined (1:1 ratio) sequentially with 99 undiluted injectable drugs at room temperature. Each combination was prepared twice. One sample underwent a visual inspection and a light obstruction particle count test immediately after mixing. These tests were repeated on the other sample 4 hours after the initial mixing. To be considered compatible, the mixtures had to be free of precipitate or any other observable changes (turbidity, crystals, gas formation or colour change) and had to meet the specification established by USP <788> 1.B, both at time zero and 4 hours after mixing.
Results : In all, 87 of the 99 injectable drugs tested with Plasmalyte-A® were found to be compatible both visually with the naked eye and with the particle counter, as per USP <788>.
Conclusion : A certain number of drugs were found to be compatible when mixed in a 1:1 ratio with Plasmalyte-A®. However, it should be borne in mind that only the physical criteria were examined in this study.
Keywords : Compatibility, Plasmalyte-A®, Y-site administration
Le Plasmalyte-AMD est une solution cristalloïde, un soluté d’hydratation isotonique, iso-osmotique à pH neutre utilisé au Centre hospitalier universitaire (CHU) Sainte-Justine pour l’hydratation et l’hyperhydratation intraveineuses, et ce, exclusivement pour les patients en soins critiques ou en période postopératoire1. Le Plasmalyte-AMD présente plusieurs avantages comparativement aux solutés « traditionnels », soit le Lactate Ringer pour certaines utilisations et le normal salin (NS) dans tous les cas de remplacement de liquide, quand il est nécessaire d’utiliser une solution électrolytique physiologiquement équilibrée et de maintenir l’équilibre acido-basique normal tout en réduisant les risques2–4. Si le Lactate Ringer et le Plasmalyte-AMD sont considérés comme des solutions à la fois isotoniques et équilibrées, le NS n’est qu’isotonique et non équilibré en raison de sa composition, contrairement aux deux précédents qui sont davantage physiologiques.
La composition du Plasmalyte-AMD s’apparente davantage à celle du Lactate Ringer qu’à celle du NS. Le soluté NS est celui des trois qui possède les plus grandes concentrations d’ions de sodium et de chlore (seuls ions du soluté), ainsi qu’une osmolarité plus élevée que l’osmolarité moyenne du plasma chez l’individu en bonne santé. Le Lactate Ringer et le Plasmalyte-AMD sont relativement semblables et se rapprochent davantage de la composition plasmatique. Une des plus grandes différences entre les deux est l’utilisation d’acétate et de gluconate comme source de bicarbonate (pouvoir tampon) dans le Plasmalyte-AMD au lieu du lactate retrouvé dans le Lactate Ringer, et l’absence de calcium5.
En raison de sa composition, le Plasmalyte-AMD et le Lactate Ringer présentent moins de risques d’acidose métabolique (acidose lactique et acidose hyperchlorémique) que le NS. Cela explique l’utilisation du Plasmalyte-AMD en soins intensifs puisque l’acidose hyperchlorémique entraîne une mortalité plus élevée chez les patients concernés, dont ceux en contexte de choc (traumatologie, grands brûlés, choc distributif et périopératoire) pour lesquels l’hydratation intraveineuse est exclusive et nécessite d’importantes quantités de liquide2,3.
L’utilisation du Plasmalyte-AMD serait avantageuse, comparativement aux solutés « traditionnels », comme le démontrent certaines études1,6,7. Une étude comparant le Plasmalyte-AMD au NS chez les enfants souffrant de gastroentérite aiguë conclut que la réhydratation avec du Plasmalyte-AMD était bien tolérée et permettait même une amélioration de la concentration de bicarbonate dans le sang et des symptômes (d’après l’échelle clinique de déshydratation) plus rapide8. Un autre avantage du Plasmalyte AMD par rapport au Lactate Ringer est sa concentration de sodium plus élevée à 140 mEq/L, particulièrement intéressante pour des patients chez qui il est souhaitable de faire de la neuroprotection en visant habituellement une natrémie plus élevée (145 à 155 mEq/L)9.
Il est donc probable de voir à l’avenir son utilisation augmenter dans les centres hospitaliers. L’administration en Y associée à d’autres médicaments intraveineux devient alors fort probable.
Cette étude a pour but de vérifier la compatibilité entre le Plasmalyte-AMD et 99 autres médicaments intraveineux pour une administration en Y afin d’éviter la formation de précipités dans la tubulure, ce qui pourrait occasionner la perte/blocage de voies intraveineuses, pouvant alors entraîner des délais dans l’administration d’autres médications. À noter que, par prudence, il est toujours possible d’utiliser un filtre en ligne intraveineuse pour les voies centrales, réduisant ainsi les risques d’embolisation.
Hypothétiquement, il ne devrait pas y avoir un grand nombre d’incompatibilités — s’il y en a, elles ne devraient pas être graves —, car le Plasmalyte-AMD, par sa composition, est très semblable au plasma humain5.
Le Plasmalyte-AMD (Baxter, lot W8J25A1) utilisé durant l’étude se présentait en sacs de 1 L avec les concentrations suivantes d’électrolytes : Na+ 140 mEq/L, K+ 5,0 mEq/L, Mg2+ 3,0 mEq/L, Cl− 98 mEq/L, acétate 27 mEq/L et gluconate 23 mEq/L5.
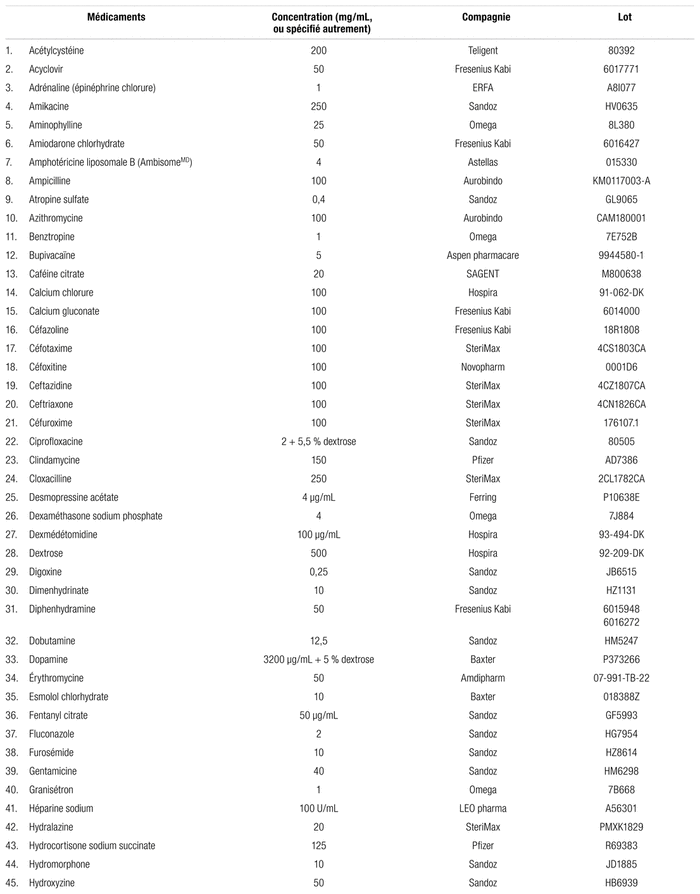
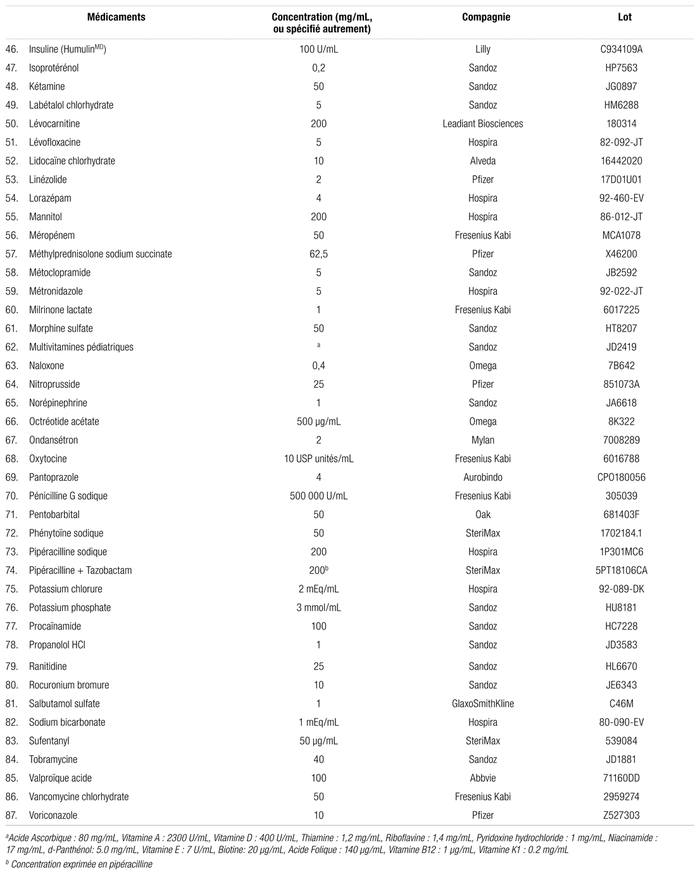
Le Plasmalyte-AMD a été mélangé successivement à 99 autres médicaments injectables présentés dans les tableaux I et II. Les médicaments nécessitant une dissolution ont été préparés avec de l’eau stérile pour injection, sauf si la monographie demandait d’utiliser du NS. La majorité des médicaments ont été testés à leur concentration maximale, initiale ou originale; c’est-à-dire selon la concentration commerciale de départ, afin de simuler le degré de risque maximum des problèmes potentiels. Les autres ont été testés à la concentration maximale utilisée au CHU Sainte-Justine, mais il est parfois délicat d’utiliser ces concentrations dites « maximales », car elles sont parfois dépassées dans certaines circonstances cliniques et ces dépassements ne sont pas toujours pris en compte dans l’évaluation des compatibilités ou incompatibilités. Tous les médicaments reconditionnés en ampoules de verre ont été filtrés à l’aide d’une aiguille filtrante de 5 μm pour éviter de confondre un débris de verre avec un précipité préalablement à son utilisation.
Tableau I Médicaments compatibles avec le Plasmalyte-AMD pour administration en Y (respectant la norme USP <788> 1.B)

Tableau II Médicaments incompatibles avec le Plasmalyte-AMD pour administration en Y (respectant la norme USP <788> 1.B)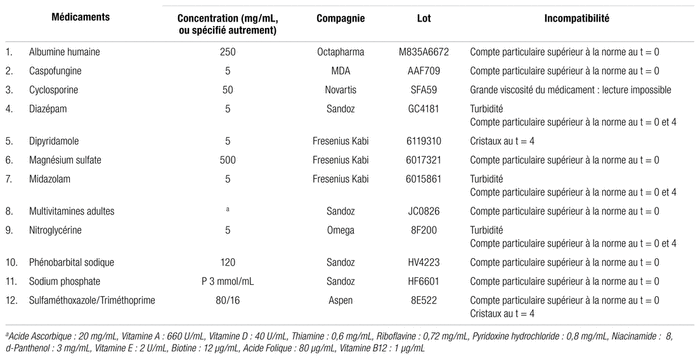
Tous les tests ont été effectués sous une lumière fluorescente et à la température ambiante (20 °C, pièce climatisée). Toutes les manipulations avec compteur de particules ont été réalisées sous hotte, dans la salle blanche du secteur fabrication de la pharmacie du CHU Sainte-Justine, limitant les risques de contamination par l’air, tel que le propose l’USP <788>. Tous les mélanges ont été réalisés en duplicata à l’aide de seringues stériles de 30 mL de polypropylène (BD). Un volume de 10 mL de Plasmalyte-AMD était mélangé manuellement par inversion à 10 mL du médicament à tester. Immédiatement après ce mélange, une évaluation visuelle à l’œil nu contre un fond blanc puis noir avait lieu afin de déceler tout changement d’aspect qui serait un signe d’incompatibilité, soit la formation d’un précipité ou de bulles de gaz, un changement de couleur, de turbidité ou de viscosité directement dans la seringue. Pour vérifier la viscosité, l’évaluateur agitait légèrement l’échantillon afin d’en vérifier le comportement. En l’absence de ces signes, l’un des deux échantillons passait au compteur de particules. Les mélanges présentant une incompatibilité visuellement détectable, pouvant nuire au compteur de particules, par exemple par formation de cristaux, n’ont pas subi de tests à l’aide de cet instrument. Quatre heures plus tard, le deuxième échantillon était soumis au même protocole. Cet intervalle de temps permettait de simuler, avec un petit excès sécuritaire, la durée de contact de deux médicaments lors des injections simultanées à de très faibles débits, comme c’est parfois le cas chez les nouveau-nés prématurés10–16. La durée de séjour maximale dans les tubulures de deux médicaments administrés en Y est d’environ trois heures10–16.
Le dénombrement des particules dans les solutions a été réalisé à l’aide de l’appareil LS-20 Liquid Particle CounterMD (Lighthouse Worldwide Solutions, Medford, OR, USA), un compteur de particules préalablement paramétré pour l’analyse des données selon la norme USP <788>18,19. L’appareil fonctionne en mesurant la diminution de l’intensité lumineuse d’un laser balayant l’échantillon. Le logiciel intégré convertit la mesure en comptage de particules en se basant sur une courbe de calibration. La procédure pour tester les petits volumes consiste à analyser quatre portions supérieures à 5 mL chacune et à éliminer la première lecture18. Le volume des échantillons était de 20 mL, les quatre premiers millilitres servant à rincer l’appareil. L’analyse était ensuite réalisée à raison de trois fois 5 mL en moyenne, laissant 1 mL dans l’appareil à la fin du test afin d’éviter d’aspirer de l’air lors de l’analyse de la dernière fraction. Cette manière de procéder facilitait les manipulations et réduisait la quantité totale de médicaments utilisés20.
La compatibilité visuelle, déterminée lors des évaluations, se limitait à observer à l’œil nu la présence ou non de particules, de bulles de gaz, d’une augmentation de la turbidité ou de la viscosité. Tout changement observable était considéré comme un signe d’incompatibilité10–17,20.
La spécification établie par l’USP <788> a servi au dénombrement particulaire. Elle stipule que les solutions parentérales et injectables fournies en volume nominal de moins de 100 mL (USP <788> et test 1.B.) réussissent le test de comptabilité si le nombre de particules présentes dans les unités testées par contenant n’excède pas 6000 particules de plus de 10 μm et 600 de plus de 25 μm par contenant de 20 mL, soit le volume total préparé dans notre cas19. Le nombre de particules de plus de 10 μm ne devait pas dépasser 300 particules/mL, soit 6000 particules divisées par le volume total de 20 mL. Le nombre de particules de plus de 25 μm ne devait pas dépasser 30 particules/mL, soit 600 particules divisées par le volume total de 20 mL19. C’est sur cette base que s’appuie l’interprétation de toutes les valeurs de résultats20.
Le Plasmalyte-AMD est compatible avec 87 des 99 médicaments testés (tableau I). Ces mélanges n’ont démontré aucune incompatibilité visuelle et répondaient aux spécifications établies par l’USP <788>1.B immédiatement après le mélange (temps [t] = 0) et après quatre heures (t = 4). Juste après leur préparation, les mélanges compatibles présentaient un nombre de particules de plus de 10 μm se situant entre 1,8 et 114,8/mL. Le nombre de particules de plus de 25 μm se situait entre 0,0 et 20,5/mL. Après quatre heures, le nombre de particules de plus de 10 μm se situait entre 0,4 et 211,4/mL et celui des particules de plus de 25 μm, entre 0,0 et 29,9/mL.
Par contre, 12 des médicaments testés se sont révélés incompatibles avec le Plasmalyte AMD (tableau II), selon les spécifications adoptées par l’étude. La majorité d’entre eux présentait une incompatibilité d’après le nombre de particules présent dans les échantillons, soit à t = 0 et/ou t = 4. Six des 12 médicaments étaient inclus dans les médicaments incompatibles pour la seule raison qu’ils dépassaient le compte particulaire accepté selon la norme USP <788>1.B, soit, pour un échantillon de 20 mL, 300 particules de plus de 10 μm et 30 particules de plus de 25 μm. Cinq autres médicaments ont présenté une incompatibilité visible à l’œil nu : il était possible d’observer la formation de cristaux de mélanges incompatibles et l’apparition de turbidité lors du mélange de trois autres mélanges incompatibles.
Le mélange avec la cyclosporine a été impossible à analyser avec le compteur de particules vu sa grande viscosité initiale, lui valant une place dans le tableau des médicaments incompatibles (tableau II). Les mélanges présentant des cristaux (dipyridamole et sulfaméthoxazole/triméthoprime) n’ont pas été testés avec le compteur de particules en t = 4, puisque la formation de cristaux est en soi une preuve d’incompatibilité et qu’il était préférable de l’éviter pour ne pas faire face à de potentiels problèmes avec l’appareil18.
Parmi les 10 mélanges avec médicaments incompatibles ayant subi des tests de comptage de particules pour t = 0 et t = 4, sept ne répondaient pas aux exigences de la norme seulement en t = 0, et les trois autres en t = 0 et en t = 4 et correspondaient aux mélanges avec turbidité. Le mélange de l’association triméthoprime/sulfaméthoxazole, en plus d’une formation de cristaux à t = 4, présentait également une incompatibilité de décompte de particules en t = 0. Les comptes particulaires en t = 0 de 10 μm et plus ne répondant pas à la norme se situaient entre 647,9 et 22 304,0, et ceux de 25 μm et plus, entre 31,8 et 340,2. En t = 4, les comptes particulaires de 10 μm et plus se situaient entre 27 536,5 et 82 605,7, et ceux de 25 μm et plus, entre 367,0 et 2249,2.
Le type de manipulations de mélanges en seringue utilisé comme méthode de simulation de l’administration intraveineuse clinique en Y s’apparente à celui utilisé dans de nombreuses autres études de compatibilité10–17,20,21. Ce modèle, reconnu dans la littérature médicale, implique que deux solutions administrées conjointement par injection en Y se rencontrent en un ratio de 1:122. Les médicaments ont presque tous été testés à concentration maximale, initiale ou originale, soit un ratio 1:1, sur la base du principe que les médicaments ne précipitant pas à haute concentration ne le feront généralement pas à une concentration inférieure. La concentration maximale, initiale ou originale de certains médicaments comme la cloxacilline dépassait la concentration maximale clinique utilisée au CHU Sainte-Justine. Dans ces cas, c’est cette dernière qui était utilisée pour les tests de compatibilité. Toutes les préparations ont été testées immédiatement (t = 0) et quatre heures après le mélange (t = 4), ce qui est la méthode classique utilisée lors des tests de compatibilité quand l’administration est en Y10–17,20,21.
La littérature scientifique compte peu de données sur les compatibilités avec le Plasmalyte-AMD, rendant difficile les comparaisons avec les autres résultats mentionnés.
Quant à la phénytoïne, souvent incompatible lors de mélanges, elle est clairement compatible avec le Plasmalyte-AMD, visuellement et avec décompte de particules22.
Le propofol 1 % n’a pas pu faire partie des médicaments testés, car il se présente sous la forme d’une préparation opaque qui ne peut pas être analysée avec le compteur de particules24. Il n’a donc pas été inclus dans l’étude. De même, la cyclosporine qui, mélangée au Plasmalyte-AMD selon un ratio de 1:1, présentait une grande viscosité, empêchant la lecture de la solution avec le compteur de particules. Il aurait fallu une plus grande dilution du médicament pour permettre le passage dans le compteur de particules. Ces résultats étant absents, il a été préférable de classer ce médicament dans la section des incompatibilités par précaution et jusqu’à ce qu’un autre type de protocole puisse être élaboré.
L’utilité d’une méthode fiable, sensible, quantitative et objective, telle que celle utilisant le compteur de particules pour réaliser les tests de compatibilité, a été démontrée une fois de plus, tout comme dans l’article portant sur la compatibilité de la cloxacilline20. Dans cette dernière étude, le compteur de particules avait permis de détecter des préparations incompatibles qui n’avaient pas été repérées à l’œil nu. Cette méthode permet aussi de confirmer les mélanges visuellement compatibles. C’est le compteur de particules qui a permis de détecter ou de confirmer l’incompatibilité des mélanges de Plasmalyte-AMD avec six médicaments intraveineux différents, leur incompatibilité n’ayant pas été détectée clairement à l’œil nu. L’observation visuelle permet malgré tout de détecter très rapidement les changements d’aspect.
Certains points suscitent toutefois des interrogations. Premièrement, l’azithromycine présentait un compte particulaire moyen de 29,9 particules de 25 μm et plus par mL en t = 4. La norme dans le cas de l’étude, qui utilisait des échantillons de 20 ml, situe la limite d’incompatibilité à 30 particules, soit 0,1 de plus que le résultat obtenu. Les multivitamines adultes ont une incompatibilité, avec un compte de 34,1 particules de 25 μm et plus en t = 0. Ce dénombrement peut porter à réflexion étant donné qu’elles ont en général une plus petite concentration de principes actifs (la vitamine K1 étant même absente de la formulation adulte de multivitamines) que les multivitamines pédiatriques qui, elles, sont compatibles. Il serait logique de s’attendre à ce que ces dernières présentent davantage une incompatibilité. Ce fait pourrait être attribuable à une différence de véhicule composant la formulation du médicament et non pas aux principes actifs eux-mêmes. Le cas du mélange avec la norépinéphrine est particulièrement intéressant puisqu’il donnait une couleur jaunâtre lors du mélange avec le Plasmalyte-AMD. Selon la monographie de Pfizer (celle de Sandoz, fabricant du médicament utilisé dans l’étude, n’étant pas disponible), le médicament devrait être jeté s’il est plus foncé que jaune pâle. Il serait intéressant de pousser les tests plus loin avec des analyses chimiques des concentrations afin de vérifier si ce changement de teinte affecte ou non la médication. Dans la même perspective, refaire les tests ayant présenté une incompatibilité par décompte particulaire ainsi que ceux ayant eu un résultat limite, comme dans le cas de l’azithromycine, pourrait être bénéfique. Cela pourrait minimiser les risques d’erreur de manipulation et confirmer ou infirmer les résultats sur la base de ces résultats d’analyse chimique qui permettraient de vérifier la teneur du médicament testé et, ainsi, sa compatibilité tant physique que chimique.
Si l’on compare la technique de détection ayant permis de déterminer une incompatibilité pour le Plasmalyte-AMD par rapport à d’autres études testant la compatibilité entre médicaments intraveineux pour administration en Y, par exemple celle sur le citrate de caféine, il est possible de constater qu’ici, presque toutes les incompatibilités ne viennent pas seulement du compte de particules de 10 et 25 μm et plus, mais d’une incompatibilité visible à l’œil nu, soit une formation d’un précipité, de cristaux, d’un changement de couleur, etc21,23. Une incompatibilité physique semble donc plus facile à détecter visuellement avec le Plasmalyte-AMD, ce qui est rassurant lors de l’administration.
Par rapport au Lactate Ringer, le Plasmalyte-AMD peut présenter moins d’incompatibilités puisqu’il ne contient pas de calcium, reconnu incompatible avec le magnésium et les bicarbonates ou encore la ceftriaxone. Cela lui confère un avantage en pratique clinique22.
Parmi les 99 médicaments testés, 87 se sont révélés compatibles lorsqu’ils étaient mélangés selon un ratio de 1:1 avec le Plasmalyte-AMD, les deux substances étant généralement à leur concentration maximale, initiale ou originale. Il faut toutefois prendre en considération le fait que seuls les critères physiques sont pris en charge ici, ce qui ne permet pas de garantir l’efficacité clinique de mélanges reconnus compatibles. Toutefois, les résultats sont particulièrement pertinents dans un contexte de soins critiques pour la médication à administrer sans délai (antibiotiques) et pour la titration sans interruption du soluté (agents vasoactifs), et ce, dans les contextes où l’hydratation aux cristalloïdes est primordiale (choc septique, hypovolémique, etc.).
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs. La totalité des médicaments étudiés provenait du département de pharmacie du CHU Sainte Justine.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Les auteurs tiennent à remercier Mme Mihaela Friciu, agente de recherche, Plateforme de biopharmacie, Faculté de pharmacie, Université de Montréal, Montréal, pour son aide tout au long de l’élaboration des tests. Une autorisation écrite a été obtenue de cette personne.
1. Zander R. Fluid Management. Die Deutsche Bibliothek 2006: p.10.
2. Boldt J. The balanced concept of fluid resuscitation. Br J Anaesth 2007;99:312–5.
3. Mythen M, Vercueil A. Fluid Balance. Vox Sanguinis 2004;87(suppl. 1):S77–81.
4. AABB, America’s Blood Centers, American Red Cross. Circular of information for the use of human blood and blood components. July 2002: 4: 74 p.
5. Kratz A, Ferraro M, Sluss PM, Lewandrowski KB. Laboratory reference values. N Engl J Med 2004;351:1548–63.
6. Hadimioglu N, Saadaway I, Saglam T, Ertug Z, Dinckan A. The effect of different crystalloid solutions on acid-base balance and early kidney function after kidney transplantation. Anesth Analog 2008;107:264–9.
7. Mc Farlane C, Lee AA. Comparison of Plasmalyte 148 and 0.9 % saline for intra-operative fluid replacement. Anaesthesia 1994; 49:779–81.
8. Allen, CH, Goldman, RD, Bhatt S, Simon HK, Gorelick MH, Spandforter PR et coll. A randomized trial of Plasma-Lyte A and 0.9 % sodium chloride in acute pediatric gastroenteritis. BMC Pediatr 2016;16:117.
9. Kochanek PM, Tasker RC, Bell MJ, Adelson PD, Carney N, Vavilala MS et coll. Management of pediatric severe traumatic brain injury: 2019 consensus and guidelines-based algorithm for first and second tier therapies. Pediatr Crit Care Med 2019; 20:269–79.
10. Ferreira E, Forest JM, Hildgen P. Compatibilité du dimenhydrinate injectable pour l’administration en Y. Pharmactuel 2004;37:17–20.
11. Péré H, Chassé V, Forest JM, Hildgen P. Compatibilité du pantoprazole injectable lors d’administration en Y. Pharmactuel 2004;37: 193–6.
12. Pelletier É, Forest JM, Hildgen P. Compatibilité de la kétamine injectable lors de l’administration en dérivé avec d’autres médicaments usuels. Pharmactuel 2006;39:71–5.
13. Pelletier É, Forest JM, Hildgen P. Compatibilité des mélanges de morphine et de kétamine ou d’hydromorphone et de kétamine injectables lors de leur administration en dérivé avec d’autres médicaments usuels. Pharmactuel 2007;40(suppl. 2):23–7.
14. Tollec S, Touzin K, Pelletier É, Forest JM. Évaluation visuelle de la compatibilité physique de la naloxone avec d’autres médicaments intraveineux usuels. Pharmactuel 2013;46:16–22.
15. Legris ME, Valiquette ME, Lavoie A, Forest JM, Leclair G. Compatibilité physique par évaluation visuelle du salbutamol injectable lors de son administration en Y. Pharmactuel 2011;44:14–8.
16. Forest JM, Hildgen P. Compatibilité de l’acétylcystéine injectable lors d’administration en Y avec d’autres médicaments usuels. Pharmactuel 2014;47:161–6.
17. Legris ME, Lavoie A, Forest JM, Hildgen P. Compatibilité par évaluation visuelle du thiopental injectable lors de son administration en Y avec des médicaments usuels. Pharmactuel 2014;47:167–72.
18. Manuel d’instruction de l’appareil LS-20 Liquid Particle Counter (Lighthouse Worldwide Solutions, Medford, OR). 54 p.
19. <788> Particulate matter in injections. In: United States Pharmacopeia. USP 36. Rockville, MD; United States Pharmacopeia; 2012. p.350–3.
20. Sullivan T, Forest JM, Leclair G. Compatibility of cloxacillin sodium with selected intravenous drugs during simulated Y-site administration. Hosp Pharm 2015;50:214–20.

21. Mitchell AL, Gailey RA. Compatibility of caffeine citrate with other medications commonly used in a neonatal intensive care unit. J Ped Pharm Pract 1999;4:239–42.
22. Trissel LA. Trissel’s tables of physical compatibility. 1ère éd. Lake Forest: Multimatrix;1996. 590 p.
23. Audet MA, Forest É, Friciu M, Forest JM, Leclair G, Compatibilité du citrate de caféine injectable avec plusieurs autres médicaments. Pharmactuel 2017;50:27–33.
24. Sethi M, Owyang CG, Meyers C, Parekh R, Shah KH, Manini AF. Choice of resuscitative fluids and mortality in emergency department patients with sepsis. Am J Emerg Med 2018; 36:625–9.
PHARMACTUEL, Vol. 54, No. 1, 2021