Carolann Bolduc, Pharm.D., M.Sc1,2,3, Rachel Rouleau, B.Pharm., M.Sc4,5,6,7, Marie-France Demers, B.Pharm., M.Sc., BCPP4,8,9, Line Guénette, B.Pharm., M.Sc., Ph.D.4,5,10,11
Reçu le 23 juillet 2020: Accepté après révision par les pairs le 4 janvier 2021
Résumé
Objectif : Décrire l’utilisation de l’instrument RxIntensi-TMD et du Medication Regimen Complexity Index chez une population gériatrique en soins de longue durée quant à la quantification de la complexité du régime médicamenteux.
Méthode : Il s’agit d’une étude descriptive, transversale et rétrospective menée auprès de personnes âgées de 65 ans et plus, issues du Projet d’évaluation de la personnalisation des soins du Centre intégré universitaire de santé et de services sociaux de la Capitale-Nationale. En tout, 320 sujets ont été sélectionnés aléatoirement : 160 sujets au début de l’intervention (T0) et 160 sujets 12 mois plus tard (T12 mois). La complexité des régimes médicamenteux a été quantifiée par une seule personne électroniquement au moyen de l’instrument RxIntensi-TMD et manuellement pour le Medication Regimen Complexity Index.
Résultats : À T0, les scores de complexité du régime médicamenteux moyens étaient de 18,5 ± 8,6 pour l’instrument RxIntensi-TMD et de 47,9 ± 23,0 pour le Medication Regimen Complexity Index. À T12 mois, ces scores étaient respectivement de 16,8 ± 8,1 et de 45,8 ± 20,6. Les instruments affichaient une concordance modérée à élevée (coefficient de corrélation intraclasse de 0,73 à T0 et de 0,75 à T12 mois). Pour les 320 sujets, trois pondérations manquantes ont été relevées à sept reprises avec l’instrument RxIntensi-TMD. En contrepartie, neuf pondérations manquantes ont été répertoriées à 305 reprises avec le Medication Regimen Complexity Index.
Conclusion : À l’instar du Medication Regimen Complexity Index, l’instrument RxIntensi-TMD permet d’identifier les sujets ayant une pharmacothérapie complexe. Assurément, leur capacité à hiérarchiser la prestation des soins pharmaceutiques constitue une avenue future à approfondir.
Mots-clés : Complexité du régime médicamenteux, gériatrie, indices d’intensité, Medication Regimen Complexity Index, soins de longue durée
Abstract
Objective : To describe the use of the RxIntensi-T® instrument and the Medication Regimen Complexity Index in a geriatric long-term care population for quantifying medication regimen complexity.
Method : A descriptive, cross-sectional, retrospective study of individuals aged 65 years and older from the Personalization of Care Evaluation Project (PEPS) of the Centre intégré universitaire de santé et de services sociaux de la Capitale-Nationale. A total of 320 subjects were randomly selected: 160 subjects at the beginning of the intervention (T0) and 160 subjects 12 months later (T12 months). Medication regimen complexity was quantified by a single person electronically using the RxIntensi-T® instrument and manually for the Medication Regimen Complexity Index.
Results : At T0, the mean medication regimen complexity scores were 18.5 ± 8.6 for the RxIntensi-T® instrument and 47.9 ± 23.0 for the Medication Regimen Complexity Index. At T12 months, these scores were 16.8 ± 8.1 and 45.8 ± 20.6, respectively. The instruments showed moderate to high agreement (intraclass correlation coefficient of 0.73 at T0 and 0.75 at T12 months). For the 320 subjects, three missing weightings were found seven times with the RxIntensi-T®. In contrast, nine missing weightings were identified 305 times with the Medication Regimen Complexity Index.
Conclusion : Like the Medication Regimen Complexity Index, the RxIntensi-T® identifies patients with complex pharmacotherapy. Their ability to prioritize the delivery of pharmaceutical care is clearly an avenue to explore.
Keywords : Geriatrics, intensity indices, long-term care, medication regimen complexity, Medication Regimen Complexity Index
Les soins pharmaceutiques sont au cœur de la pratique des pharmaciens œuvrant en établissement de santé1–3. Une étude pivot publiée en 1999 par Bond et ses collaborateurs met en évidence les bienfaits associés à la prestation de ces soins4. Parmi ceux-ci, les auteurs ont montré une diminution du taux de mortalité et des erreurs liées aux médicaments4. Or, divers obstacles freinent actuellement la prestation optimale des soins pharmaceutiques au Québec, dont la pénurie importante de main-d’œuvre et les récentes fusions de certains établissements de santé2,5,6. Une disparité importante est ainsi présente d’un établissement de santé à un autre quant aux soins pharmaceutiques offerts7.
À la lumière de ces informations, l’Association des pharmaciens des établissements de santé du Québec (A.P.E.S.) estime qu’il est plus que nécessaire de procéder à une réorganisation plus uniforme et cohérente des soins pharmaceutiques1. Ce désir de réorganisation met l’accent sur les soins pharmaceutiques prodigués à la population gériatrique1. Au sein même de cette population, il apparaît important de se doter d’une démarche objective permettant une priorisation adéquate des patients.
Divers outils décrits dans la littérature scientifique constituent des pistes de solution pour améliorer la hiérarchisation des soins pharmaceutiques chez cette patientèle. Parmi ceux-ci, notons la liste des critères de vulnérabilité élaborée en 2016 par l’Ordre des pharmaciens du Québec (OPQ)1. Cette dernière prend en compte les caractéristiques relatives aux patients (p. ex., quatre comorbidités et plus), à leurs problèmes de santé (p. ex., pathologie chronique telle que le diabète) et à leurs médicaments (p. ex., huit médicaments et plus). Plus un patient remplit un nombre élevé de critères, plus il est considéré comme vulnérable aux problèmes pharmacothérapeutiques. Selon cette liste, les patients les plus vulnérables sont ceux requérant prioritairement des soins pharmaceutiques1. D’autres instruments, tels que le GerontoNet, le Brighton Adverse Drug Reactions Risk (BADRI) model et le Adverse Drug Reaction Risk in Older Persons (ADRROP) scale, ont été mis au point afin d’identifier les sujets âgés davantage à risque d’effets indésirables médicamenteux, mais ils comportent des limites quant à leur validité et à leur applicabilité pratique8. Enfin, la documentation scientifique propose également une multitude d’instruments électroniques, dont le Computerized Alert System (CAS) utilisé dans le Centre intégré universitaire de santé et de services sociaux de l’Estrie - Centre hospitalier universitaire de Sherbrooke1,9. Le CAS est un instrument directement interfacé aux dossiers-patients informatisés, émettant des alertes basées sur les critères de Beers. Arvisais et coll. ont démontré que le recours au CAS, ajouté à un modèle d’intervention pharmacien-médecin, a permis non seulement une réduction des médicaments potentiellement inappropriés, mais également l’identification efficace des sujets nécessitant des interventions pharmaceutiques9. À notre avis, l’utilisation pratique à grande échelle de ces outils demeure limitée. En effet, alors que la démarche de priorisation des patients à l’aide de certains d’entre eux requiert une revue extensive des dossiers-patients, d’autres exigent des technologies non uniformément accessibles (p. ex., dossiers-patients électroniques)1,9.
Pour pallier cette problématique, certains auteurs avancent la possibilité de prioriser les patients sous la gouverne de la complexité de leurs régimes médicamenteux1,10–15. Certains instruments, dont le Medication Regimen Complexity Index (MRCI), permettent de mesurer objectivement la complexité d’un traitement10,11,16. Le MRCI est un instrument qui a été élaboré en 2004 par George et ses collaborateurs. Sa validité (validité de contenu, de construit et de critère) ainsi que sa fiabilité (accord interjuges et méthode du test-retest) ont été initialement démontrées dans une population souffrant de maladie pulmonaire obstructive chronique10. Ayant été ultérieurement validé dans diverses populations hospitalières et communautaires (insuffisants rénaux dialysés, insuffisants cardiaques, diabétiques, etc.), le MRCI demeure l’outil le plus largement utilisé en recherche pour mesurer la complexité d’un régime médicamenteux12,15,16. Cet instrument quantifie la complexité en se basant sur 65 éléments catégorisés en trois sections distinctes : section A (forme pharmaceutique), section B (fréquence d’administration) et section C (directives additionnelles nécessaires à l’administration des médicaments). Un score de complexité a préalablement été assigné à chacun de ces éléments. Étant donné que chacun des médicaments présents dans un régime médicamenteux est soumis à cet instrument, il est possible d’obtenir trois totaux de complexité distincts pour les sections A, B et C. Ultimement, la somme de ces trois totaux constitue la complexité globale d’un régime médicamenteux telle qu’obtenue par le MRCI9.
Bien que cet instrument ait été initialement conçu pour mesurer la complexité d’un régime médicamenteux dans une perspective d’adhésion thérapeutique, des études subséquentes ont contribué à l’expansion de son utilité clinique10. D’ailleurs, la complexité telle qu’obtenue par le MRCI a démontré, dans diverses populations gériatriques, non seulement une augmentation de la non-adhésion thérapeutique, mais également des hospitalisations et des réadmissions hospitalières17. Bien qu’une corrélation importante soit reconnue entre le nombre de médicaments présents dans un régime médicamenteux et la complexité de celui-ci, d’autres facteurs sont également positivement associés au concept chez les sujets âgés hébergés en soins de longue durée, dont les interactions médicamenteuses, les médicaments potentiellement inappropriés et les duplications thérapeutiques18,19. Notamment, diverses variables inhérentes aux patients corrèlent avec la complexité d’un régime médicamenteux mesurée à l’aide du MRCI. Selon l’étude australienne de Chen et coll. incluant des patients gériatriques hébergés en soins de longue durée, la complexité d’un régime médicamenteux serait positivement corrélée avec la fragilité ainsi qu’avec la dépendance des patients dans leurs activités de la vie quotidienne (score Katz ADL Scale)20. Toutefois, sa corrélation avec un indice de comorbidités serait faible (Charlson Comorbidy Index [CCI])20. En contrepartie, Wimmer et coll. ont entre autres démontré, chez des sujets gériatriques communautaires et institutionnalisés, que ceux détenant davantage de comorbidités (CCI modifié) ou ayant des statuts cognitifs supérieurs (Mini Mental State Examination [MMSE]) auraient des régimes médicamenteux plus complexes15. Malgré tout, le faible nombre d’études sur le sujet et l’absence de consensus établi soulignent l’importance de comprendre plus extensivement les facteurs cliniques associés à la complexité d’un régime médicamenteux.
En 2016, une étude à répartition aléatoire réalisée par McDonald et coll. évoque l’impact d’une intervention infirmière comprenant l’utilisation d’un algorithme automatisé calculant le score MRCI, d’un système d’alerte repérant les sujets avec un MRCI élevé et d’un module électronique orientant l’élaboration d’un plan de soins (p. ex., inciter les infirmières à collaborer avec le prescripteur afin de simplifier le régime médicamenteux) chez une population gériatrique ambulatoire. Aucune différence statistiquement significative n’a été obtenue entre le groupe exposé à l’intervention et le groupe témoin quant aux hospitalisations, aux visites à l’urgence ainsi qu’aux scores de complexité. Or, cette absence de différence s’explique entre autres par le faible recours à l’intervention chez le groupe exposé (42 % des patients). Des analyses réalisées dans le sous-groupe de sujets ayant été réellement exposés à l’intervention révèlent des taux d’hospitalisation et des scores de MRCI significativement moindres au suivi21.
Toutefois, très peu de pharmaciens utilisent actuellement le MRCI ou tout autre instrument de ce type afin de hiérarchiser la prestation des soins pharmaceutiques. D’une part, le MRCI nécessite habituellement une quantification manuelle. Par conséquent, le recours à cet instrument peut exiger beaucoup de temps pour le pharmacien, souvent déjà contraint à une charge de travail élevée13. Bien que certaines automatisations électroniques aient été rapportées dans la documentation scientifique, leur accessibilité demeure limitée. D’autre part, bien que plusieurs formes pharmaceutiques et fréquences d’administration différentes soient incorporées dans l’instrument original, il est possible que ces listes ne soient pas exhaustives, nécessitant une extrapolation subjective des scores assignés. À cet égard, aucune étude ne s’est préalablement intéressée à la faisabilité d’utilisation de cet instrument en matière de pondérations manquantes.
Récemment, un instrument québécois permettant de quantifier la complexité d’un régime médicamenteux a été rendu disponible. En 2016, par l’intermédiaire du projet « Intensité », l’OPQ a confié à Vigilance Santé la tâche d’identifier des critères permettant d’estimer l’intensité des soins pharmaceutiques à prodiguer aux patients22. Vigilance Santé est une compagnie québécoise constituée entre autres d’une équipe de 15 pharmaciens qui met au point différents logiciels de soutien clinique pour les professionnels de la santé23. Pour ce faire, cette compagnie a d’abord convenu que le régime médicamenteux des patients contribuait incontestablement aux soins pharmaceutiques à prodiguer. À la lumière de cette constatation, Vigilance Santé s’est intéressée aux caractéristiques des médicaments nécessitant davantage de soins pharmaceutiques. De ce fait, 14 critères médicamenteux ont été sélectionnés, dont la complexité posologique, la possibilité d’effets indésirables graves et la présence d’interactions (ces critères sont détaillés en annexe)22. Vigilance Santé a par la suite établi une valeur quantitative arbitraire à chacun de ces critères en fonction du temps dont le pharmacien a besoin pour procéder à leur gestion. Les responsables de ce projet ont été en mesure d’appliquer les critères déterminés à plus de 25 000 médicaments actuellement offerts au Canada. Ainsi, chacun de ces médicaments détient un score individualisé en fonction des critères lui correspondant. Il est, par la suite, possible de quantifier la complexité d’un régime médicamenteux en faisant la somme des indices d’intensité de chacun des médicaments le composant22. Depuis 2019, il est possible de calculer électroniquement ce score par l’entremise d’un instrument intitulé « RxIntensi-TMD », accessible dans le logiciel RxVigilanceMD, un aviseur thérapeutique24. À notre connaissance, la majorité des établissements de santé québécois paient un abonnement pour avoir accès à ce logiciel. Étant relativement nouveau, l’instrument RxIntensi-TMD ne semble pas avoir encore été utilisé sur le terrain. De surcroît, aucune étude publiée n’est accessible quant à sa validité, aux données probantes utilisées pour son élaboration, à sa concordance avec un instrument validé mesurant un construit similaire, tel que le MRCI, et à sa faisabilité d’utilisation.
Une réorganisation actualisée de la pratique pharmaceutique est requise, et il est souhaitable de se doter d’outils valides, adaptés à la réalité québécoise et faciles d’usage afin d’identifier les patients nécessitant davantage d’interventions pharmaceutiques parmi la clientèle gériatrique. Il apparaît donc important de comparer l’instrument RxIntensi-TMD à un outil existant et validé, soit le MRCI. L’objectif principal de ce projet de recherche consiste à décrire la quantification de la complexité du régime médicamenteux à l’aide de l’instrument RxIntensi-TMD et du MRCI dans une population âgée issue du Projet d’évaluation de la personnalisation des soins (PEPS) du Centre intégré universitaire de santé et de services sociaux (CIUSSS) de la Capitale-Nationale. Il s’agit d’un projet lancé en 2017 dans le CIUSSS de la Capitale-Nationale qui a fait l’objet d’une étude quasi-expérimentale où deux centres d’hébergement et de soins de longue durée (CHSLD) étaient exposés à un nouveau modèle de pratique, alors que deux autres étaient exposés aux soins usuels (groupe témoin). Ce nouveau modèle de pratique favorisait le déploiement maximal du champ d’exercice des infirmiers et des pharmaciens ainsi qu’une collaboration étroite entre ces deux types de professionnels25,26. Par ailleurs, on cherche également à atteindre trois objectifs secondaires dans cette même population soit : 1) décrire la concordance des scores de complexité du régime médicamenteux obtenus à l’aide de chacun des instruments; 2) décrire les variables associées aux scores de complexité du régime médicamenteux parmi le niveau de soins, l’autonomie fonctionnelle (profil iso-Système de mesure de l’autonomie fonctionnelle [SMAF]), le nombre de pathologies et le nombre de médicaments constituant ce régime; et 3) décrire la faisabilité d’utilisation des deux instruments en matière de pondérations manquantes.
Cette étude utilise un devis descriptif de population transversale avec une collecte de données rétrospective, et ce, avec deux temps de mesures distincts. La population cible à laquelle il est souhaitable de généraliser les résultats correspond à toutes les personnes résidant dans les CHSLD du Québec. La population à l’étude, pour sa part, correspond aux personnes de 65 ans et plus résidant dans l’un des sites participants du projet PEPS des CHSLD du CIUSSS de la Capitale-Nationale. À noter que la population totale ayant été exposée à l’intervention PEPS comptabilisait 359 sujets. En contrepartie, la population constituant le groupe témoin était de 242 sujets. Le seul critère d’inclusion de la présente étude était d’être un sujet issu du projet PEPS. Plus précisément, il s’agissait de toutes les personnes de 65 ans et plus résidant dans l’un des sites participants (deux CHSLD exposés et deux CHSLD témoins) aux moments prédéterminés. Aucun critère d’exclusion n’a été retenu. L’échantillon a été sélectionné aléatoirement, de façon électronique, par un biostatisticien, avec stratification en fonction des sites et selon la répartition suivante : 160 sujets au début de l’intervention PEPS (T0) et 160 sujets 12 mois après le début de l’intervention PEPS (T12 mois). Sous cet angle, l’échantillon était composé de 40 sujets dans chacun des sites, et ce, respectivement pour deux moments distincts. Les sujets ont été sélectionnés aléatoirement, de façon distincte, aux deux temps de collecte des données. Par conséquent, l’ensemble des sujets inclus à T0 était différent de celui inclus à T12mois. L’intérêt d’une telle sélection était d’observer le comportement des instruments dans des régimes médicamenteux ayant potentiellement une complexité différente en raison de l’intervention du projet PEPS. Également, l’espérance de vie des patients en CHSLD permettait difficilement une analyse longitudinale complète. Les données du projet PEPS, issues des dossiers pharmaceutiques et médicaux, relatives à ces 320 sujets sélectionnés ont été extraites dans un fichier ExcelMD et anonymisées par le biostatisticien.
Une collecte de données a été réalisée sur une période s’échelonnant sur cinq semaines, soit du 6 mai au 7 juin 2019. Les données ont été colligées de façon rétrospective et renvoient à deux moments distincts : à T0, soit le 30 mars 2017 (pour trois CHSLD) ou le 22 mai 2017 (pour un CHSLD) et à T12 mois, soit le 30 mars 2018 (pour trois CHSLD) ou le 22 mai 2018 (pour un CHSLD). Pour chacun des sujets, des variables relatives aux patients, à la quantification de la complexité du régime médicamenteux par l’instrument RxIntensi-TMD et le MRCI ainsi qu’à la faisabilité d’utilisation de ces deux instruments ont été colligées. La majorité des variables à colliger étaient accessibles par l’entremise du fichier ExcelMD fourni par le biostatiscien, soit : le numéro de dossier, l’âge, le sexe, le niveau de soins, le profil iso-SMAF, le nombre de pathologies et la liste des médicaments constituant le régime médicamenteux de chacun des sujets. Le niveau de soins renvoyait à l’intensité des soins médicaux à prodiguer, tel qu’indiqué dans le formulaire Niveaux de soins et réanimation cardiorespiratoire du ministère de la Santé et des Services sociaux, qui variait entre « prolonger la vie par tous les soins nécessaires » (niveau de soins A) et « assurer le confort uniquement sans viser à prolonger la vie » (niveau de soins D)27. À noter qu’avant 2016, l’intensité des soins médicaux à prodiguer se définissait par des critères numériques27. Ainsi, dans l’éventualité où un niveau de soins issu de l’ancienne nomenclature était colligé, une transition était prévue : les niveaux de soins un, deux et trois étaient respectivement qualifiés comme étant des niveaux de soins A, B et C. L’intérêt de cette variable vient entre autres de l’attention étroite que lui portent les pharmaciens exerçant en CHSLD lors des révisions pharmacothérapeutiques. En effet, la pertinence de certains médicaments dans un régime médicamenteux peut différer d’un niveau de soins à un autre28. Le profil iso-SMAF, pour sa part, renvoie au niveau d’autonomie fonctionnelle d’un patient et correspond à une variable quantitative discrète variant entre 1 (difficultés inhérentes aux tâches domestiques) et 14 (sujet alité dépendant pour les activités de sa vie quotidienne et ayant une atteinte mentale très grave)29. Les informations relatives aux médicaments incluaient entre autres la dénomination générique, la forme pharmaceutique ainsi que l’intervalle posologique. L’ensemble des données colligées a été incorporé dans une adaptation de l’outil de collecte réalisée dans un autre chiffrier du logiciel ExcelMD.
La complexité du régime médicamenteux de chacun des sujets a été quantifiée à l’aide des deux instruments, soit RxIntensi-TMD et MRCI. Tous les médicaments constituant les régimes médicamenteux, incluant les médicaments réguliers et à prendre « si besoin », ont été pris en considération. D’une part, l’instrument RxIntensi-TMD est accessible dans l’onglet « Éditeur de profil » du logiciel RxVigilanceMD. Les dénominations génériques des médicaments constituant un régime médicamenteux y ont été sélectionnées, permettant d’obtenir automatiquement le score de complexité de ce régime. Dans l’éventualité où un médicament donné n’était pas présent dans l’instrument RxIntensi-TMD, une valeur basée sur le jugement clinique était attribuée et notée. Cette valeur arbitraire était déterminée par une pharmacienne, en se basant sur les valeurs disponibles de médicaments similaires. D’autre part, l’instrument original publié par George et coll. a été utilisé pour quantifier la complexité d’un régime médicamenteux à l’aide du MRCI10. Alors qu’une pondération doit impérativement être attribuée à chacune des formes pharmaceutiques (section A) présentes dans le régime médicamenteux ainsi qu’à la fréquence d’administration (section B) de l’ensemble des médicaments constituant ce régime, une pondération n’est pas systématiquement attribuée à la section C. En effet, pour cette dernière, une pondération n’est attribuée que si des directives additionnelles sont présentes dans la posologie d’un ou plusieurs des médicaments constituant le régime. Dans l’éventualité où une forme pharmaceutique ou une fréquence d’administration présente dans le régime médicamenteux d’un sujet n’était pas incluse dans les listes de pondérations du MRCI, une valeur basée sur le jugement clinique était attribuée et notée. Pour les formes pharmaceutiques non disponibles, la pharmacienne attribuait le score de la forme pharmaceutique la plus étroitement apparentée, listée dans la section A du MRCI. En ce qui a trait aux fréquences d’administration, la logique des pondérations disponibles dans la section B a été maintenue. Plus précisemment, pour les médicaments affichant une fréquence d’administration définie par un nombre de « fois par jour », le score attribué correspond à ce nombre de fois (p. ex., « deux fois par jour » détient le score de 2). Dans l’éventualité où à ce nombre de « fois par jour » s’ajoute la mention « si besoin », le score est divisé par deux (p. ex., « deux fois par jour si besoin » détient le score de 1). En contrepartie, pour les médicaments affichant une fréquence d’administration définie par un intervalle d’heure, le score attribué correspond au nombre quotidien de prises, auquel s’ajoute une valeur de 0,5 (p. ex., « aux 12 heures » détient le score de 2,5). Dans l’éventualité où à cet intervalle d’heure s’ajoute la mention « si besoin », le score correspond au nombre quotidien de prises par jour divisé par deux, auquel s’ajoute également une valeur de 0,5 (p. ex., « aux 12 heures si besoin » détient le score de 1,5). Alors que les informations relatives à la forme pharmaceutique et à la fréquence d’administration étaient présentes dans le fichier ExcelMD fourni préalablement par le biostatisticien, celles relatives aux directives additionnelles nécessaires à l’administration de la médication ont dû être colligées à l’aide du logiciel pharmaceutique GesphaRxMD. Seuls les commentaires indiqués dans la section « Posologie » étaient pris en considération. Une autorisation de la part de la direction des services professionnels du CIUSSS de la Capitale-Nationale a été préalablement obtenue afin d’accéder aux dossiers-patients, le projet PEPS ayant déjà fait l’objet d’une autorisation de la part du comité d’éthique de la recherche de ce CIUSSS.
Parallèlement à la quantification de la complexité du régime médicamenteux, des données relatives à la faisabilité d’utilisation des deux instruments ont été récoltées. En ce qui concerne l’instrument RxIntensi-TMD, le nombre de médicaments présents dans le régime médicamenteux de chacun des sujets non inclus dans l’instrument a été colligé. Quant à l’instrument MRCI, le nombre de formes posologiques ou de fréquences d’administration présentes dans le régime médicamenteux de chacun des sujets n’ayant pas de pondération associée dans les sections A et B de la grille a été relevé.
Les analyses statistiques ont été réalisées par l’intermédiaire du logiciel SASMD avec l’aide d’un biostatisticien. De par le devis de l’étude, des statistiques descriptives ont été réalisées. Les variables qualitatives nominales et ordinales colligées ont été exprimées en termes de proportions. Quant aux variables quantitatives discrètes et continues, elles ont été exprimées à l’aide de mesures de tendance centrale (moyennes) et de mesures de dispersion (écarts-types). Pour décrire la concordance des scores de complexité des régimes médicamenteux obtenus à l’aide de l’instrument RxIntensi-TMD et du MRCI, le coefficient de corrélation intraclasse ainsi que le coefficient de corrélation de Pearson ont été utilisés. Enfin, pour décrire la relation entre les scores de complexité du régime médicamenteux obtenus à l’aide de chacun des instruments et le niveau de soins, le profil iso-SMAF, le nombre de pathologies ainsi que le nombre de médicaments constituant ce régime, le coefficient de corrélation de Pearson et un modèle de régression à mesures répétées ont été utilisés. Le seuil de signification statistique a été fixé à 5 %.
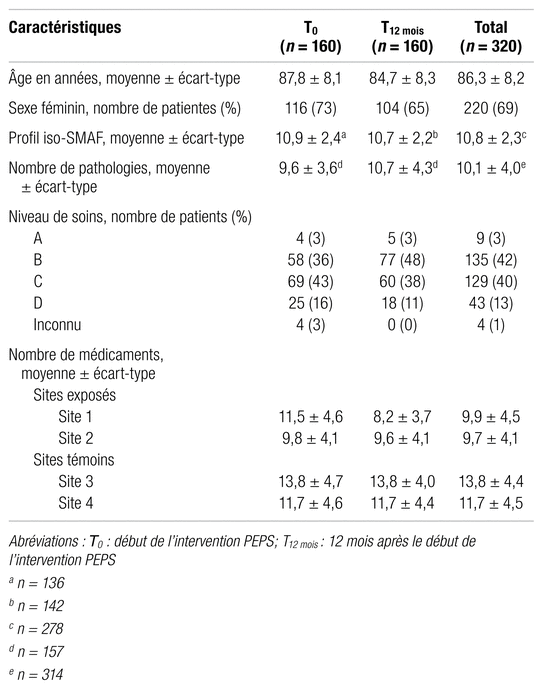
Les caractéristiques de base des 320 sujets constituant l’échantillon à l’étude sont présentées dans le tableau I. À noter que, parmi les 160 résidents ayant été sélectionnés à T0, 51 ont été resélectionnés aléatoirement à T12 mois. Globalement, la population avait un âge moyen de 86 ans et était majoritairement de sexe féminin (69 %). Les niveaux de soins B et C étaient ceux que l’on retrouvait chez la majorité des sujets, soit chez 83 % d’entre eux27. Le profil iso-SMAF moyen de 10,8 indique que les sujets à l’étude détenaient un bas niveau d’autonomie fonctionnelle29. Par ailleurs, la population s’avérait plurimorbide avec, en moyenne, une liste de 10,1 pathologies par sujet. Enfin, les sujets issus du site 1 avaient un nombre moyen de médicaments supérieur à T0 (11,5 ± 4,6), comparativement à T12mois (8,2 ± 3,7). Pour tous les autres sites, le nombre moyen de médicaments par sujet était relativement similaire entre les deux temps de collecte.
Tableau I Caractéristiques de base des patients inclus dans l’étude
Les scores de complexité du régime médicamenteux, obtenus à l’aide de l’instrument RxIntensi-TMD et du MRCI, sont présentés dans le tableau II. Ces scores de complexité ont été calculés, de façon séparée, pour chacun des sites issus du projet PEPS, et ce, pour les deux moments étudiés : T0 et T12 mois. Dans l’ensemble, alors que le score de complexité obtenu avec l’instrument RxIntensi-TMD pour les 160 sujets sélectionnés à T0 était de 18,5 ± 8,6, le MRCI moyen s’élevait, lui, à 47,9 ± 23,0. Quant aux sujets sélectionnés à T12 mois, le score de complexité obtenu avec l’instrument RxIntensi-TMD et le MRCI moyens étaient respectivement de 16,8 ± 8,1 et de 45,8 ± 20,6.
Tableau II Quantification de la complexité du régime médicamenteux à l’aide de l’instrument RxIntensi-TMD et du MRCI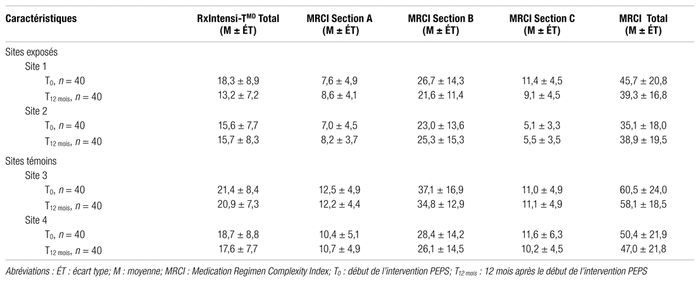
Afin d’apprécier la concordance de l’instrument RxIntensi-TMD et du MRCI, un test de corrélation intraclasse a été réalisé. Les coefficients de corrélations intraclasse obtenus étaient de 0,73 à T0 et de 0,75 à T12 mois. Des coefficients de corrélation de Pearson ont également été mesurés (coefficients de corrélations de Pearson : 0,73 (p < 0,001) à T0 et 0,75 (p < 0,001) à T12 mois). Une corrélation positive est objectivée entre les scores de complexité obtenus au moyen des deux instruments distinctement utilisés.
Par ailleurs, les relations entre les scores de complexité du régime médicamenteux et le niveau de soins, le profil iso-SMAF, le nombre de pathologies ainsi que le nombre de médicaments constituant ce régime sont présentées dans les tableaux III et IV. Des coefficients de corrélation de Pearson ont permis de déterminer, parmi ces éléments, les variables contribuant principalement à la complexité d’un régime médicamenteux. À la lumière de ces mesures d’association, seuls le nombre de pathologies et le nombre de médicaments sont corrélés, de façon statistiquement significative, avec la complexité du régime médicamenteux, et ce, peu importe l’instrument utilisé. Or, un effet confondant résultant d’une relation linéaire positive entre le nombre de pathologies et le nombre de médicaments (coefficients de corrélations de Pearson : 0,31 [p < 0,001] à T0 et 0,42 [p < 0,001] à T12 mois) a été observé. Par conséquent, un modèle de régression linéaire à mesures répétées a permis de mettre en évidence que seule la relation entre la complexité d’un régime médicamenteux et le nombre de médicaments constituant ce régime est significative. Les estimations de covariance obtenues sont présentées au tableau V.
Tableau III Variables reliées à la complexité du régime médicamenteux obtenue par l’instrument RxIntensi-TMD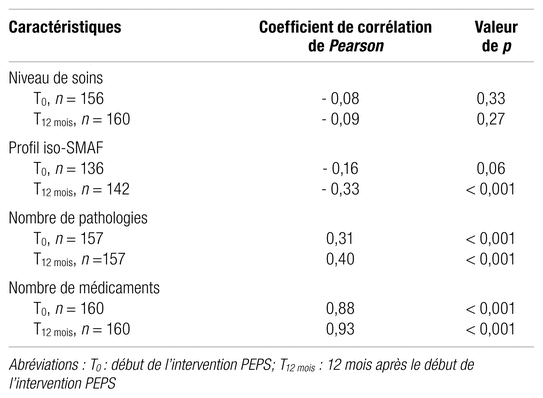
Tableau IV Variables reliées à la complexité du régime médicamenteux obtenue par le MRCI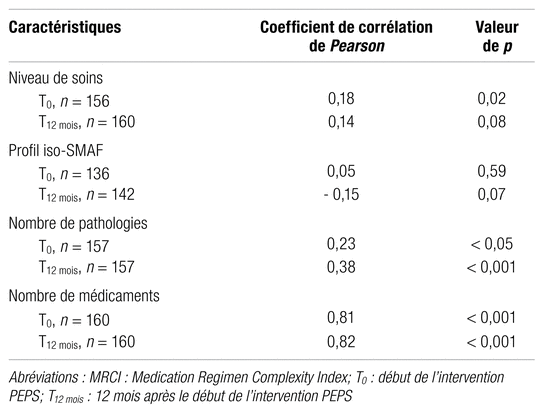
Tableau V Estimation de covariance entre la complexité d’un régime médicamenteux et le nombre de médicaments constituant ce régime selon un modèle de régression linéaire à mesures répétées
La faisabilité d’utilisation des deux instruments a été mesurée dans une perspective de pondérations manquantes. En ce qui concerne l’instrument RxIntensi-TMD, un indice d’intensité a dû être attribué arbitrairement à sept reprises lors de la quantification de la complexité du régime médicamenteux des 320 sujets constituant l’échantillon. Plus précisément, les indices d’intensité manquants concernaient les produits suivants : crème topique à base de lidocaïne et de kétamine (n = 4), rince-bouche magique (n = 2) et gel topique à base de morphine et de métronidazole (n = 1). Les indices d’intensité attribués sont présentés en annexe. En revanche, pour l’instrument MRCI, une pondération quant à la forme posologique ou à la fréquence d’administration des médicaments constituant le régime médicamenteux des 320 sujets étudiés a dû être extrapolée, et ce, à 305 reprises. De façon détaillée, les formes posologiques colligées n’étant pas quantifiées dans la section A du MRCI s’avéraient être des shampooings (n = 54), des lotions topiques (n = 36) ainsi qu’une huile topique (n = 1). Par ailleurs, les fréquences d’administration n’ayant pas de pondération associée dans la section B de la grille du MRCI étaient les suivantes : « aux heures si besoin » (n = 189), « aux 30 minutes si besoin » (n = 11), « aux trois heures si besoin » (n = 8), « six jours sur sept » (n = 3), « cinq jours sur sept » (n = 2), ainsi que « cinq fois par jour » (n = 1). L’ensemble des pondérations ayant été attribuées est présenté en annexe.
L’objectif général de cette étude consistait à décrire l’utilisation de l’instrument RxIntensi-TMD et du MRCI dans une population âgée hébergée en soins de longue durée, issue du projet PEPS du CIUSSS de la Capitale-Nationale. Prioritairement, l’utilisation de ces instruments a permis d’obtenir deux estimations distinctes de la complexité du régime médicamenteux, et ce, pour 160 sujets sélectionnés à T0 ainsi que pour 160 sujets sélectionnés à T12 mois.
Pour les sujets sélectionnés à T0, le score moyen de complexité obtenu avec l’instrument RxIntensi-TMD était de 18,5 ± 8,6 et le MRCI moyen était de 47,9 ± 23,0. Quant aux sujets sélectionnés à T12 mois, le score moyen de complexité obtenu avec l’instrument RxIntensi-TMD était de 16,8 ± 8,1 et le MRCI moyen était de 45,8 ± 20,6. Alors que Georges et coll. n’ont pas fourni de barèmes qualitatifs pour interpréter les scores quantitatifs totaux obtenus, certains auteurs mentionnent qu’un MRCI supérieur ou égal à 20 renverrait à un régime médicamenteux hautement complexe10,30. Dans cet ordre d’idée, les scores de complexité obtenus mettent en lumière la vulnérabilité importante des personnes âgées sélectionnées dans ce projet et la pertinence de prioriser ces patients pour des interventions pharmaceutiques. En contrepartie, aucune étude n’évoque une quelconque interprétation qualitative quant aux scores quantitatifs obtenus avec l’instrument RxIntensi-TMD.
Seul un petit nombre d’études utilisant le MRCI s’intéressait spécifiquement à une population gériatrique en soins de longue durée. Au premier abord, la complexité du régime médicamenteux de 415 sujets vivant dans cinq centres de soins de longue durée au Portugal a été décrite par Advinha et coll. en 2014. Les régimes médicamenteux étaient, en moyenne, constitués de 8,3 ± 3,8 principes actifs et avaient un MRCI moyen de 18,2 ± 9,618. Puis, en 2017, Alves-Conceição et coll. ont quantifié la complexité du régime médicamenteux de 125 sujets gériatriques en soins de longue durée au Brésil. Les sujets avaient, en moyenne, 4,6 ± 3,0 principes actifs par régime médicamenteux totalisant un MRCI moyen de 15,1 ± 9,8. En guise de comparaison, les scores de complexité décrits dans ces deux études s’avèrent moindres que ceux calculés par l’intermédiaire du projet de recherche actuel. Un élément distinctif pouvant entre autres expliquer cette disparité concerne le nombre de principes actifs moyen par sujet. En effet, les sujets issus du projet PEPS détenaient un nombre de médicaments supérieur (voir tableau I), bien qu’ils aient été considérés comme moindrement polymédicamentés, comparativement aux sujets d’autres établissements du Québec31. Une hypothèse à cet effet concerne la présence de médicaments à prendre « si besoin » dans les régimes médicamenteux des patients. Les régimes médicamenteux observés dans le cadre du projet PEPS affichaient à maintes reprises de telles fréquences d’administration. Ces dernières sont d’ailleurs associées à des pondérations supérieures dans la section B du MRCI. En revanche, bien que les deux études mentionnées précédemment indiquent la prise en compte des médicaments à prendre « si besoin » dans leur score total, l’étude d’Advinha et coll. spécifie n’en avoir colligé qu’une très faible proportion18,19. Les pratiques locales relatives à la présence de médicaments à prendre « si besoin » dans les régimes médicamenteux peuvent donc considérablement influer sur les scores de MRCI obtenus.
De façon exploratoire, l’impact de la médication à prendre « si besoin » sur un échantillon des régimes médicamenteux à l’étude a été observé. Ces analyses ont été réalisées chez les 40 sujets issus du site 1 à T0. Parmi ces 40 régimes médicamenteux, 90 % comprenaient au moins une molécule à prendre « si besoin ». La complexité de ces régimes médicamenteux a été recalculée en excluant, cette fois-ci, les molécules ayant une telle fréquence d’administration. Les scores obtenus étaient les suivants : 14,8 ± 7,5 pour l’instrument RxIntensi-TMD et 31,4 ± 12,2 pour le MRCI. Il s’agit d’une diminution de l’ordre de 20 % et 36 % respectivement pour l’instrument RxIntensi-TMD et le MRCI, comparativement aux scores comptabilisant, de façon concomitante, les molécules à prise régulière et celles « si besoin ». Par conséquent, la présence des fréquences d’administration « si besoin » dans les régimes médicamenteux semble avoir un impact moindre sur la complexité telle que calculée avec l’instrument de Vigilance Santé, comparativement à celle obtenue au moyen du MRCI.
Enfin, deux études australiennes ont également utilisé le MRCI dans une population hébergée en soins de longue durée. D’une part, l’étude de Chen et coll. réalisée chez 242 sujets rapporte un MRCI médian de 4220. Les régimes médicamenteux décrits étaient constitués, en médiane, de neuf médicaments à prise régulière et de quatre médicaments à prise « si besoin »20. D’autre part, l’étude de Lalic et coll. a, quant à elle, quantifié la complexité du régime médicamenteux chez 383 sujets gériatriques32. Ces régimes étaient constitués d’un nombre médian de 10 médicaments à prise régulière. Bien que pris en compte pour l’obtention du MRCI médian s’élevant à 43,5, le nombre médian de médicaments à prise « si besoin » n’a pas été spécifié32. Ne rapportant toutefois pas de MRCI moyens, ces résultats s’apparentent davantage à l’ordre de grandeur des scores obtenus par l’entremise de ce projet de recherche.
Des coefficients de corrélation intraclasse ont été calculés : 0,73 à T0 et 0,75 à T12 mois. Les résultats de ces mesures d’accord évoquent une concordance modérée à élevée entre les instruments33. Ainsi, à la lumière de ces résultats, l’instrument RxIntensi-TMD permettrait une reconnaissance des patients ayant des régimes médicamenteux complexes sensiblement comparable à celle de l’instrument MRCI, confirmant sa validité de construit.
Toutefois, il n’en demeure pas moins qu’un contraste entre les facteurs contribuant à la complexité des régimes médicamenteux de chacun des instruments est perceptible. Afin d’illustrer cette disparité, deux régimes médicamenteux simplifiés seront mis en opposition : 1) une crème à base de menthol à appliquer quatre fois par jour si douleur; et 2) un comprimé de warfarine et un comprimé d’amiodarone à prendre une fois par jour régulièrement. Alors que l’instrument MRCI attribue un score de complexité supérieur au premier régime médicamenteux décrit, l’instrument RxIntensi-TMD établit que le deuxième régime nécessiterait prioritairement des interventions pharmaceutiques. Des études subséquentes seront nécessaires afin non seulement de départager l’utilité clinique de ces deux instruments, mais également de décrire plus extensivement leur capacité à reconnaître les sujets nécessitant prioritairement des soins pharmaceutiques. D’ailleurs, il aurait été intéressant d’observer si les patients dont les régimes médicamenteux étaient plus complexes selon l’un ou l’autre de ces instruments étaient aussi ceux qui avaient davantage bénéficié d’interventions dans le cadre du projet PEPS.
Diverses variables contribuaient, dans une mesure plus importante, aux scores de complexité du régime médicamenteux obtenus. D’abord, pour le MRCI, le score moyen relatif à la fréquence d’administration des médicaments (section B) constituait plus de 50 % du score total moyen de l’instrument. Puis, pour l’instrument RxIntensi-TMD, certains médicaments majoraient davantage à la hausse le score de complexité total, dont le méthotrexate (indice d’intensité : 10), la warfarine (indice d’intensité : 8) et le tamoxifène (indice d’intensité : 7). Par ailleurs, peu importe l’instrument utilisé, l’ensemble des scores de complexité du régime médicamenteux précédemment obtenus étaient positivement corrélés avec le nombre de médicaments constituant ces régimes. Selon le modèle de régression linéaire à mesures répétées, on estime que, pour chaque médicament additionnel dans un régime médicamenteux, le score de complexité obtenu par l’instrument RxIntensi-TMD et le MRCI augmenterait de 1,6 et 3,9 respectivement.
Dans l’étude d’Advinha et coll. mentionnée précédemment, les variables reliées à la complexité d’un régime médicamenteux étaient le nombre de médicaments constituant ces régimes (coefficient de corrélation [r] : 0,922, p < 0,001) ainsi que la fréquence d’administration de ceux-ci (r : 0,879, p < 0,001)18. Puis, dans l’étude d’Alves-Conceiçao, la complexité des régimes médicamenteux était principalement majorée à la hausse par la fréquence d’administration (section B), suivie des directives additionnelles nécessaires à l’administration (section C) et, enfin, de la forme pharmaceutique (section A) des médicaments constituant ces régimes19. Par conséquent, les résultats de ce projet de recherche indiquant que le score de complexité d’un régime médicamenteux est positivement corrélé avec le nombre de médicaments constituant ce régime et que la fréquence d’administration des médicaments (section B) contribue, dans une mesure plus importante, au score de complexité total sont en adéquation avec la documentation scientifique actuelle.
L’intérêt clinique de la corrélation entre le MRCI et le nombre de médicaments constituant un régime médicamenteux est abordée dans la documentation scientifique. En 2015, en raison de la forte corrélation entre ces deux concepts (coefficient de corrélation de Pearson de 0,96 [p < 0,001]) et la similitude des variables étudiées leur étant significativement associées, Wimmer et coll. évoquent la possibilité de prioriser les patients plutôt par leur nombre de médicaments15. En effet, il va de soi que ce procédé s’insérerait plus aisément dans le quotidien d’un pharmacien. En 2016, Wimmer et coll. renchérissent en démontrant que la complexité d’un régime médicamenteux, telle qu’obtenue par le MRCI, ne serait pas un meilleur prédicteur d’hospitalisations non prévues que le nombre de médicaments constituant ce régime34. Une autre étude publiée en 2016 par ces investigateurs démontre, chez certains sujets âgés, que la complexité d’un régime médicamenteux serait, toutefois, un meilleur prédicteur de mortalité toutes causes confondues, comparativement à la polypharmacie. Il faut toutefois garder en tête que cette étude n’a pas permis d’établir une association entre la complexité d’un régime médicamenteux et la mortalité toutes causes chez les sujets féminins, chez les personnes ayant plus de 80 ans ainsi que chez celles ayant des problèmes cognitifs (score du MMSE inférieur à 26); des caractéristiques que l’on rencontre fréquemment en CHSLD35. Des études subséquentes permettant de distinguer l’utilité de ces deux concepts dans une perspective de hiérarchisation des soins pharmaceutiques seront nécessaires.
Les obstacles relatifs aux pondérations manquantes de chacun des instruments ont été colligés. De prime abord, pour trois médicaments retrouvés à sept reprises dans les régimes médicamenteux de l’ensemble des sujets inclus dans l’étude, aucun indice d’intensité ne figurait dans l’instrument RxIntensi-TMD. Or, dans tous les cas, cette absence de quantification s’expliquait par la présence d’une préparation magistrale dans le régime médicamenteux. En effet, l’instrument RxIntensi-TMD n’a attribué des indices d’intensité qu’à des dénominations génériques distinctement commercialisées. En contrepartie, trois formes posologiques ainsi que six fréquences d’administration n’étaient pas pondérées dans la grille du MRCI. Ces variables ont été répertoriées à 305 reprises au total. De tels obstacles ont été observés dans près de 60 % des régimes médicamenteux quantifiés. La quantification de la complexité des régimes médicamenteux à l’aide du MRCI se heurte à l’attribution de multiples valeurs arbitraires en raison de la non-disponibilité de pondérations associées à certaines formes pharmaceutiques et fréquences d’administration rencontrées en pratique. Bien que ces valeurs soient déterminées avec logique, l’influence de la subjectivité d’un évaluateur à un autre n’est pas exclue. Par conséquent, ce projet de recherche a permis d’attribuer, à l’instrument RxIntensi-TMD, une faisabilité d’utilisation supérieure quant à l’exhaustivité des pondérations fournies. Dans une perspective de faisabilité d’utilisation plus globable, des études ultérieures mesurant objectivement le temps requis pour quantifier la complexité des régimes médicamenteux à l’aide de ces instruments seraient intéressantes. En effet, l’auteur, ayant quantifié les régimes médicamenteux dans le cadre de ce projet de recherche, rapporte, de façon subjective, un temps requis moindre avec l’instrument RxIntensi-TMD (environ deux minutes), comparativement au MRCI (environ 10 minutes).
À la lumière des scores de complexité présentés au tableau II, une tendance quant à la diminution de la complexité des régimes médicamenteux entre T0 et T12 mois est perceptible pour les sujets issus du premier site. Il s’agit d’une diminution de l’ordre approximatif de 28 % pour l’instrument RxIntensi-TMD et de 14 % pour le MRCI. Quant aux sujets issus du deuxième site, aucune diminution de la complexité du régime médicamenteux n’est discernable. Ce constat peut entre autres s’expliquer par un nombre moyen de principes actifs par sujet pratiquement comparable entre T0 et T12 mois. Enfin, en ce qui concerne les sujets issus des CHSLD témoins (sites 3 et 4), aucune diminution cliniquement significative de la complexité des régimes médicamenteux entre T0 et T12 mois n’est identifiable. Ces résultats sont facilement explicables de par l’absence d’intervention PEPS chez ces sujets. Malgré ces observations, leur extrapolation demeure difficile dans le mesure où, parmi les sujets provenant des sites exposés, sélectionnés à T0, les proportions de resélection à T12 mois ne sont que de 10 % pour le site 1 et de 47,5 % pour le site 2. Les résultats du projet PEPS quant à l’impact de ce nouveau modèle de pratique sur la complexité des régimes médicamenteux de l’ensemble des sujets inclus permettront d’aborder extensivement le sujet.
Ce projet de recherche se contraint à certaines limites méthodologiques. Dans un premier temps, le MRCI a initialement été conçu dans le but de repérer les patients dont les régimes médicamenteux sont complexes, et ce, majoritairement dans une perspective d’adhésion thérapeutique10. Toutefois, au-delà d’une simple complexité technique d’administration de la médication, sa capacité à quantifier une complexité clinique a bel et bien été décrite subséquemment22. Dans un deuxième temps, aucune recherche extensive n’a été effectuée relativement aux directives additionnelles nécessaires à l’administration des médicaments (section C du MRCI). En effet, seuls les commentaires inclus dans les lignes de la section « Posologie » du logiciel GesphaRxMD étaient considérés. Par conséquent, il est possible que certaines directives additionnelles aient été omises, sous-estimant ainsi les scores de complexité totaux obtenus au moyen du MRCI. À titre d’exemple, la section C du MRCI attribue une pondération spécifique aux médicaments ayant des doses croissantes ou décroissantes. Dans l’éventualité où, pour de tels médicaments, aucune date et/ou étape spécifique n’était désignée dans les champs posologiques, aucune pondération n’était attribuée à tort. Cependant, comparativement au score de la section B de l’instrument, le score de la section C influe moindrement sur les scores totaux de complexité obtenus, amenuisant ainsi le biais associé. En ce qui concerne l’instrument RxIntensi-TMD, il n’existe, pour le moment, aucune autre étude dans la documentation scientifique l’ayant utilisé pour quantifier la complexité d’un régime médicamenteux, ce qui limite la comparaison des résultats obtenus. Il convient de souligner la non-disponibilité des précisions relatives à la validité et à la fiabilité de cet instrument. Enfin, 51 sujets sélectionnés à T0 ont été resélectionnés aléatoirement à T12 mois. Cette double sélection aurait pu potentiellement accroître la similitude entre les coefficients de corrélation calculés aux deux temps étudiés. Or, les tests statistiques utilisés ont été préalablement déterminés par le biostatisticien dans l’optique d’amoindrir cette limite potentielle.
La généralisation des résultats quant à la complexité des régimes médicamenteux à l’ensemble des personnes âgées hébergées en soins de longue durée au Québec est possible advenant une similitude avec les caractéristiques de l’échantillon actuel. En effet, l’absence de critère d’exclusion ainsi que le caractère multicentrique de ce projet de recherche lui confèrent une bonne validité externe. En contrepartie, la généralisation à l’ensemble des aînés, dont ceux issus du milieu communautaire, reste à établir. Par ailleurs, bien que le logiciel RxVigilanceMD s’avère un outil dont la majorité des CHSLD au Québec peut disposer, son accessibilité demeure conditionnelle à un abonnement payant auquel un clinicien externe n’a pas accès.
Le projet de recherche actuel a permis de mettre en évidence une concordance modérée à élevée entre l’instrument RxIntensi-TMD et le MRCI dans une population de personnes âgées hébergée en CHSLD. Également, une faisabilité d’utilisation satisfaisante a été observée pour l’instrument RxIntensi-TMD. À la lumière de ces résultats, l’utilisation de l’instrument RxIntensi-TMD pourrait permettre d’identifier plus systématiquement les patients dont le régime médicamenteux est complexe. Sa capacité à prioriser les patients constitue, sans aucun doute, un sujet d’intérêt pour de futures études, et ce, dans l’optique de majorer l’efficience de l’organisation des soins pharmaceutiques dans les CHSLD du Québec. Advenant l’utilisation éventuelle d’un tel instrument, la description des impacts cliniques et organisationnels engendrés serait tout aussi intéressante.
Cet article comporte une annexe; elle est accessible sur le site de Pharmactuel (www.pharmactuel.com).
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
1. Association des pharmaciens des établissements de santé du Québec. Recommandations sur la pratique de la pharmacie en établissement de santé. Axe 1: soins pharmaceutiques. [en ligne] https://www.apesquebec.org/sites/default/files/publications/ouvrages_specialises/20180424_publications_pubspec_projet1.pdf (site visité le 5 octobre 2019).
2. Association des pharmaciens des établissements de santé du Québec. Meilleures pratiques en CHSLD et en SAD: Propositions de l’Association des pharmaciens des établissements de santé du Québec. [en ligne] https://www.apesquebec.org/sites/default/files/publications/memoires/20161103-mem-chsld-sad.pdf (site visité le 5 octobre 2019).
3. Hepler CD, Strand LM. Opportunities and responsibilities in pharmaceutical care. Am J Hosp Pharm 1990;47:533–43.
4. Bond CA, Raehl CL, Franke T. Clinical pharmacy services and hospital mortality rates. Pharmacotherapy 1999;19:556–64.
5. Association des pharmaciens des établissements de santé du Québec. Pénurie de pharmaciens en établissement de santé. [en ligne] https://www.apesquebec.org/lapes/propos/penurie-de-pharmaciens-en-etablissement-de-sante (site visité le 5 octobre 2019).
6. Payeur F, Azeredo AC. Les scénarios d’analyse des perspectives démographiques du Québec, 2011–2061. Institut de la statistique du Québec 2015;20:19–25.
7. Vérificateur général du Québec. Rapport du Vérificateur général du Québec à l’Assemblée nationale pour l’année 2014–2015: Médicaments et services pharmaceutiques. [en ligne] https://www.vgq.qc.ca/Fichiers/Publications/rapport-annuel/2014-2015-VOR-Printemps/fr_Rapport2014-2015-VOR-Chap06.pdf (site visité le 5 octobre 2019).
8. Jennings E, Gallagher P, O’Mahony D. Detection and prevention of adverse drug reactions in multi-morbid older patients. Age Ageing 2019;48:10–3.
9. Arvisais K, Bergeron-Wolff S, Bouffard C, Michaud A, Bergeron J, Mallet L et al. A pharmacist-physician intervention model using a computerized alert system to reduce high-risk medication use in elderly inpatients. Drugs Aging 2015;32:663–70.
10. George J, Phun YT, Bailey MJ, Kong DC, Stewart K. Development and validation of the medication regimen complexity index. Ann Pharmacother 2004;38:1369–76.
11. Hirsch JD, Metz KR, Hosokawa PW, Libby AM. Validation of a patient-level medication regimen complexity index as a possible tool to identify patients for medication therapy management intervention. Pharmacotherapy 2014;34: 826–35.

12. Lepelley M, Genty C, Lecoanet A, Allenet B, Bedouch P, Mallaret MR et al. Electronic Medication Regimen Complexity Index at admission and complications during hospitalization in medical wards: a tool to improve quality of care? Int J Qual Health Care 2018;30: 32–8.
13. Mansur N, Weiss A, Beloosesky Y. Looking beyond polypharmacy: quantification of medication regimen complexity in the elderly. Am J Geriatr Pharmacother 2012;10:223–9.
14. McDonald MV, Peng TR, Sridharan S, Foust JB, Kogan P, Pezzin LE et al. Automating the medication regimen complexity index. J Am Med Inform Assoc 2013;20:499–505.

15. Wimmer BC, Johnell K, Fastbom J, Wiese MD, Bell JS. Factors associated with medication regimen complexity in older people: a cross-sectional population-based study. Eur J Clin Pharmacol 2015;71:1099–108.
16. Paquin AM, Zimmerman KM, Kostas TR, Pelletier L, Hwang A, Simone M et al. Complexity perplexity: a systematic review to describe the measurement of medication regimen complexity. Expert Opin Drug Saf 2013;12:829–40.
17. Alves-Conceicao V, Rocha KSS, Silva FVN, Silva ROS, Cerqueira-Santos S, Nunes MAP et al. Are clinical outcomes associated with medication regimen complexity? A systematic review and meta-analysis. Ann Pharmacother 2020;54:301–13.
18. Advinha AM, de Oliveira-Martins S, Mateus V, Pajote SG, Lopes MJ. Medication regimen complexity in institutionalized elderly people in an aging society. Int J Clin Pharm 2014;36:750–6.
19. Alves-Conceicao V, Silva DTD, Santana VL, Santos EGD, Santos LMC, Lyra DP Jr. Evaluation of pharmacotherapy complexity in residents of long-term care facilities: a cross-sectional descriptive study. BMC Pharmacol Toxicol 2017;18:59.

20. Chen EY, Bell JS, Ilomaki J, Keen C, Corlis M, Hogan M et al. Medication regimen complexity in 8 australian residential aged care facilities: impact of age, length of stay, comorbidity, frailty, And dependence in activities of daily living. Clin Interv Aging 2019;14:1783–95.

21. McDonald MV, Feldman PH, Barrón-Vayá Y, Peng TR, Sridharan S, Pezzin LE. Outcomes of clinical decision support (CDS) and correlates of CDS for home care patients with high medication regimen complexity: a randomized trial. J Eval Clin Pract 2016;22:10–9.
22. Ordre des pharmaciens du Québec. Projet sur le niveau d’intensité des services pharmaceutiques : Mieux cibler les interventions. L’interaction 2017;6:11.
23. Vigilance Santé. Accueil. [en ligne] https://www.vigilance.ca/ (site visité le 12 novembre 2020).
24. Vigilance Santé. RxVigilance. [en ligne] https://www.vigilance.ca/rxvigilance (site visité le 12 novembre 2020).
25. Tisnado-Garland C, Guénette L, Rouleau R, Sirois C. Le modèle PEPS: une organisation basée sur la collaboration infirmier-pharmacien. Perspective infirmière 2020;17:22–9.
26. Tisnado-Garland C, Guénette L, Kröger E, Carmichael PH, Rouleau R, Sirois C. A new care model reduces polypharmacy and potentially inappropriate medications in long-term care. J Am Med Dir Assoc 2021;22:141–7.
27. Santé et services sociaux Québec. Niveaux de soins et réanimation cardiorespiratoire - DT9261. [en ligne] https://www.inesss.qc.ca/fileadmin/doc/INESSS/Rapports/OrganisationsSoins/Formulaire_NiveauxdeSoins_RCR.pdf (site visité le 5 octobre 2019).
28. Collège des médecins du Québec. La pratique médicale en soins de longue durée. [en ligne] http://www.cmq.org/publications-pdf/p-1-2015-04-01-fr-pratique-medicale-en-soins-de-longue-duree.pdf (site visité le 23 septembre 2020).
29. Centre d’expertise en santé de Sherbrooke. Les profils Iso-SMAF. [en ligne] https://www.expertise-sante.com/outils-cliniques/outils-rsipa/profils-iso-smaf/ (site visité le 5 octobre 2019).
30. Dierich MT, Mueller C, Westra BL. Medication regimens in older home care patients. J Gerontol Nurs 2011;37:45–55.
31. Institut canadien d’information sur la santé. Utilisation des médicaments chez les personnes âgées au Canada, 2016. [en ligne] https://www.cihi.ca/sites/default/files/document/drug-use-among-seniors-2016-fr-web.pdf (site visité le 11 novembre 2019).
32. Lalic S, Sluggett JK, Ilomaki J, Wimmer BC, Tan ECK, Robson L et al. Polypharmacy and medication regimen complexity as risk factors for hospitalization among residents of long-term care facilities: a prospective cohort study. J Am Med Dir Assoc 2016;17:1067.e1–e6.
33. Koo TK, Li MY. A guideline of selecting and reporting intraclass correlation coefficients for reliability research. J Chiropr Med 2016;15: 155–63.

34. Wimmer BC, Bell JS, Fastbom J, Wiese MD, Johnell K. Medication regimen complexity and number of medications as factors associated with unplanned hospitalizations in older people: a population-based cohort study. J Gerontol A Biol Sci Med Sci 2016;71:831–7.

35. Wimmer BC, Bell JS, Fastbom J, Wiese MD, Johnell K. Medication regimen complexity and polypharmacy as factors associated with all-cause mortality in older people: a population-based cohort study. Ann Pharmacother 2016; 50:89–95.

PHARMACTUEL, Vol. 54, No. 2, 2021