Étude TWILIGHT : réduction de la durée d’une double thérapie antiplaquettaire comprenant du ticagrélor chez les patients à haut risque ischémique ou hémorragique postintervention coronarienne percutanée
Sally Lavallée1,2,3,4*, Pharm.D., M.Sc., Alissar Mourad1,2,4,5*, Pharm.D., M.Sc., François Robidoux1,2,4,6*, Pharm.D., M.Sc., Gabriel Varinot1,2,4,5*, Pharm.D., M.Sc., Jenny Yan3, Pharm.D., M.Sc.
1Candidat à la maîtrise en pharmacothérapie avancée au moment de la rédaction, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
2Résident en pharmacie au moment de la rédaction, Centre universitaire de santé McGill, site Glen, Montréal (Québec) Canada;
3Pharmacienne, Centre universitaire de santé McGill, Montréal (Québec) Canada;
4Clinicien associé, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
5Pharmacien, Centre intégré universitaire du Centre-Sud-de-l’Île-de-Montréal, Hôpital de Verdun, Montréal (Québec) Canada;
6Pharmacien, Centre intégré de santé et de services sociaux de la Montérégie-Ouest, Hôpital Anna Laberge, Châteauguay (Québec) Canada
Reçu le 24 mai 2020: Accepté après révision par les pairs le 23 octobre 2020
Titre : Ticagrelor with or without aspirin in high-risk patients after PCI. N Engl J Med 2019;381:2032-421.
Auteurs : Mehran R, Baber U, Sharma SK, Cohen DJ, Angiolillo DJ, Briguori C et coll.
Commanditaires : La compagnie AstraZeneca, qui commercialise le BrilintaMD, a fourni les ressources financières et les comprimés pour l’étude, mais elle ne s’est pas engagée dans les étapes du processus de recherche (conception, collecte des données, analyse, etc.). La Icahn School of Medicine at Mount Sinai a quant à elle conçu et subventionné l’étude, appuyée par une bourse d’AstraZeneca.
Cadre de l’étude : La double thérapie antiplaquettaire (DTAP) combinant des inhibiteurs du P2Y12 et l’acide acétylsalicylique (AAS) permet de réduire le nombre d’événements cardiovasculaires après une intervention coronarienne percutanée (ICP). La DTAP à base de clopidogrel pour une durée de 12 mois a largement été utilisée après la publication des résultats des études CURE et PCI-CURE ayant démontré des bénéfices quant à la réduction des événements cardiovasculaires, accompagnée toutefois d’une augmentation du risque de saignements mineurs2–4. Certaines études, comme l’étude DAPT, ont évalué une durée prolongée de la DTAP au-delà de 12 mois, révélant des bénéfices supplémentaires en ce qui concerne le risque thrombotique malgré un risque de saignements augmenté5–9.
Afin de réduire les risques de saignements, les études OPTIMIZE, STOPDAPT-2 et SMART-CHOICE ont évalué des durées plus courtes, soit un à six mois de DTAP à base de clopidogrel, et ces trois études ont montré des résultats similaires en ce qui concerne la non-infériorité d’une DTAP raccourcie quant aux objectifs ischémiques, associée à une diminution du risque de saignements10–12. Néanmoins, il s’agissait d’études de non-infériorité qui avaient inclus peu de patients avec syndrome coronarien aigu (SCA) à haut risque. Également, ces trois études ainsi que l’étude TWILIGHT ont exclu les patients avec infarctus du myocarde avec élévation du segment ST (STEMI)13–16.
La durée optimale de la DTAP continue d’être remise en question à la suite de l’émergence de tuteurs médicamenteux moins thrombogènes et du ticagrélor, agent plus puissant et présentant une pharmacocinétique moins variable que les autres inhibiteurs du P2Y12. Il est à noter que le type de tuteur utilisé dans chacune des études variait au regard de l’alliage et du principe actif qu’il contenait. L’étude OPTIMIZE a utilisé un tuteur à base de zotarolimus, alors que l’étude STOPDAPT-2 a utilisé des tuteurs médicamenteux à base de cobalt-chrome et d’évérolimus. L’étude TWILIGHT a accepté une gamme plus large de tuteurs selon les pratiques locales12,13. L’objectif ultime était de réduire au minimum le risque de saignements tout en conservant les bénéfices en matière d’événements ischémiques.
L’étude TWILIGHT avait pour but d’évaluer une durée de DTAP plus courte avec un retrait précoce de l’acide acétylsalicylique, suivi d’une monothérapie au ticagrélor. Cette étude est novatrice, car elle se distingue par son utilisation du ticagrélor et par sa population de patients à risque ischémique ou hémorragique élevé ayant subi une ICP élective ou urgente, excluant toutefois les patients avec STEMI.
Protocole de recherche : Il s’agit d’une étude à répartition aléatoire contrôlée, à double insu, avec placebo, et multicentrique, réalisée au sein de 187 sites dans 11 pays. Un comité indépendant était responsable de la conduite de l’étude, de l’intégrité de l’analyse des données et de la publication des résultats. Il fallait disposer d’au moins 8200 patients pour montrer une diminution du risque relatif de saignements de 28 % avec une puissance de 80 %. La répartition aléatoire était stratifiée selon le centre. Grâce à ce nombre de patients, on obtenait une puissance de 80 % permettant d’exclure une différence absolue du risque pour l’objectif secondaire des thromboses de 1,6 %. Un suivi téléphonique était réalisé au premier mois, complété par une visite en personne aux sixième et douzième mois suivant la répartition aléatoire, et par un dernier suivi téléphonique trois mois après la fin de l’étude. Un rapport des risques instantanés a été établi pour l’objectif primaire de saignements avec un test statistique bilatéral pour évaluer la supériorité. Quant à l’objectif secondaire des thromboses, une analyse de non-infériorité a été effectuée.
Patients : Les patients inclus dans l’étude étaient des patients avec infarctus du myocarde sans élévation du segment ST (NSTEMI), angine instable, angine stable ou maladie coronarienne asymptomatique ayant subi une intervention de revascularisation réussie avec la pose d’au moins un tuteur médicamenteux de deuxième génération, et qui étaient admissibles à recevoir une DTAP à base de ticagrélor. Les patients qui n’adhéraient pas à la prise d’AAS ou de ticagrélor durant les trois mois post-ICP étaient exclus de l’étude. L’observance était définie par la prise d’au moins 80 % des doses en faisant le décompte manuel des comprimés. De plus, les patients qui avaient présenté des événements ischémiques définis comme un accident vasculaire cérébral, un infarctus du myocarde (IM) ou une revascularisation coronarienne avant la répartition aléatoire ont aussi été exclus de l’étude. Ils devaient également ne pas avoir de saignements majeurs définis comme des saignements de grade 3b ou supérieur selon l’échelle validée du Bleeding Academic Research Consortium (BARC) durant la période de trois mois précédant la répartition aléatoire17. De plus, ils devaient avoir au moins un critère clinique ou angiographique additionnel les mettant à haut risque d’événements ischémiques ou de saignements postrevascularisation. Les patients sous anticoagulants oraux ou ayant subi un STEMI étaient exclus. Les autres critères d’exclusion se retrouvent au tableau I.
Tableau I Critères d’inclusion et d’exclusion de l’étudea

Interventions : Après une période initiale ouverte de trois mois de DTAP à base de ticagrélor et d’AAS à la suite du congé d’hôpital, les patients admissibles ont été répartis aléatoirement à l’aveugle selon un ratio 1:1 afin de poursuivre l’AAS à raison de 81 à 100 mg une fois par jour (groupe AAS) ou un placebo identique (groupe placebo) pour une durée additionnelle de 12 mois. Tous les patients ont poursuivi la prise de ticagrélor 90 mg deux fois par jour pendant 12 mois, puis à la discrétion du médecin traitant.
Points évalués : L’objectif primaire consistait en la première apparition de saignements de grade 2, 3 ou 5 selon l’échelle BARC durant la période de 12 mois de traitement supplémentaire suivant la répartition aléatoire (voir tableau II). Le premier paramètre secondaire évalué était un composite de la survenue de décès toutes causes confondues, d’infarctus du myocarde et d’accident vasculaire cérébral (AVC) non fatal durant cette même période.
Tableau II Définitions BARCa

D’autres paramètres secondaires de saignements ont été évalués, soit les saignements de type 3 ou 5 selon la classification BARC, les saignements majeurs et mineurs selon la classification Thrombolysis in Myocardial Infarction (TIMI), les saignements modérés, importants ou menaçant le pronostic vital selon les critères Global Use of Strategies to Open Occluded Coronary Arteries (GUSTO), et les saignements majeurs selon les critères de l’International Society on Thrombosis and Haemostasis (ISTH). Enfin, d’autres paramètres secondaires individuels d’efficacité, tels que la mortalité d’origine cardiovasculaire, les infarctus du myocarde, l’AVC et les thromboses définitives ou probables de tuteurs, ont été évalués.
Résultats : Les caractéristiques des patients de l’étude sont présentées dans le tableau III. Parmi les 9006 patients initialement enrôlés, 7119 ont été répartis aléatoirement durant une période supplémentaire de 12 mois suivant la période initiale de trois mois. Parmi les 1887 patients non inclus, les principales raisons de leur exclusion étaient les suivantes : apparition d’un événement ischémique chez 111 d’entre eux ayant eu un IM, un AVC ou un décès; non-implantation de tuteur chez 134 d’entre eux; et saignements de grade 3b ou supérieur selon l’échelle BARC dans les trois mois post-ICP chez 52 d’entre eux. L’autre raison principale d’exclusion était la non-observance du traitement pendant la période de trois mois précédant la répartition aléatoire chez 1148 patients.
Tableau III Caractéristiques de base des patients répartis aléatoirement dans l’étudea
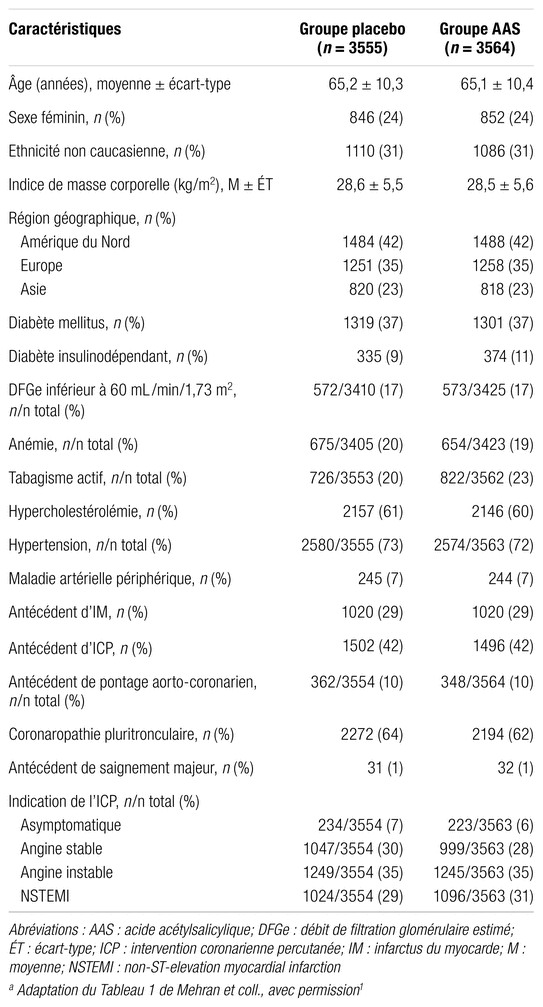
Les caractéristiques des deux groupes étaient similaires en ce qui concerne l’âge, le sexe, l’indice de masse corporelle et les comorbidités associées à un risque élevé de saignements ou de thrombose. La répartition des critères angiographiques était similaire dans les deux groupes. L’observance du traitement durant la période de 12 mois suivant la répartition aléatoire était similaire entre les deux groupes (87,1 % dans le groupe placebo et 85,9 % dans le groupe AAS).
Les principaux résultats sont présentés dans le tableau IV. L’objectif primaire a été observé chez 141 patients (4,0 %) du groupe placebo et chez 250 patients (7,1 %) du groupe AAS (risque relatif instantané [RRI] : 0,56; intervalle de confiance à 95 % [IC 95 %] : 0,45–0,68; valeur p < 0,001). Cette réduction des saignements a également été observée pour les saignements plus importants de grade 3 et 5 sur l’échelle BARC, avec une incidence de 1,0 % dans le groupe placebo et de 2,0 % dans le groupe AAS (RRI : 0,49; IC 95 %: 0,33–0,74). Les autres échelles de saignements utilisées (GUSTO, TIMI, ISTH) ont aussi démontré de telles réductions.
Tableau IV Résultats des objectifs primaires et secondaires 12 mois après la répartition aléatoirea
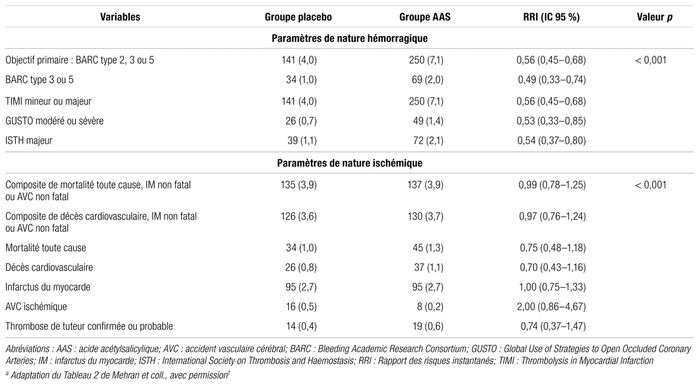
En ce qui concerne l’objectif composite secondaire, englobant les événements de mortalité toutes causes confondues, d’infarctus du myocarde ou d’AVC non fatals, a été observé chez 3,9 % des patients de chaque groupe (RRI : 0,99; IC 95 % 0,78–1,25). Quant aux autres paramètres ischémiques, les résultats étaient comparables entre les deux groupes. Des analyses de sensibilité pour les pertes au suivi ont confirmé ces observations pour l’objectif primaire et secondaire principal.
Grille d’évaluation critique

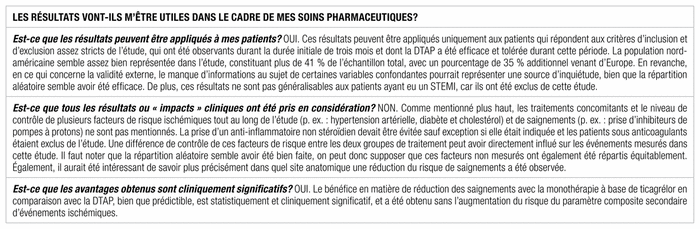
Discussion
L’étude TWILIGHT a permis de démontrer la pertinence de réduire la durée de la DTAP à trois mois, puis de poursuivre le ticagrélor en monothérapie chez certains patients à haut risque de saignements ou ischémique. Le protocole de recherche à répartition aléatoire contrôlé et la conception judicieuse de l’étude ont permis de répondre à certaines inquiétudes méthodologiques soulevées dans les études précédentes STOP-DAPT2 et SMART CHOICE, notamment quant à la taille de l’échantillon et à la sélection d’une population à risque plus élevé11,12. Cela a permis de démontrer la réduction des saignements, de même que la non-infériorité de la durée raccourcie de la DTAP par rapport aux événements ischémiques.
Des paramètres d’évaluation clinique et non des paramètres intermédiaires ont été utilisés. Une réduction des saignements BARC de type 2, 3 ou 5 de 28 % avait été anticipée pour démontrer la supériorité du régime étudié. Finalement, une diminution relative de 44 %, soit 3,08 % en absolu, a été obtenue. Ces résultats amènent d’ailleurs à se demander si les bénéfices généralement attribués à la DTAP postrevascularisation chez les patients à haut risque de thrombose sont le résultat d’un effet favorable exclusivement issu de l’inhibition du P2Y12, en raison d’un manque de documentation concernant l’usage d’un inhibiteur du P2Y12 en monothérapie après un SCA avec pose d’un tuteur médicamenteux. Un autre point positif est le fait que tous les événements cliniques survenus ont été confirmés par un comité externe indépendant, ce qui vient limiter le risque de biais. Une sous-étude expérimentale menée parallèlement à l’investigation principale a démontré dans un modèle ex vivo que le retrait de l’AAS ne semblait pas avoir un impact sur les mécanismes sous-jacents de thrombogénicité endovasculaire et de réactivité plaquettaire19.
Le choix d’un objectif primaire axé sur les saignements plutôt que sur les événements ischémiques était pertinent dans le contexte actuel. Les résultats des études GLOBAL LEADERS, OPTIMIZE et RESET n’ont pas démontré d’effet significatif sur la réduction des saignements avec l’utilisation d’une DTAP plus courte10,13. Les études STOP-DAPT-2 et SMART CHOICE avaient, quant à elles, démontré une réduction des risques de saignements avec une DAPT plus courte, d’où l’intérêt d’utiliser les saignements comme objectif primaire11,12,20. De plus, en sélectionnant des patients à haut risque ischémique, les auteurs voulaient démontrer qu’une réduction des saignements était possible tout en préservant des bénéfices similaires à ceux d’une DTAP en matière d’événements ischémiques dans une population où une baisse d’efficacité de la thérapie antithrombotique aurait un impact plus facilement observable.
Parmi les limites de l’étude, il faut mentionner que la population étudiée demeure restreinte. En effet, les patients à très haut risque ischémique ou de saignements, dont ceux avec un STEMI et ceux ayant eu un événement ischémique ou de saignements durant les trois mois avant l’arrêt de l’AAS, ont été exclus de cette étude. Les patients qui n’ont pas été répartis aléatoirement étaient à plus haut risque d’événements ischémiques, tel que démontré par une plus grande fréquence d’apparition de l’objectif composite de décès toutes causes, infarctus du myocarde et AVC, chez ceux-ci (6,2 % comparativement à 3,9 % pour les deux groupes à l’étude). Également, on constate une plus grande fréquence de saignements de grade 2, 3 ou 5 selon l’échelle BARC chez les individus non répartis aléatoirement (10,9 % comparativement à 4,0 % pour le groupe placebo et 7,1 % pour le groupe AAS).
Ainsi les résultats semblent être davantage applicables à une population à risque modéré à élevé d’événements ischémiques ou de saignements. Une autre limite non négligeable de l’étude est que l’incidence à un an de l’objectif secondaire principal dans le groupe AAS a été surestimée par les investigateurs. En effet, ceux-ci avaient estimé une incidence d’événement ischémique de 8 %, alors qu’une incidence de 3,9 % a été observée, soit la moitié de l’incidence prédite, causant un manque de puissance pour détecter une différence dans l’objectif secondaire principal. Aussi, les auteurs mentionnent un échantillon nécessaire de 8200 patients, mais ultimement 7119 patients ont été répartis aléatoirement. Ainsi, il est légitime de penser qu’on ne peut pas conclure sur la non-infériorité de la poursuite du ticagrélor en monothérapie par rapport à la poursuite d’une DTAP en ce qui concerne le risque ischémique. De plus, plusieurs caractéristiques de base essentielles concernant les patients sont manquantes, par exemple la prise de médicaments associés à un risque de saignements, certaines pathologies inflammatoires augmentant le risque thrombotique et la prise d’un inhibiteur de la pompe à protons. Cela pourrait introduire un biais de confusion potentiel non mesuré. Les patients non observants ont été exclus de l’étude et c’est un facteur à prendre en considération dans le choix du ticagrélor en raison de sa prise deux fois par jour. Enfin, il est à noter que le ticagrélor n’est pas remboursé en monothérapie par le régime général d’assurance médicaments du Québec, ce qui vient limiter son utilisation au Québec.
La courte durée de l’étude suscite un questionnement sur la conduite à tenir après un traitement de 12 mois par ticagrélor en monothérapie, au terme de trois mois de DTAP. Un retour à l’AAS en prévention secondaire semble l’option la plus sécuritaire, mais aucune étude n’a encore abordé le sujet. En comparaison, l’étude GLOBAL LEADERS s’était déroulée sur deux ans et avait d’abord démontré un avantage à un an, mais pas à deux ans quant à l’objectif primaire de mortalité toutes causes et infarctus du myocarde à onde Q pour le ticagrélor en monothérapie par rapport à une DTAP traditionnelle10,21. Cela illustre le fait que certains bénéfices pourraient s’atténuer avec une durée de traitement plus longue. De plus, les résultats de l’étude actuelle doivent être mis en perspective par rapport à d’autres stratégies étudiées. L’étude DAPT a comparé une DTAP prolongée au-delà d’un an avec le clopidogrel et l’AAS, comparativement à l’AAS seule, et l’étude PEGASUS-TIMI54 a étudié une DTAP prolongée avec dose variable de ticagrélor comparativement à l’AAS seule. Ces dernières avaient révélé une diminution du risque ischémique au profit d’une augmentation des saignements6,16. L’étude COMPASS a exploré une stratégie alternative à la DTAP en comparant l’association du rivaroxaban avec l’AAS — rivaroxaban en monothérapie et AAS en monothérapie — chez des patients avec maladie cardiovasculaire stable22. Cette étude a démontré une diminution de l’objectif composite primaire, soit l’incidence de mortalité cardiovasculaire, d’IM ou d’AVC, chez les patients recevant un traitement par rivaroxaban avec AAS, comparativement à l’AAS seul. Une comparaison directe entre ces trois stratégies n’a pas été effectuée.
Conclusion
En somme, l’étude TWILIGHT a démontré qu’une DTAP à base de ticagrélor et d’AAS pendant trois mois, suivie d’une monothérapie à base de ticagrélor pendant 12 mois, permettait de réduire les saignements. Cependant, un doute persiste quant à la non-infériorité en matière de prévention des événements ischémiques, comparativement à une DTAP d’une durée de 12 mois, en raison d’un manque de puissance statistique. Cette étude s’est concentrée sur les patients à haut risque hémorragique ou ischémique pour lesquels le sujet n’avait pas été étudié en profondeur jusqu’à présent. Mais il reste que les populations à très haut risque ischémique (STEMI) ou de saignements ont été exclues. Malgré ses faiblesses, cette étude semble ouvrir la porte à la pertinence d’une durée réduite de la DTAP pour les populations avec un risque ischémique ou de saignements modéré à élevé, associée au maintien d’une diminution du risque thrombotique possiblement non inférieure à la durée usuelle de la DTAP.
Financement
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Conflits d’intérêts
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Remerciements
Les auteurs tiennent à remercier Louise Mallet, professeure titulaire de clinique à l’Université de Montréal, pour les avoir guidés dans la rédaction de cet article et lors du processus de révision par les pairs. Les auteurs tiennent aussi à remercier Christine Hamel, pharmacienne et rédactrice en chef de Pharmactuel. Une autorisation écrite a été obtenue de ces personnes.
Références
1. Mehran R, Baber U, Sharma SK, Cohen DJ, Angiolillo DJ, Briguori C et coll. Ticagrelor with or without aspirin in high-risk patients after PCI. N Engl J Med 2019;381:2032–42.

2. Mehta SR, Bainey KR, Cantor WJ, Lordkipanidzé M, Marquis-Gravel G, Robinson SD et coll. 2018 Canadian Cardiovascular Society/Canadian Association of Interventional Cardiology Focused update of the guidelines for the use of antiplatelet therapy. Can J Cardiol 2018;34:214–33.

3. Mehta SR, Yusuf S, Peters RJ, Bertrand ME, Lewis BS, Natarajan MK et coll. Effects of pretreatment with clopidogrel and aspirin followed by long-term therapy in patients undergoing percutaneous coronary intervention: the PCI-CURE study. Lancet 2001;358:527–33.

4. Yusuf S, Zhao F, Mehta SR, Chrolavicius S, Tognoni G, Fox KK. Clopidogrel in unstable angina to prevent recurrent events trial investigators. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N Engl J Med 2001;345:494–502.

5. Mauri L, Kereiakes DJ, Yeh RW, Driscoll-Shempp P, Cutlip DE, Steg PG et coll. Twelve or 30 months of dual antiplatelet therapy after drug-eluting stents. N Engl J Med 2014;371:2155–66.


6. Bonaca MP, Bhatt DL, Cohen M, Steg PG, Storey RF, Jensen EC et coll. Long-term use of ticagrelor in patients with prior myocardial infarction. N Engl J Med 2015;372:1791–800.

7. Flather M, Bakhai A, Perez de Arenaza D. Long-term use of ticagrelor in patients with prior myocardial infarction. N Engl J Med 2015;373:1274.
8. Kikkert WJ, Damman P. Optimal duration of dual antiplatelet therapy for coronary artery disease. Neth Heart J 2018;26:321–33.


9. Helft G, Steg PG, Le Feuvre C, Georges JL, Carrie D, Dreyfus X et coll. OPTImal DUAL Antiplatelet Therapy Trial Investigators. Stopping or continuing clopidogrel 12 months after drug-eluting stent placement: the OPTIDUAL randomized trial. Eur Heart J 2016; 37:365–74.
10. Vranckx P, Valgimigli M, Jüni P, Hamm C, Steg PG, Heg D et coll. Ticagrelor plus aspirin for 1 month, followed by ticagrelor monotherapy for 23 months vs aspirin plus clopidogrel or ticagrelor for 12 months, followed by aspirin monotherapy for 12 months after implantation of a drug-eluting stent: a multicentre, open-label, randomised superiority trial. Lancet 2018;392:940–9.

11. Hahn JY, Song YB, Oh J-H, Chun WJ, Park YH, Jang WJ et coll. Effect of P2Y12 inhibitor monotherapy vs dual antiplatelet therapy on cardiovascular events in patients undergoing percutaneous coronary intervention: the SMART-CHOICE randomized clinical trial. JAMA 2019;321:2428–37.


12. Watanabe H, Domei T, Morimoto T, Natsuaki M, Shiomi H, Toyota T et coll. Effect of 1-month dual antiplatelet therapy followed by clopidogrel vs 12-month dual antiplatelet therapy on cardiovascular and bleeding events in patients receiving PCI: the STOPDAPT-2 randomized clinical trial. JAMA 2019;321:2414–27.


13. Feres F, Costa RA, Abizaid A, Leon MB, Marin-Neto JA, Botelho RV et coll. Three vs twelve months of dual antiplatelet therapy after zotarolimus-eluting stents: the OPTIMIZE randomized trial. JAMA 2013;310:2510–22.
14. Gwon HC, Hahn J-Y, Park KW, Song YB, Chae I-H, Lim DS et coll. Six-month versus 12-month dual antiplatelet therapy after implantation of drug-eluting stents: the efficacy of Xience/Promus versus Cypher to reduce late loss after stenting (EXCELLENT) randomized, multicenter study. Circulation 2012;125:505–13.

15. Schulz-Schüpke S, Byrne RA, Ten Berg JM, Neumann FJ, Han Y, Adriaenssens T et coll. ISAR-SAFE: a randomized, double-blind, placebo-controlled trial of 6 vs. 12 months of clopidogrel therapy after drug-eluting stenting. Eur Heart J 2015;36:1252–63.

16. Colombo A, Chieffo A, Frasheri A, Garbo R, Masotti-Centol M, Salvatella N et coll. Second-generation drug-eluting stent implantation followed by 6- versus 12-month dual antiplatelet therapy: the SECURITY randomized clinical trial. J Am Coll Cardiol 2014;64:2086–97.

17. Vranckx P, White HD, Huang Z, Mahaffey KW, Armstrong PW, Van de Werf et coll. Validation of BARC bleeding criteria in patients with acute coronary syndromes: the TRACER trial. J Am Coll Cardiol 2016;67:2135–44.

18. Mehran R, Rao SV, Bhatt DL, Gibson CM, Caixeta A, Eikelboom J et coll. Standardized bleeding definitions for cardiovascular clinical trials: a consensus report from the Bleeding Academic Research Consortium. Circulation 2011;123:2736–2747.

19. Baber U, Zafar MU, Dangas G, Escolar G, Angiolillo DJ, Sharma SK et coll. Ticagrelor with or without aspirin after PCI: the TWILIGHT platelet substudy. J Am Coll Cardiol 2020;75: 578–86.

20. Kim BK, Hong MK, Shin DH, Nam CM, Kim JS, Ko YG et coll. A new strategy for discontinuation of dual antiplatelet therapy: the RESET trial (real safety and efficacy of 3-month dual antiplatelet therapy following Endeavor zotarolimus-eluting stent implantation). J Am Coll Cardiol 2012;60: 1340–8.

21. Ziada KM, Moliterno DJ. Dual antiplatelet therapy: is it time to cut the cord with aspirin? JAMA 2019;321:2409–11.

22. Eikelboom JW, Connolly SJ, Bosch J, Dagenais GR, Hart RG, Shestakovska O et coll. 272 Rivaroxaban with or without aspirin in stable cardiovascular disease. N Engl J Med 273 2017;377:1319–30.

Pour toute correspondance: Gabriel Varinot, Centre universitaire de santé McGill, 1001, boulevard Décarie, Montréal (Québec) H4A 3J1, CANADA; Téléphone : 514 934-1934; Courriel : gabriel.varinot.1@gmail.com
*Sally Lavallée, Alissar Mourad, François Robidoux et Gabriel Varinot ont contribué de façon équivalente à la rédaction de cet article (
Return to Text
)
(Return to Top)
PHARMACTUEL, Vol. 54, No. 1, 2021