Andréane Bouchard, Pharm.D., M.Sc1,2,3*, Ariane Du Sault, Pharm.D., M.Sc1,2,4*, Mèryem Labidi, Pharm.D., M.Sc1,2,5*, Andréanne Rompré, Pharm.D., M.Sc1,2,6*
2Résidente en pharmacie, au moment de la rédaction, Centre hospitalier universitaire de Québec –Université Laval, Hôpital Saint-François d’Assise, Québec (Québec) Canada ;
3Pharmacienne, Centre hospitalier universitaire de Québec – Université Laval, Hôpital Saint-François d’Assise, Québec (Québec) Canada ;
4Pharmacienne, Centre intégré universitaire de santé et de services sociaux de la Mauricie–et–du–Centre-du-Québec, Centre hospitalier affilié universitaire régional, Trois-Rivières (Québec) Canada ;
5Pharmacienne, Centre intégré universitaire de santé et de services sociaux de l’Est-de-l’Île-de-Montréal, Hôpital Maisonneuve-Rosemont, Montréal (Québec) Canada ;
6Pharmacienne, Centre intégré universitaire de santé et de services sociaux de la Mauricie–et–du–Centre-du-Québec, Centre Cloutier-du Rivage, Trois-Rivières (Québec) Canada
Reçu le 20 août 2020: Accepté après révision par les pairs le 26 novembre 2020
Titre de l’article: Rivaroxaban in peripheral artery disease after revascularization. N Engl J Med 2020;382:1994-20041.
Auteurs : Bonaca MP, Bauersachs RM, Anand SS, Debus ES, Nehler MR, Patel MR et coll.
Commanditaires : L’étude a été financée par les compagnies pharmaceutiques Bayer et Janssen, fabricants du rivaroxaban. La compagnie Bayer a également participé à la conception de l’étude, au choix des sites, à l’interprétation des données et à la rédaction du manuscrit.
Cadre de l’étude : La maladie artérielle périphérique (MAP) touche jusqu’à 20 % des adultes de plus de 60 ans, particulièrement ceux présentant des facteurs de risque tels que le tabagisme, le diabète et l’insuffisance rénale2. La thérapie standard de la MAP repose actuellement sur l’utilisation d’un antiplaquettaire, d’une statine à forte intensité, et sur la maîtrise des facteurs de risque3–5. Les patients qui subiront une revascularisation ont, à long terme, un risque augmenté de présenter un événement cardiovasculaire ou un événement périphérique grave. En effet, ils ont un risque cumulatif de présenter un infarctus du myocarde (IM) ou un accident vasculaire cérébral (AVC) de 9,8 %, et un risque d’amputation ou de nouvelle revascularisation périphérique de 41,9 % dans les deux à trois années suivant l’intervention6. Les données sur le traitement médical de la MAP symptomatique, notamment en période postrevascularisation, sont limitées et surtout axées sur les antiplaquettaires7. L’utilisation d’anticoagulants oraux directs pour prévenir les événements cardiovasculaires et périphériques chez les patients atteints de MAP est une pratique nouvelle4. Le rivaroxaban, administré à la dose de 2,5 mg deux fois par jour, a déjà été évalué dans l’étude COMPASS chez des patients atteints de maladie cardiovasculaire athérosclérotique stable8. Le rivaroxaban, en ajout à l’acide acétylsalicylique (AAS), avait démontré une plus grande réduction des événements cardiovasculaires que l’AAS seule8. Environ 27 % des patients inclus dans l’étude présentaient une MAP, un sous-groupe chez qui les bénéfices associés au rivaroxaban étaient maintenus8. Les paramètres combinés étudiés dans COMPASS en tant qu’objectifs secondaires comprenaient la survenue d’une ischémie aiguë au niveau des membres inférieurs et supérieurs, une des principales complications associées à la MAP8. Ces résultats ont servi de prémisse à l’étude VOYAGER-PAD qui a porté sur le rivaroxaban, en postrevascularisation, chez les patients atteints de MAP symptomatique.
Protocole de recherche : Il s’agit d’un essai clinique multicentrique visant à démontrer la supériorité du rivaroxaban à la dose de 2,5 mg, en ajout au traitement standard composé d’AAS 100 mg, chez les patients atteints de MAP symptomatique subissant la revascularisation d’un membre inférieur pour réduire la survenue d’événements périphériques et cardiovasculaires. La sécurité du traitement est évaluée en lien avec le risque de saignements majeurs. Il s’agit d’une étude à répartition aléatoire, contrôlée avec placebo et menée à double insu.
Patients : Les patients inclus dans l’étude devaient avoir plus de 50 ans et présenter une MAP aux membres inférieurs documentée, c’est-à-dire une maladie symptomatique limitant les activités quotidiennes, une confirmation par imagerie de la maladie et un indice tibio-brachial inférieur ou égal à 0,80, ou un indice brachial à l’orteil inférieur ou égal à 0,60. Ils devaient avoir subi la revascularisation endovasculaire ou chirurgicale d’une artère périphérique, réalisée avec succès dans les 10 derniers jours. Les patients étaient exclus si leur maladie était asymptomatique, si leur état clinique était instable avant l’intervention, s’ils avaient un antécédent d’AVC ou d’ischémie cérébrale transitoire (ICT), s’ils étaient à haut risque de saignements ou si la prise de clopidogrel pour plus de six mois ou de tout autre antiplaquettaire, peu importe la durée, était envisagée.
Interventions : Les patients admissibles étaient recrutés dans les 10 jours suivant la chirurgie et répartis aléatoirement selon un ratio 1:1 dans les groupes rivaroxaban et placebo. Les patients du groupe rivaroxaban ont reçu 2,5 mg par voie orale deux fois par jour et tous les patients répartis aléatoirement ont reçu de l’AAS 100 mg par voie orale une fois par jour durant l’étude. La répartition aléatoire était stratifiée en fonction du type d’intervention (traitement endovasculaire ou intervention chirurgicale) et de la prise concomitante ou non de clopidogrel chez ceux ayant eu un traitement endovasculaire. Les suivis ont eu lieu au premier, troisième et sixième mois postintervention, puis tous les six mois par la suite, avec un suivi à la fin de l’étude et 30 jours après la fin de l’étude.
Points évalués : L’objectif primaire d’efficacité pour déterminer la supériorité du rivaroxaban en ajout au traitement standard portait sur la survenue d’un événement périphérique ou cardiovasculaire, soit l’ischémie critique ou l’amputation causée par un événement vasculaire, un AVC ischémique, un IM ou le décès d’origine cardiovasculaire. Pour les objectifs secondaires d’efficacité, différents éléments composés d’événements périphériques et cardiovasculaires ont été évalués selon un modèle hiérarchique. L’objectif primaire de sécurité évalué était le risque de saignements majeurs selon la définition du Thrombolysis in Myocardial Infarction (TIMI). Les risques de saignements majeurs selon la définition de l’International Society on Thrombosis and Haemostasis (ISTH) et du Bleeding Academic Research Consortium (BARC) ont été évalués comme objectifs secondaires de sécurité.
Résultats : D’août 2015 à janvier 2018, 6564 patients ont été inclus dans l’étude. Le tableau I décrit les principales caractéristiques des patients, celles-ci étant similaires entre les deux groupes. La présence de comorbidités était élevée dans les deux groupes, l’hypertension, la dyslipidémie et le diabète étant chacun présents chez plus de 40 % des patients. Le tiers des patients a été traité chirurgicalement, alors que les deux tiers ont reçu un traitement endovasculaire.
Tableau I Caractéristiques des patients inclus dans l’étude VOYAGER-PADa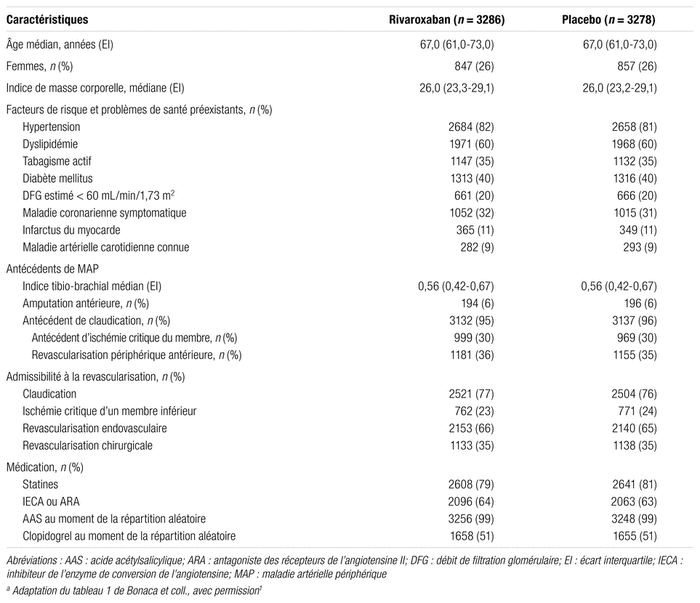
Les résultats de l’étude sur l’efficacité du rivaroxaban sont présentés dans le tableau II. Pour l’objectif primaire d’efficacité, dans le groupe rivaroxaban, 15,5 % des patients ont présenté un événement, comparativement à 17,8 % dans le groupe placebo. De plus, les courbes d’incidence cumulative d’événements de l’objectif primaire d’efficacité tendent à se séparer dès les trois premiers mois de traitement par le rivaroxaban. L’effet semble se maintenir dans le temps et la différence entre les groupes semble s’accentuer vers la fin de l’étude. Le nombre nécessaire à traiter (NNT) était de 44 patients traités pendant 28 mois pour prévenir un événement. L’analyse Kaplan-Meier à trois ans est aussi en faveur du groupe rivaroxaban (rapport de risque [RR] : 0,85; intervalle de confiance à 95 % [IC 95 %]: 0,76–0,96, p = 0,009). Ce bénéfice est principalement attribuable à la diminution des ischémies aiguës des membres inférieurs. Les décès de cause cardiovasculaire étaient quant à eux numériquement plus élevés dans le groupe rivaroxaban. Concernant les objectifs secondaires d’efficacité, les cinq premiers éléments constitutifs étaient tous statistiquement plus faibles dans le groupe rivaroxaban. La mortalité toutes causes confondues n’a pas été réduite dans le groupe rivaroxaban.
Tableau II Principaux résultats d’efficacité de l’étude VOYAGER-PADa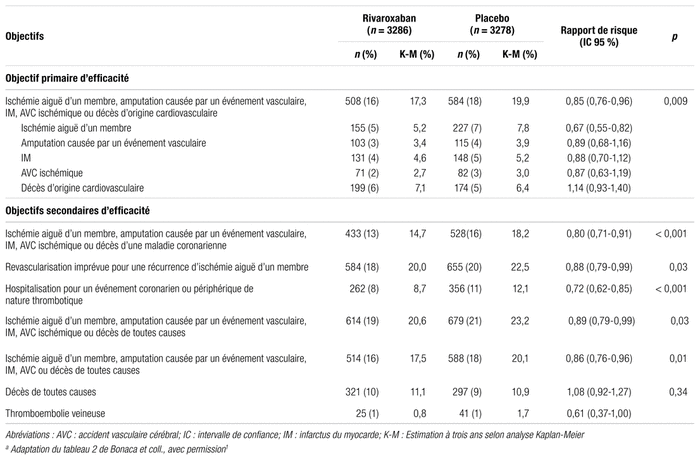
Concernant l’objectif primaire de sécurité présenté dans le tableau III, évalué selon la classification TIMI, 62 patients (1,9 %) ont subi un saignement majeur dans le groupe rivaroxaban, comparativement à 44 patients (1,35 %) dans le groupe placebo. Ces résultats ne sont pas statistiquement significatifs (RR : 1,43; IC 95 % : 0,97–2,10, p = 0,07). Les résultats selon la définition de l’échelle BARC sont similaires à ceux évalués par l’échelle TIMI. Par contre, selon la définition de l’ISHT, il y a eu significativement plus de saignements majeurs dans le groupe rivaroxaban que dans le groupe placebo (RR : 1,42; IC 95 % : 1,10–1,84, p = 0,007). Le nombre nécessaire pour nuire est de 82 patients traités durant 28 mois pour entraîner un saignement majeur.
Tableau III Principaux résultats de sécurité de l’étude VOYAGER-PADa