
Gilbert Matte1,2, Chantal Guevremont1,2, Anthony Ciarallo3,4, Coleen Schroeder1,2, Tonia Doerksen1,2, Marjorie Friesen1,2, André Bonnici1,2, Chantal Duquet5, Jean-Matthieu Beauregard6,7
Reçu le 11 septembre 2020: Accepté après révision le 17 novembre 2020
Résumé
Objectif : Familiariser les pharmaciens d’hôpitaux et les autres professionnels de la santé avec le concept de « théranostique », le travail collaboratif entre la pharmacie et le département d’imagerie médicale, et la place importante que cette technologie est appelée à occuper dans le traitement des cancers.
Méthode : Une revue de la littérature scientifique a permis de décrire cette approche et une recherche sur le site de Santé Canada a contribué à définir les nouvelles molécules disponibles sous protocole de recherche clinique.
Résultats : La littérature scientifique montre les avantages de l’approche théranostique qui permet le triage des patients et l’évaluation du traitement radiothérapeutique avant son administration. L’approche est déjà utilisée pour la prise en charge de certains cancers. Une nouvelle génération d’agents se liant spécifiquement aux récepteurs tumoraux marqués en premier aux isotopes radioactifs diagnostiques (Fluor-18, Gallium-68), utilisés en tomographie par émission de positrons, et ensuite à de nouveaux isotopes thérapeutiques ouvre la porte à une nouvelle ère de traitements personnalisés. Jusqu’à récemment seulement disponibles sous protocole de recherche clinique, le Lutétium-177 Dotatate et sa contrepartie diagnostique, le Gallium-68 Dotatate, sont rapidement devenus indispensables dans la prise en charge des tumeurs neuroendocrines et ont obtenu une autorisation de mise en marché canadienne (LutatheraMD et NetSpotMD, respectivement).
Conclusion : La théranostique sera appelée à prendre une place importante en oncologie au cours des prochaines années. La préparation et la gestion des agents théranostiques seront effectuées en médecine nucléaire. Notre expérience démontre qu’une participation du département de pharmacie facilitera l’implantation de cette nouvelle technologie.
Mots clés : Évaluation de l’efficacité, Ga-68, Lu-177, LutatheraMD, Lutecium, Lutetium, NetSpotMD, oncologie, pharmacie, radiopharmacie, radiothérapie, somatostatine, TEP, théranostique, traitement du cancer
Abstract
Objective : To familiarize hospital pharmacists and other health professionals with the concept of “theranostics”, collaborative work between the pharmacy and medical imaging department, and the important role this technology will play in cancer treatment.
Method : A review of the scientific literature enabled us to describe this approach, and a search on Health Canada’s website helped identify the new drugs available in clinical research studies.
Results : The scientific literature shows the advantages of the theranostic approach. It makes it possible to triage patients and to evaluate a radiation treatment prior to its administration. The approach is already being used in the management of certain cancers. A new generation of agents that specifically bind to tumour receptors labeled first with diagnostic radioisotopes (fluorine-18, gallium-68), which are used in positron emission tomography (PET), and then with new therapeutic isotopes is opening the door to a new era of personalized treatments. Available until recently only in clinical research studies, lutetium-177 DOTATATE and its diagnostic counterpart, gallium-68 DOTATATE, have quickly become indispensable in the management of neuroendocrine tumours and have received Canadian market authorization (Lutathera® and NetSpot®, respectively).
Conclusion : Theranostics will play an important role in oncology in the coming years. Theranostic agents will be prepared and managed in nuclear medicine. Our experience shows that the pharmacy department’s participation will facilitate the implementation of this new technology.
Keywords : Cancer treatment, efficacy evaluation, Ga-68, Lu-177, Lutathera®, lutecium, lutetium, NetSpot®, oncology, PET, pharmacy, radiopharmacy, radiotherapy, somatostatin, theranostics
Au cours des dernières années, des technologies émergentes ont permis d’offrir de nouvelles possibilités de traitement dans le domaine du cancer, telles que les thérapies géniques et cellulaires, et la théranostique1,2. Les coûts requis pour leur utilisation et mise en place limitent malheureusement leur accès, et il devient nécessaire de justifier leur choix comme option de traitement.
Une nouvelle génération de produits radiopharmaceutiques théranostiques pour le traitement personnalisé du cancer est apparue en Europe, aux États-Unis et en Australie, et devient progressivement disponible au Canada. Le terme « théranostique » a été créé en contractant les mots « thérapeutique » et « diagnostique ». Bien que le terme « théranostique » soit récent (la définition dans le dictionnaire anglophone Collins a été soumise en 2013), le concept en lui-même n’est pas nouveau pour la prise en charge de certains cancers3. Celui-ci permet l’évaluation et la confirmation du bien-fondé de la thérapie, et ce, avant son administration. Il comprend deux aspects. En premier lieu, un agent radiopharmaceutique diagnostique permet de sélectionner la thérapie en démontrant par imagerie dite « moléculaire » (tomographie par émission de positrons [TEP]) le ciblage du tissu visé (le cancer), confirmant ainsi l’admissibilité du patient. En deuxième lieu, une version thérapeutique du radiopharmaceutique est ensuite injectée. Le terme « théranostique » ne se limite pas à la médecine nucléaire : il est appliqué à d’autres technologies incluant les nanoparticules et la résonance magnétique4.
Les pharmaciens d’oncologie sont familiarisés avec l’utilisation de différents isotopes radioactifs pour le diagnostic et le traitement des cancers, tels que le cancer de la thyroïde, les phéochromocytomes et le lymphome folliculaire5,6. Le choix de l’isotope diagnostique est crucial7. Maintenant qu’elle est déployée, l’imagerie TEP, grâce à sa précision, permet de mieux évaluer le patient et de détecter des lésions qui ne pouvaient être visualisées par l’ancienne technologie scintigraphique8,9. La nouvelle génération d’agents diagnostiques théranostiques utilise essentiellement la technique de la TEP.
Un des premiers centres canadiens à utiliser l’agent thérapeutique (Lu-177-Dotatate) a été le Centre hospitalier universitaire (CHU) de Québec – Université Laval. La contribution de l’auteur en tant que « radiopharmacien de formation » a été sollicitée lors de la préparation de la demande d’essai clinique en 2015. En 2019, Santé Canada a autorisé la mise en marché d’un premier couple de radiopharmaceutiques théranostiques : un analogue de la somatostatine marqué au Gallium-68 (Ga-68) pour l’imagerie TEP diagnostique (Ga-68-Dotatate, ou NetSpotMD) et au lutétium-177 (Lu-177) pour sa contrepartie thérapeutique (Lu-177-Dotatate, ou LutatheraMD)10,11. Ce premier couple cible les tumeurs neuroendocrines surexprimant les récepteurs de la somatostatine.
Le diagnostic s’effectue grâce au marquage d’un analogue de la somatostatine à l’aide d’isotopes pour la TEP (p. ex., fluor-18 [F-18] ou Ga-68). Ces radiopharmaceutiques ont ainsi une affinité, in vivo, pour les récepteurs de la somatostatine présents sur les cellules cancéreuses. Leurs émissions β+ sont détectées par une caméra TEP. L’image confirme que la molécule est captée par les tissus cancéreux. Le dérivé de somatostatine est subséquemment marqué avec un nouvel isotope tel que le Lu-177, dont les émissions sont radiothérapeutiques (particules β-). Ce second radiopharmaceutique est ensuite injecté, typiquement en plus grande quantité, et il s’accumulera de la même façon sur les cellules cancéreuses. La radiation créera des dommages à celles-ci. Ces isotopes ne se limitent pas à une seule molécule et peuvent être attachés à une variété d’agents, permettant d’offrir une approche théranostique pour différentes pathologies. Au Canada, de nouveaux agents sont déjà accessibles au moyen d’un protocole de recherche.
Notre expérience a démontré qu’un travail de collaboration entre les départements de médecine nucléaire et de pharmacie couvrant les différents aspects de la pharmacie (clinique, galénique et centre d’information) pourra faciliter la mise en place du traitement par le département de médecine nucléaire.
Une revue de la littérature scientifique a été réalisée en utilisant une combinaison des termes suivants pour effectuer la recherche bibliographique : théranostique, theranostic, Gallium-68, Ga68, Lutétium 177, Lu-177, Ir-192, PET, NetSpotMD, LutatheraMD, nuclear medicine, PET scan, Yttrium 90, I-131, Indium-111 et Zevalin métaiodobenzylguanidine (MIBG). Cette recherche a permis de définir les nouvelles molécules disponibles et leur application clinique. Ces molécules sont aussi comparées aux traitements standards présentement offerts et les plus couramment utilisés. Le site des essais cliniques de Santé Canada a été consulté et les centres hospitaliers canadiens susceptibles d’offrir ce programme ont également été contactés pour évaluer l’accès à ce service dans un contexte national.
Le concept de théranostique requiert le choix d’une molécule (anticorps monoclonaux, hormones ou autres, tel que décrit dans les tableaux I) ayant démontré une affinité pour un type de récepteur spécifique au tissu tumoral ciblé. Si la nature chimique de la molécule choisie le permet, un atome radioactif lui est directement greffé. Sinon, un groupe chélateur est conjugué chimiquement à la molécule, permettant d’attacher un atome radioactif sans modifier l’affinité et la spécificité de la molécule pour les récepteurs tumoraux. Les marquages se feront, dans un premier temps, par l’attachement d’un atome radioactif diagnostique et, dans un deuxième temps, un nouveau marquage sera effectué en utilisant un isotope thérapeutique.
Tableau I Exemple d’agents théranostiques à l’extérieur du Canada
Il existe une variété d’atomes radioactifs pouvant s’attacher à une molécule. Par exemple, le F-18, un isotope du Fluor produit par cyclotron, peut être incorporé directement à la molécule ou encore il est possible d’attacher d’autres isotopes qui, eux, sont des « métaux lourds » grâce à la présence d’un chélateur conjugué à la molécule. Parmi les isotopes de métaux lourds, on trouve les isotopes du gallium (Ga) et du cuivre (Cu). Les propriétés physiques (radioactives) et chimiques de ces isotopes détermineront leur choix. Les isotopes utilisés par la TEP, tels que le F-18 et le Ga-68, émettent des particules β + (positrons) qui sont transformées en rayons gamma. Les rayons gamma traversent le tissu et sont détectés par une caméra de la TEP. Ils seront utilisés pour la partie diagnostique de l’examen. Les demi-vies physiques respectives du F-18 et du Ga-68 sont courtes, limitant ainsi la radiation à laquelle le patient sera soumis (tableau II). Ce sont d’excellents isotopes à des fins diagnostiques. Dans les deux cas, les courtes décroissances physiques (demi-vies physiques de 110 minutes pour le F-18 et de 68 minutes pour le Ga-68) limitent leur approvisionnement à travers le réseau de la santé. Les agents diagnostiques marqués au Ga-68 sont préférablement préparés et utilisés sur place.
Tableau II Isotopes utilisés en théranostic15,26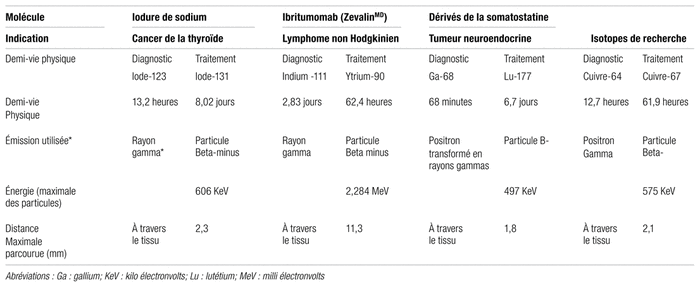
D’autres atomes, tels que le Lu-177 et le Cu-67, émettent des radiations qui ne seront pas aussi bien détectées par une caméra. La radiation émise (particule β-identique à un électron) ne voyage pas beaucoup au travers des tissus et produira une ionisation du milieu sur son trajet. Pour ces raisons, ils ne peuvent pas être utilisés à des fins diagnostiques. Ils peuvent néanmoins remplacer chimiquement le Ga-68 sur la molécule, permettant de déposer une dose de radiation thérapeutique directement sur la tumeur. Leur présence sur la molécule ne doit pas significativement modifier les propriétés biologiques, telles que la biodistribution et l’attachement aux récepteurs, démontrées par leur équivalent diagnostique. Par exemple, le Lu-177 émet des particules β- voyageant sur une distance maximale de 1,8 mm du lieu d’émission; leurs effets ionisants se trouvent limités à la région du tissu cancéreux auquel la molécule est attachée (tableau II).
Les propriétés physiques et biologiques des isotopes utilisés en traitement peuvent être prises en considération lorsque le physicien calcule la dose de radiation reçue par un tissu à la suite de l’administration d’une thérapie radioactive12. Le tableau II présente un sommaire de certaines de ces propriétés pour permettre au lecteur d’apprécier les différences entres les isotopes utilisés en théranostique. La biodistribution, à la suite de l’injection intraveineuse, est surtout associée à la molécule à laquelle l’isotope est attaché. La littérature médicale répertorie aussi d’autres isotopes qui peuvent être utilisés à des fins thérapeutiques cliniques, comme le palladium-103 ou le césium-131 utilisés en brachythérapie pour le traitement du cancer13. Afin de simplifier le contenu et pour des raisons d’espace, les implants radioactifs ne sont pas discutés dans cette revue. Elle se limite aux isotopes émettant des particules β-injectées.
Dans un premier temps, un atome radioactif diagnostique émetteur de positrons (typiquement le Ga-68) marque une molécule qui devrait s’attacher spécifiquement à la tumeur. L’injection de la molécule radio-marquée non seulement confirme l’affinité de la molécule pour le tissu cancéreux mais permet d’évaluer la pharmacocinétique in vivo. Son accumulation préférentielle, sa forte rétention par la tumeur ainsi que sa plus faible accumulation et une clairance rapide des tissus sains seront quantifiées grâce à une caméra de TEP. Ce processus permettra au physicien nucléaire d’obtenir les données de biodistribution qui peuvent aussi contribuer à définir la dose de radiation efficace et sécuritaire à délivrer à la tumeur sans trop affecter les autres organes. Cette étape permet de personnaliser le dosage thérapeutique pour certains protocoles de traitement14. La seconde étape consiste à injecter la version thérapeutique de la molécule marquée avec l’isotope thérapeutique.
Présentement, les molécules de la nouvelle génération les plus étudiées et utilisées cliniquement sont des dérivés de la somatostatine. À la suite de l’évaluation diagnostique, le traitement radioactif d’un patient avec une tumeur neuroendocrine de stade avancé consiste généralement en quatre doses séparées (cycles) d’un dérivé de la somatostatine marqué au Lu-177. Initialement les doses étaient fixes15. Grâce à des études récentes, on espère améliorer la réponse au traitement en personnalisant la dose14.
Une revue de patients avec un diagnostic de tumeur neuroendocrine avancée ayant une forte expression des récepteurs de la somatostatine, publiée en 2017, démontre l’impact de cette approche. Parmi les 1214 patients traités par un groupe hollandais de janvier 2000 à janvier 2015, 443 ayant été traités avant 2013 ont été jugés admissibles à une analyse d’efficacité et de survie. Les autres patients, sous un protocole différent, ont seulement été inclus dans une analyse d’innocuité. La valeur médiane du suivi pour l’étude d’innocuité était de 64 mois. La valeur médiane de la survie sans progression (SSP) dans ce groupe de patients était de 35 mois, la valeur de la survie globale (SG) s’est établie à 58 mois. Pour les patients inclus dans l’étude d’efficacité et de survie, la valeur médiane du suivi était de 78 mois, celle de la SG, de 63 mois, alors que la SSP était de 29 mois16. Une autre étude rétrospective plus récente mais de plus petite envergure confirme ces résultats encourageants pour 44 patients souffrant de tumeurs inopérables ou métastatiques ayant des récepteurs de la somatostatine. La valeur médiane du suivi était de 80 mois pour tous les patients de l’étude et de 135 mois pour les survivants. La SG était de 79 mois et 32 % des patients étaient toujours en vie 12 ans après le début du traitement17. On note parmi ces études des différences de protocole pour les doses et la chimiothérapie d’appoint.
Les effets indésirables étaient généralement bien tolérés et réversibles (nausées, vomissements, fatigue, changements endocriniens et métaboliques). Une augmentation de la toxicité hématologique (grade 3–4) a été observée chez 10 % des patients et une augmentation des transaminases hépatiques, chez 3 % d’entre eux (grade 3–4). Les effets indésirables dans les deux études citées plus haut incluaient l’insuffisance rénale, la leucémie aiguë et le syndrome myélodysplasique pour respectivement 1 %, 0,7 % et 1,5 % des patients16. Les auteurs concluent que le traitement par la somatostatine marquée au Lu-177 est une solution de rechange favorable aux autres options offertes aux patients atteints de tumeurs neuroendocrines gastro-entéro-pancréatiques ou bronchiales métastatiques exprimant des récepteurs de la somatostatine16–18.
L’étude NETTER-1 fut l’une des premières à comparer l’administration de l’octréotide à longue durée d’action (LAR) 60 mg à celle d’une dose fixe du dérivé octréotate (Dotatate) marqué au Lu-177 chez des patients avec tumeurs neuroendocrines intestinales métastatiques bien différenciées. Cette étude avait démontré un net avantage en faveur du Lu-177-Dotatate : les SSP après 20 mois étaient respectivement de 10,8 % et 65,2 %, alors que les réponses tumorales objectives étaient de 3 % et 18 %15. L’analyse intérimaire indique même un avantage de survie globale en faveur du Lu-177-Dotatate.
En sol québécois, un groupe du CHU de Québec – Université Laval étudie un dosage thérapeutique personnalisé basé sur la fonction rénale, la surface corporelle et la dose de radiation reçue par les reins. Les résultats préliminaires démontrent une augmentation de l’état de santé/qualité de vie (selon les questionnaires QLCQ0C30 et GI-NET21 de l’European Organization for Research and Treatment of Cancer, qui incluent une évaluation des symptômes, tels que douleur, fatigue, diarrhée, nausée, insomnie, perte d’appétit, etc.). Une amélioration de l’état de santé a été observée chez 50 % des patients. Vingt-trois pour cent (23 %) des patients ont démontré une réponse partielle, 35 % une réponse mineure et 33 % une stabilité de leur maladie. Une progression a été observée chez seulement 7 % des patients14. La figure 1 illustre un exemple du suivi chez un patient atteint d’un insulinome métastatique qui a participé à l’étude réalisée au CHU de Québec – Université Laval.
|
|
||
|
Figure 1 Exemple d’imagerie médicale associée aux études théranostiquesa,b |
||
Il existe plusieurs approches pour le traitement conventionnel des tumeurs aux récepteurs de la somatostatine au stade avancé, dont l’octréotide LAR administré par voie intramusculaire toutes les quatre semaines. L’évérolimus ou le sunitinib sont administrés de façon continue (le coût mensuel de ces deux traitements est évalué à environ 5000 $ par mois)19. Au Canada, le prix de quatre cycles de Lu-177-Dotatate par patient est estimé à 140 000 $. Le premier couple de produits théranostiques de la nouvelle génération (diagnostic et thérapeutique) fait maintenant partie des options thérapeutiques pour traiter des tumeurs neuroendocrines en Europe, en Australie et aux États-Unis. Il inclut les dérivés de la somatostatine marqués au Ga-68 (étape diagnostique) et au Lu 177 (étape thérapeutique). L’efficacité de cette approche est maintenant démontrée et justifie l’autorisation de mise en marché dans différents pays, incluant le Canada. Le coût de ce traitement au dérivé marqué au Lu-177 demeure très élevé (plus de 90 000 euros pour quatre doses de traitement)20. Néanmoins, la présence de l’agent diagnostique est incontestablement un avantage par rapport à d’autres technologies dispendieuses. Bien que son coût estimé aux États-Unis soit approximativement de 4000 $ la dose, il permet de mieux cibler les patients qui pourraient bénéficier de son contrepoids thérapeutique, et ainsi d’éviter des traitements futiles21.
Plusieurs autres agents ciblant d’autres tumeurs sont présentement à l’étude. Le tableau I, en annexe, présente les nouveaux produits susceptibles d’avoir un impact clinique et d’être offerts au Canada sous peu.
L’utilisation de l’approche théranostique est appelée à prendre un essor marqué pour l’évaluation du patient et ensuite son traitement. Déjà dans le milieu médical canadien, l’intérêt est élevé et l’approche théranostique pour la prise en charge des tumeurs neuroendocrines a justifié une évaluation de l’Agence canadienne des médicaments et des technologies de la santé19. Les résultats quant à la qualité de vie des patients atteints de tumeurs neuroendocrines sont encourageants, et ce, même si le pronostic ne peut pas encore être totalement défini16. Néanmoins, l’aspect diagnostique effectué par la version TEP de la molécule permet un triage des patients et limite l’administration de la thérapie à une population ciblée de patients susceptibles d’y répondre. De nouvelles molécules seront bientôt offertes pour les traitements de cancers plus fréquents, tels que le cancer de la prostate (tableaux I)22,23.
Au Canada, certains centres hospitaliers universitaires situés à Vancouver, Calgary, Edmonton, Hamilton, London, Toronto, Sherbrooke, Montréal et Québec avaient jusqu’ici accès à cette technique par l’intermédiaire de leur centre de recherche (Tableau I). La demi-vie physique du Lu-177 (portion thérapeutique) étant de 6,6 jours, la date de péremption d’une préparation commerciale pourra permettre une distribution à grande échelle. Cependant, la courte demi-vie des versions diagnostiques (utilisant le Ga-68 ou le F-18) limitera leur distribution locale. Le marquage étant une étape de synthèse chimique donnant naissance à une nouvelle entité chimique, les nouveaux agents diagnostiques, non homologués et certains (marqués au Ga-68) devront être approuvés par Santé Canada et préparés localement, et ce, suivant les règles pour les produits radiopharmaceutiques.
Le Dotatate est le premier agent diagnostique ayant obtenu son autorisation de mise en marché au Canada. On le trouve sous forme de trousse. Le dérivé de la somatostatine se présente sous forme stérile dans une fiole, prêt pour le marquage relatif à l’aspect diagnostique. L’isotope (Ga-68) est extrait d’un générateur sous forme de solution stérile qui sera ajoutée à la fiole du dérivé de la somatostatine. À la suite de l’addition des deux solutions, un contrôle de la qualité est effectué pour confirmer le marquage. Cela permet la préparation sur place en suivant les normes locales pour la préparation de produits radiopharmaceutiques. Au Québec, l’accès à cette technique demeure limité. Le dérivé thérapeutique sera commercialisé, déjà marqué au Lu-177. Préalablement, avant l’autorisation de mise en marché, la prise en charge des tumeurs qui répondent à la somatostatine se faisait dans différents centres : les patients devaient se rendre au département de médecine nucléaire de Sherbrooke (Centre intégré universitaire de santé et de services sociaux de l’Estrie-Centre hospitalier universitaire de Sherbrooke) pour avoir accès aux techniques de diagnostic, puis au CHU de Québec pour le traitement. La commercialisation devrait donc faciliter l’accès. Le prochain duo d’agents sera probablement autorisé pour le diagnostic et le traitement du cancer de la prostate23,24.
Quelques pharmaciens sont déjà engagés dans certains aspects galéniques associés à l’approche théranostique en médecine nucléaire. Au CHU de Québec – Université Laval, le département de pharmacie a contribué à l’implantation du projet de traitement par Lu-177-Dotatate. Les normes de l’Ordre des technologues en imagerie médicale, en radio-oncologie et en électrophysiologie médicale du Québec n’étant pas instaurées au moment de la préparation de la demande d’essai clinique à Santé Canada, la pharmacie a collaboré avec le département de médecine nucléaire pour adapter les politiques et procédures de préparations stériles en pharmacie à la réalité de la médecine nucléaire. Les techniques de préparations stériles ont été modulées selon les contraintes physiques des installations en médecine nucléaire (blindage, appareils spécialisés de dosimétrie dans la hotte, etc.). Les dates limites d’utilisation (DLU), telles que recommandées par la norme 2014 de l’Ordre des pharmaciens du Québec, ont été appliquées, de même que les normes reliées à l’entretien des installations et à la formation du personnel. Des assistants techniques en pharmacie (ATP) ont participé à la formation sur les techniques de manipulation stérile des technologues de médecine nucléaire chargés du marquage au Lu-177.
Un pharmacien certificateur a ensuite évalué et certifié les technologues au même titre que les ATP. Par la suite, les technologues ont été intégrés au programme annuel de certification des ATP pour les techniques stériles, tel que requis par les agences réglementaires dans le cadre d’une étude clinique. Le département de pharmacie collabore aussi à la préparation d’une solution magistrale d’acides aminés administrée au patient comme protection rénale afin de réduire l’accumulation de Lu-177-Dotatate dans le cortex rénal. Enfin, en Europe, aux États Unis, en Australie et ailleurs au Canada, des pharmaciens formés en médecine nucléaire (radiopharmaciens) contribuent à la production et/ou au contrôle de la qualité des produits radiopharmaceutiques préparés sur place.
Présentement, sur le plan clinique, le pharmacien n’est pas nécessairement concerné, mais, à mesure que cette technique se déploiera, la contribution du pharmacien d’oncologie deviendra nécessaire : il devra revoir le profil pharmacologique du patient pour s’assurer qu’aucun médicament ne pourra influer sur la captation tumorale ou entrer en compétition avec elle, tout en s’assurant, comme pour les autres médicaments d’oncologie, de l’intégrité de la fonction rénale et de la formule sanguine (tableau III).
Tableau III Information pour le pharmacien d’hôpital lors de l’administration du LutatheraMD
L’approche théranostique du traitement du cancer est au début de son déploiement au Québec. Pour l’instant, à l’exception des protocoles de recherche, elle est limitée aux tumeurs neuroendocrines. Parmi les avantages que l’approche théranostique peut offrir, on note l’effet ciblé et l’évaluation du traitement avant même que ce dernier soit administré. Il devient donc possible de stratifier les patients et de sélectionner ceux qui ont la meilleure chance de répondre au traitement, permettant ainsi d’éviter les coûts d’une thérapie non efficace. L’expérience acquise grâce au dérivé de la somatostatine (Dotatate) indique que le déploiement de cette nouvelle technologie bénéficiera d’une approche d’équipe pour laquelle la participation du département de pharmacie sera incontestablement un atout.
Aucun financement en relation avec le présent article n’a éte déclare par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclare aucun conflit d’intérêts en relation avec le présent article.
1. Zhao L, Cao YJ. Engineered T cell therapy for cancer in the clinic. Front Immunol 2019;10: 2250.

2. Lorenzoni A, Capozza A, Seregni E, Giovanella L. Nuclear Medicine Theranostics: Between atoms and patients. Dans : Giovanella L, rédacteur. Nuclear Medicine Therapy. 1ère éd. Bellinzona: Springer; 2019. p.1–9.
3. Wachsman D. Theranostics new words suggestion. Collins dictionary 2013. [en ligne] https://www.collinsdictionary.com/submission/15089/Ta-Da (site visité le 8 février 2021).
4. Elgqvist J. Nanoparticles as theranostic vehicles in experimental and clinical application – focus on prostate and breast cancer. Int J Mol Sc 2017;18:1102.
5. Ballinger J. Theranostic radiopharmaceuticals: established agents in current use. Br J Radiol 2018;91:20170969.

6. Conti PS, White C, Piester P, Molina A, Aussie J, Foster P. The role of imaging with 111 In Ibritumomab Tiuxetan in the Ibritumomab Tiuxetan (Zevalin) regiment: Results from the Zevalin imaging registry. J Nuc Med 2005;46:1812–8.
7. Deppen SA, Blume J, Bobbey A, Shah C, Graham MM, Lee P et al. 68Ga-DOTATATE compared with 111In-DTPA –Octreotide and conventional imaging for pulmonary and gastroenteropancreatic neuroendocrine tumors: a systematic review and meta-analysis. J Nuc Med 2016;57:872–8.
8. Schreiter NF, Brenner W, Nogami M, Nogami M, Huppertz A, Pape UF et al. Cost comparison of 111 In DTPA-Octreotide scintigraphy and 68Ga-Dotatoc PET/CT for staging enteropancreatic neuroendocrine tumours. Eur J Nuc Med Mol Imaging 2012;39:72–82.
9. Lee I, Paeng JC, Shin CS, Jang JY, Cheon GJ, Lee DS et al. Comparison of diagnostic sensitivity and quantitative indices between 68Ga-DOTATOC PET/CT and 111 In-PentreotideSPECT/CT in neuroendocrine tumors: a preliminary report. Nucl Med Mol Imaging 2015; 49:284–290.

10. Novartis. Monographie de la trousse pour la préparation d’injection de Gallium 68-Dotatate (NetspotMD). Millburn, New Jersey. Février 2020.
11. Novartis. Monographie du lutethium (177Lu) oxodotreotide (LutatheraMD) Millburn, New Jersey. Février 2019.
12. Kassis A. Therapeutic Radionuclides : Biophysical and radiobiologic principles. Sem Nucl Med 2008;38:358–66.
13. Aronowitz JN, Rivard MJ. The phyogeny or permanent prostate brachytherapy. J Comtemp Brachyterapy 2013;5:89–92.
14. Del Prete M, Buteau FA, Arsenault F, Saighi N, Bouchard LO, Beaulieu A et al. Personalized 177Lu –octreotate peptide receptor radionuclide therapy of neuroendocrine tunours: initial results for the P-PRRT trial. Eur J Nuc Med Mol Imaging 2019;46:728–42.
15. Strosberg J, El-Haddad G, Wolin E, Ahndifar A, Yao J, Chasen B et al. Phase 3 trial of 177Lu Dotatate for gut neuroendocrine tumors. N Engl J Med 2017;376:125–35.

16. Bradander T, Van der Zwan WA, Teunissen JJM, Kam BLR, Feelders RA, de Herder WW et al. Long term efficacy, survival and safety of [177Lu DOTA0 Tyr3] Octreotate in patients with gastroenteorpancreatic and bronchila neurodendocrine tumors. Clin. Cancer Res 2017; 23:4617–24.
17. Gabriel M, Nilica B, Kaiser B, Virgolini IJ. Twelve-year follow-up after peptide receptor radionuclide therapy. J Nuc Med 2019;60:524–9.
18. Mittra ES. Neuroendocrine tumor therapy: 177Lu-Dotatate. Am J Roent 2018;211:278–85.
19. Pan-Canadian Oncology Drug Review. Initial economic guidance report. Lutetium Lu-177-dotatate (LutatheraMD) for gastroenteropancreatic neuroendocrine tumors. 2019. [en ligne] https://www.cadth.ca/sites/default/files/pcodr/Reviews2019/10142LutetiumLu177dotatateGEP-NET_inEGR_NOREDACT-ABBREV_Post_31May2019_final.pdf (site visité le 8 février 2021).
20. Liu A. Fierce Pharma. Novartis accused of gaming Europe’s orphan drug program to price Lutathera sky-high. 2019. [en ligne] https://www.fiercepharma.com/pharma/novartis-accused-gaming-ema-orphan-program-to-price-lutathera-price-sky-high (site visité le 8 février 2021).
21. Shell J, Keutgen XM, Milo C, Nilubol N, Patel D, Sadowski S et al. 68-Gallium dotatate scanning in symptomatic patients with negative anatomic imaging but suspected neuroendocrine tumors. Int J Endoc Oncol 2018;5:IJE04.
22. Rahbar K, Afshar-Oromieh A, Jadvar H, Ahmadzadehfar H. PSMA theranostics current status and future directions. Mol Imaging 2018;17: 1536012118776068.
23. Pillai MRA, Nanabala R, Joy A, Sasikumar A, Furn F, Knapp R. Radiolabeled enzyme inhibitor and biding agents targeting PSMA: Effective theranostic tool for imaging and therapy of prostate cancer. Nucl Med Biol 2016;43:693–720.
24. Derlin T, Schmuck S. [177 Lu]-PSMA-617 radionuclide therapy inpatients with metastatic resistant prostate cancer. Lancet Oncol 2018;19:e372.
25. Massicano AVF, Manquez-Nostra B, Lapi SE. Targeting HER2 in Nuclear Medicine for imaging and therapy. Mol. Imaging 2018;17: 1536012117745386.

26. Bhusari P, Shukla J, Dhawan D, Mittal B. Exploring the theranostic role of Lu-177 herceptin in a HER2 expressing breast cancer: Preliminary studies on comparison with F-18-FDG PET/CT. J Nuc Med 2018;59(suppl 1.):490.
PHARMACTUEL, Vol. 54, No. 2, 2021