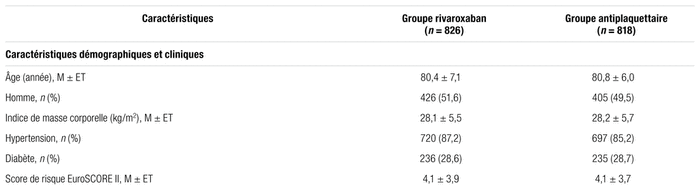Le rivaroxaban comme traitement antithrombotique après l’implantation d’une valve aortique par cathéter : étude GALILEO
Rosalie Darveau, Pharm.D., M.Sc1,2,3*, Maryse Fortin, B.Sc., Pharm.D., M.Sc1,2,4*, Alexandre Sanctuaire, B.Sc., DESS, Pharm.D., M.Sc1,2,3*, Camille Thibault, Pharm.D., M.Sc1,2,5*, Julie Méthot, B.Pharm., M.Sc., Ph.D3,6,7
1Candidat à la maîtrise en pharmacothérapie avancée au moment de la rédaction, Faculté de pharmacie, Université Laval, Québec (Québec) Canada
;
2Résident en pharmacie au moment de la rédaction, Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval, Québec (Québec) Canada
;
3Pharmacien, Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval, Québec (Québec) Canada
;
4Pharmacienne, Centre intégré universitaire de la Mauricie-et-du-Centre-du-Québec, Hôtel-Dieu d’Arthabaska, Victoriaville (Québec) Canada
;
5Pharmacienne, Centre hospitalier universitaire de Québec – Université Laval, Hôpital Saint-François d’Assise, Québec (Québec) Canada
;
6Professeure agrégée et directrice du programme de maîtrise en pharmacothérapie avancée, Faculté de pharmacie, Université Laval, Québec (Québec) Canada
;
7Chercheuse associée, Centre de recherche, Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval, Québec (Québec) Canada
Reçu le 26 septembre 2020: Accepté après révision par les pairs le 16 décembre 2020
Titre de l’article : A controlled trial of rivaroxaban after transcatheter aortic-valve replacement. N Engl J Med 2020;382:120-91.
Auteurs : Dangas GD, Tijssen JGP, Wo.hrle J, Sondergaard L, Gilard M, Mo.llmann H et coll., pour le groupe d’investigateurs GALILEO.
Commanditaires : Bayer et Janssen Pharmaceuticals ont contribué financièrement à l’étude. Des membres des compagnies figuraient au comité exécutif du développement du protocole et de supervision de l’étude. Bayer a agi à titre de fournisseur pour le rivaroxaban pendant l’étude.
Cadre de l’étude : La sténose aortique est la cardiopathie valvulaire la plus courante et sa prévalence est en augmentation continuelle2–4. Aucun traitement pharmacologique ne peut la traiter ni réduire sa progression3. Le traitement définitif de la sténose aortique symptomatique est le remplacement de valve par méthode chirurgicale ou par l’implantation valvulaire aortique par cathéter (TAVI)3. Cette dernière est la technique de choix pour les patients à haut risque chirurgical5.
Les sociétés savantes recommandent un régime antiplaquettaire en prévention des complications thromboemboliques possibles à la suite d’un TAVI, telles que les accidents vasculaires cérébraux (AVC), les thromboses veineuses profondes (TVP), les embolies pulmonaires (EP) et les thromboses de valves6,7. À ce jour, les recommandations reposent sur des consensus d’experts qui favorisent une double thérapie antiplaquettaire (DTAP) pour trois à six mois, suivie d’une monothérapie à long terme pour les patients sans indication d’anticoagulation à la suite d’un TAVI8–10. Une monothérapie antiplaquettaire peut être envisagée pour les patients à haut risque de saignements11,12. Des données récentes soutiennent également la monothérapie antiplaquettaire sans augmentation du nombre d’événements cardiovasculaires en comparaison avec la DTAP13.
L’absence de recommandations établies concernant la pharmacothérapie antithrombotique optimale après un TAVI laisse place à plusieurs questionnements5,8,9,14. La présente étude cherche à déterminer si le rivaroxaban peut réduire les événements thromboemboliques sans augmentation des saignements chez les patients ayant eu un TAVI, en comparaison avec la thérapie antiplaquettaire conventionnelle.
Protocole de recherche : Il s’agit d’une étude clinique à répartition aléatoire, multicentrique, événementielle et ouverte, menée dans 136 centres de 16 pays. L’objectif était d’évaluer l’efficacité et la sécurité d’une thérapie antithrombotique comprenant le rivaroxaban en comparaison avec une thérapie antiplaquettaire chez des patients ayant subi un TAVI. Les patients ont été répartis aléatoirement entre ces deux groupes. Les analyses principales ont été effectuées en intention de traiter et des analyses per protocole ont également été effectuées. Les événements cliniques inclus dans les objectifs étaient évalués par un comité indépendant. Un test de supériorité était visé au départ pour l’objectif primaire; celui-ci était précédé d’un test de non-infériorité qui devait être satisfait. Toutefois, il a été décidé de réaliser l’analyse à l’aide de tests bilatéraux.
Patients : Les hommes et les femmes de 18 ans et plus ayant subi un TAVI avec succès par voie iléofémorale ou sous-clavière étaient admissibles à l’étude. Une intervention réussie était définie comme l’implantation par cathéter d’une bioprothèse de la valve aortique dans une position anatomiquement appropriée, et ce, avec une performance de la valve attendue et une absence de complications périprocédurales. Les principaux critères d’exclusion étaient l’indication d’une anticoagulation à long terme, l’indication absolue d’une DTAP, une diathèse hémorragique connue et un débit de filtration glomérulaire estimé (DFGe) inférieur à 30 mL/min/1,73 m2.
Interventions : Les patients étaient répartis aléatoirement dans un des deux groupes selon un rapport 1:1 avant de quitter l’hôpital, entre les jours un et sept suivant le TAVI. Les patients du groupe rivaroxaban ont reçu le rivaroxaban à la dose quotidienne de 10 mg ainsi que 75 à 100 mg d’acide acétylsalicylique (AAS) pour trois mois, suivis du rivaroxaban en monothérapie. Les patients développant de la fibrillation auriculaire (FA) recevaient le rivaroxaban à une dose quotidienne augmentée à 15 ou 20 mg selon le DFGe. L’AAS était poursuivi tel que prévu pendant trois mois suivant le TAVI. Les patients du groupe antiplaquettaire ont reçu l’AAS à la dose quotidienne de 75 à 100 mg ainsi que 75 mg de clopidogrel pour trois mois, suivis de l’AAS en monothérapie. Une dose de charge minimale de 300 mg de clopidogrel était recommandée. Un antagoniste de la vitamine K (AVK) (cible visée du rapport international normalisé 2 à 3) était instauré si de la FA survenait. Si cette dernière se présentait dans les trois premiers mois, le clopidogrel était cessé. Si elle se présentait dans les mois subséquents, l’AAS était cessé. Un suivi a été effectué aux mois un, trois et six, puis tous les six mois.
Points évalués : L’objectif primaire d’efficacité portait sur la mortalité toutes causes et les événements thromboemboliques (AVC, TVP, EP, infarctus du myocarde, embolies systémiques et thromboses symptomatiques de valves). L’objectif d’efficacité secondaire portait sur la mortalité cardiovasculaire et les événements thromboemboliques. L’objectif primaire de sécurité incluait des saignements menaçant la vie, invalidants ou majeurs, définis selon le Valve Academic Research Consortium15.
Résultats : Dans cette étude, qui s’est déroulée de décembre 2015 à mai 2018, 1644 patients ont été inclus. La répartition aléatoire a été réalisée après le TAVI, soit 826 patients dans le groupe rivaroxaban et 818 dans le groupe antiplaquettaire. Le temps médian de répartition aléatoire a été de 2,0 jours (étendue : 0 à 8). Le tableau I présente les caractéristiques des patients inclus dans l’étude. Tous groupes confondus, un nouveau diagnostic de FA a été émis en moyenne chez 11 % des patients.
Tableau I Caractéristiques de base des patients inclus dans l’étudea
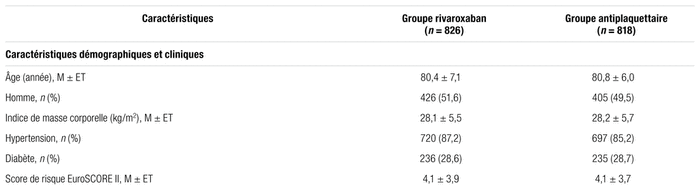
Le suivi médian a été de 17 mois (interquartile : 13 à 21). Pendant les trois premiers mois, l’exposition médiane à la thérapie combinée a été de 90 jours pour chacun des groupes. La durée médiane d’exposition au rivaroxaban dans le groupe rivaroxaban a été de 428 jours et de 474 jours pour l’AAS dans le groupe antiplaquettaire. L’étude a été terminée chez 96,8 % des patients et le statut vital était connu chez 98,0 %. Le traitement a été cessé prématurément dans le groupe rivaroxaban et le groupe antiplaquettaire, soit chez 307 et 194 patients respectivement.
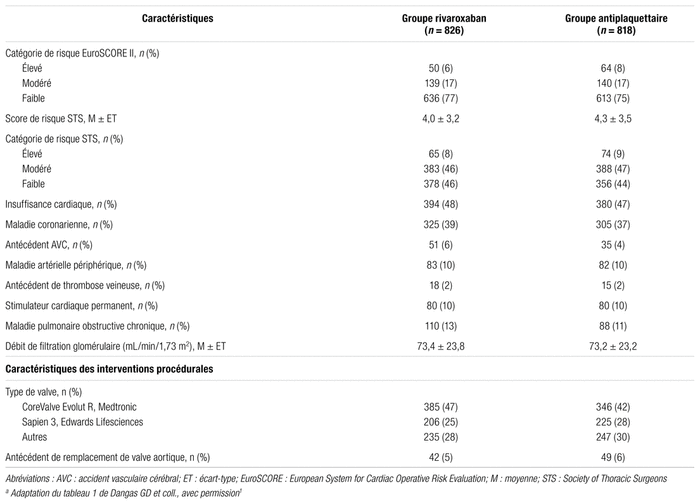
Selon l’analyse en intention de traiter, les résultats de l’analyse de l’objectif primaire d’efficacité montrent une différence significative entre les groupes en ce qui a trait à la mortalité toutes causes ou l’incidence des premiers événements thromboemboliques. De fait, 105 patients du groupe rivaroxaban et 78 du groupe antiplaquettaire ont présenté un événement (9,8 comparativement à 7,2 par 100 personnes-années, rapport de risque [RR] : 1,35; intervalle de confiance 95 % [IC 95 %] : 1,01–1,81; p = 0,04). Le nombre nécessaire pour nuire (NNH) est de 32. En ce qui concerne l’objectif secondaire d’efficacité, 7,8 comparativement à 6,3 par 100 personnes-années ont présenté un événement dans le groupe rivaroxaban en comparaison avec le groupe antiplaquettaire, RR : 1,22; IC 95 % : 0,89–1,69. Aucune différence n’est ressortie concernant les thromboses de valves symptomatiques. La ventilation des résultats pour l’objectif primaire montre une augmentation de la mortalité toutes causes (5,8 comparativement à 3,4 par 100 personnes-années, RR : 1,69; IC 95 % : 1,13–2,53) et une augmentation de la mortalité de causes non cardiovasculaires (2,6 comparativement à 1,0 par 100 personnes-années, RR : 2,67; IC 95 % : 1,33–5,35) pour le groupe rivaroxaban. Aucune différence entre les groupes n’a été notée pour l’objectif primaire de sécurité. Toutefois, une tendance était remarquée pour les saignements dans le groupe rivaroxaban, en comparaison avec le groupe antiplaquettaire (p = 0,08). Dans l’analyse per protocole, la différence entre les groupes pour l’objectif primaire d’efficacité (RR : 1,21; IC 95 % : 0,86–1,70) et la composante de mortalité (RR : 1,23; IC 95 % : 0,71–2,15) était atténuée. Les principaux résultats sont présentés dans le tableau II.
Tableau II Principaux résultats d’efficacité et de sécurité de l’étude (intention de traiter)a
Grille d’évaluation critique

Discussion
GALILEO est une étude répartition aléatoire à devis ouvert comparant le rivaroxaban à une DTAP suivant un TAVI chez des patients sans indication d’anticoagulation. Les auteurs concluent, sous toute réserve en raison de la fin prématurée de l’étude, que le rivaroxaban à dose quotidienne de 10 mg est associé à un risque augmenté de mortalité et de complications thromboemboliques. Ce résultat est cependant influencé par les morts subites et les causes non cardiovasculaires. Les auteurs concluent également à un risque numériquement augmenté, mais non statistiquement significatif, de saignements. L’absence de bénéfices cliniques diminue l’intérêt des résultats de la sous-étude de GALILEO qui démontre que le rivaroxaban est associé à une diminution de l’incidence de l’épaississement des feuillets valvulaires et à un meilleur mouvement des feuillets par imagerie. Ces conditions prédisposent habituellement aux thromboses de valve16.
À la suite d’un TAVI chez une population qui ne requiert pas d’anticoagulation, la DTAP a démontré une réduction des événements cardiovasculaires et cérébrovasculaires17. Au même titre, l’AAS en monothérapie a révélé les mêmes données tout en réduisant davantage les risques de saignements majeurs, sans augmentation des événements cardiovasculaires11,13. Cependant, des données observationnelles démontrent que la DTAP conventionnelle serait insuffisante pour réduire les thromboses de valve après un TAVI18–20. Davantage de thromboses de valve surviendraient en comparaison avec les procédures effectuées par sternotomie, d’où l’intérêt pour les auteurs de tenter d’ajouter un anticoagulant oral19.
Les AOD ont démontré une réduction des événements thromboemboliques pour diverses indications21–31. Toutefois, les données appuyant leur utilisation après un TAVI demeurent limitées14. Seeger et coll. ont comparé l’utilisation de l’apixaban à celle d’un AVK chez les patients en FA à la suite d’un TAVI32. Les résultats ont démontré des bénéfices pour l’événement de sécurité à 30 jours dans le groupe apixaban. Aucune différence n’a été notée pour les AVC à 30 jours et à 12 mois. Le devis observationnel et unicentrique de cette étude limite son application à grande échelle. Des résultats similaires à ceux de GALILEO font état d’une augmentation de la mortalité toutes causes, des infarctus et des AVC avec les AOD, à la suite d’un TAVI33. Les AVK ont, quant à eux, démontré des bénéfices chez les patients avec antécédent de FA et ayant eu un remplacement de valve aortique par sternotomie ou par TAVI34,35. Des données récentes font état d’une réduction des saignements majeurs à un mois et à un an (RR : 0,63; IC 95 % : 0,43–0,90; p = 0,01) pour un régime d’anticoagulant seul, AOD ou VKA, en comparaison avec son association au clopidogrel, chez une population avec une indication d’anticoagulation, à la suite d’un TAVI36. L’analyse secondaire d’efficacité semblait également favoriser la monothérapie. Ces résultats créent une dualité quant à l’efficacité des AOD à la suite d’un TAVI. Actuellement, aucune étude à répartition aléatoire ne soutient le recours à une anticoagulation à la suite d’un TAVI comme unique indication.
Les objectifs de l’étude définis de façon standardisée et jugés par un comité indépendant à l’insu de la répartition aléatoire des patients sont les forces de cette étude. Ces aspects viennent limiter le biais d’un devis ouvert dans lequel les déclarations des patients pourraient être influencées. Cette étude comporte toutefois certaines limites nuançant les résultats. D’abord, il y a eu davantage d’arrêts prématurés dans le groupe rivaroxaban (307 patients) comparativement au groupe antiplaquettaire (194 patients). De plus, l’étude montrait une augmentation numérique des saignements dans le groupe rivaroxaban sans impact majeur sur la mortalité. Cet effet est à prendre avec précaution étant donné la population initiale dont l’état ne nécessitait pas une pharmacothérapie anticoagulante et en raison de l’arrêt prématuré qui a apporté des changements dans l’analyse statistique. Il faut considérer que la population subissant un TAVI est souvent âgée, frêle, et qu’elle présente plusieurs comorbidités. Également, la majorité des décès dans le groupe rivaroxaban est due à des causes inconnues et non cardiovasculaires comme les cancers. La majorité des événements thromboemboliques sont survenus après le traitement. Le mécanisme sous-jacent expliquant la mortalité augmentée dans le groupe rivaroxaban selon les analyses en intention de traiter est ainsi incertain. Cette différence de mortalité est atténuée dans l’analyse per protocole, en respect des limites de cette analyse statistique sur l’effet de la répartition aléatoire.
La cessation prématurée de l’étude pour des raisons de sécurité limite son application clinique et demande des précautions quant à l’analyse de ses IC 95 %. Les valeurs p de l’article n’étaient pas prédéterminées et doivent donc être interprétées avec prudence. L’incidence des événements pendant l’étude a été plus faible qu’anticipée. Les auteurs expliquent cette situation par l’inclusion uniquement des patients ayant subi une intervention sans complications et n’ayant pas d’indication d’anticoagulation.
Les résultats de cette étude s’ajoutent à la documentation déjà présente sur la prévention des événements thromboemboliques à la suite d’un TAVI. Il était novateur d’envisager l’utilisation d’un AOD dans une population chez laquelle une anticoagulation n’était pas indiquée. Davantage de données de sécurité et d’efficacité sont nécessaires afin de rassurer les professionnels de la santé sur leurs utilisations. Des études sont en cours afin de répondre aux questions résiduelles occasionnées par GALILEO37–40.
Conclusion
Les résultats de l’étude ne soutiennent pas l’ajout du rivaroxaban à une dose de 10 mg à la suite d’un TAVI chez une population ne nécessitant pas une pharmacothérapie anticoagulante. Une augmentation de l’incidence de l’objectif composé de la mortalité toutes causes et des événements thromboemboliques a été observée. Les résultats suggèrent aussi une augmentation du risque de saignements. À l’exception des patients présentant une thrombose de valve à la suite d’une implantation réussie, le recours à un traitement anticoagulant de première intention reste encore à être défini.
Financement
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Conflits d’intérêts
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Julie Méthot est rédactrice adjointe de Pharmactuel. Les auteurs n’ont déclaré aucun autre conflit d’intérêts en relation avec le présent article.
Références
1. Dangas GD, Tijssen JGP, Wöhrle J, Sondergaard L, Gilard M, Möllmann H et al. A controlled trial of rivaroxaban after transcatheter aortic-valve replacement. N Engl J Med 2020; 382:120–9.

2. Pilgrim T, Windecker S. Expansion of transcatheter aortic valve implantation: new indications and socio-economic considerations. Eur Heart J 2018;39:2643–5.


3. Marquis-Gravel G, Redfors B, Leon MB, Généreux P. Medical treatment of aortic stenosis. Circulation 2016;134:1766–84.


4. Durko AP, Osnabrugge RL, Van Mieghem NM, Milojevic M, Mylotte D, Nkomo VT et al. Annual number of candidates for transcatheter aortic valve implantation per country: current estimates and future projections. Eur Heart J 2018;39:2635–42.


5. Asgar AW, Ouzounian M, Adams C, Afilalo J, Fremes S, Lauck S et al. 2019 Canadian Cardiovascular Society position statement for transcatheter aortic valve implantation. Can J Cardiol 2019;35:1437–48.


6. Hansson NC, Grove EL, Andersen HR, Leipsic J, Mathiassen ON, Jensen JM et al. Transcatheter aortic valve thrombosis: incidence, predisposing factors, and clinical implications. J Am Coll Cardiol 2016;68:2059–69.


7. Nombela-Franco L, Webb JG, de Jaegere PP, Toggweiler S, Nuis RJ, Dager AE et al. Timing, predictive factors, and prognostic value of cerebrovascular events in a large cohort of patients undergoing transcatheter aortic valve implantation. Circulation 2012;126:3041–53.


8. Nishimura RA, Otto CM, Bonow RO, Carabello BA, Erwin JP, Fleisher LA et al. 2017 AHA/ACC Focused update of the 2014 AHA/ACC Guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association task force on clinical practice guidelines. Circulation 2017;135:e1159–95.


9. Baumgartner H, Falk V, Bax JJ, De Bonis M, Hamm C, Holm PJ et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017;38:2739–91.


10. Webb J, Rodés-Cabau J, Fremes S, Pibarot P, Ruel M, Ibrahim R et al. Transcatheter aortic valve implantation: a Canadian Cardiovascular Society position statement. Can J Cardiol 2012;28:520–8.


11. Rodés-Cabau J, Masson JB, Welsh RC, Bel Blanco BG, Pelletier M, Webb JG et al. Aspirin versus aspirin plus clopidogrel as antithrombotic treatment following transcatheter aortic valve replacement with a balloon-expandable valve: The ARTE (Aspirin versus aspirin + clopidogrel following transcatheter aortic valve implantation) randomized clinical trial. JACC Cardiovasc Interv 2017;10:1357–65.

12. Raheja H, Garg A, Goel S, Banerjee K, Hollander G, Shani J et al. Comparison of single versus dual antiplatelet therapy after TAVR: A systematic review and meta-analysis. Catheter Cardiovasc Interv 2018;92:783–91.


13. Brouwer J, Nijenhuis VJ, Delewi R, Hermanides RS, Holvoet W, Dubois C et al. Aspirin with or without clopidogrel after transcatheter aortic-valve implantation. N Engl J Med 2020;383: 1447–57.


14. Guedeney P, Mehran R, Collet JP, Claessen BE, Ten Berg J, Dangas GD. Antithrombotic therapy after transcatheter aortic valve replacement. Circ Cardiovasc Interv 2019; 12:e007411.


15. Kappetein AP, Head SJ, Genereux P, Piazza N, van Mieghem NM, Blackstone EH et al. Updated standardized endpoint definitions for transcatheter aortic valve implantation : the Valve Academic Research Consortium-2 consensus document. J Am Coll Cardiol 2012; 60:1438–54.


16. De Backer O, Dangas GD, Jilaihawi H, Leipsic JA, Terkelsen CJ, Makkar R et al. Reduced leaflet motion after transcatheter aortic-valve replacement. N Engl J Med 2020;382:130–9.

17. Saito Y, Nazif T, Baumbach A, Tchétché D, Latib A, Kaple R et al. Adjunctive antithrombotic therapy for patients with aortic stenosis undergoing transcatheter aortic valve replacement. JAMA Cardiol 2020;5:92–101.

18. Chakravarty T, Sondergaard L, Friedman J, De Backer O, Berman D, Kofoed KF et al. Subclinical leaflet thrombosis in surgical and transcatheter bioprosthetic aortic valves: an observational study. Lancet 2017;389:2383–92.


19. Makkar RR, Fontana G, Jilaihawi H, Chakravarty T, Kofoed KF, De Backer O et al. Possible subclinical leaflet thrombosis in bioprosthetic aortic valves. N Engl J Med 2015;373:2015–24.


20. Chakravarty T, Patel A, Kapadia S, Raschpichler M, Smalling RW, Szeto WY et al. Anticoagulation after surgical or transcatheter bioprosthetic aortic valve replacement. J Am Coll Cardiol 2019;74:1190–200.


21. Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009;361:1139–51.


22. Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011;365:883–91.


23. Granger CB, Alexander JH, McMurray JJ, Lopes RD, Hylek Em, Hanna M et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011;365:981–92.


24. Schulman S, Kearon C, Kakkar AK, Mismetti P, Schellong S, Eriksson H et al. Dabigatran versus warfarin in the treatment of acute venous thromboembolism. N Engl J Med 2009;361:2342–52.


25. Büller HR, Prins MH, Lensin AWA, Cecousus H, Jacobson BF et al. Oral rivaroxaban for the treatment of symptomatic pulmonary embolism. N Engl J Med 2012;366:1287–97.


26. Agnelli G, Buller HR, Cohen A, Curto M, Gallus AS, Johnson M et al. Oral apixaban for the treatment of acute venous thromboembolism. N Engl J Med 2013;369:799–808.


27. Büller HR, Décousus H, Grosso MA, Mercuri M, Middelpdorp S, Prins MH et al. Edoxaban versus warfarin for the treatment of symptomatic venous thromboembolism. N Engl J Med 2013;369:1406–15.


28. Bauersachs R, Berkowitz SD, Brenner B, Buller HR, Décousus H, Gallus AS et al. Oral rivaroxaban for symptomatic venous thromboembolism. N Engl J Med 2010;363: 2499–510.


29. Raskob GE, van Es N, Verhamme P, Carrier M, Di Nisio M, Garcia D et al. Edoxaban for the treatment of cancer-associated venous thromboembolism. N Engl J Med 2018;378: 615–24.

30. Khorana AA, Soff GA, Kakkar AK, Vadhan-Raj S, Riess H, Wun T et al. Rivaroxaban for thromboprophylaxis in high-risk ambulatory patients with cancer. N Engl J Med 2019;380: 720–8.


31. Agnelli G, Becattini C, Meyer G, Munoz A, Huisman MV, Connors JM et al. Apixaban for the treatment of venous thromboembolism associated with cancer. N Engl J Med 2020;382:1599–607.


32. Seeger J, Gonska B, Rodewald C, Rottbauer W, Wöhrle J. Apixaban in patients with atrial fibrillation after transfemoral aortic valve replacement. JACC Cardiovasc Interv 2017;10:66–74.

33. Jochheim D, Barbanti M, Capretti G, Stefanini GG, Hapfelmeier A, Zadrozny M et al. Oral anticoagulant type and outcomes after transcatheter aortic valve replacement. JACC Cardiovasc Interv 2019;12:1566–76.


34. Abdul-Jawad Altisent O, Durand E, Muñoz-García AJ, Nombela-Franco L, Cheema A, Kefer J et al. Warfarin and antiplatelet therapy versus warfarin alone for treating patients with atrial fibrillation undergoing transcatheter aortic valve replacement. JACC Cardiovasc Interv 2016;9:1706–17.


35. Mérie C, Køber L, Skov Olsen P, Andersson C, Gislason G, Jensen JS et al. Association of warfarin therapy duration after bioprosthetic aortic valve replacement with risk of mortality, thromboembolic complications, and bleeding. JAMA 2012;308:2118–25.


36. Nijenhuis VJ, Brouwer J, Delewi R, Hermanides RS, Holvoet W, Dubois CLF et al. Anticoagulation with or without clopidogrel after transcatheter aortic-valve implantation. N Engl J Med 2020;382:1696–707.


37. Collet JP, Berti S, Cequier A, Van Belle E, Lefevre T, Leprince P et al. Oral anti-Xa anticoagulation after trans-aortic valve implantation for aortic stenosis: The randomized ATLANTIS trial. Am Heart J 2018;200:44–50.


38. Van Mieghem NM, Unverdorben M, Valgimigli M, Mehran R, Boersma E, Baber U et al. Edoxaban versus standard of care and their effects on clinical outcomes in patients having undergone transcatheter aortic valve implantation in atrial fibrillation-rationale and design of the ENVISAGE-TAVI AF trial. Am Heart J 2018;205:63–9.


39. U.S. National Library of Medicine. ClinicalTrials.gov. Anticoagulation alone versus anticoagulation and aspirin following transcatheter aortic valve interventions (1:1) (AVATAR). [en ligne] https://clinicaltrials.gov/ct2/show/NC02735902 (site visité le 16 mai 2020).
40. U.S. National Library of Medicine. ClinicalTrials.gov. Dual antiplatelet therapy versus oral anticoagulation for a short time to prevent cerebral embolism after TAVI (AUREA). [en ligne] https://clinicaltrials.gov/ct2/show/NCT01642134 (site visité le 16 mai 2020).
Pour toute correspondance: Alexandre Sanctuaire, Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval, 2725, chemin Sainte-Foy, Québec (Québec), G1V 4G5, CANADA; Téléphone : 418 656-8711; Courriel : alexandre.sanctuaire.iucpq@ssss.gouv.qc.ca
*Rosalie Darveau, Maryse Fortin, Alexandre Sanctuaire et Camille Thibault ont contribué de façon équivalente à la rédaction de cet article (
Return to Text
)
(Return to Top)
PHARMACTUEL, Vol. 54, No. 2, 2021