Étude PIONEER 6 : La sécurité cardiovasculaire du sémaglutide oral chez les diabétiques de type 2
Catherine
Poitras
,
Pharm.D., M.Sc.
1,2,3,
Mélanie
Lachapelle
,
Pharm.D., M.Sc.
1,2,4,
Stéphanie
Roy
,
Pharm.D., M.Sc.
1,5,6,
Olivier
Eap
,
B.Pharm., M.Sc.
1,5,7,
Johanne
Paradis
,
B.Pharm., M.Sc.
8
1
Candidat à la maîtrise en pharmacothérapie avancée au moment de la rédaction, Faculté de Pharmacie, Université Laval, Québec (Québec) Canada
;
2
Résidente en pharmacie au moment de la rédaction, Centre intégré de santé et de services sociaux du Bas-Saint-Laurent, Hôpital régional de Rimouski, Rimouski (Québec) Canada
;
3
Pharmacienne, Centre intégré de santé et de services sociaux du Bas-Saint-Laurent, Hôpital régional de Rimouski, Rimouski (Québec) Canada
;
4
Pharmacienne, Centre intégré de santé et de services sociaux de l’Abitibi-Témiscamingue, Hôtel-Dieu d’Amos, Amos (Québec) Canada
;
5
Résident en pharmacie au moment de la rédaction, Centre intégré de santé et de services sociaux de l’Outaouais, Hôpital de Hull, Gatineau (Québec) Canada
;
6
Pharmacienne, Centre intégré universitaire de santé et de services sociaux de l’Estrie–Centre hospitalier universitaire de Sherbrooke, Hôpital Brome-Missisquoi-Perkins, Cowansville (Québec) Canada
;
7
Pharmacien, Centre intégré universitaire de santé et de services sociaux de la Mauricie–et–du-Centre-du-Québec, Centre hospitalier affilié universitaire régional, Trois-Rivières (Québec) Canada
;
8
Pharmacienne, Centre intégré de santé et de services sociaux de l’Outaouais, Hôpital de Hull, Gatineau (Québec) Canada
Reçu le 29 septembre 2020: Accepté après révision par les pairs le 22 avril 2021
Titre de l’article: Oral semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2019;381:841-511.
Auteurs : Husain M, Birkenfeld AL, Donsmark M, Dungan K, Eliaschewitz FG, Franco DR et coll. pour le groupe d’étude PIONEER 6.
Commanditaires:
La présente étude est financée et conçue par Novo Nordisk. La compagnie est responsable du déroulement, de la collecte des données et des analyses statistiques.
Cadre de l’étude
: Les maladies cardiovasculaires sont la première cause de mortalité chez les patients atteints de diabète de type 22. Depuis 2008, à la suite de la découverte d’une association entre la rosiglitazone et une augmentation des évènements cardiovasculaires, la Food and Drug Administration exige que l’innocuité cardiovasculaire des antihyperglycémiants soit démontrée avant leur approbation3–5. Les agonistes des récepteurs du glucagon-like peptide-1 (aGLP1) représentent une classe pharmacologique d’antihyperglycémiants couramment utilisés pour le diabète de type 2, notamment en raison de leurs bénéfices quant à la perte de poids et de leur faible risque d’hypoglycémie. Les lignes directrices canadiennes du diabète positionnent, entre autres, cette classe d’antihyperglycémiants en deuxième ligne de traitement dans le diabète de type 2, en ajout à la metformine lorsque la cible d’hémoglobine glyquée (HbA1c) n’est pas atteinte6. Parmi les aGLP1, le lixisénatide et l’exénatide ont démontré une sécurité cardiovasculaire, alors que le liraglutide, le sémaglutide par voie sous-cutanée et le dulaglutide ont démontré des bénéfices cardiovasculaires7–11. Les investigateurs de l’étude PIONEER 6 évaluent l’innocuité cardiovasculaire du sémaglutide administré par voie orale chez les patients atteints de diabète de type 2, soit le premier agent des aGLP1 conçu pour une absorption gastro-intestinale.
Protocole de recherche:
: L’étude PIONEER 6 est un essai à répartition aléatoire, multicentrique, en double aveugle, mené dans 214 sites répartis dans 21 pays. L’objectif général de l’étude est de démontrer la non-infériorité du sémaglutide par voie orale comparativement au placebo chez les patients diabétiques de type 2 à haut risque d’évènements cardiovasculaires. L’étude vise à exclure une augmentation de plus de 80 % du risque d’événements cardiovasculaires par l’obtention d’un rapport de risque dont la limite supérieure de l’intervalle de confiance à 95 % ne dépasse pas 1,8. Un test de supériorité quant à l’objectif primaire a été prévu advenant la démonstration de la non-infériorité. La durée de l’étude était prévue jusqu’à l’atteinte minimale de 122 événements.
Patients
: Les patients admissibles devaient être atteints de diabète de type 2 et considérés comme à haut risque cardiovasculaire, soit des personnes âgées d’au moins 50 ans avec antécédent de maladie cardiovasculaire ou de maladie rénale chronique, ou d’au moins 60 ans avec minimalement un facteur de risque cardiovasculaire.
Les patients étaient exclus s’ils avaient reçu un traitement par un aGLP1 ou un inhibiteur de la dipeptidyl peptidase-4 dans les 90 jours précédents. Si un événement cardiaque avait eu lieu dans les 60 jours précédents, soit un infarctus du myocarde (IM), un accident vasculaire cérébral (AVC), une hospitalisation pour de l’angine instable ou un accident ischémique transitoire, ou si une revascularisation était déjà prévue lors de la sélection des participants, les patients étaient également exclus. Un antécédent d’intervention chirurgicale majeure impliquant l’estomac et pouvant affecter l’absorption du médicament était aussi un critère d’exclusion. Enfin, faisaient partie des patients exclus ceux qui souffraient d’insuffisance cardiaque de classe fonctionnelle IV de la New York Heart Association et les insuffisants rénaux ayant un débit de filtration glomérulaire inférieur à 30 mL/min/1,73 m2.
Interventions
: Les sujets à l’étude ont été assignés, en complément des traitements standards, à une dose croissante de sémaglutide oral une fois par jour ou à un placebo selon un ratio 1:1. La répartition aléatoire a été stratifiée selon les antécédents de maladie cardiovasculaire ou d’insuffisance rénale chronique et la présence unique de facteurs de risque cardiovasculaires. Le traitement a été instauré à la dose de 3 mg puis majoré à intervalles de quatre semaines jusqu’à la dose cible de 14 mg par jour. Il était possible de diminuer les doses en cours d’étude si des effets indésirables se présentaient chez les patients, mais les investigateurs étaient encouragés à optimiser la dose aussitôt les effets indésirables résolus. Les patients ont été suivis toutes les six à sept semaines en présentiel ou par téléphone.
Points évalués
: L’objectif primaire de l’étude est le temps écoulé entre la répartition aléatoire et la survenue d’un événement cardiovasculaire majeur comprenant la mort d’origine cardiovasculaire, un IM non fatal ou un AVC non fatal. Les objectifs secondaires principaux de l’étude sont les suivants : le temps écoulé avant la survenue d’un événement cardiovasculaire majeur et d’une angine instable ou d’une insuffisance cardiaque menant à une hospitalisation; une mesure composite de mortalité toutes causes, d’IM non fatal et d’AVC non fatal; et les événements individuels de ces résultats composites. Des objectifs supplémentaires d’efficacité concernant les variations de l’HbA1c, du poids et des taux de lipides ont aussi été étudiés.
Résultats
: Parmi les 3183 patients recrutés de janvier à août 2017, 1591 ont été assignés au groupe recevant le sémaglutide par voie orale, comparativement à 1592 pour le groupe placebo. Les caractéristiques de base des patients étaient similaires entre les deux groupes et sont présentées au tableau I. Au total, 82 % des patients ont obtenu une dose quotidienne de 14 mg de sémaglutide. Le temps médian d’un patient dans l’étude était de 15,9 mois. Environ 75 % des patients à l’étude ont reçu le traitement par sémaglutide ou placebo pendant plus d’un an.
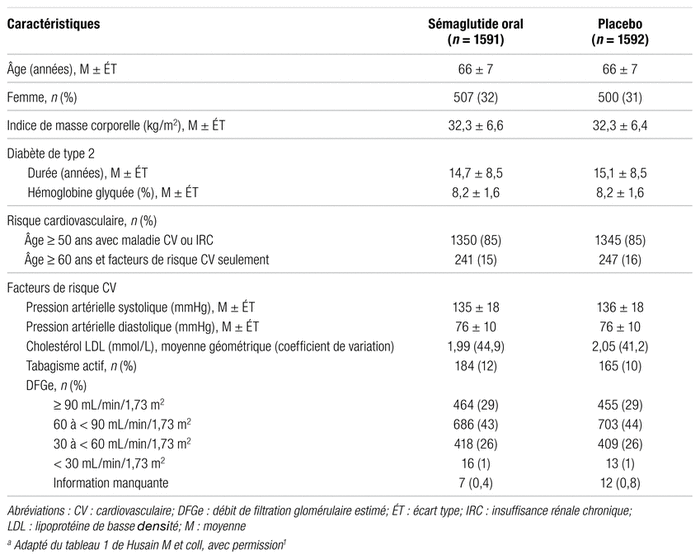
Tableau I
Caractéristiques cliniques et démographiques de base des patients à l’étudea
Le tableau II présente les principaux résultats de l’étude. L’objectif primaire, soit la survenue d’un événement cardiovasculaire majeur, est rapporté chez 61 des 1591 patients (3,8 %) recevant le sémaglutide et 76 des 1592 patients (4,8 %) sous placebo (rapport de risques [RR] : 0,79; intervalle de confiance à 95 % [IC 95 %] : 0,57–1,11,
p
< 0,001 pour la non-infériorité). Cependant, le sémaglutide n’a pas démontré une supériorité statistique par rapport au placebo (
p
= 0,17).
Tableau II
Résultats des objectifs de sécurité cardiovasculairea
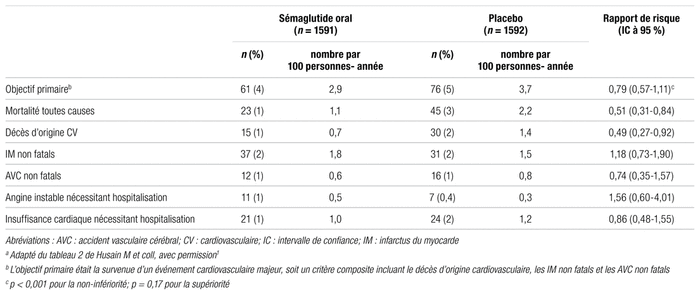
Les autres objectifs de l’étude n’ont pas été analysés de façon à déterminer la non-infériorité et la supériorité par des comparaisons entre les groupes. Les analyses n’ont pas été ajustées pour les comparaisons multiples et devraient être considérées comme exploratoires. Parmi les composantes individuelles des événements cardiovasculaires majeurs, le décès d’origine cardiovasculaire est survenu chez 15 des 1591 patients (0,9 %) du groupe sémaglutide et chez 30 des 1592 patients (1,9 %) sous placebo (RR : 0,49; IC 95 % : 0,27–0,92). Du côté des IM non fatals, 37 patients (2,3 %) du groupe sémaglutide en ont souffert comparativement à 31 (1,9 %) dans le groupe sous placebo (RR : 1,18; IC 95 % : 0,73–1,90). En ce qui concerne les AVC non fatals, 12 patients (0,8 %) du groupe sémaglutide ont été affectés comparativement à 16 (1,0 %) dans le groupe sous placebo (RR : 0,74; IC 95 % : 0,35–1,57).
Parmi les paramètres d’efficacité du traitement, les patients du groupe sémaglutide ont eu une perte de poids moyenne plus importante que les patients du groupe placebo (−4,2 kg
vs
−0,8 kg). L’HbA1c des patients sous sémaglutide a diminué de façon plus importante par rapport aux patients sous placebo (−1,0 %
vs
−0,3 %).
Le tableau III présente les résultats liés à la tolérance aux traitements. Parmi les 1591 patients du groupe sémaglutide, 301 (18,9 %) ont présenté des effets indésirables graves, tandis que ce nombre s’élève à 358 chez les 1592 patients (22,5 %) du groupe placebo. Pour les effets indésirables ayant mené à l’arrêt du traitement, plus de cas se retrouvent dans le groupe sémaglutide (184 patients sur 1591 [11,6 %]) comparativement au groupe placebo (104 patients sur 1592 [6,5 %]). Cette différence est surtout liée à des troubles gastro-intestinaux, dont principalement des nausées, des vomissements et de la diarrhée. Plus d’hypoglycémies graves sont rapportées dans le groupe sémaglutide (23 patients sur 1 591 [1,4 %]) comparativement au groupe placebo (13 patients sur 1592 [0,8 %]). Il est à noter que tous les patients ayant présenté une hypoglycémie grave recevaient de l’insuline ou une sulfonylurée de façon concomitante.
Tableau III
Événements indésirables survenus pendant l’étudea

Grille d’évaluation critique

Discussion
Les résultats de l’étude PIONEER 6 démontrent que l’innocuité cardiovasculaire du sémaglutide par voie orale est non inférieure à celle du placebo chez les patients diabétiques de type 2 âgés d’au moins 50 ans avec antécédent de maladie cardiovasculaire ou de maladie rénale chronique et chez les patients d’au moins 60 ans avec minimalement un facteur de risque cardiovasculaire. Une baisse marquée de l’HbA1c est notée dans le groupe sémaglutide malgré l’ajout plus fréquent d’antihyperglycémiants dans le groupe placebo.
Les principales forces de cette étude résident dans sa méthodologie. En effet, PIONEER 6 est un essai multicentrique international, à répartition aléatoire, mené en double aveugle auprès de 3183 patients et contrôlé par placebo. La taille de l’échantillon était prévue pour mesurer la survenue de 122 évènements, ce qui était requis pour exclure une augmentation de plus de 80 % du risque d’événements cardiovasculaires avec une puissance de 90 %. La fréquence des évènements, estimée à trois pour 100 personnes-année, est basée sur les résultats d’études similaires impliquant des médicaments de la même classe thérapeutique, dont l’étude SUSTAIN 6 qui comportait 3297 patients10. La taille de l’échantillon était adéquate pour démontrer la non-infériorité du sémaglutide par voie orale. La répartition aléatoire des patients, selon un ratio 1:1, limite l’introduction de biais de confusion. Le faible nombre de patients perdus de vue pendant l’étude indique que les chercheurs ont assuré un suivi étroit, limitant ainsi un biais potentiel. Par ailleurs, la validité externe permet une application des résultats à une large population de patients diabétiques de type 2 à haut risque cardiovasculaire. En effet, l’étude comporte peu de critères d’exclusion et ces derniers sont définis explicitement dans l’annexe du protocole de recherche.
L’étude présente certaines limites. Certains facteurs confondants n’ont pas été analysés en profondeur même s’ils ont été brièvement énoncés dans la discussion. En effet, l’ajustement de la médication concomitante était laissé à la discrétion du clinicien, ce qui risquait d’introduire un biais de confusion, car certains antihyperglycémiants et médicaments cardiovasculaires ont démontré des bénéfices cardiovasculaires. Par exemple, l’ajout d’iSGLT2 était plus importante dans le groupe placebo (7 %
vs
3,1 %) ce qui aurait pu favoriser les patients de ce groupe et contribuer à minimiser les effets bénéfiques du sémaglutide oral12. Nous n’avons également aucune donnée sur l’observance au traitement, même si cela semblait prévu dans le protocole. La façon de prendre ce médicament étant contraignante pour les patients, cela aurait été intéressant d’avoir des résultats en ce sens.
Contrairement à l’étude SUSTAIN 6, conçue pour évaluer la sécurité cardiovasculaire du sémaglutide par voie sous-cutanée, le sémaglutide oral n’a pas démontré de supériorité dans la prévention des événements cardiovasculaires par rapport au placebo10. Les groupes de patients dans les deux études étaient similaires en termes de nombre de participants, d’âge moyen et de facteurs de risque cardiovasculaires. Cependant, la durée médiane de SUSTAIN 6 était de 2,1 ans, alors qu’elle était de 1,3 an pour PIONEER 6. L’HbA1c moyenne au début de l’étude était légèrement plus élevée dans l’étude SUSTAIN 6 (8,7 %
vs
8,2 %)10. Davantage d’événements cardiovasculaires sont survenus dans l’étude SUSTAIN 6 (254 sur 3297) par rapport à l’étude PIONEER 6 (137 sur 3183). Ces facteurs pourraient expliquer qu’une supériorité a pu être démontrée pour le sémaglutide injectable, contrairement au placebo. La réduction du risque était comparable dans les deux études, soit 26 % dans l’étude SUSTAIN 6 et 21 % dans l’étude PIONEER 6, bien que la réduction n’ait pas été statistiquement significative pour le sémaglutide oral. Par ailleurs, selon une méta-analyse de 2019, il est démontré que les différentes voies d’administration du sémaglutide ont permis d’obtenir des effets similaires quant à la perte de poids moyenne et à la diminution de l’HbA1c13.
Les résultats de l’étude sont particulièrement intéressants compte tenu de l’autorisation de mise en marché du sémaglutide par voie orale (RybelsusMD) par Santé Canada le 30 mars 202014. En juin 2020, l’Institut national d’excellence en santé et services sociaux a recommandé au ministre d’ajouter le sémaglutide par voie orale à la liste des médicaments de la Régie de l’assurance maladie du Québec avec le statut de médicament d’exception. Toutefois, en date d’août 2021, l’approbation pour le sémaglutide oral n’avait toujours pas été obtenue, ce qui constitue actuellement un plus grand fardeau économique pour le patient15. D’autant plus que le liraglutide, le sémaglutide injectable, l’empagliflozine et la canagliflozine ont démontré une supériorité quant aux bénéfices cardiovasculaires lorsque comparés au placebo9,10,16,17. Les prescripteurs pourront donc demeurer plus réticents à prescrire cette option alternative par voie orale tant qu’il n’y aura pas de nouvelles données sur les bénéfices cardiovasculaires. Un autre aspect à considérer concerne le schéma posologique qui peut s’avérer difficile à respecter pour les patients, soit à jeun, 30 minutes avant la prise de nourriture, d’un breuvage ou d’un autre médicament, avec 120 mL d’eau.
Conclusion
L’étude PIONEER 6 a démontré la non-infériorité du sémaglutide oral par rapport au placebo pour la prévention des évènements cardiovasculaires chez les patients atteints de diabète de type 2 à haut risque cardiovasculaire. Lorsque comparé au placebo, le sémaglutide par voie orale occasionne davantage d’effets indésirables gastro-intestinaux. Des données supplémentaires sont attendues afin d’évaluer si le sémaglutide oral a un effet protecteur sur le plan cardiovasculaire et, ainsi, de situer la molécule par rapport aux autres antihyperglycémiants utilisés dans le traitement du diabète de type 2.
Remerciements
Cet article a été réalisé dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université Laval. Les auteurs en remercient la responsable, Julie Méthot. Cette personne a donné son autorisation écrite.
Financement
Aucun financement en lien avec le présent article n’a été déclaré par les auteurs.
Conflits d’intérêts
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Références
1. Husain M, Birkenfeld AL, Donsmark M, Dungan K, Eliaschewitz FG, Franco DR et al. Oral semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2019;381:841–51.

2. American Diabetes Association. 10. Cardiovascular disease and risk management: Standards of medical care in diabetes-2019. Diabetes Care 2019;42(suppl. 1):103–23.

3. Home PD, Pocock SJ, Beck-Nielsen H, Curtis PS, Gomis R, Hanefeld M et al. Rosiglitazone evaluated for cardiovascular outcomes in oral agent combination therapy for type 2 diabetes (RECORD): A multicentre, randomised, open-label trial. Lancet 2009;373:2125–35.

4. Nissen SE, Wolski K. Rosiglitazone revisited: An updated meta-analysis of risk for myocardial infarction and cardiovascular mortality. Arch Intern Med 2010;170:1191–201.

5. U.S. Food and Drug Administration guidance for industry. Diabetes mellitus evaluating cardiovascular risk in new antidiabetic therapies to treat type 2 diabetes. 2008. [en ligne] https://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/ucm071627 (site visité le 20 mai 2020).
6. Diabetes Canada clinical practice guidelines expert committee. Pharmacologic glycemic management of type 2 diabetes in adults: 2020 update. Can J Diabetes 2020;44:575–91.

7. Pfeffer MA, Claggett B, Diaz R, Dickstein K, Gerstein HC, Kober LV et al. Lixisenatide in patients with type 2 diabetes and acute coronary syndrome. N Engl J Med 2015;373:2247–57.

8. Holman RR, Bethel MA, Mentz RJ, Thompson VP, Lokhnygina Y, Buse JB et al. Effects of once-weekly exenatide on cardiovascular outcomes in type 2 diabetes. N Engl J Med 2017; 377:1228–39.

9. Marso SP, Daniels GH, Brown-Frandsen K, Kristensen P, Mann JF, Nauck MA et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2016;375:311–22.


10. Marso SP, Bain SC, Consoli A, Eliaschewitz FG, Jodar E, Leiter LA et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2016;375:1834–44.

11. Gerstein HC, Colhoun HM, Dagenais GR, Diaz R, Lakshmanan M, Pais P et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): A double-blind, randomised placebo-controlled trial. Lancet 2019;394:121–30.

12. Wu L, Gunton JE. The changing landscape of pharmacotherapy for diabetes mellitus: A review of cardiovascular outcomes. Int J Mol Sci 2019;20;5853–70.


13. Nuhoho S, Gupta J, Hansen BB, Fletcher-Louis M, Dang-Tan T, Paine A. Orally administered semaglutide versus GLP-1 RAs in patients with type 2 diabetes previously receiving 1–2 oral antidiabetics: systematic review and network meta-analysis. Diabetes Ther 2019;10:2183–99.


14. Novo Nordisk Canada Inc. Monographie de produit : Rybelsus. [en ligne] https://www.novonordisk.ca/content/dam/Canada/AFFILIATE/www-novonordisk-ca/OurProducts/PDF/Rybelsus-PM-EN-monograph.pdf (site visité le 8 juillet 2020).
15. Liste des médicaments, 18 août 2021. Régie de l’assurance maladie du Québec. [en ligne] https://www.ramq.gouv.qc.ca/sites/default/files/documents/liste-med-2021-08-18-fr.pdf (site visité le 9 septembre 2021).
16. Zinman B, Wanner C, M. Lachin J, Fitchett D, Bluhmki E, Hantel S et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015;373:2117–28.

17. Neal B, Perkovic V, Mahaffey KW, de Zeeuw D, Fulcher G, Erondu N et al. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med 2017;377:644–57.

Pour toute correspondance: Catherine Poitras, Centre intégré de santé et de services sociaux, Hôpital régional de Rimouski, 150, avenue Rouleau, Rimouski (Québec), G5L 5T1, CANADA; Téléphone : 418 724–3000 poste 8451; Courriel :
catherine.poitras.cisssbsl@ssss.gouv.qc.ca
(Return to Top)
PHARMACTUEL, Vol. 54, No. 4, 2021