Étude AFIRE : Le rivaroxaban en monothérapie est-il aussi efficace et sécuritaire qu’en association avec un antiplaquettaire chez les patients présentant une maladie coronarienne stable nécessitant une anticoagulation pour de la fibrillation auriculaire?
Marc-Antoine
Bérubé
,
Pharm.D., M.Sc.
1,2,3,
Antoine
Larochelle
,
Pharm.D., M.Sc.
1,2,4,
Marie-Ève
Lebreux
,
Pharm.D., M.Sc.
1,2,3,
Alexandra
Parent
,
Pharm.D., M.Sc.
1,2,3,
Maude
Blanchet
,
B.Pharm., M.Sc.
3
1
Candidat à la maîtrise en pharmacothérapie avancée au moment de la rédaction, Faculté de pharmacie, Université Laval, Québec (Québec) Canada
;
2
Résident en pharmacie au moment de la rédaction, Centre hospitalier universitaire de Québec – Université Laval, Hôpital de l’Enfant-Jésus, Québec (Québec) Canada
;
3
Pharmacien, Centre hospitalier universitaire de Québec – Université Laval, Hôpital de l’Enfant-Jésus, Québec (Québec) Canada
;
4
Pharmacien, Centre intégré de santé et des services sociaux de l’Abitibi-Témiscamingue, Hôpital Hôtel-Dieu d’Amos, Amos (Québec) Canada
Reçu le 24 octobre 2020: Accepté après révision par les pairs le 27 avril 2021
Titre de l’article: Antithrombotic therapy for atrial fibrillation with stable coronary disease. N Engl J Med 2019;381:1103-131.
Auteurs : Yasuda S, Kaikita K, Akao M, Ako J, Matoba T, Nakamura M et coll.
Commanditaires:
Étude financée par la Japan Cardiovascular Research Foundation et commanditée par Bayer Yakuhin, filière asiatique de la compagnie Bayer commercialisant le rivaroxaban au Japon. Cette dernière n’a pas participé à la conception de l’étude, à la collecte de données et à leur analyse.
Cadre de l’étude
: Environ 25 % des patients souffrant de fibrillation auriculaire (FA) présentent une maladie coronarienne athérosclérotique (MCAS), tandis que 10 % des patients avec FA ont eu une intervention coronarienne percutanée (ICP) avec installation d’au moins un tuteur par le passé2. Le rôle de la double thérapie antiplaquettaire instaurée immédiatement après une ICP pour prévenir les évènements cardiovasculaires majeurs (thrombose de tuteur, infarctus du myocarde, accident vasculaire cérébral [AVC] ou décès) est bien connu3–5. Bien que l’anticoagulation à long terme avec un anticoagulant oral (ACO) prévienne les AVC chez les patients avec FA, l’emploi concomitant d’un ACO et d’une double thérapie antiplaquettaire chez les patients ayant subi une ICP accroît considérablement le risque de saignement6.
La gestion de la triple thérapie, comprenant un ACO, de l’acide acétylsalicylique (AAS) et un inhibiteur du P2Y12, chez les patients avec FA ayant subi une ICP récente a fait l’objet de nombreuses publications dans les dernières années7–12. Alors que la triple thérapie était autrefois indiquée jusqu’à une période maximale de 12 mois après l’ICP, la durée recommandée s’est vue réduite dans les dernières années3,5,13. Les plus récentes lignes directrices canadiennes sur la FA recommandent l’utilisation de la triple thérapie pour une durée d’un jour à un mois chez les patients à haut risque d’évènements ischémiques ayant subi une ICP14. Or, bien que l’utilisation d’un ACO en monothérapie un an après l’ICP soit recommandée par les lignes directrices de 2018, cette conduite reposait principalement sur l’augmentation du risque de saignement avec les thérapies combinées, sans réellement pouvoir s’appuyer sur des études démontrant la non-infériorité de la monothérapie en prévention des évènements cardiovasculaires6. Avant la publication de l’étude AFIRE, seule l’étude OAC-ALONE avait comparé, de manière prospective, l’efficacité et la sécurité d’une monothérapie par un ACO avec celles de l’association antiplaquettaire et ACO chez une population avec FA et MCAS stable plus d’un an après une ICP15. Cependant, cette étude n’avait pas la puissance nécessaire pour émettre des conclusions applicables en clinique.
Protocole de recherche
: L’étude AFIRE est un essai clinique ouvert prospectif multicentrique à répartition aléatoire. Les participants ont été recrutés à partir de 294 centres hospitaliers au Japon. L’objectif des investigateurs était d’évaluer l’efficacité et la sécurité du rivaroxaban en monothérapie en comparaison avec une thérapie combinant le rivaroxaban et un antiplaquettaire chez des patients souffrant de FA non valvulaire présentant une MCAS stable. L’analyse de l’objectif primaire d’efficacité était d’abord une analyse de non-infériorité. Une analyse de supériorité pour l’objectif primaire de sécurité était prévue si la non-infériorité était atteinte.
Patients
: Les patients inclus dans l’étude devaient être âgés d’au moins 20 ans, souffrir de FA non valvulaire de score CHADS
2
supérieur ou égal à 1, et présenter une MCAS stable, définie par la présence d’au moins un des critères suivants : ICP effectuée minimalement 12 mois avant le recrutement (incluant les angioplasties sans implantation de tuteur), pontage aorto-coronarien réalisé au minimum 12 mois auparavant ou présence d’une sténose de 50 % ou plus sur au moins une artère coronarienne, confirmée par angiographie, n’ayant pas nécessité de revascularisation.
Les patients présentant une contre-indication à l’un des médicaments à l’étude étaient exclus. Un antécédent de thrombose de tuteur, une procédure de revascularisation coronarienne ou une chirurgie invasive prévue, une tumeur active ou une hypertension artérielle non contrôlée (supérieure ou égale à 160 mmHg de pression systolique) au moment de la répartition aléatoire étaient également des facteurs d’exclusion. Enfin, les patients étaient exclus si le clinicien jugeait qu’ils ne pouvaient pas interrompre une thérapie antiplaquettaire vu les caractéristiques des lésions coronariennes, ou que leur recrutement était inapproprié.
Interventions
: Les patients étaient répartis aléatoirement selon un ratio 1:1 dans le groupe rivaroxaban 15 mg une fois par jour (10 mg si clairance de la créatinine entre 15 et 49 mL/min) ou dans le groupe rivaroxaban et antiplaquettaire combinés. L’agent antiplaquettaire pouvait être l’AAS, le clopidogrel ou le prasugrel, au choix du médecin. Les patients étaient répartis aléatoirement selon l’âge, le sexe, les antécédents d’ICP et d’AVC, la présence d’insuffisance cardiaque, d’hypertension et de diabète. La période prévue de suivi initiale était minimalement de 24 mois, mais pouvait se prolonger jusqu’à 45 mois, et comprenait des suivis à la répartition aléatoire, à six mois puis à la fin de l’étude.
Points évalués
: L’objectif primaire d’efficacité est un composé d’évènements regroupant la survenue d’AVC, d’embolie systémique, d’infarctus du myocarde, d’angine instable nécessitant une revascularisation et la mortalité de toutes causes. L’apparition de saignement majeur selon les critères de l’International Society on Thrombosis and Hemostasis constituait l’objectif primaire d’innocuité16. Les objectifs secondaires comportaient, entre autres, les composantes individuelles de l’objectif primaire ainsi que la mortalité d’origine cardiovasculaire et non cardiovasculaire. Les évènements ont été validés par un comité indépendant.
Résultats
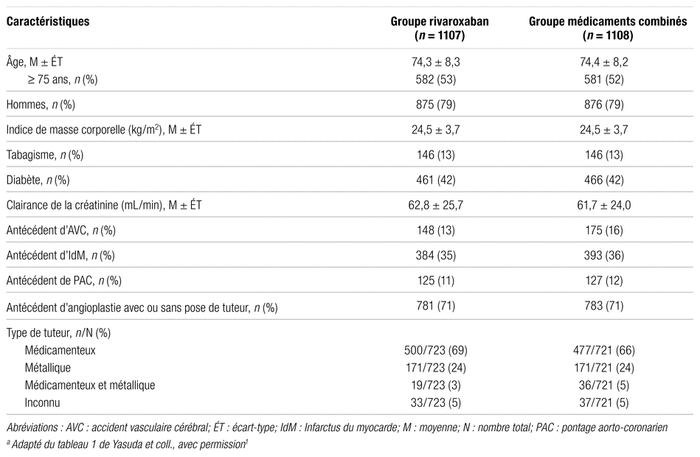
: De février 2015 à septembre 2017, 2240 patients ont été recrutés. Après la répartition aléatoire, 1118 patients ont été inclus dans chacun des groupes. L’analyse en intention de traiter modifiée incluait quant à elle 1107 patients dans le groupe monothérapie et 1108 dans le groupe médicaments combinés. La durée médiane de traitement était de 23 mois. Le tableau I permet d’apprécier la répartition équitable des caractéristiques de base des patients; aucune différence significative n’étant présente entre les deux groupes. Le score CHA
2
DS
2
-VASc médian au sein de la population à l’étude était de 4 et le score HAS-BLED médian était de 2. Concernant les antiplaquettaires dans le groupe médicaments combinés, approximativement 70 % des patients étaient sous AAS 100 mg ou moins par voie orale une fois par jour, 25 % sous clopidogrel et 1,5 % sous prasugrel.
Tableau I
Caractéristiques de base des patients inclus dans l’étude AFIREa
Le tableau II résume les principaux résultats de l’étude. Parmi les sujets répartis aléatoirement ayant reçu au moins une dose du traitement à l’étude ou du traitement comparateur, un évènement de l’objectif primaire d’efficacité est survenu chez 89 patients recevant la monothérapie par rapport à 121 patients recevant les médicaments combinés (rapport de risque [RR] : 0,72; intervalle de confiance à 95 % [IC 95 %] : 0,55–0,95;
p
< 0,001 pour la non-infériorité,
p
= 0,02 pour la supériorité en analyse
post hoc
). En raison de l’augmentation de la mortalité dans le groupe médicaments combinés, l’étude a été cessée prématurément. Notons cependant que l’objectif primaire d’efficacité n’incluait initialement que les décès de cause cardiovasculaire, mais qu’un amendement au protocole avait été apporté conséquemment en cours d’étude pour y inclure la mortalité de toutes causes. Pour l’objectif primaire d’innocuité, l’incidence des saignements majeurs était moins élevée dans le groupe rivaroxaban par rapport au groupe médicaments combinés (1,62 %
vs
2,76 % par patient-année, RR : 0,59; IC 95 % : 0,39–0,89,
p
= 0,01).
Tableau II
Principaux résultats d’efficacité et d’innocuité de l’étude AFIREa
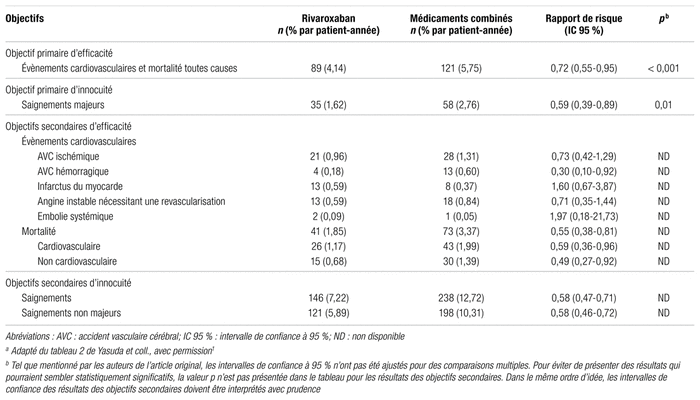
Concernant les objectifs secondaires, la mortalité de toutes causes était moindre dans le groupe monothérapie que dans le groupe médicaments combinés (1,85 %
vs
3,37 % par patient-année, RR : 0,55; IC 95 % : 0,38–0,81). Ce résultat s’explique autant par une diminution de la mortalité de type cardiovasculaire que non cardiovasculaire.
Des analyses de sous-groupes ont démontré que la non-infériorité du groupe monothérapie pour les objectifs primaires est constante quels que soient le sexe des patients, la présence de diabète ou d’insuffisance rénale, le score CHADS
2
et HAS-BLED, la dose de rivaroxaban ou la nature du traitement de revascularisation de la MCAS.
Grille d’évaluation critique

Discussion
L’étude AFIRE démontre la non-infériorité du rivaroxaban en monothérapie par rapport à l’association d’un antiplaquettaire avec le rivaroxaban pour prévenir les évènements cardiovasculaires et la mortalité de toutes causes chez des patients souffrant de FA et d’une MCAS stable. Elle démontre également la supériorité de la monothérapie concernant la survenue de saignements majeurs.
L’étude comporte certaines forces notables. Sa conception est adéquate pour répondre à la question clinique et le nombre de patients recrutés y est suffisamment important. Notons cependant à cet effet que l’arrêt précoce de l’étude a conduit à la survenue d’un nombre inférieur d’évènements (210) par rapport au nombre calculé initialement pour obtenir la puissance attendue, soit 219 évènements. Les principales variables confondantes considérées correspondent aux objectifs de l’étude, et la répartition aléatoire a permis leur répartition similaire dans les deux groupes, réduisant les biais de confusion. Les critères d’inclusion larges, incluant des patients âgés avec plusieurs comorbidités, rendent les résultats de l’étude plus applicables aux patients rencontrés en pratique. En outre, la question clinique est pertinente puisqu’il est connu depuis longtemps que le traitement antithrombotique optimal diffère entre les patients souffrant de FA et ceux avec une MCAS stable. L’étude AFIRE est la première étude à répartition aléatoire contrôlée à s’intéresser spécifiquement aux objectifs de l’association d’un AOD et d’un antiplaquettaire chez les patients souffrant de ces deux pathologies. L’utilisation d’un AOD comme molécule à l’étude, contrairement à la warfarine, est plus représentative de la pratique actuelle. De plus, les analyses de sous-groupes permettent d’écarter la possibilité que les résultats soient influencés par un groupe de patients précis.
L’étude AFIRE comporte également plusieurs limitations. D’abord, elle est en partie financée par la compagnie commercialisant le rivaroxaban, ce qui introduit un biais de financement. Aussi, le fait qu’il s’agisse d’une étude ouverte introduit un biais d’information, ce qui diminue la validité interne. Cette façon de faire est difficilement justifiable puisqu’il n’aurait pas été préjudiciable pour les patients du groupe sous monothérapie de recevoir un placebo en comprimé faisant office d’antiplaquettaire en ajout au rivaroxaban. Également, l’objectif primaire d’efficacité prévue initialement devait être composé des évènements cardiovasculaires et des décès de cause cardiovasculaire. Le changement apporté au protocole en cours d’étude pour y inclure la mortalité de toutes causes a eu un impact direct sur les résultats et a contribué à ce que le groupe monothérapie se distingue davantage du groupe médicaments combinés. Avec 15 décès de cause non cardiovasculaire dans le groupe rivaroxaban et 30 dans le groupe médicaments combinés, la taille de l’effet aurait été de moindre ampleur avec l’objectif initial. Les auteurs semblent ainsi profiter de résultats inattendus afin d’arriver aux conclusions désirées. En outre, l’absence de distinction du type d’AVC dans l’objectif primaire d’efficacité est une faiblesse importante dans le protocole puisqu’il comprend les AVC hémorragiques dont la survenue est une mesure relative à l’innocuité. Ceux-ci étaient certes plus nombreux dans le groupe médicaments combinés et peuvent donc avoir contribué à rendre l’analyse de l’objectif primaire d’efficacité statistiquement significative en faveur du groupe monothérapie.
Comme décrit précédemment, la validité externe est pauvre, l’étude étant réalisée chez une population japonaise, majoritairement masculine, et dans laquelle l’obésité est nettement moins prévalente qu’en Amérique du Nord. Des données indiquent d’ailleurs que le risque de saignement serait plus élevé au sein de la population asiatique de l’Est que chez les populations d’origine caucasienne, alors que le risque ischémique serait moindre19. Les doses de rivaroxaban employées dans l’étude diffèrent également de nos pratiques. Bien que ces doses correspondent à celles approuvées au Japon, elles ne représentent pas la conduite retenue dans les autres études d’AOD associés à un antiplaquettaire. Les études AUGUSTUS et ENTRUST-AF PCI employaient respectivement l’apixaban et l’édoxaban aux doses usuelles recommandées, alors que les ajustements étaient réalisés conformément aux critères prévus dans les différentes monographies20,21. L’emploi d’une dose moindre de rivaroxaban dans AFIRE pourrait avoir avantagé les résultats d’innocuité et limite par conséquent la représentativité externe des résultats. Un autre aspect réduisant la validité externe concerne la population incluse dans l’étude qui semblait présenter une MCAS moins sévère, tel que défini par la prévalence plutôt faible de patients ayant subi un infarctus du myocarde, soit environ le tiers de la population. Il est d’ailleurs de pratique courante de cesser plus précocement les antiplaquettaires chez les patients avec une MCAS ayant eu recours à une ICP de manière élective.
Concernant le groupe médicaments combinés, seulement 26,8 % ont reçu un inhibiteur du P2Y12. Alors que la pratique canadienne favorise l’utilisation du clopidogrel lorsqu’un antiplaquettaire et un anticoagulant sont combinés durant la première année suivant une ICP, aucune recommandation ne spécifie quel antiplaquettaire employer (clopidogrel ou AAS) après un an pour une MCAS stable, lorsqu’une association médicamenteuse est souhaitée3. Néanmoins, il est de pratique courante de poursuivre le clopidogrel dans ces circonstances lorsqu’il a été utilisé la première année. Cette divergence quant à la proportion de patients ayant reçu un inhibiteur du P2Y12 dans le groupe médicaments combinés peut s’expliquer par la proportion plus grande d’individus asiatiques ayant un polymorphisme génétique du cytochrome P450 2C19 associé à une non-réponse au clopidogrel22. Aucune analyse de sous-groupe ne s’est d’ailleurs intéressée aux résultats selon l’antiplaquettaire reçu.
Avant l’étude AFIRE, le traitement antithrombotique optimal 12 mois après une ICP chez les patients souffrant de FA était encore peu étudié. Le seul essai à répartition aléatoire contrôlé s’y intéressant était l’étude OAC-ALONE15. Les objectifs et la population étaient similaires à ceux de l’étude AFIRE, mais la warfarine était utilisée chez environ 75 % des patients, ce qui ne représente plus la pratique actuelle. Le nombre insuffisant de patients recrutés a conduit à l’arrêt prématuré de l’essai, entraînant une piètre puissance statistique. La non-infériorité de la monothérapie par rapport aux médicaments combinés n’a donc pas pu être démontrée pour un composite d’évènements cardiovasculaires et de mortalité. Notons toutefois que la tendance numérique montrait une incidence plus faible d’infarctus du myocarde et de thrombose de tuteur dans le groupe recevant les médicaments combinés, contrairement aux résultats de l’étude AFIRE.
Même avant la publication des études OAC-ALONE et AFIRE, en 2019, les recommandations favorisaient la monothérapie avec un ACO en présence d’une MCAS stable et de FA3,23. Effectivement, les lignes directrices 2018 de la European Heart and Rhythm Association recommandent l’utilisation d’un ACO et d’un antiplaquettaire en association au-delà de 12 mois uniquement chez les patients à haut risque d’évènements coronariens, tandis que ceux à haut risque de saignement pourraient bénéficier d’une monothérapie aussi tôt que six mois après une ICP ou un infarctus du myocarde23. Plus près de nous, la Société canadienne de cardiologie préconise depuis 2018 l’utilisation à long terme d’un AOD seul chez les patients avec FA et MCAS stable traitée par ICP, dont le traitement initial antiplaquettaire est finalisé (niveau de recommandation élevée)3. Ces recommandations sont entre autres soutenues par une étude observationnelle danoise de 2014 examinant les évènements cardiovasculaires et les saignements majeurs chez des patients avec FA et MCAS stable24. Cette étude a mis en évidence l’augmentation du risque de saignement ainsi que l’absence de diminution des évènements thrombotiques lorsqu’un antiplaquettaire est associé à un anticoagulant antagoniste de la vitamine K chez les patients avec FA et MCAS stable. Les résultats de l’étude AFIRE vont dans ce sens et confortent ainsi la pratique actuelle.
Conformément aux résultats de l’étude, l’emploi d’un AOD en monothérapie, en particulier le rivaroxaban, semble manifestement être le traitement à favoriser en cas de MCAS stable et de FA concomitante, alors que la poursuite d’un antiplaquettaire au-delà de 12 mois se révèle délétère. Notons toutefois que les patients présentant un antécédent de thrombose de tuteur, donc un risque ischémique plus important, étaient exclus de l’essai AFIRE. Les cliniciens de l’étude avaient également la possibilité d’exclure des patients pour qui il n’était pas jugé souhaitable d’interrompre le traitement antiplaquettaire. Il demeure donc raisonnable, tout comme en MCAS aiguë, d’évaluer les risques ischémique et hémorragique. D’ailleurs, dans les dernières lignes directrices canadiennes sur la FA, une précision est apportée quant à la nécessité de poursuivre l’association d’un AOD et d’un antiplaquettaire dans cette sous-population de patients présentant des caractéristiques les plaçant à haut risque d’évènements ischémiques coronariens. Pour ces patients, l’arrêt de l’antiplaquettaire à 12 mois doit tenir compte de la présentation de la maladie initiale, de leurs facteurs de risque et des facteurs relatifs à l’anatomie coronarienne et à la complexité de l’angioplastie coronarienne réalisée14. Enfin, la généralisation des résultats de l’étude AFIRE aux autres AOD est limitée vu le manque d’études comparatives entre les différents AOD et l’hétérogénéité quant aux paramètres pharmacocinétiques des molécules de cette classe. Néanmoins, malgré ce manque de documentation scientifique comparant directement les AOD entre eux, des données rétrospectives indiquent que le rivaroxaban serait inférieur aux autres AOD tant pour son efficacité dans la prévention des AVC que pour son risque de saignement25,26. Les données actuelles tendent plutôt à favoriser l’apixaban au regard du risque de saignement, plus particulièrement chez les patients de plus de 75 ans27. D’ailleurs, la plus récente mise à jour des critères de Beers considère le rivaroxaban comme un médicament à utiliser avec prudence en raison des données probantes de plus en plus nombreuses concernant l’augmentation du risque de saignement par rapport aux autres traitements anticoagulants28. Cela est d’autant plus intéressant que plus de 50 % de la population dans l’étude AFIRE était âgée de 75 ans ou plus.
Conclusion
L’étude AFIRE démontre que le rivaroxaban en monothérapie est non inférieur à un traitement combinant le rivaroxaban et un antiplaquettaire chez des patients atteints de FA et d’une MCAS stable. L’étude a été arrêtée prématurément en raison d’une augmentation de la mortalité dans le groupe médicaments combinés. Elle répond donc clairement à une question clinique qui n’avait été bien évaluée dans aucune étude à répartition aléatoire contrôlée. L’interprétation des résultats est malheureusement limitée par la mauvaise validité externe. Néanmoins, l’ampleur des résultats et l’augmentation significative de la mortalité chez les patients du groupe médicaments combinés nous confirment que la pratique actuelle, qui consiste à traiter les patients souffrant simultanément de FA et de MCAS stable par un AOD en monothérapie, demeure la meilleure approche. Une nuance quant à cette conclusion demeure pour les patients à haut risque coronarien chez qui une analyse plus poussée des risques et des bénéfices est requise.
Remerciements
Cet article a été réalisé dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université Laval. Les auteurs en remercient la responsable, Julie Méthot. Cette personne a donné son autorisation par écrit.
Financement
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Conflits d’intérêts
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Références
1. Yasuda S, Kaikita K, Akao M, Ako J, Matoba T, Nakamura M et al. Antithrombotic therapy for atrial fibrillation with stable coronary disease. N Engl J Med 2019;381:1103–13.


2. Kirchhof P, Ammentorp B, Darius H, De Caterina R, Le Heuzey JY, Schilling RJ et al. Management of atrial fibrillation in seven European countries after the publication of the 2010 ESC Guidelines on atrial fibrillation: primary results of the PREvention oF thromboembolic events--European Registry in Atrial Fibrillation (PREFER in AF). Europace 2014;16:6–14.

3. Mehta SR, Bainey KR, Cantor WJ, Lordkipanidze M, Marquis-Gravel G, Robinson SD et al. 2018 Canadian Cardiovascular Society/Canadian Association of Interventional Cardiology focused update of the guidelines for the use of antiplatelet therapy. Can J Cardiol 2018;34:214–33.


4. Bittl JA, Baber U, Bradley SM, Wijeysundera DN. Duration of dual antiplatelet therapy: a systematic review for the 2016 ACC/AHA Guideline focused update on duration of dual antiplatelet therapy in patients with coronary artery disease: a report of the American College of Cardiology/American Heart Association task force on clinical practice guidelines. J Am Coll Cardiol 2016;68:1116–39.


5. Knuuti J, Wijns W, Saraste A, Capodanno D, Barbato E, Funck-Brentano C et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J 2020;41:407–77.

6. Hansen ML, Sorensen R, Clausen MT, Fog-Petersen ML, Raunso J, Gadsboll N et al. Risk of bleeding with single, dual, or triple therapy with warfarin, aspirin, and clopidogrel in patients with atrial fibrillation. Arch Intern Med 2010;170:1433–41.


7. Fiedler KA, Maeng M, Mehilli J, Schulz-Schupke S, Byrne RA, Sibbing D et al. Duration of triple therapy in patients requiring oral anticoagulation after drug-eluting stent implantation: the ISAR-TRIPLE trial. J Am Coll Cardiol 2015;65:1619–29.


8. Dewilde WJ, Oirbans T, Verheugt FW, Kelder JC, De Smet BJ, Herrman JP et al. Use of clopidogrel with or without aspirin in patients taking oral anticoagulant therapy and undergoing percutaneous coronary intervention: an open-label, randomised, controlled trial. Lancet 2013;381:1107–15.


9. Lopes RD, Heizer G, Aronson R, Vora AN, Massaro T, Mehran R et al. Antithrombotic therapy after acute coronary syndrome or PCI in atrial fibrillation. N Engl J Med 2019;380:1509–24.


10. Cannon CP, Bhatt DL, Oldgren J, Lip GYH, Ellis SG, Kimura T et al. Dual antithrombotic therapy with dabigatran after PCI in atrial fibrillation. N Engl J Med 2017;377:1513–24.


11. Gibson CM, Mehran R, Bode C, Halperin J, Verheugt F, Wildgoose P et al. An open-label, randomized, controlled, multicenter study exploring two treatment strategies of rivaroxaban and a dose-adjusted oral vitamin K antagonist treatment strategy in subjects with atrial fibrillation who undergo percutaneous coronary intervention (PIONEER AF-PCI). Am Heart J 2015;169:472–8.e5.

12. Vranckx P, Valgimigli M, Eckardt L, Tijssen J, Lewalter T, Gargiulo G et al. Edoxaban-based versus vitamin K antagonist-based antithrombotic regimen after successful coronary stenting in patients with atrial fibrillation (ENTRUST-AF PCI): a randomised, open-label, phase 3b trial. Lancet 2019;394:1335–43.


13. Angiolillo DJ, Goodman SG, Bhatt DL, Eikelboom JW, Price MJ, Moliterno DJ et al. Antithrombotic therapy in patients with atrial fibrillation treated with oral anticoagulation undergoing percutaneous coronary intervention: a North American perspective-2018 update. Circulation 2018;138:527–36.


14. Andrade JG, Aguilar M, Atzema C, Bell A, Cairns JA, Cheung CC et al. The 2020 Canadian Cardiovascular Society/Canadian Heart Rhythm Society comprehensive guidelines for the management of atrial fibrillation. Can J Cardiol 2020;36:1847–948.


15. Matsumura-Nakano Y, Shizuta S, Komasa A, Morimoto T, Masuda H, Shiomi H et al. Open-label randomized trial comparing oral anticoagulation with and without single antiplatelet therapy in patients with atrial fibrillation and stable coronary artery disease beyond 1 year after coronary stent implantation. Circulation 2019;139:604–16.

16. Schulman S, Kearon C. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in non-surgical patients. J Thromb Haemost 2005;3:692–4.


17. Ko D, Rahman F, Schnabel RB, Yin X, Benjamin EJ, Christophersen IE. Atrial fibrillation in women: epidemiology, pathophysiology, presentation, and prognosis. Nat Rev Cardiol 2016;13:321–32.



18. Tanigawa T, Kaneko M, Hashizume K, Kajikawa M, Ueda H, Tajiri M et al. Model-based dose selection for phase III rivaroxaban study in Japanese patients with non-valvular atrial fibrillation. Drug Metab Pharmacokinet 2013; 28:59–70.

19. Jeong YH. “East asian paradox”: challenge for the current antiplatelet strategy of “one-guideline-fits-all races” in acute coronary syndrome. Curr Cardiol Rep 2014;16:485.

20. Lopes RD, Heizer G, Aronson R, Vora AN, Massaro T, Mehran R et al. Antithrombotic therapy after acute coronary syndrome or PCI in atrial fibrillation. N Engl J Med 2019;380:1509–24.


21. Vranckx P, Valgimigli M, Eckardt L, Tijssen J, Lewalter T, Gargiulo G et al. Edoxaban-based versus vitamin K antagonist-based antithrombotic regimen after successful coronary stenting in patients with atrial fibrillation (ENTRUST-AF PCI): a randomised, open-label, phase 3b trial. Lancet 2019;394:1335–43.


22. Scott SA, Sangkuhl K, Stein CM, Hulot JS, Mega JL, Roden DM et al. Clinical pharmacogenetics implementation consortium guidelines for CYP2C19 genotype and clopidogrel therapy: 2013 update. Clin Pharmacol Ther 2013;94:317–23.



23. Steffel J, Verhamme P, Potpara TS, Albaladejo P, Antz M, Desteghe L et al. The 2018 European Heart Rhythm Association practical guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Eur Heart J 2018;39:1330–93.


24. Lamberts M, Gislason GH, Lip GY, Lassen JF, Olesen JB, Mikkelsen AP et al. Antiplatelet therapy for stable coronary artery disease in atrial fibrillation patients taking an oral anticoagulant: a nationwide cohort study. Circulation 2014;129:1577–85.


25. Cohen AT, Hill NR, Luo X, Masseria C, Abariga SA, Ashaye AO. A systematic review of network meta-analyses among patients with nonvalvular atrial fibrillation: A comparison of efficacy and safety following treatment with direct oral anticoagulants. Int J Cardiol 2018;269:174–81.


26. Hellenbart EL, Faulkenberg KD, Finks SW. Evaluation of bleeding in patients receiving direct oral anticoagulants. Vasc Health Risk Manag 2017;13:325–42.



27. Malik AH, Yandrapalli S, Aronow WS, Panza JA, Cooper HA. Meta-analysis of direct-acting oral anticoagulants compared with warfarin in patients >75 years of age. Am J Cardiol 2019;123:2051–7.


28. American Geriatrics Society Beers Criteria Update Expert Panel. American Geriatrics Society 2019 updated AGS Beers criteria® for potentially inappropriate medication use in older adults. J Am Geriatr Soc 2019;67:674–94.

Pour toute correspondance: Marc-Antoine Bérubé, Centre hospitalier universitaire de Québec – Université Laval, Hôpital de l’Enfant-Jésus, 1401, 18e rue, Québec (Québec) G1J 1Z4, CANADA; Téléphone : 418 952-1881; Courriel :
marc-antoine.berube@hotmail.com
(Return to Top)
PHARMACTUEL, Vol. 54, No. 4, 2021





