Catherine
Lacroix
,
Pharm.D., M.Sc.
1,2,3,
Julie
Boisvert
,
B.Pharm., M.Sc.
4,5,
Audrey
Vachon
,
B.Pharm., M.Sc.
4,6,
Julie
Méthot
,
B.Pharm., M.Sc., Ph.D., FOPQ
4,7
Reçu le 12 décembre 2020: Accepté après révision par les pairs le 22 avril 2021
Résumé
Contexte : Le sacubitril/valsartan a été approuvé au Canada pour le traitement de l’insuffisance cardiaque avec fraction d’éjection abaissée à la suite des résultats positifs obtenus dans l’étude PARADIGM-HF, et il est utilisé dans notre institut depuis décembre 2015. Étant donné la faible représentation de la population canadienne dans les études à répartition aléatoire, il est pertinent d’analyser le profil d’utilisation du sacubitril/valsartan chez les patients du Québec.
Méthode : Cette étude descriptive, rétrospective et longitudinale a été menée auprès de patients traités par sacubitril/valsartan entre le 1er décembre 2015 et le 31 mars 2017 à la clinique d’insuffisance cardiaque de l’Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval.
Résultats : Un total de 271 patients a entrepris un traitement par sacubitril/valsartan durant cette période. Les analyses de données recueillies ( n = 271) indiquent que 38,0 % d’entre eux ont atteint la dose cible de 194/206 mg (400 mg) par jour à la fin de l’étude. L’atteinte de la dose cible semble être influencée par l’âge, la fonction rénale ainsi que par la prise initiale d’un bloqueur des canaux calciques. En cours de suivi, la dose de furosémide a été réduite chez 31,9 % des patients. Les symptômes d’hypotension (20,8 %) ont constitué l’effet indésirable le plus fréquent.
Conclusion : Cette étude a permis d’accroître le niveau de connaissances sur le profil d’utilisation du sacubitril/valsartan en ce qui a trait à l’atteinte de la dose cible, à la survenue d’effets indésirables et à l’ajustement de la médication cardiovasculaire concomitante dans la population québécoise.
Mots clés : Effets indésirables, insuffisance cardiaque, sacubitril/valsartan, titration
Abstract
Background : Sacubitril/valsartan was approved in Canada for the treatment of reduced ejection fraction heart failure, following the positive results obtained in the PARADIGM-HF study. It has been used in our facility since December 2015. Given the Canadian population’s low representation in randomized studies, it would be useful to examine the utilization profile of sacubitril/valsartan in Quebec patients.
Method : This descriptive, retrospective, longitudinal study was conducted in patients treated with sacubitril/valsartan between December 1, 2015 and March 31, 2017 at the Institut de cardiologie et de pneumologie de Québec – Université Laval’s heart failure clinic.
Results : A total of 271 patients were started on sacubitril/valsartan therapy during this period. The analyses of the data collected ( n =271) indicate that 38.0% of them reached the target dose of 194/206 mg (400 mg) daily by the end of the study. Target dose attainment appears to be influenced by age, renal function, and the initial use of a calcium channel blocker. During the follow-up, the furosemide dose was reduced in 31.9% of the patients. The most common adverse effect was hypotension symptoms (20.8%).
Conclusion : This study increased the level of knowledge regarding the utilization profile of sacubitril/valsartan in terms of target dose attainment, the occurrence of adverse effects, and the adjustment of concomitant cardiovascular medication in the Quebec population.
Keywords : Adverse effects, heart failure, sacubitril/valsartan, titration
Au Canada, l’insuffisance cardiaque touche environ 600 000 patients et le taux d’incidence est estimé à 50 000 nouveaux cas chaque année1. Il s’agit de la deuxième cause d’hospitalisation chez les personnes de plus de 65 ans et « on estime que les coûts directs reliés à l’insuffisance cardiaque dépassent les 2,8 milliards de dollars annuellement »2,3. Bien que l’utilisation d’une thérapie médicale optimale ait permis d’augmenter la survie des patients souffrant d’insuffisance cardiaque au cours des dernières décennies, il demeure néanmoins que 50 % des patients décèdent dans les cinq années suivant leur diagnostic4–6. Les médicaments ayant démontré une diminution de la mortalité associée à l’insuffisance cardiaque sont les inhibiteurs de l’enzyme de conversion de l’angiotensine (IECA), les antagonistes des récepteurs de l’angiotensine II (ARA), les bêta-bloquants (BB) et les antagonistes des récepteurs minéralocorticoïdes (ARM)5,7. Très peu de nouveaux médicaments ont démontré une efficacité dans le traitement de l’insuffisance cardiaque jusqu’à la publication de l’étude PARADIGM-HF au mois d’août 20145,7,8. Cette étude comparait l’efficacité du sacubitril/valsartan (EntrestoMD), un inhibiteur de la néprilysine et des récepteurs de l’angiotensine II, à celle de l’énalapril chez des patients qui étaient déjà sous traitement stable à base de BB avec ou sans ARM. Elle a démontré une réduction de 20 % de la mortalité cardiovasculaire avec le sacubitril/valsartan par rapport à l’énalapril chez les patients atteints d’insuffisance cardiaque avec fraction d’éjection abaissée8. À la suite de cette publication, Santé Canada a approuvé le sacubitril/valsartan et, au Québec, il est remboursé par la Régie de l’assurance maladie du Québec à titre de médicament d’exception depuis mars 2017.
Le sacubitril/valsartan est utilisé à la clinique d’insuffisance cardiaque de l’Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval (IUCPQ-UL) depuis décembre 2015. Étant donné la faible représentation de la population canadienne dans les études à répartition aléatoire, il est pertinent d’analyser le profil d’utilisation du sacubitril/valsartan dans la population québécoise afin d’enrichir notre expérience clinique avec ce médicament. L’objectif primaire est de décrire le profil d’utilisation et d’innocuité du sacubitril/valsartan chez les patients atteints d’insuffisance cardiaque avec fraction d’éjection abaissée qui sont suivis à la clinique d’insuffisance cardiaque de l’IUCPQ-UL. Les objectifs secondaires sont de décrire la proportion de patients qui ont eu un ajustement de la thérapie cardiovasculaire autre que le sacubitril/valsartan (furosémide, ARM et BB) et de déterminer le nombre d’hospitalisations et de décès entre le moment où le sacubitril/valsartan a été introduit et la fin de l’étude. L’étude permettra d’évaluer la proportion de patients ayant atteint la dose cible de sacubitril/valsartan et ayant subi un effet indésirable ou un ajustement de la thérapie cardiovasculaire autre que le sacubitril/valsartan.
Cette étude descriptive, longitudinale et rétrospective est le fruit de l’analyse de tous les dossiers des patients atteints d’insuffisance cardiaque avec fraction d’éjection abaissée qui ont reçu le sacubitril/valsartan entre le 1er décembre 2015 et le 31 mars 2017 à la clinique d’insuffisance cardiaque de l’IUCPQ-UL. Le 1er décembre 2015 correspond à la date de la première ordonnance de sacubitril/valsartan à la clinique. De plus, puisque titrer le sacubitril/valsartan jusqu’à la dose cible peut prendre jusqu’à trois mois, la date du 31 mars 2017 a été choisie comme date butoir afin de laisser le temps aux patients ayant entamé une prise de sacubitril/valsartan durant ce mois d’atteindre la dose de 194/206 mg (400 mg) par jour pour la collecte de données, qui a été effectuée en juin 2017. Il n’y avait aucun critère d’exclusion pour cette étude. Le recrutement des patients a été effectué à l’aide de la base de données Vision C+MD, un logiciel utilisé par les différents professionnels de la clinique d’insuffisance cardiaque de l’IUCPQ-UL. La définition des doses faibles et élevées des IECA, des ARA et des BB figure en annexe9.
Le dossier-patient dans Vision C+MD et dans Cristal-NetMD a été consulté pour chacun des patients à l’étude. L’autorisation de la direction des services professionnels a été requise afin d’obtenir l’accès au dossier antérieur des patients à l’étude.
L’analyse des données a été effectuée principalement à l’aide de statistiques descriptives. La régression logistique a également été utilisée afin d’évaluer la possibilité d’une association entre l’apparition d’un évènement (comme l’atteinte de la dose cible ou la survenue d’un effet indésirable) et les facteurs pouvant influer sur cet évènement (comme la dose d’IECA ou d’ARA utilisée par le patient avant de commencer son traitement par sacubitril/valsartan). Ainsi, cette analyse permettra de répondre aux questions suivantes : pour quelle raison n’atteint-on pas la dose cible de sacubitril/valsartan ou pour quelle raison l’hypotension symptomatique survient-elle? L’intervalle de confiance utilisé est de 95 % et le seuil de signification statistique a été fixé à 0,05. L’équipe a bénéficié de l’aide d’un statisticien pour l’analyse des données et les tests statistiques ont été effectués à l’aide des progiciels SAS V9.4MD et RMD.
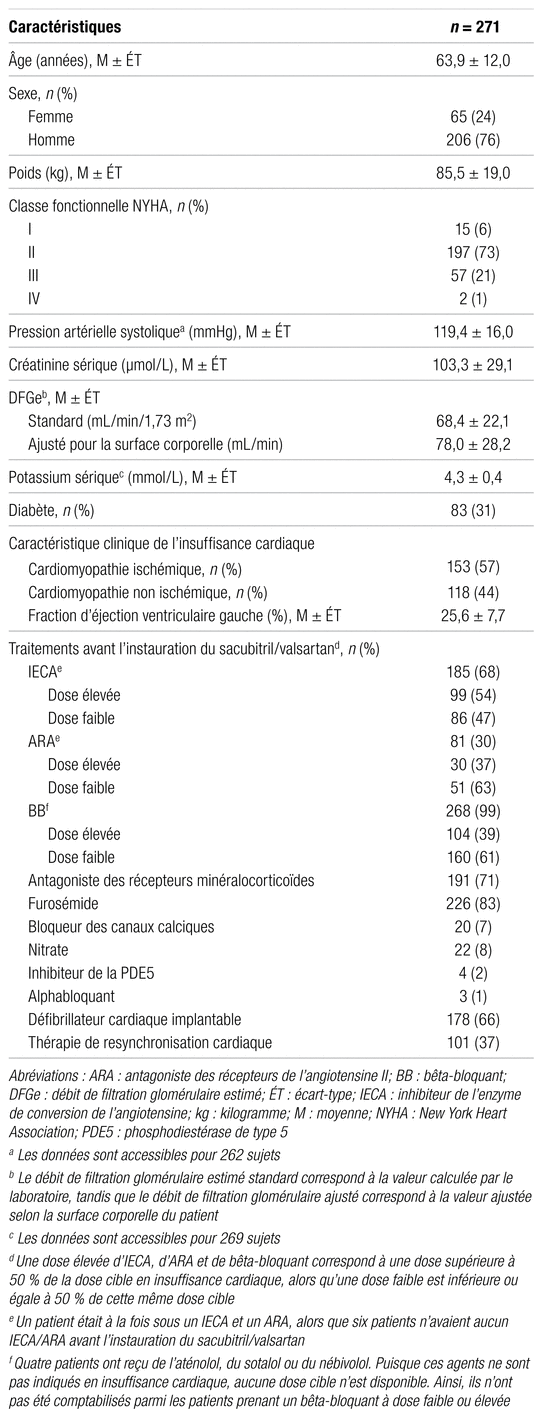
Un total de 271 patients a entrepris un traitement par sacubitril/valsartan entre le 1er décembre 2015 et le 31 mars 2017 à la clinique d’insuffisance cardiaque de l’IUCPQ-UL. Tous ces patients ont été inclus dans l’étude. Leurs caractéristiques démographiques et cliniques sont présentées dans le tableau I. Leur âge moyen était de 63,9 ans et plus des trois quarts d’entre eux étaient des hommes. La majorité (72,7 %) avait une classe fonctionnelle de la New York Heart Association (NYHA) II, et la fraction d’éjection ventriculaire gauche (FEVG) moyenne se situait à 25,6 %. De plus, la créatinine sérique moyenne et le débit de filtration glomérulaire ajusté pour la surface corporelle (DFGe) moyens étaient de 103,3 μmol/L et 78,0 mL/min respectivement. Au moment de l’introduction du sacubitril/valsartan, la prise d’IECA et d’ARA se chiffrait à 68,3 % et 29,9 % respectivement, un ARM était prescrit chez 70,5 % des sujets et la quasi-totalité (98,9 %) prenait un BB. Bien que le sacubitril/valsartan soit actuellement indiqué pour les patients de classe fonctionnelle NYHA II à IV ayant à leur dossier un IECA ou un ARA depuis au moins quatre semaines, certains patients se sont vu ajouter le médicament à leur thérapie malgré l’absence de ces critères.
Tableau I
Caractéristiques de base des patients à l’étude

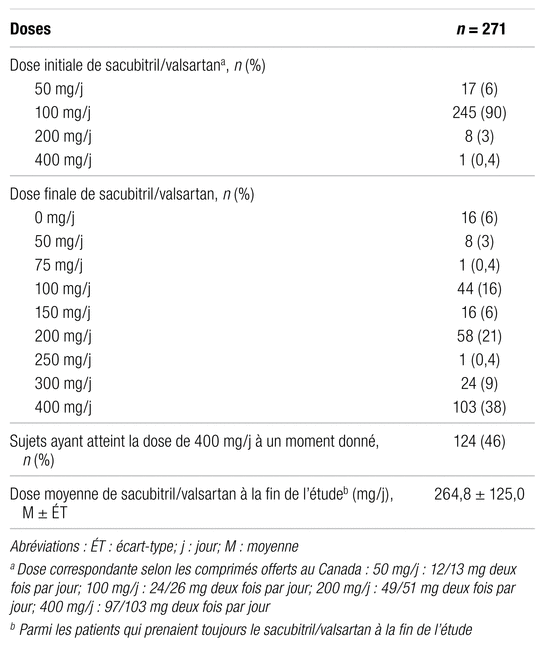
Le tableau II dresse le portrait des doses de sacubitril/valsartan chez les patients à l’étude. Au total, 45,8 % d’entre eux ont atteint la dose cible de sacubitril/valsartan à un moment ou un autre de l’étude et 38,0 % ont conservé la dose cible jusqu’à la fin de l’étude. L’analyse des données du profil d’utilisation du sacubitril/valsartan montre que 21 des 124 patients qui avaient atteint initialement la dose cible n’ont pas maintenu cette dose jusqu’à la fin de l’étude. Dans 67 % des cas, la diminution des doses était reliée à des symptômes d’hypotension. Les autres principales raisons expliquant la baisse de la dose quotidienne de sacubitril/valsartan sont l’insuffisance rénale aiguë (IRA) (9,5 %) et l’hyperkaliémie (9,5 %). Les doses initiales et finales de sacubitril/valsartan sont également décrites dans le tableau II.
Tableau II
Profil d’utilisation du sacubitril/valsartan
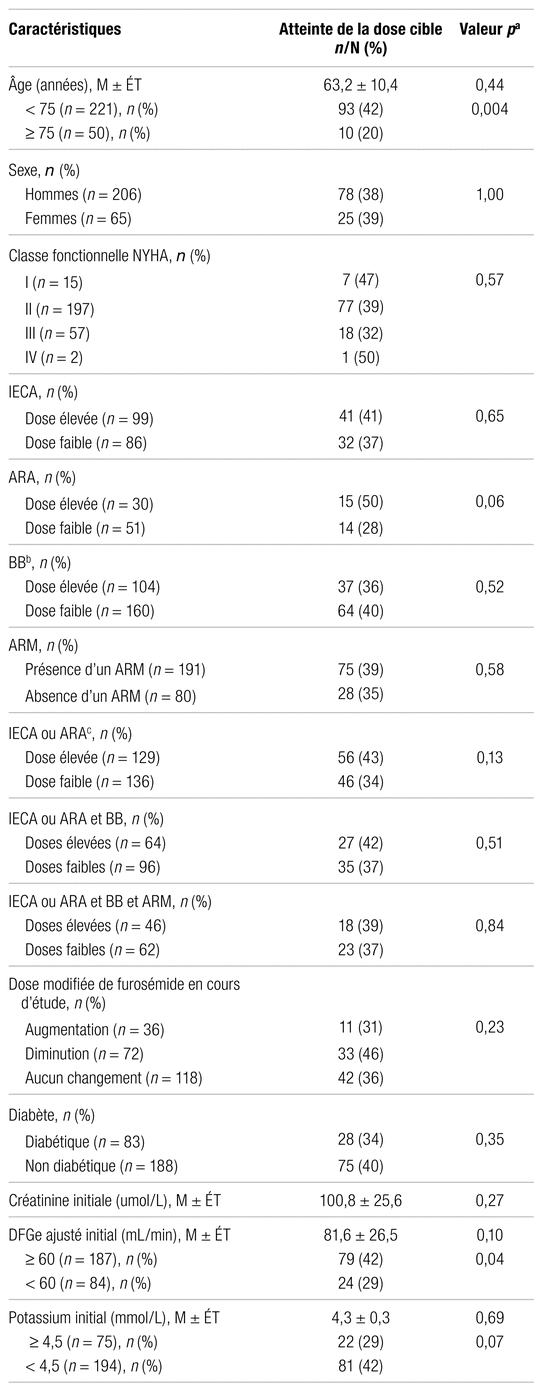
La relation entre la présence des caractéristiques cliniques et l’atteinte de la dose cible à la fin de l’étude est présentée dans le tableau III. Les 103 patients qui ont atteint la dose cible de sacubitril/valsartan à la fin de l’étude étaient plus jeunes ( p = 0,004) et avaient une meilleure fonction rénale ( p = 0,04 ) . De plus, l’utilisation préalable d’un bloqueur des canaux calciques (BCC) a favorisé l’atteinte de la dose cible ( p = 0,003).
Tableau III
Relation entre les caractéristiques des patients et l’atteinte de la dose cible de sacubitril/valsartan à la fin de l’étude (n =103)
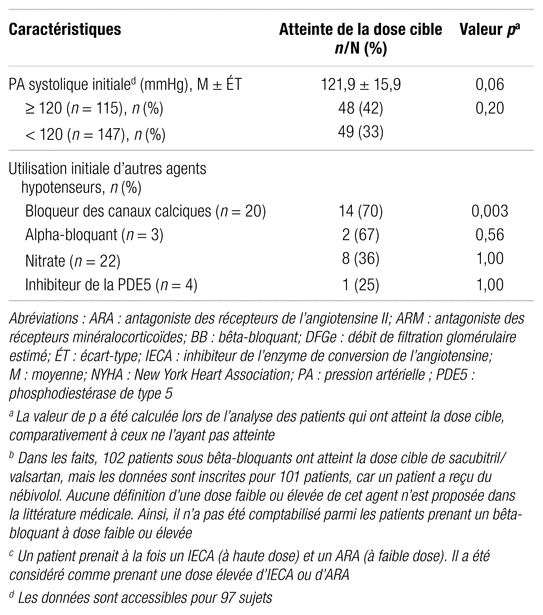
Les raisons de la non-atteinte de la dose cible de sacubitril/valsartan chez les patients recevant initialement une dose élevée d’IECA ou d’ARA sont présentées dans le tableau IV. L’atteinte de la dose cible a été limitée par les étourdissements ou une pression artérielle à la limite inférieure chez 44,8 % des patients recevant initialement une dose élevée d’IECA et chez 46,7 % de ceux recevant une dose élevée d’ARA.
Tableau IV
Raisons limitant l’atteinte de la dose cible de sacubitril/valsartan chez les patients recevant initialement une dose élevée d’IECA ou d’ARAa ainsi que profil d’innocuité du sacubirtil/valsartan pour la population générale à l’étude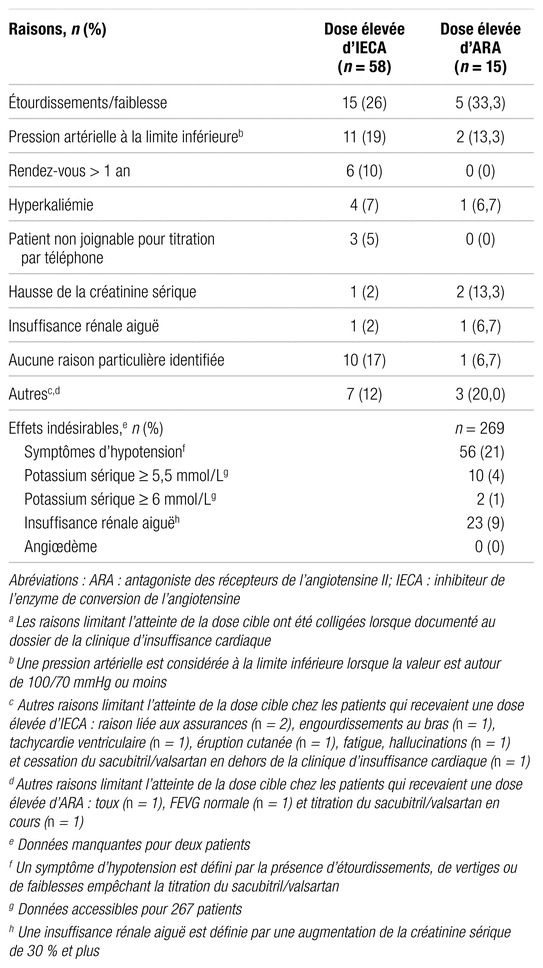
Le profil d’innocuité du sacubitril/valsartan est présenté dans le tableau IV. Les symptômes d’hypotension, observés chez environ un patient sur cinq, ont été de loin l’effet indésirable le plus fréquent. Par ailleurs, 16 patients (5,9 %) sur 269 ont cessé le sacubitril/valsartan en cours de route pour diverses raisons, les symptômes d’hypotension ayant été la principale cause de cessation chez neuf patients (56,3 %). Les autres raisons d’arrêt du traitement étaient les suivantes : hyperkaliémie ( n = 1), insuffisance cardiaque décompensée ( n = 1), IRA ( n = 1), démangeaisons, fatigue et nausées ( n = 1), hallucinations, épuisement et douleurs aux pieds ( n = 1), découverte d’une FEVG initialement normale ( n = 1) et tachycardie ventriculaire ( n = 1).
Comme présenté dans le tableau V, la relation entre certaines caractéristiques cliniques et la survenue de symptômes d’hypotension, d’hyperkaliémie et d’IRA a été évaluée entre le moment de l’introduction du sacubitril/valsartan et la fin de l’étude. Les 56 patients qui ont présenté des symptômes d’hypotension avaient une pression artérielle systolique initiale moyenne plus basse, comparativement à ceux qui n’ont pas présenté cet effet indésirable ( p = 0,04). Par ailleurs, les 10 patients qui ont présenté une hyperkaliémie avaient un potassium sérique initial plus élevé ( p < 0,0001) et la majorité était diabétique ( p = 0,0001). Par ailleurs, on observe que la fonction rénale initiale, illustrée par le DFGe ajusté, était plus faible chez les 23 patients ayant présenté une IRA ( p = 0,005) et que ces derniers étaient statistiquement plus âgés que ceux n’ayant pas présenté cet effet indésirable ( p = 0,01).
Tableau V
Relation entre les caractéristiques des patients et la présence de symptômes d’hypotension, d’hyperkaliémie et d’insuffisance rénale aiguë
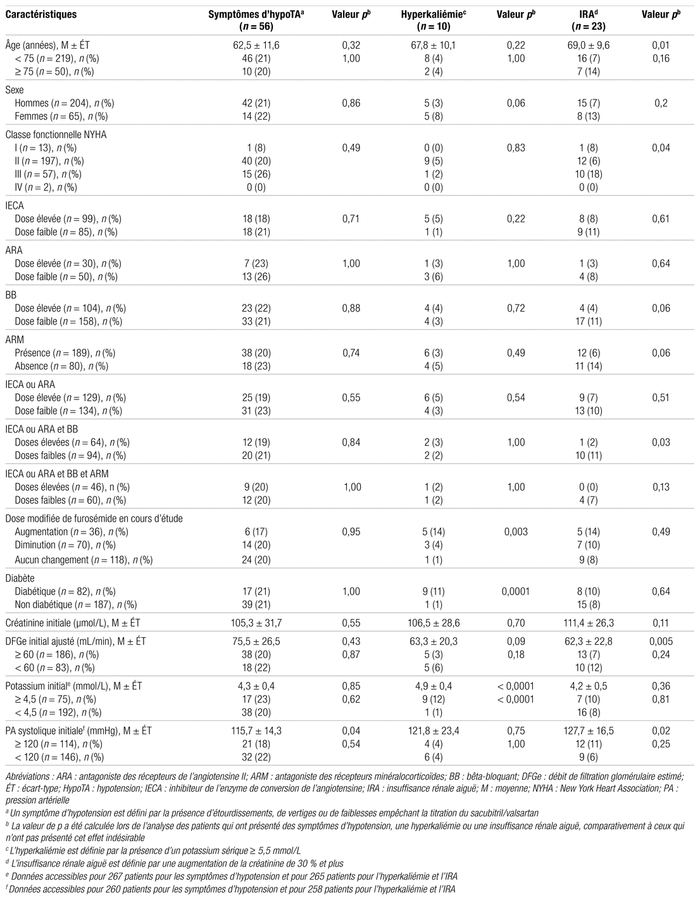
Un des objectifs secondaires consiste à décrire la proportion de patients qui ont eu un ajustement de la thérapie cardiovasculaire autre que le sacubitril/valsartan (furosémide, ARM et BB) entre le moment où le sacubitril/valsartan a été introduit et la fin de l’étude. La dose quotidienne de furosémide a été réduite chez 72 patients (31,9 %) sur 226, alors qu’elle a été augmentée chez 36 d’entre eux (15,9 %). Également, on observe une baisse de la dose journalière de l’ARM chez 16,2 % des patients, alors que 8,9 % ont eu une hausse. Enfin, parmi les 268 sujets qui prenaient un BB, 29 (10,8 %) ont vu leur dose diminuer durant la période de l’étude, alors que 41 (15,3 %) ont eu une majoration de dose. Somme toute, la majorité des patients a maintenu une dose stable de furosémide, d’ARM et de BB au cours de l’étude.
Le nombre d’hospitalisations et de décès entre le début de la prise du sacubitril/valsartan et la fin de l’étude a également été évalué. On observe que 59 patients (21,8 %) ont eu au moins une hospitalisation, et un total de 68 épisodes d’hospitalisation a été recensé. Les principales raisons d’admission ont été les suivantes : implantation d’un défibrillateur cardiaque implantable (DCI), d’une thérapie de resynchronisation cardiaque ou installation d’un MitraClipMD (38,2 %), insuffisance cardiaque décompensée (22,0 %), arythmie (20,6 %), syndrome coronarien aigu (10,3 %) et autres (repositionnement d’une sonde de stimulateur cardiaque, œdème aigu du poumon, tamponnade, transplantation cardiaque et remplacement de valve) (8,8 %). Cinq décès (1,8 %) sont survenus durant l’étude et tous étaient reliés à une décompensation d’insuffisance cardiaque.
Dans le cadre de ce projet, l’objectif principal était de décrire le profil d’utilisation et d’innocuité du sacubitril/valsartan chez les patients atteints d’insuffisance cardiaque avec fraction d’éjection abaissée et suivis à la clinique d’insuffisance cardiaque de l’IUCPQ-UL. L’analyse des données recueillies indique que 45,8 % d’entre eux ont atteint la dose cible de sacubitril/valsartan à un moment donné durant l’étude et que 38,0 % ont maintenu cette dose jusqu’à la fin de l’étude. Il a également été observé que le fait d’être âgé de moins de 75 ans ( p = 0,004), d’avoir un DFGe ajusté initial supérieur à 60 mL/min ( p = 0,04) ou d’utiliser un BCC avant le début de l’étude ( p = 0,003) favorisait l’atteinte de la dose cible de sacubitril/valsartan. Du point de vue de l’innocuité, les symptômes d’hypotension ont constitué l’effet indésirable le plus fréquent avec une incidence de 20,8 %.
L’étude TITRATION évaluait la tolérabilité de deux schémas de titration de la dose de sacubitril/valsartan sur une période de trois (schéma rapide) ou six semaines (schéma lent) chez les patients atteints d’insuffisance cardiaque avec fraction d’éjection abaissée. Cette étude a démontré que 75,9 % des patients ont atteint et maintenu la dose de 97/103 mg (200 mg) deux fois par jour à 12 semaines, et ce, indépendamment du schéma de titration et de la dose initiale d’IECA ou d’ARA9. Ce résultat n’a pas été reproduit dans notre étude, puisque seulement 38,0 % des patients ont atteint la dose cible à la fin de l’étude. La principale explication de ce grand écart est le schéma de titration du sacubitril/valsartan utilisé. En effet, la titration était effectuée par le personnel de recherche dédié sur une période stricte de trois ou six semaines pour l’étude TITRATION, alors que, dans la présente étude, la titration s’effectuait lors du rendez-vous médical ou par suivi téléphonique selon la demande du cardiologue et la disponibilité des pharmaciens. Ainsi, la période de titration était très variable entre les patients et elle pouvait s’étendre de quelques semaines à plusieurs mois en fonction des effectifs en place et de la liste d’attente pour l’attribution des rendez-vous en clinique. Compte tenu de cet aspect, la durée de titration n’a pas été collectée dans la présente étude. En somme, lors de la période de collecte de données, plusieurs patients n’avaient pas encore atteint la dose cible de sacubitril/valsartan simplement en raison d’un suivi moins fréquent et non parce que leur pression artérielle limitait la titration ou qu’ils éprouvaient un effet indésirable. De plus, le fait que l’on n’ait pas trouvé d’explication à la non-atteinte de la dose cible chez 17,2 % et 6,7 % des patients qui recevaient initialement une dose élevée d’IECA et d’ARA respectivement nous laisse croire qu’une majoration de la dose de sacubitril/valsartan chez plusieurs patients pourrait être tentée. Récemment, Barry et Lee ont publié une étude de cohorte rétrospective comprenant 128 patients, évaluant l’utilisation, l’innocuité et la tolérabilité du sacubitril/valsartan dans une clinique d’insuffisance cardiaque multidisciplinaire10. L’étude a démontré que 85 patients (66 %) avaient atteint la dose cible. Les patients devaient voir le pharmacien clinicien toutes les quatre à huit semaines.
Bien qu’il ait été démontré, dans une analyse post-hoc de l’étude PARADIGM-HF, que le sacubitril/valsartan demeurait supérieur à l’énalapril lorsqu’une diminution de dose de l’un ou l’autre des médicaments était requise, il est recommandé de viser l’atteinte de la dose cible afin d’obtenir le maximum de bénéfices en matière de réduction d’évènements cardiovasculaires11. Plusieurs caractéristiques cliniques ont été évaluées dans la présente étude afin de déterminer si certaines d’entre elles pourraient faciliter ou nuire à l’atteinte de la dose cible de sacubitril/valsartan. Il était attendu que les patients ayant une dose élevée d’IECA ou d’ARA avant l’instauration du sacubitril/valsartan atteindraient la dose cible à la fin de l’étude. L’analyse de ces données s’est avérée toutefois statistiquement non significative. Il a été observé que les patients sous BCC lors de l’instauration du sacubitril/valsartan ont atteint davantage la dose cible de sacubitril/valsartan ( p = 0,003). On peut supposer que ces patients présentaient une pression artérielle plus haute au départ, ce qui nous permettait d’augmenter les doses de sacubitril/valsartan. Les étourdissements et la pression artérielle à la limite inférieure représentaient 44,8 % et 46,7 % des raisons empêchant la majoration du sacubitril/valsartan à la dose cible chez les patients qui recevaient auparavant une dose élevée d’IECA et d’ARA respectivement.
Les principaux effets indésirables rapportés dans l’étude PARADIGM-HF étaient l’hypotension symptomatique (14,0 %), l’hyperkaliémie supérieure à 5,5 mmol/L (16,1 %) ou à 6,0 mmol/L (4,3 %) et l’augmentation de la créatinine sérique à 220 μmol/L ou plus (3,3 %)8. Ainsi, dans l’étude PARADIGM-HF, il y avait moins d’hypotension, mais davantage d’hyperkaliémie comparativement à la présente étude. Il est à noter toutefois que les définitions de l’hypotension et de la détérioration rénale diffèrent entre les deux études, ce qui peut surestimer ou sous-estimer la présence de ces effets indésirables et rend la comparaison plus ardue. De plus, l’étude PARADIGM-HF a effectué une période de « run-in », ce qui peut sous-estimer l’incidence des effets indésirables. En fait, il a été rapporté que 12 % des patients se sont retirés de cette étude en raison d’effets indésirables durant cette période8.
Plusieurs caractéristiques cliniques ont été évaluées dans la présente étude afin de déterminer si certaines d’entre elles pourraient permettre de prédire la survenue ou non de symptômes d’hypotension, d’hyperkaliémie et d’IRA après l’introduction du sacubitril/valsartan. À la lumière de l’analyse des données, il a été observé que les sujets qui avaient présenté des symptômes d’hypotension présentaient une pression artérielle systolique initiale plus basse. L’étude TITRATION a rapporté que seulement 5,3 % des patients qui prenaient initialement une dose élevée d’IECA/ARA ont présenté de l’hypotension symptomatique, ce qui nous a amenés à penser que la dose initiale d’IECA ou d’ARA préalablement prise par le patient reflétait sa prédisposition à présenter cet effet indésirable9. Toutefois, si, dans la présente étude, une pression artérielle systolique initiale basse est associée à la survenue de symptômes d’hypotension ( p = 0,04), l’utilisation d’une dose faible d’IECA ou d’ARA avant l’introduction du sacubitril/valsartan ne semble pas l’être. Par ailleurs, on observe que les patients qui souffrent de diabète ou qui ont un potassium sérique initial égal ou supérieur à 4,5 mmol/L sont davantage à risque d’hyperkaliémie. De plus, les patients qui ont expérimenté cet effet indésirable avaient tendance à avoir un DFGe initial plus faible. Il était attendu que la prise d’un ARM augmenterait le risque d’hyperkaliémie, mais l’analyse des données s’est avérée statistiquement non significative. Enfin, on remarque que les patients qui ont présenté une IRA avaient un DFGe initial ajusté plus bas et étaient plus âgés. Ils avaient également tendance à prendre de faibles doses d’IECA ou d’ARA et de BB au préalable.
Par ailleurs, l’évaluation de l’ajustement de la thérapie cardiovasculaire autre que le sacubitril/valsartan (furosémide, ARM, BB) a été effectuée. En raison de l’effet natriurétique du sacubitril/valsartan, on s’attendait à observer une diminution de la dose de furosémide et, possiblement, bien que non souhaitable, d’ARM. À la lumière de l’analyse des données, 72 patients (31,9 %) sur 226 et 31 patients (16,2 %) sur 191 ont eu une diminution de la dose de furosémide et d’ARM, respectivement. Parmi les patients qui ont expérimenté une diminution de la dose de furosémide, 33 (45,8 %) ont atteint la dose cible de sacubitril/valsartan. Il est à noter que l’évolution de la maladie joue un rôle important dans l’ajustement de la thérapie cardiovasculaire. À notre connaissance, aucune étude, à l’heure actuelle, n’a évalué l’impact de l’ajustement de la thérapie cardiovasculaire sur l’atteinte de la dose cible de sacubitril/valsartan.
Le nombre d’hospitalisations et de décès a également été évalué. On observe que plus du cinquième des patients a eu au moins une hospitalisation pour diverses raisons entre le moment de l’introduction du sacubitril/valsartan et la fin de l’étude. L’admission pour une décompensation d’insuffisance cardiaque représentait 22 % des hospitalisations, ce qui est supérieur aux résultats obtenus dans l’étude PARADIGM-HF (12,8 %)8. L’écart entre ces résultats pourrait en partie s’expliquer par la définition utilisée. En effet, dans la présente étude, quelques patients ont eu plusieurs épisodes d’hospitalisation pour insuffisance cardiaque décompensée, alors que, dans l’étude PARADIGM-HF, seule la première hospitalisation pour insuffisance cardiaque décompensée était comptabilisée. Il est à noter que le nombre d’hospitalisations pourrait aussi être sous-estimé dans notre étude, car certains patients ont pu être hospitalisés dans des établissements de santé autres que l’IUCPQ-UL et les séjours hospitaliers n’auraient donc pas été comptabilisés. Par ailleurs, cinq patients (1,8 %) sont décédés durant l’étude et tous les décès étaient reliés à une décompensation d’insuffisance cardiaque. Ces résultats sont inférieurs à ceux obtenus dans l’étude PARADIGM-HF, où 13,3 % des patients sont décédés de cause cardiovasculaire8. Notons toutefois que le suivi de l’étude PARADIGM-HF s’est échelonné sur près de trois ans, alors que la présente étude a évalué, rétrospectivement, les patients sur une période maximale d’environ un an et demi.
La principale force de cette étude est la généralisation des données à la population canadienne. En effet, les résultats obtenus sont applicables à l’ensemble des patients atteints d’insuffisance cardiaque avec FEVG abaissée, suivis dans les différents hôpitaux du Québec et du Canada. De plus, bien que toutes les caractéristiques pouvant influer sur l’atteinte de la dose cible de sacubitril/valsartan ne soient pas encore connues, plusieurs informations pertinentes ont été colligées, ce qui permet de dresser un portrait plus fidèle de la réalité des patients utilisant le sacubitril/valsartan dans la clinique d’insuffisance cardiaque de l’IUCPQ-UL. Comme il n’existe que très peu d’informations sur l’utilisation de cette nouvelle thérapie auprès de la population canadienne, l’étude favorise ainsi le partage de notre expérience clinique avec différents professionnels de la santé engagés auprès des patients atteints d’insuffisance cardiaque10.
Cette étude comporte cependant quelques limites. De par la nature rétrospective de la collecte de données, la validité interne des résultats obtenus a pu être influencée par un biais d’information. En effet, quoique la majorité des informations ait été présente dans les différents logiciels consultés, quelques données étaient manquantes ou imprécises. À titre d’exemple, il n’était pas toujours mentionné, de façon précise, la raison de la diminution ou de la cessation du sacubitril/valsartan, de même que la raison pour laquelle le médicament a été instauré chez des patients en classe fonctionnelle NYHA I ou qui ne prenaient pas déjà un IECA ou un ARA depuis au moins quatre semaines. Quelques données ont aussi été interprétées à partir des écrits des pharmaciens et des cardiologues, ce qui a pu diminuer la précision des résultats de l’étude. Aussi, étant donné que les patients suivis à la clinique d’insuffisance cardiaque de l’IUCPQ-UL viennent de différentes régions du Québec, certains tests de laboratoire effectués dans d’autres centres hospitaliers n’ont peut-être pas été consignés dans les logiciels et bases de données consultés, ce qui a pu contribuer à sous-estimer l’incidence des effets indésirables. Par ailleurs, comme les hospitalisations survenues dans des établissements de santé autres que l’IUCPQ-UL n’ont pas été comptabilisées, l’incidence des hospitalisations rapportées dans la présente étude, tel qu’expliqué précédemment, a pu elle aussi être sous-estimée. Enfin, il est à noter qu’en cours de route les effectifs en place ainsi que le temps alloué à l’ajustement téléphonique des médicaments ont été réduits, ce qui a pu nuire au taux d’atteinte de la dose cible de sacubitril/valsartan.
Cette étude a permis d’accroître le niveau de connaissances sur le profil d’utilisation et l’innocuité du sacubitril/valsartan dans un contexte de pratique de la cardiologie au quotidien en ce qui a trait à l’atteinte des doses cibles, à la survenue des effets indésirables et à l’ajustement de la médication cardiovasculaire autre que le sacubitril/valsartan. Bien que seulement 38 % des patients aient atteint la dose cible de sacubitril/valsartan à la fin de l’étude, la durée de la titration du sacubitril/valsartan est un élément important à considérer dans l’interprétation des résultats. De plus, à la lumière des résultats obtenus, l’atteinte de la dose cible de sacubitril/valsartan semble être influencée par l’âge, la fonction rénale ainsi que par la prise initiale d’un BCC. Également, les symptômes d’hypotension ont été le principal effet indésirable empêchant la titration du sacubitril/valsartan, survenant chez environ un patient sur cinq dans notre étude. Tel qu’observé, une pression artérielle initiale basse semble prédire la survenue de cet effet secondaire. Malgré tout, le faible taux de cessation du sacubitril/valsartan démontre que cette thérapie est bien tolérée et sécuritaire. Ainsi, d’autres études de plus grande envergure seront nécessaires afin de répondre à cette question.
Les auteurs tiennent à remercier les cardiologues et les pharmaciens de la clinique d’insuffisance cardiaque de l’IUCPQ - UL ainsi que Monsieur Serge Simard, biostatisticien au centre de recherche de l’IUCPQ – UL pour leur précieuse collaboration tout au long de la réalisation du projet. Une autorisation écrite a été obtenue de cette personne.
Aucun financement avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Julie Méthot est rédactrice adjointe de Pharmactuel . Les auteurs n’ont déclaré aucun autre conflit d’intérêts en relation avec le présent article.
1. Fondation des maladies du cœur et de l’AVC. Le fardeau de l’insuffisance cardiaque. Cœur et avc (2016). [en ligne] https://www.coeuretavc.ca/-/media/pdf-files/iavc/2017-heart-month/coeuretavc-bulletindesante-2016.ashx?la=fr-ca&hash=C4DC90B70F65C23BA5572F3137B5D420D415BB7C (site visité le 20 mars 2021).
2. Institut canadien d’information sur la santé. Séjours hospitaliers au Canada. ICIS (2020). [en ligne] https://www.cihi.ca/fr/sejours-hospitaliers-au-canada (site visité le 20 mars 2021).
3. Cook C, Cole G, Asaria P, Jabbour R, Francis DP. The annual global economic burden of heart failure. Int J Cardiol 2014;15;171:368–76.
4. King JB, Bress AP, Reese AD, Munger MA. Neprilysin inhibition in heart failure with reduced ejection fraction: a clinical review. Pharmacotherapy 2015;35:823–37.
5. Buggey J, Mentz RJ, DeVore AD, Velazquez EJ. Angiotensin receptor neprilysin inhibition in heart failure: mechanistic action and clinical impact. J Card Fail 2015;21:741–50.
6. Pham AQ, Patel Y, Gallagher B. LCZ696 (angiotensin-neprilysin inhibition): the new kid on the heart failure block? J Pharm Pract 2015; 28:137–45.
7. Vachon A, Marchand LE. Le sacubitril/valsartan (Entresto). Québec Pharmacie 2016;63:1–13.
8. McMurray JJ, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014;371:993–1004.
9. Senni M, McMurray JJ, Wachter R, McIntyre HF, Reyes A, Majercak I et al. Initiating sacubitril/valsartan (LCZ696) in heart failure: results of TITRATION, a double-blind, randomized comparison of two uptitration regimens. Eur J Heart Fail 2016;18:1193–202.

10. Barry AR, Lee C. Pharmacist- or nurse practitioner-led assessment and titration of sacubitril/valsartan in a heart failure clinic: a cohort study. Can J Hosp Pharm 2020;73:186–92.

11. Vardeny O, Claggett B, Packer M, Zile MR, Rouleau J, Swedberg K et al. Efficacy of sacubitril/valsartan vs. enalapril at lower than target doses in heart failure with reduced ejection fraction: the PARADIGM-HF trial. Eur J Heart Fail 2016;18:1228–34.

PHARMACTUEL, Vol. 54, No. 4, 2021