Camille
Thibault
,
Pharm.D., M.Sc.
1,2,3,
Michel
Germain
,
Pharm.D., M.Sc.
4,5,
Isabelle
Toupin
,
B.Pharm., M.Sc.
4,5,
Julie
Méthot
,
B.Pharm., M.Sc., Ph.D., FOPQ
4,6
Reçu le 11 février 2021: Accepté après révision par les pairs le 30 avril 2021
Résumé
Objectif : Déterminer le taux de désensibilisation à l’acide acétylsalicylique s’étant soldé par un succès chez les patients qui ont reçu un des différents protocoles de désensibilisation à l’acide acétylsalicylique à l’Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval.
Méthode : Une étude descriptive longitudinale avec une collecte de données rétrospective incluant les patients ayant reçu un des protocoles de désensibilisation à l’acide acétylsalicylique à l’Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval entre le 1 er janvier 2007 et le 6 juin 2020 a été réalisée.
Résultats : L’étude a inclus 105 protocoles de désensibilisation à l’acide acétylsalicylique. Le taux de succès a été de 92,4 %, tous protocoles confondus. Il n’y a eu aucune différence statistiquement significative entre le taux de succès des différents protocoles utilisés ( p = 0,53). Parmi les 105 protocoles effectués, 19 patients ont présenté une réaction d’hypersensibilité; 12 ont vu leur protocole de désensibilisation modifié. Au total, six patients ont échoué au protocole de désensibilisation. L’étude n’a pas permis de déterminer si le respect des recommandations avant le début du protocole de désensibilisation a eu un impact sur l’issue de la désensibilisation.
Conclusion : Les protocoles de désensibilisation utilisés à l’Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval ont un fort taux de succès. Une étude incluant un plus grand nombre de patients sera nécessaire pour déterminer s’il y a une différence statistiquement significative entre l’ancien et le nouveau protocole.
Mots clés : Acide acétylsalicylique, allergie, désensibilisation, hypersensibilité
Abstract
Objective : To determine the rate of successful acetylsalicylic acid desensitization in patients who received one of the different acetylsalicylic acid desensitization protocols at the Institut de cardiologie et de pneumologie de Québec - Université Laval.
Method : We conducted a longitudinal, descriptive study with retrospective data collection involving patients who had received one of the acetylsalicylic acid desensitization protocols at the Institut de cardiologie et de pneumologie de Québec - Université Laval between January 1, 2007 and June 6, 2020.
Results : The study included 105 acetylsalicylic acid desensitization protocols. The all-protocol success rate was 92.4%. There was no statistically significant difference in the success rate between the different protocols used ( p = 0.53). For these 105 protocols, 19 patients experienced a hypersensitivity reaction, and 12 had their desensitization protocol modified. In all, six patients failed the desensitization protocol. The study was unable to determine whether adherence to the recommendations before initiating the desensitization protocol had an impact on the outcome of the desensitization.
Conclusion : The desensitization protocols used at the Institut de cardiologie et de pneumologie de Québec – Université Laval have a high success rate. A study with a larger number of patients will be needed to determine if there is a statistically significant difference between the old and the new protocol.
Keywords : Acetylsalicylic acid, allergy, desensitization, hypersensitivity
L’acide acétylsalicylique (AAS) est un antiplaquettaire fréquemment utilisé en maladie cardiovasculaire1. Par exemple, il est utilisé en association avec un inhibiteur du récepteur P2Y12 à la suite d’une intervention coronarienne percutanée (ICP) ou chez un patient ayant subi un syndrome coronarien aigu (SCA). Cette association est la pierre angulaire du traitement antiplaquettaire2. Une allergie à l’AAS est problématique étant donné que la prise d’AAS est essentielle à la suite d’une ICP. L’incidence réelle de l’hypersensibilité à l’AAS se situe autour de 1,5 à 2,6 %3,4. Les symptômes typiques généralement présents chez les patients allergiques à l’AAS sont l’angiœdème à 82 %, les rashs à 10 % et l’asthme à 10 %3,5. Les symptômes présentés permettront de mieux distinguer si la réaction est plutôt une intolérance ou bien une réelle réaction d’hypersensibilité3. Un protocole de désensibilisation à l’AAS peut cependant être tenté lorsque son administration est essentielle.
En 2007, le premier protocole de désensibilisation de l’Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval (IUCPQ-UL) a été réalisé (annexe). Ce protocole de désensibilisation à l’AAS, lorsqu’il se solde par un succès, permet d’administrer aux patients allergiques une petite dose quotidienne d’AAS à raison de 80 mg une fois par jour6. Le protocole était basé sur les conclusions de l’étude de Page et Schroder, publiée en 2007, qui combinait les points forts de deux autres études, soit l’étude de Wong et coll. et l’étude de Silberman et coll7–9. À ce moment, il existait peu de données probantes et d’expériences cliniques publiées sur la désensibilisation à l’AAS. Au début de 2019, les pharmaciens en cardiologie de l’Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval (IUCPQ-UL) ont procédé à une revue de la littérature scientifique pour réévaluer leur protocole de désensibilisation. L’objectif était également de rédiger une ordonnance individuelle standardisée pour mieux en encadrer la gestion et la prescription par les médecins. Deux protocoles de désensibilisation à l’AAS ont ainsi pu être créés; un protocole court et un protocole long. Le choix du protocole reposait sur la gravité de la réaction allergique antérieure (annexe). La désensibilisation concernant la maladie respiratoire exacerbée par l’AAS a été exclue du protocole de l’IUCPQ-UL compte tenu de ses enjeux différents. Le protocole de désensibilisation utilisé en cardiologie n’était donc pas approprié. Généralement, le protocole de Scripps est utilisé pour les désensibilisations à l’AAS chez les patients ayant une maladie respiratoire exacerbée par l’AAS avec une dose pouvant atteindre 325 mg une fois par jour12. Il doit y avoir un prétraitement et il est fortement suggéré que la désensibilisation soit supervisée par un allergologue, professionnel de la santé non disponible à l’IUCPQ-UL10,12.
La principale problématique est que la documentation scientifique actuelle sur le sujet présente des protocoles de désensibilisation très différents les uns des autres. Certaines études, comme celle de Chopra et coll., présentent certaines caractéristiques inhérentes à un protocole qui augmenteraient ses chances de succès, par exemple le nombre de paliers de doses d’AAS administrées12. Cependant, il ne ressort aucune recommandation claire de cette littérature. Également, il n’existe aucune revue de littérature permettant de conclure à un plus grand taux de succès pour le protocole de désensibilisation à la suite de la modification de ce dernier. Cette étude constituerait donc les premiers pas vers une telle comparaison. De plus, certaines données en lien avec les protocoles de désensibilisation à l’AAS demeurent à préciser dans cette documentation : le lieu optimal pour réaliser la désensibilisation à l’AAS, la gestion des médicaments préprotocole, la surveillance optimale pendant et après la désensibilisation, le délai pour la perte de désensibilisation lorsque l’AAS n’est pas pris pendant quelques jours, le risque d’allergie croisée avec les autres anti-inflammatoires non stéroïdiens (AINS) et la durée idéale du protocole.
L’objectif général de cette étude est d’obtenir un portrait de l’expérience de désensibilisation à l’AAS à l’IUCPQ-UL et de la partager pour contribuer à la documentation sur ce sujet. L’objectif primaire découlant de l’objectif général est de déterminer le taux de désensibilisation à l’AAS s’étant soldé par un succès chez les patients qui ont bénéficié d’un protocole de désensibilisation à l’AAS à l’Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval. Divers objectifs secondaires découlent également de cette étude, soit décrire les réactions allergiques des patients ayant été désensibilisés; les recommandations prédésensibilisation lorsqu’elles n’ont pas été respectées; les cas où le protocole a dû être modifié pour arriver à réaliser la désensibilisation avec succès; les cas où la désensibilisation a échoué; la gestion des réactions allergiques lors des échecs à la désensibilisation; les conduites thérapeutiques appliquées après un échec à la désensibilisation ainsi que les interventions réalisées avec le nouveau protocole de désensibilisation issu de la revue de la littérature scientifique de 2019.
Cette étude est de nature descriptive longitudinale avec une collecte de données rétrospective. La population cible comprenait tous les patients allergiques à l’AAS. La population à l’étude regroupait tous les patients allergiques à l’AAS bénéficiant d’un protocole de désensibilisation à l’AAS dans un centre hospitalier. L’échantillon, quant à lui, incluait les patients ayant bénéficié d’un protocole de désensibilisation à l’AAS à l’IUCPQ-UL entre le 1er janvier 2007 et le 6 juin 2020. Il n’y avait aucun critère d’exclusion. Les maladies respiratoires exacerbées par l’AAS n’étaient pas un critère d’exclusion de l’étude, puisqu’elles ne permettaient pas d’exclure des patients du protocole de désensibilisation à l’AAS de 2007. Cela dit, les protocoles de désensibilisation n’ont pas été conçus pour désensibiliser les patients atteints de ce type de maladie.
Les patients ont été recrutés à l’aide du logiciel GesphaRxMD. Les patients ayant l’entrée « asa suspension 2 mg/mL magistrale-désensibilisation » dans leur dossier GesphaRxMD ont été sélectionnés pour retrouver ceux d’entre eux qui avaient bénéficié d’un protocole de désensibilisation à l’AAS. Chaque dossier identifié par GesphaRxMD a ensuite été analysé au moyen du Dossier patient électronique (DPE). Les informations collectées ont été obtenues grâce à différents documents, tels que les notes d’évolution médicale, les notes de suivis infirmiers, la feuille d’administration des médicaments et les prescriptions médicales. Le Directeur des services professionnels a donné son accord pour la consultation des dossiers et le projet a été approuvé par le comité d’éthique de l’IUCPQ-UL.
Les informations désirées ont été colligées dans un formulaire standardisé. Ce formulaire a été préalablement testé sur trois dossiers par trois personnes différentes : la résidente ainsi que ses deux responsables hospitaliers. Plusieurs informations ont été colligées pour chaque patient, notamment l’indication d’administration de l’AAS, l’agent causal de la réaction d’hypersensibilité antérieure, les symptômes de la réaction d’hypersensibilité antérieure, l’arrêt de certains médicaments préprotocole de désensibilisation, le résultat de la désensibilisation, le site de réalisation du protocole de désensibilisation, le type de protocole de désensibilisation utilisé, la présence d’une réaction d’hypersensibilité pendant le protocole, la nature de la réaction d’hypersensibilité pendant le protocole et les gestes permettant de gérer la réaction d’hypersensibilité pendant le protocole.
L’étudiante a effectué les analyses des informations obtenues à l’aide du logiciel SPSSMD. Des statistiques descriptives ont été réalisées à l’aide de tableaux de fréquences pour les variables nominales. Ces résultats sont exprimés en pourcentage. Une moyenne avec écart-type a été calculée pour les taux de succès des protocoles de désensibilisation. Le test d’ANOVA a été utilisé pour comparer le taux de succès entre les différents protocoles de désensibilisation à l’AAS. Une valeur de p inférieure à 0,05 était jugée statistiquement significative.
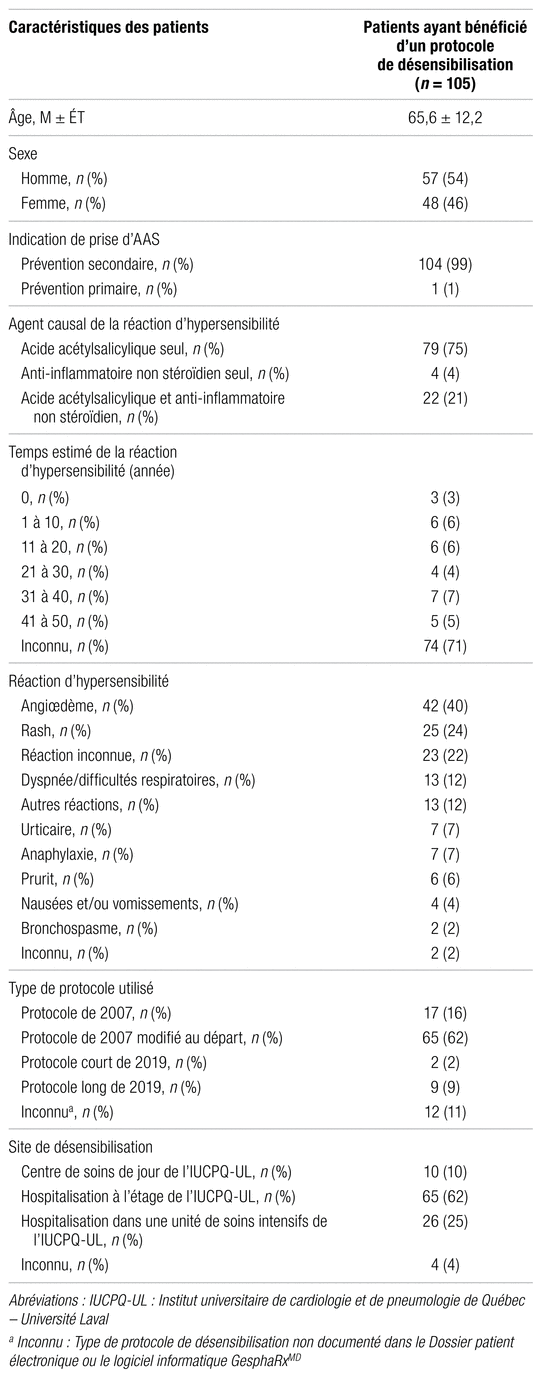
Initialement, 108 épisodes contenant des protocoles de désensibilisation ont été recensés au moyen de la recherche GesphaRxMD. Au total, 105 protocoles de désensibilisation ont été retenus, puisque trois patients n’ont finalement reçu aucun protocole de désensibilisation. Parmi ces 105 épisodes, 103 patients ont été recensés, puisque deux patients ont reçu deux protocoles de désensibilisation pendant des hospitalisations différentes. En effet, l’AAS avait été suspendu, d’où la nécessité de répéter le protocole de désensibilisation. Les caractéristiques des patients ayant bénéficié d’un protocole de désensibilisation à l’AAS sont présentées dans le tableau I.
Tableau I
Caractéristiques des patients ayant bénéficié d’un protocole de désensibilisation à l’acide acétylsalicylique à l’Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval

En moyenne, les patients ayant reçu un protocole de désensibilisation à l’AAS à l’IUCPQ-UL avaient 66 ans (65,6 ± 12,2). Le temps estimé de la réaction d’hypersensibilité antérieure était inconnu pour 70,5 % d’entre eux. L’agent causal de la réaction d’hypersensibilité antérieure était l’AAS dans 96,2 % des cas. Dans 24,8 % des cas, le patient était allergique à un ou plusieurs AINS, de façon isolée ou concomitante à l’AAS. Les réactions d’hypersensibilité antérieures se présentaient majoritairement par de l’angiœdème (40 %) et/ou un rash (23,8 %). Dans 21,9 % des cas, la réaction d’hypersensibilité antérieure était inconnue. Les patients pouvaient avoir bénéficié d’un des quatre types de protocole de désensibilisation suivants : le protocole de 2007, le protocole de 2007 modifié au départ, le protocole court de 2019 et le protocole long de 2019. Le protocole de 2007 mentionnait d’atteindre une dose maximale de 325 mg. Certains médecins ou pharmaciens spécifiaient d’emblée d’atteindre une dose maximale différente que celle stipulée dans le protocole de 2007, par exemple 81 mg. Ces protocoles entraient donc dans la catégorie « protocole de 2007 modifié au départ ».
Le taux de succès du protocole de désensibilisation de l’IUCPQ-UL, tous protocoles confondus, a été de 92,4 %. En divisant le taux de réussite selon le protocole utilisé, on établit que le protocole de désensibilisation de 2007 a été un succès dans 94,1 % des cas. Le protocole de 2007 modifié à l’origine a été une réussite pour 92,3 % des patients. Concernant le protocole de 2019, que ce soit le protocole court ou le protocole long, 100 % des patients ont réussi à le terminer. Il n’y a pas de différence statistiquement significative pour le taux de succès entre les différents protocoles ( p = 0,53). Au total, il y a donc eu 97 succès, six échecs et deux résultats inconnus pour le protocole de désensibilisation.
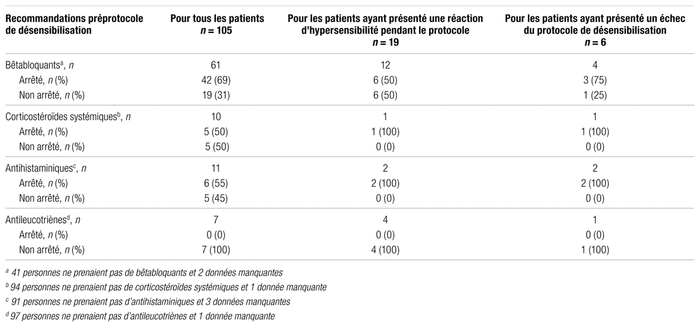
Le respect des recommandations concernant l’arrêt de certains médicaments préprotocole de désensibilisation à l’AAS est présenté dans le tableau III. La principale inquiétude quant au fait que ces médicaments ne sont pas cessés en préprotocole de désensibilisation, comme les corticostéroïdes, est qu’ils peuvent retarder l’apparition d’une réaction d’hypersensibilité ou même tout simplement camoufler une réaction d’hypersensibilité. Les bêtabloquants non cessés en préprotocole de désensibilisation peuvent rendre plus difficile la gestion des symptômes de la réaction d’hypersensibilité par l’épinéphrine. Les résultats obtenus ne semblent toutefois pas corroborer cette crainte. Parmi les patients recevant des bêtabloquants, 68,9 % les ont arrêtés avant le protocole de désensibilisation. Parmi les patients recevant des corticostéroïdes systémiques, 50 % les ont cessés avant le protocole. Le seul patient prenant des corticostéroïdes qui ait échoué au protocole ne les avait pas suspendus au préalable. Parmi les patients recevant des antihistaminiques, 54,5 % les ont arrêtés avant le début du protocole. Parmi les six patients ayant échoué au protocole de désensibilisation, deux prenaient des antihistaminiques et ils les ont cessés avant le protocole. Parmi les patients recevant des antileucotriènes, aucun ne les a cessés avant le début du protocole; un seul patient recevant un antileucotriène a échoué au protocole de désensibilisation.
Tableau II
Taux de succès du protocole de désensibilisation à l’acide acétylsalicylique de l’Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval
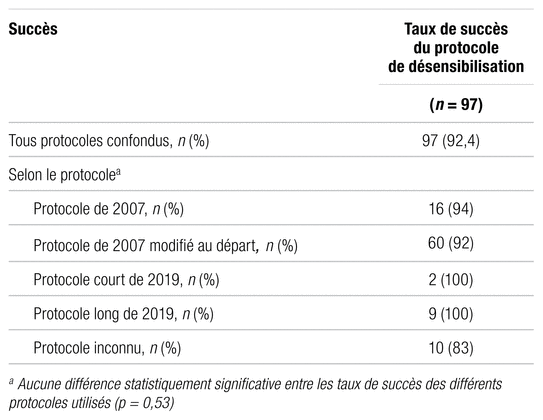
Tableau III
Respect des recommandations préprotocole de désensibilisation à l’acide acétylsalicylique à l’Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval
Le tableau IV présente les cas de patients ayant présenté une réaction d’hypersensibilité au protocole de désensibilisation à l’AAS. Parmi les 19 patients ayant présenté une réaction d’hypersensibilité, trois ont reçu le protocole de 2007; 11, le protocole de 2007 modifié au départ; et trois, le protocole long de 2019; deux données sont manquantes. Parmi ces 19 patients, 14 avaient une allergie seule à l’AAS, quatre, une allergie à l’AAS et aux AINS et un, une allergie seule aux AINS. Chez sept patients, la réaction d’hypersensibilité présentée durant le protocole de désensibilisation a été similaire à la réaction d’hypersensibilité antérieure, voire la même. Parmi les 19 patients ayant présenté une réaction d’hypersensibilité, sept ont pu quitter l’hôpital avec de l’AAS sans que leur état nécessite une modification de leur protocole. Chez les 12 autres patients, le protocole a été modifié pour qu’il soit un succès. Parmi ces 12 patients, six ont réussi la désensibilisation et six ont échoué au protocole de désensibilisation.
Tableau IV
Description des cas ayant présenté une réaction d’hypersensibilité au protocole de désensibilisation à l’acide acétylsalicylique à l’Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval
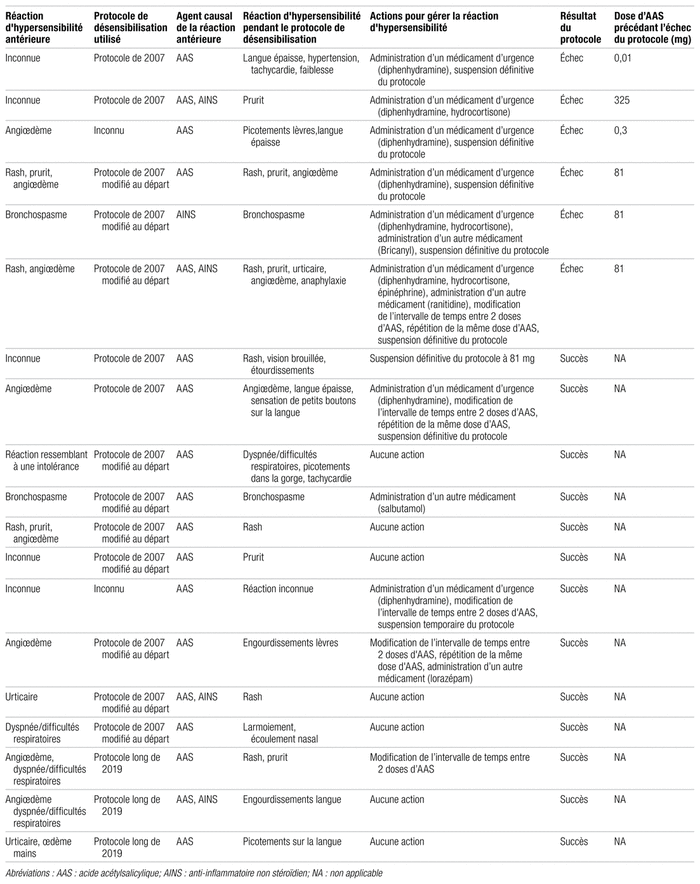
Parmi les 19 patients ayant présenté une réaction d’hypersensibilité au protocole de désensibilisation à l’AAS, six cas se sont soldés par un échec. Malgré les modifications apportées au protocole, la désensibilisation a échoué pour ces six patients. Un ou plusieurs médicaments d’urgence ont dû être administrés chez ces six patients. Il y a eu répétition de la même dose d’AAS et modification de l’intervalle de temps entre deux doses chez un seul patient. Parmi ces six patients, trois (50 %) ont présenté une réaction d’hypersensibilité après avoir reçu la dose de 81 mg.
Onze patients ont reçu le protocole de désensibilisation de 2019. Tous les patients ont réussi le protocole de désensibilisation, protocole court ou protocole long. Trois patients ont toutefois présenté une réaction d’hypersensibilité pendant la désensibilisation. Un seul d’entre eux a vu son protocole modifié; l’intervalle de temps entre la prise de deux doses du protocole de désensibilisation a été modifié. Ce patient a reçu le protocole long de 2019. Aucune action n’a été entreprise pour les deux autres patients et le protocole a pu être mené à terme tel que prévu. Les 11 patients ont tous quitté l’hôpital avec de l’AAS.
Tous les patients ayant présenté un échec de désensibilisation à l’AAS se sont vus prescrire un inhibiteur du P2Y12 seul puisqu’ils ne pouvaient pas recevoir de l’AAS. Les options quant aux inhibiteurs du P2Y12 sont le clopidogrel 75 mg une fois par jour, le ticagrélor 90 mg deux fois par jour ou le prasugrel 10 mg une fois par jour. Aucun patient ne s’est fait prescrire un inhibiteur du P2Y12 à dose non standard ou un anticoagulant en remplacement de l’AAS.
En 2007, lors de la création du protocole de désensibilisation à l’AAS, les pharmaciens de l’IUCPQ-UL se sont principalement basés sur l’étude de Page et Schroeder7. Cette étude comparait l’étude de Wong et coll. 2000 à celle de Silberman et coll. 2005. L’étude de Wong a obtenu un taux de succès de 82 %; elle comprenait 11 patients et un schéma de doses variables débutant par une dose de départ de 0,1 mg à 10 mg8. Le temps d’administration était de 10 à 30 minutes entre les doses. De son côté, l’étude de Silberman et coll. 2005 a obtenu un taux de succès de 87,5 %; elle incluait 16 patients, et le régime posologique consistait à débuter par une dose de 5 mg. La dose finale de 75 mg était atteinte avec des paliers de doses administrées toutes les 30 minutes9. Le peu de données disponibles à ce moment-là rendait ces résultats intéressants pour la construction du premier protocole de l’IUCPQ-UL en 2007. Pour la mise à jour de leur protocole de désensibilisation en 2019, les pharmaciens de l’IUCPQ-UL se sont basés sur des études plus récentes, telles que celle de Rossini et coll. 2017. Cette étude a réussi à obtenir un taux de succès de 95,4 % avec son protocole. Celui-ci débutait par une dose initiale de 1 mg d’AAS et atteignait la dose de 100 mg en six paliers de doses, sur une période de 5,5 heures10. Pour sa part, la méta-analyse de Bianco et coll. 2016 a plutôt permis de comparer différents protocoles de désensibilisation à l’AAS. Bien que les protocoles inclus dans l’étude aient été assez hétérogènes, ils ont eu un taux de succès assez élevé. L’étude de Bianco et coll. 2016 mentionne qu’il semble y avoir un lien entre la vitesse d’administration du protocole et le risque de réaction d’hypersensibilité. Enfin, la méta-analyse de Verdoia et coll. 2016 a comparé l’efficacité de 14 protocoles différents. La médiane du taux de succès calculée était de 96,7 %. Cependant, aucune autre conclusion n’est ressortie quant aux facteurs pouvant influer sur la différence d’efficacité entre les protocoles11. En plus de ces résultats, pour réaliser le protocole de l’IUCPQ-UL, certains autres éléments ont dû être considérés. Le temps de réalisation total du protocole, incluant la surveillance postprotocole de désensibilisation, était un élément variant énormément dans la littérature scientifique. Par exemple, le protocole de Rossini et coll. 2017 durait 9,5 heures. Une certaine contrainte quant à la durée du protocole existait donc, puisqu’une infirmière devait être entièrement dédiée au protocole de désensibilisation du patient. Pour un patient alité aux soins intensifs, la surveillance n’était pas un problème, toutefois, pour un patient se retrouvant à l’étage ou au centre de soins de jour, un protocole durant plus longtemps qu’un quart de travail devenait difficile à réaliser. De plus, les doses utilisées constituaient une contrainte pour éviter les erreurs dans les soins infirmiers. Certains protocoles utilisaient des doses telles que 0,1 mg, 0,3 mg, 1 mg et 3 mg, ce qui pouvait engendrer des erreurs lors de l’administration de la solution d’AAS. C’est avec toutes ces notions en tête que le protocole court et le protocole long de 2019 ont été créés. L’objectif d’avoir un protocole court et un protocole long était de les utiliser selon la gravité de la réaction d’hypersensibilité antérieure; les données probantes tendaient à démontrer qu’un protocole plus long était associé à un meilleur taux de réussite. Ainsi, un protocole plus court pouvait être utilisé pour les réactions plus légères ou de type intolérance à l’AAS, alors que le protocole long permettait d’optimiser les chances de succès pour les réactions plus importantes. À la suite de la publication du nouveau protocole de l’IUCPQ-UL, une méta-analyse plus récente, publiée par Chopra et coll. en 2019, a permis de vérifier s’il y avait une différence d’efficacité entre les protocoles court et long. Chopra et coll. 2019 comparait les études contenant plus de six paliers d’administration de doses, comparativement à celles en contenant moins de six inclusivement. L’étude a réussi à démontrer que les protocoles contenant plus de six paliers étaient plus efficaces que ceux en contenant moins de six inclusivement (99,2 % vs 95,4 %, p = 0,0007). Cette même étude a réussi à démontrer qu’il n’y avait pas de différence statistiquement significative dans le taux de réussite entre les protocoles durant moins de deux heures et ceux durant plus de deux heures13. Le protocole de 2007 de l’IUCPQ-UL contenait huit paliers, alors que le protocole court et long de 2019 n’en contenait que six. Les protocoles court et long de 2019 se retrouvent donc à la limite des deux groupes; un taux de succès global de 92,4 % a tout de même été obtenu et se rapproche de celui obtenu dans l’étude de Chopra. Aucune différence statistiquement significative n’a été démontrée entre les taux de succès en fonction du protocole utilisé. En se basant sur les résultats de Chopra, une différence aurait été attendue entre le protocole de 2007 et le protocole de 2019, étant donné que le protocole de 2007 appartient au groupe « plus de six paliers », alors que les protocoles court et long de 2019 appartiennent au groupe « moins de six paliers inclusivement ». Cependant, en termes de durée du protocole, celui de 2007 dure 1 h 45, alors que les protocoles court et long de 2019 durent respectivement 2 h 00 et 3 h 30. Le fait qu’aucune différence statistiquement significative n’a été démontrée entre les protocoles semble corroborer les données de la littérature scientifique sur la durée de réalisation du protocole. Cependant, puisqu’il n’y avait que 11 patients ayant reçu les protocoles de 2019 comparativement à 94 pour les protocoles de 2007, il est impossible de dire si le nouveau protocole de désensibilisation est réellement plus ou moins efficace que celui de 2007. Néanmoins, il semble y avoir une légère tendance en faveur d’une plus grande efficacité du nouveau protocole par rapport à l’ancien, vu le taux de réussite de 100 % pour le protocole court et le protocole long. Le portrait obtenu à partir de l’expérience de l’IUCPQ-UL semble donc montrer, sous toute réserve, que le nouveau protocole est tout aussi efficace et sécuritaire que le précédent.
Puisqu’il n’y a pas eu suffisamment de patients à avoir bénéficié du nouveau protocole de désensibilisation, il n’a pas été possible de réaliser certaines comparaisons entre toutes les données collectées. L’étude n’a pas permis de déterminer si le respect des recommandations préprotocole de désensibilisation a eu un impact sur l’issue de la désensibilisation. En effet, les médicaments non cessés avant le protocole de désensibilisation n’ont pas été reliés à des évènements particuliers, à une réaction retardée avec les corticostéroïdes systémiques, ou encore à une difficulté dans la gestion de la réaction d’hypersensibilité avec les bêtabloquants. Tous les patients ayant échoué au protocole de désensibilisation et devant quitter le lieu de traitement avec un antiplaquettaire ont reçu des inhibiteurs du P2Y12. Fait intéressant, car d’autres solutions de rechange auraient pu être envisagées par l’équipe traitante. Par exemple, pendant un certain temps, certains cardiologues de l’IUCPQ-UL ont favorisé le clopidogrel 150 mg une fois par jour. L’étude de Bianco et coll. 2016 a même réalisé un sondage sur les différentes pratiques en cas d’échec du protocole de désensibilisation. Les résultats démontraient que les pratiques étaient très diversifiées, utilisant des anticoagulants, des anti-inflammatoires non stéroïdiens ou même des oméga-35. Comme il y a eu très peu de cas d’échec aux différents protocoles et que les échecs étaient assez différents les uns des autres, il est difficile de savoir si certaines caractéristiques sont prépondérantes dans cette population et lesquelles pourraient permettre de prédire un échec du protocole de désensibilisation à l’AAS. Les résultats obtenus ne permettent toutefois pas encore de répondre aux questions restantes concernant le protocole de désensibilisation : le lieu optimal pour le réaliser, la gestion des médicaments préprotocole, la surveillance optimale pendant et après le protocole, le risque d’allergie croisée avec les AINS ainsi que la durée idéale du protocole. Il faudra une cohorte de plus grande envergure pour réussir à répondre à ces questionnements.
Plusieurs limites ont pu ressortir dans ce projet. Tout d’abord, le petit nombre de patients inclus dans l’étude ne permet pas d’émettre des conclusions sur les différences entre l’ancien et le nouveau protocole. De ce fait, il n’a pas été possible de réaliser des analyses statistiques pour toutes les informations collectées, ce qui aurait pu augmenter la puissance de l’étude. Ensuite, tous les dossiers-patients n’étaient pas documentés de manière égale par les pharmaciens et les médecins. En effet, pour le protocole de 2007, puisqu’il n’y avait pas d’ordonnance individuelle standardisée, certaines informations pouvaient et étaient régulièrement manquantes dans le dossier. Par exemple, les informations reliées à la réaction d’hypersensibilité antérieure étaient souvent absentes. Certaines informations reliées au déroulement même du protocole de désensibilisation à l’AAS n’étaient pas toujours présentes. Ce manque d’informations a donc pu fausser les résultats actuels. Une autre des limites est qu’à la mémoire de certains pharmaciens de cardiologie à l’IUCPQ-UL certains protocoles de désensibilisation n’ont peut-être pas été informatisés dans le dossier GesphaRxMD. Cela est en lien avec la pratique différente qu’impliquait la présence constante du pharmacien au département d’hémodynamie, pratique révolue depuis. Certains patients ayant reçu un protocole de désensibilisation entre 2007 et 2020 n’ont donc peut-être pas été inclus.
Cette étude est le point de départ de l’élaboration d’un protocole de désensibilisation à l’AAS standardisé qui pourrait être partagé à l’échelle provinciale. L’expérience portant sur la désensibilisation à l’AAS dans les autres centres munis d’un laboratoire d’hémodynamie et qui réalisent activement des désensibilisations à l’AAS pourrait permettre d’optimiser le protocole existant. Un protocole harmonisé parmi les centres pourrait voir le jour et ainsi assurer une gestion plus efficace et sécuritaire de la désensibilisation à l’AAS au Québec. Les centres hospitaliers moins exposés à cette situation pourront donc avoir accès à un protocole de qualité.
Cette étude rétrospective a permis d’obtenir un portrait plus précis concernant les protocoles de désensibilisation utilisés à l’IUCPQ-UL de 2007 à 2020. Le taux de succès de 92,4 % du protocole de désensibilisation de l’IUCPQ-UL semble démontrer que les protocoles sont efficaces pour désensibiliser les patients. Toutefois, aucune différence statistiquement significative n’a été démontrée quant au taux de succès en fonction du protocole. Le fort taux de succès et le faible nombre d’échecs a, en contrepartie, limité la possibilité de déterminer les conditions médicales ou caractéristiques des patients prédisant un échec du protocole de désensibilisation. Une étude rétrospective de plus grande envergure sera nécessaire pour mieux refléter le taux de succès du protocole de désensibilisation de 2019.
Cet article comporte une annexe; elle est accessible sur le site de Pharmactuel (www.pharmactuel.com).
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Julie Méthot est rédactrice adjointe de Pharmactuel . Les auteurs n’ont déclaré aucun autre conflit d’intérêts en relation avec le présent article.
1. Micromedex Healthcare series. Monographie de l’aspirine. Thomson Micromedex, 1974–2020. [en ligne] https://www.micromedexsolutions.com (site visité le 22 septembre 2020).
2. Mehta SR, Bainey KR, Cantor WJ, Lordkipanidzé M, Marquis-Gravel G, Robinson SD et al. Canadian Cardiovascular Society/Canadian Association of Interventional Cardiology Focused update of the guidelines for the use of antiplatelet therapy. Can J Cardiol 2018;34:214–33.
3. Gnanenthiran SR, Yiannikas J, Lowe HC, Brieger D, Limaye S. Aspirin hypersensitivity in patients with coronary artery disease: linking pathophysiology to clinical practice. Am Heart J 2018;203:74–81.
4. Rossini R, Angiolillo DJ, Musumeci G, Scuri P, Invernizzi P, Bass TA et al. Aspirin desensitization in patients undergoing percutaneous coronary interventions with stent implantation. Am J Cardiol 2008;101:786–9.
5. Bianco M, Bernardi A, D’Ascenzo F, Cerrato E, Omede P, Montefusco A et al. Efficacy and safety of available protocols for aspirin hypersensitivity for patients undergoing percutaneous coronary intervention: a survey and systematic review. Circ Cardiovasc Interv 2016;9:e002896.
6. Leimgruber A. Allergo-immunologie : les réactions allergiques aux anti-inflammatoires non stéroïdiens. Rev Med Suisse 2008;100:100–3.
7. Page NA, Schrœder WS. Rapid desensitization protocols for patients with cardiovascular disease and aspirin hypersensitivity in an era of dual antiplatelet therapy. Ann Pharmacother 2007;41:61–7.
8. Wong JT, Nagy CS, Krinzman SJ, Maclean JA, Bloch KJ. Rapid oral challenge-desensitization for patients with aspirin-related urticaria-angioedema. J Allergy Clin Immunol 2000;105: 997–1001.
9. Silberman S, Neukirch-Stoop C, Steg PG. Rapid desensitization procedure for patients with aspirin hypersensitivity undergoing coronary stenting. Am J Cardiol 2005;95:509–10.
10. Rossini R, Iorio A, Pozzi R, Bianco M, Musumeci G, Leonardi S et al. Aspirin desensitization in patients with coronary artery disease: results of the multicenter ADAPTED registry (Aspirin desensitization in patients with coronary artery disease). Circ Cardiovasc Interv 2017;10: e004368.
11. Verdoia M, Barbieri L, Schaffer A, Nardin M, Suryapranata H, De Luca G et al. Acetylsalicylic acid desensitization in patients with coronary artery disease : a comprehensive overview of currently available protocols. Vascul Pharmacol 2016;80:43–9.
12. Szczeklik A, Stevenson DD. Aspirin-induced asthma: advances in pathogenesis and management. J Allergy Clin Immunol 1999;104:5–13.
13. Chopra AM, Díez-Villanueva P, Córdoba-Soriano JG, Lee JKT, Al-Ahmad M, Ferraris VA et al. Meta-analysis of acetylsalicylic acid desensitization in patients with acute coronary syndrome. Am J Cardiol 2019;124:14–9.
PHARMACTUEL, Vol. 54, No. 4, 2021