Insuline hebdomadaire pour le traitement du diabète de type 2 sans traitement préalable à l’insuline
Jessica Le Blanc, Pharm.D.1,2,3, Véronique Bilodeau, Pharm.D.1,4,5, Justine Huot, Pharm.D.1,4,6, Catherine Perreault, Pharm.D.1,4,7
1Candidate à la maîtrise en pharmacothérapie avancée au moment de la rédaction, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
2Résidente en pharmacie au moment de la rédaction, Centre intégré universitaire de santé et de services sociaux de l’Est-de-l’Île-de-Montréal, Hôpital Maisonneuve-Rosemont, Montréal (Québec) Canada;
3Pharmacienne, Centre intégré universitaire de santé et de services sociaux de l’Est-de-l’Île-de-Montréal, Hôpital Maisonneuve-Rosemont, Montréal (Québec) Canada;
4Résidente en pharmacie au moment de la rédaction, Centre intégré de santé et de services sociaux de la Montérégie-Centre, Hôpital Charles-Le Moyne, Longueuil (Québec) Canada;
5Pharmacienne, Centre intégré de santé et de services sociaux de la Montérégie-Est, Hôpital Pierre-Boucher, Longueuil (Québec) Canada;
6Pharmacienne, Centre intégré de santé et de services sociaux de la Montérégie-Centre, Hôpital Charles-Le Moyne, Longueuil (Québec) Canada;
7Pharmacienne, Centre intégré de santé et de services sociaux la Montérégie-Est, Hôpital Honoré-Mercier, Saint-Hyacinthe (Québec) Canada
Reçu le 19 avril 2021: Accepté après révision par les pairs le 22 septembre 2021
Titre : Once-weekly insulin for type 2 diabetes without previous insulin treatment. N Engl J Med 2020;383:2107-161.
Auteurs : Rosenstock J, Bajaj HS, Janez A, Silver R, Begtrup K, Hansen MV et coll.
Commanditaires: Cette étude a été financée par Novo Nordisk.
Cadre de l’étude : Le diabète, tous types confondus, est une maladie fréquente qui touche 880 000 Québécois2. Malgré les nombreux agents antidiabétiques sur le marché, l’évolution de la maladie entraîne chez plusieurs patients le recours éventuel à des injections d’insuline.
Selon les lignes directrices de pratique clinique 2020 de Diabète Canada, les injections d’insuline basale contre le diabète de type 2 sont recommandées, entre autres, aux patients chez qui les autres traitements antidiabétiques sont contre-indiqués ou ne suffisent pas à l’obtention d’une bonne maîtrise de la glycémie. Elles le sont aussi en cas de décompensation métabolique ou d’hyperglycémie symptomatique3. L’insuline basale n’est habituellement pas un traitement de première intention du diabète de type 2 pour plusieurs raisons, dont le risque accru d’hypoglycémie, la prise de poids probable, l’absence de bienfaits cardiovasculaires et le mode d’administration contraignant (injection sous-cutanée quotidienne).
La fréquence d’administration de l’insuline basale peut constituer une barrière à l’adhésion au traitement et à l’atteinte des cibles thérapeutiques chez plusieurs patients. En 2011, une enquête menée auprès de 1516 adultes américains souffrant de diabète de type 2 a révélé que les patients seraient plus enclins à essayer un traitement nécessitant une injection par semaine plutôt qu’une par jour. Dans cette étude, les patients percevaient plusieurs avantages aux injections hebdomadaires par rapport aux injections quotidiennes, dont une plus grande flexibilité, une meilleure qualité de vie et l’impression que le traitement est plus léger4.
L’insuline icodec, un analogue récent de l’insuline basale, a l’avantage d’avoir une demi-vie d’environ sept jours et de permettre l’atteinte des concentrations sanguines maximales 16 heures après l’injection1. Cette molécule d’insuline modifiée se fixe à l’albumine et crée des complexes circulants dont la demi-vie d’élimination est d’environ 196 heures5. C’est ce profil pharmacocinétique qui rend possible l’administration hebdomadaire, réduisant le nombre d’injections et améliorant potentiellement l’acceptabilité du traitement par les patients.
Cet article porte un regard critique sur l’étude de phase 2 qui compare l’efficacité et l’innocuité de l’insuline basale icodec, administrée une fois par semaine, à celles de l’insuline basale glargine (100 unités/mL [U100]) à injection quotidienne1. À notre connaissance, c’est la seule étude à ce jour sur ce nouveau type d’insuline.
Protocole de recherche : Il s’agit d’une étude multicentrique de phase 2 à répartition aléatoire à double insu et double placebo. Cette étude regroupait 246 patients atteints de diabète de type 2 traités par la metformine, qui n’avaient jamais pris d’insuline, qui prenaient ou non un inhibiteur de la dipeptidyl peptidase de type 4 (iDPP-4) et dont l’hémoglobine glyquée (HbA1c) au début de l’étude se situait entre 7,0 et 9,5 %. D’une durée de 33 semaines (deux semaines de dépistage, 26 semaines de traitement et cinq semaines de suivi), elle a été menée en Europe et en Amérique. La taille de l’échantillon a été jugée suffisante par les chercheurs pour observer un changement de 0,5 % de l’HbA1c en 26 semaines (intervalle de confiance bilatéral à 95 % et écart-type de 1 %). Les auteurs n’ont pas énoncé la puissance statistique de leur étude pour le calcul de la taille de leur échantillon.
Patients : Les principaux critères d’inclusion étaient l’âge (de 18 à 75 ans), le fait de n’avoir jamais pris d’insuline, un diagnostic de diabète de type 2 depuis au moins 180 jours, des doses quotidiennes stables de metformine avec ou sans iDPP-4 dans les 90 derniers jours et une HbA1c entre 7,0 et 9,5 % inclusivement. Les principaux critères d’exclusion étaient les suivants : grossesse ou allaitement, état d’acidocétose diabétique dans les 90 jours précédents, événement ischémique ou hospitalisation pour angine instable dans les 180 jours précédents, insuffisance cardiaque de classe IV (New York Heart Association), insuffisance rénale avec débit de filtration glomérulaire estimé (DFGe) inférieur à 60 mL/min/1,73 m2, insuffisance hépatique, hypertension artérielle mal maîtrisée et traitement du diabète ou de l’obésité par des médicaments autres que ceux des critères d’inclusion dans les 90 jours précédant l’étude.
Interventions : Les participants ont été assignés de façon aléatoire (ratio 1:1) dans les divers groupes afin de recevoir les injections sous-cutanées suivantes : insuline icodec hebdomadaire et placebo quotidien ou insuline glargine U100 quotidienne et placebo hebdomadaire. La stratification s’est faite selon le recours ou non à un iDPP-4. La dose d’insuline hebdomadaire totale au départ dans les deux groupes était égale, soit 70 unités par semaine dans le groupe icodec et 10 unités par jour dans le groupe glargine U100. Elle était ensuite ajustée chaque semaine lors d’un rendez-vous en personne ou au téléphone selon les trois dernières glycémies mesurées à jeun le matin. La cible glycémique était de 3,9 à 6,0 mmol/L, et l’ajustement se faisait de la manière suivante : +2 unités par jour ou +14 unités par semaine si la glycémie se situait entre 6,1 et 7,0 mmol/L, + 4 unités par jour ou +28 unités par semaine si la glycémie dépassait 7,0 mmol/L, −2 unités par jour ou −14 unités par semaine si la glycémie se trouvait entre 3,0 et 3,8 mmol/L, et −4 unités par jour ou −28 unités par semaine si la glycémie était inférieure à 3,0 mmol/L.
Points évalués : L’objectif primaire était le changement d’HbA1c par rapport à la valeur de base à la semaine 26 à l’aide de paramètres prédéfinis par les auteurs (estimands). L’hypothèse des auteurs au moment de l’analyse (trial product estimand) était que tous les patients avaient respecté le traitement qui leur avait été assigné pendant toute la durée de l’étude et n’avaient pas commencé de traitement auxiliaire (c’est-à-dire d’autres médicaments que la metformine ou un iDPP-4). Pour ce faire, les données obtenues après ces événements intercurrents ont été remplacées par une imputation à l’aide d’un modèle linéaire mixte.
Par la suite, les chercheurs ont évalué l’objectif primaire selon l’assignation initiale seulement, sans tenir compte de l’arrêt de traitement ou du début d’un traitement auxiliaire, ce qui correspond à une analyse en intention de traiter.
Les objectifs secondaires étaient les modifications, à la semaine 26, de la glycémie à jeun, du poids corporel et de la moyenne du profil glycémique de neuf glycémies mesurées par le patient à des moments précis tout au long de la journée ainsi que la dose hebdomadaire moyenne d’insuline au cours des deux dernières semaines de traitement. La durée pendant laquelle la glycémie s’est maintenue dans l’intervalle thérapeutique de 3,9 à 7,8 mmol/L, mesurée par une surveillance dite flash à l’aide de l’appareil FreeStyle Libre Pro au cours des deux dernières semaines de traitement, a été un autre critère évalué.
Les chercheurs ont aussi évalué l’innocuité de l’insuline icodec en vérifiant le nombre d’événements indésirables graves, le nombre d’alertes d’hypoglycémie (niveau 1: glycémie entre 3,0 et 3,9 mmol/L) sur 24 heures et pendant la nuit seulement, le nombre d’hypoglycémies cliniquement significatives ou graves (niveau 2: glycémie inférieure à 3,0 mmol/L; niveau 3: hypoglycémie avec atteinte cognitive nécessitant une assistance externe) et le nombre d’hypoglycémies graves (niveau 3) uniquement. Les patients mesuraient leur glycémie lorsqu’ils soupçonnaient une hypoglycémie. Les hypoglycémies confirmées étaient signalées même en l’absence de symptômes. Les événements indésirables cardiovasculaires, les réactions au point d’injection et les réactions d’hypersensibilité ont été évalués par un comité indépendant en respectant l’insu.
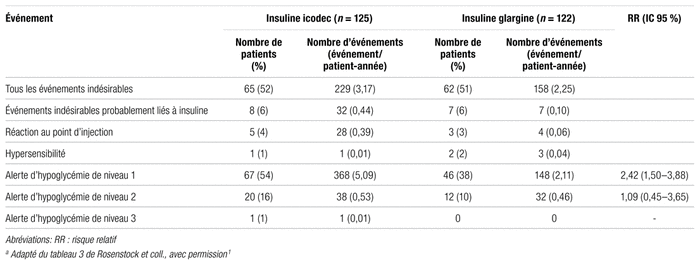
Résultats : Les caractéristiques des patients inclus à l’étude ainsi que les principaux résultats obtenus sont présentés aux tableaux I, II et III.
Tableau I Caractéristiques des patients de l’étudea
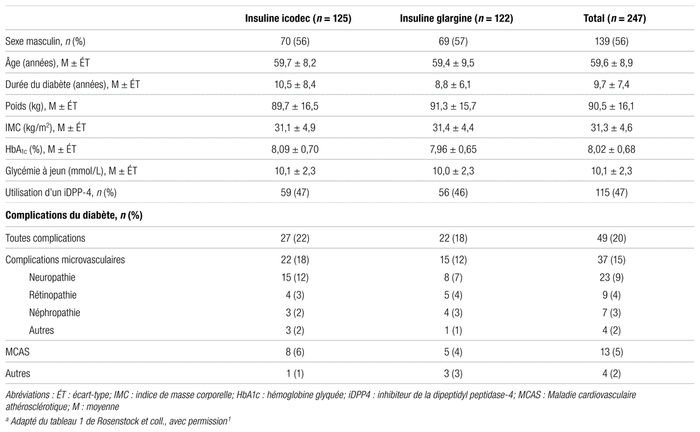
Tableau II Résultats de l’efficacité de l’insuline icodeca
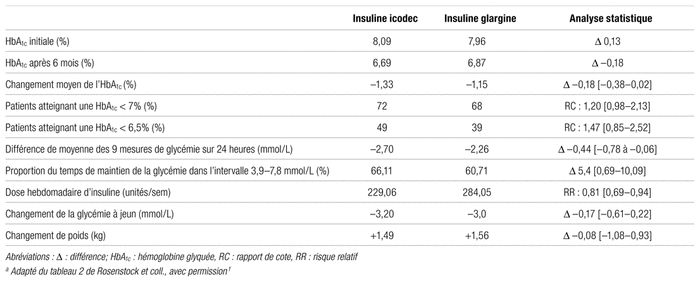
Tableau III Profil d’innocuité de l’insuline icodeca
Grille d’évaluation critique

Discussion
Dans cette étude de phase 2, les deux groupes ont connu une diminution similaire de l’hémoglobine glyquée. Ce résultat est intéressant, car une administration hebdomadaire plutôt que quotidienne est généralement associée à une meilleure observance et à une plus grande satisfaction des patients6. Ainsi, l’efficacité relative de l’insuline icodec dans un contexte d’utilisation réelle pourrait être meilleure que dans cette étude, car le double placebo ne permettait pas d’évaluer l’effet de la fréquence d’administration sur l’adhésion.
Le choix de l’objectif primaire, soit la différence de réduction de l’HbA1c après 26 semaines de traitement, est approprié, puisqu’il s’agit d’une mesure d’efficacité associée à une diminution des complications microvasculaires et potentiellement macrovasculaires du diabète. En outre, c’est le paramètre de suivi dans la pratique. Une baisse de l’HbA1c de 0,5 % est généralement considérée cliniquement significative7–10. Dans cette étude, la différence absolue n’était que de 0,18 point de pourcentage. En plus de ne pas être statistiquement significative, cette différence n’était donc pas cliniquement significative. Dans l’évaluation de la proportion de patients atteignant la cible d’HbA1c, les limites supérieures évaluées étaient de 7,0 % et de 6,5 %. Selon les lignes directrices canadiennes, la cible générale pour la plupart des patients est de 7,0 %, alors qu’une cible de 6,5 % est envisagée pour les patients plus jeunes à faible risque d’hypoglycémie, ce qui n’est généralement pas le cas des patients prenant de l’insuline11. Ainsi, l’évaluation de l’atteinte d’une HbA1c inférieure à 6,5 % est moins pertinente, car cette cible est rarement utilisée pour un patient atteint de diabète de type 2 prenant de l’insuline. Par ailleurs, une limite de l’HbA1c est qu’elle ne reflète pas les fluctuations de la glycémie se produisant au cours d’une journée. Le critère d’évaluation secondaire du profil glycémique sur 24 heures pallie en partie cette limite, même si les neuf mesures dans une journée ne sont pas vraiment possibles dans la vie courante. Les lignes directrices canadiennes sur le traitement du diabète recommandent d’ailleurs d’évaluer la maîtrise de la glycémie à la fois à l’aide de l’HbA1c et de l’auto-surveillance des glycémies12. Une moyenne des glycémies légèrement plus basse dans le groupe insuline icodec pour ce critère secondaire a été observée, ce qui s’expliquerait principalement par les glycémies post-prandiales. Ce résultat est intéressant puisque certaines données probantes semblent indiquer que des glycémies post-prandiales élevées pourraient constituer un facteur prédictif indépendant plus important de maladies cardiovasculaires13,14. Aucune différence dans les deux groupes n’a été détectée pour la moyenne des glycémies à jeun, ce qui est peu surprenant considérant que l’ajustement des doses d’insuline se faisait en fonction de ces moyennes. Enfin, l’analyse du profil des glycémies sur 24 heures révèle une durée dans la cible glycémique (3,9 à 7,8 mmol/L) plus élevée de 5,4 % dans le groupe insuline icodec. Une telle augmentation a aussi été associée à des bienfaits cliniques, une différence d’au moins 5 % étant jugée significative15,16.
Dans l’évaluation de l’innocuité, la classification des hypoglycémies utilisée dans l’étude s’apparente à celle qui est reconnue et tient compte de la glycémie (inférieure à 4,0 mmol/L) et de la nécessité d’une assistance17,18. Les auteurs concluent que l’insuline icodec présente un faible risque d’hypoglycémie semblable à celui de l’insuline glargine U100. Cette conclusion repose sur les faibles taux d’événements par patient-année en absolu (5,09 dans le groupe insuline icodec et 2,11 dans le groupe insuline glargine U100). Par contre, cette différence était statistiquement significative (RR: 2,42; IC à 95 % : 1,50–3,88).
Sur le plan des proportions, 53,6 % des sujets du groupe insuline icodec ont eu au moins une hypoglycémie contre 37,7 % dans le groupe insuline glargine U100. Même si elles n’étaient pas graves pour la plupart, ces hypoglycémies peuvent être préoccupantes pour les patients. Pour les hypoglycémies de niveau 2 ou 3, ces taux étaient de 0,53 dans le groupe insuline icodec et de 0,46 dans le groupe insuline glargine U100. La proportion de patients ayant subi au moins une hypoglycémie de niveau 2 ou 3 était de 16 % dans le groupe insuline icodec contre 9,8 % dans le groupe insuline glargine U100. Il est probable que les taux par patient-année sous-estiment l’incidence réelle puisqu’ils sont calculés pendant toute la durée de l’étude, ce qui inclut une période d’ajustement importante pendant laquelle les patients recevaient une dose sous-thérapeutique et étaient conséquemment moins susceptibles de faire une hypoglycémie.
Les auteurs avancent l’hypothèse que la tendance vers une incidence plus élevée d’hypoglycémie dans le groupe insuline icodec pourrait s’expliquer par le protocole d’ajustement des doses qui était le même dans les deux groupes, soit en fonction de la moyenne des glycémies à jeun du matin des trois jours précédents. Un ajustement plus prudent de l’insuline icodec pourrait être préférable. Cette hypothèse ainsi que son effet sur les autres paramètres cliniques restent à explorer. Quelques différences dans les caractéristiques de départ des patients de chaque groupe pourraient aussi avoir nui aux résultats du groupe icodec, soit la durée médiane plus longue du diabète (10,5 vs 8,8 années dans les groupes insuline icodec et insuline glargine U100, respectivement) et la proportion de complications microvasculaires (17,6 % vs 12,3 % dans les groupes insuline icodec et insuline glargine U100, respectivement). Ces valeurs semblent indiquer que les patients étaient possiblement plus malades et plus fragiles dans le groupe insuline icodec et donc potentiellement plus susceptibles de faire une hypoglycémie.
Les auteurs n’ont pas ajouté d’information sur le traitement des hypoglycémies ni précisé la teneur de l’assistance externe mentionnée dans leur définition des hypoglycémies graves. Il aurait été pertinent de savoir quelle proportion d’hypoglycémie a nécessité des soins plus complexes que la consommation de glucides par voie orale.
La fréquence hebdomadaire des suivis pour ajuster la dose d’insuline et la référence à trois valeurs plutôt qu’à une sont appropriées. Cependant, l’étude n’aborde pas l’effet de l’administration hebdomadaire d’insuline lorsqu’un ajustement rapide de la dose est nécessaire et ne précise pas si d’autres ajustements ont été faits dans le groupe insuline glargine U100 entre les suivis. L’incidence plus élevée d’hypoglycémie dans le groupe icodec pourrait découler de l’impossibilité d’ajuster le traitement dès le lendemain d’une hypoglycémie. Cette moins grande flexibilité pourrait aussi complexifier la gestion des jours de maladie. Enfin, on constate que le nombre de patients ayant eu des effets indésirables au point d’injection (5 et 3 dans le groupe insuline icodec et insuline glargine U100, respectivement) est faible, mais que le nombre absolu d’événements par patient-année est plus élevé dans le groupe insuline icodec (28) que dans le groupe insuline glargine U100 (4). Bien que rares, ces effets indésirables méritent quand même une attention particulière. Ce profil d’innocuité préliminaire devra donc être exploré plus en profondeur dans une étude de phase 3.
La méthodologie de l’étude est de bonne qualité. L’administration et les ajustements des doses à l’insu des participants ont limité les biais d’information. Par ailleurs, l’exhaustivité des paramètres mesurés permet de dresser un portrait global des répercussions cliniques du traitement à l’étude. Enfin, le choix de l’insuline glargine U100 comme comparateur est pertinent puisqu’il s’agit d’une insuline basale largement utilisée.
L’étude comporte aussi plusieurs limites. D’abord, la durée du suivi de 26 semaines est courte pour constater l’ampleur des différences, surtout que l’atteinte des doses thérapeutiques semble avoir été plus rapide avec insuline icodec qu’avec l’insuline glargine U100. Il pourrait en résulter une surestimation de l’effet sur l’HbA1c dans les deux groupes. Par ailleurs, les critères de sélection restrictifs des sujets limitaient l’applicabilité des résultats à une population plus large de patients atteints de diabète de type 2. Par exemple, les patients ayant un DFGe inférieur à 60 mL/min/1,73 m2 étaient exclus, alors que l’insuline est envisagée plus tôt en pratique chez ces patients en cas de progression du diabète du fait que leur fonction rénale réduite restreint les options de traitement. Les patients atteints de diabète de type 1 et ceux traités par un inhibiteur du cotransporteur sodium-glucose de type 2 (iSGLT2), un analogue du glucagon-like peptide de type 1 (GLP-1) ou l’insuline prandiale étaient aussi exclus. L’extrapolation des résultats à ces populations n’est donc pas possible pour l’instant.
Les patients prenant une sulfonylurée étaient également exclus, bien que cette classe soit très utilisée en pratique après l’instauration de la metformine, notamment pour des raisons de couverture d’assurance et de coût (liste de la Régie de l’assurance maladie du Québec). D’ailleurs, le coût sera aussi un facteur déterminant dans l’évaluation de ce nouveau produit aux fins d’inscription à la liste des médicaments couverts et ultimement d’utilisation en pratique. Étant donné son efficacité prometteuse et son profil d’innocuité préliminaire, il sera intéressant de prendre connaissance des résultats de l’étude de phase 3 en cours de recrutement afin de confirmer les effets cliniques de l’insuline icodec19.
Au-delà de l’évaluation clinique de l’insuline icodec, il faut se questionner sur sa place potentielle dans l’arsenal thérapeutique du diabète. L’étude évalue cette insuline chez les patients traités par la metformine avec ou sans iDPP-4. Dans la pratique, un iSGLT-2 ou un analogue du GLP-1 sont souvent prescrits avant l’insuline, notamment en raison du mode d’administration par voie orale (iSGLT2 et sémaglutide), de leurs bienfaits cardiovasculaires (iSGLT2 et sémaglutide en sous-cutané) et de la perte de poids associée20. Les patients qui commencent un traitement d’insuline après l’épuisement de ces autres options pourraient donc être différents de la population à l’étude. On peut également penser que l’administration hebdomadaire aura des effets bénéfiques moindres chez les patients recevant aussi des injections d’insuline prandiale. Néanmoins, l’insuline icodec pourrait être intéressante chez les patients dont la fonction rénale est réduite ou qui sont intolérants aux autres classes d’antidiabétiques. L’inclusion de ces populations dans des études futures serait pertinente pour mieux définir la place de ce traitement.
Conclusion
Selon les résultats de cette étude de phase 2, l’insuline icodec hebdomadaire aurait une efficacité semblable à celle de l’insuline glargine U100 quotidienne pour réduire l’HbA1c et les glycémies, mais son profil d’innocuité indique une incidence d’hypoglycémie de niveau 1 supérieure. Une étude de phase 3 est donc nécessaire. L’effet du traitement à plus long terme, notamment sur le plan de l’innocuité cardiovasculaire et des complications microvasculaires et dans une population plus large, ainsi que le traitement des hypoglycémies devraient être évalués. De plus, une étude pharmaco-économique serait de mise pour mieux positionner l’insuline icodec dans l’arsenal thérapeutique du diabète de type 221. En effet, la prise d’insuline une seule fois par semaine pourrait favoriser une meilleure adhésion en simplifiant le traitement des patients, mais cet avantage ne peut être vérifié qu’en situation d’utilisation réelle. Il serait aussi intéressant d’élargir le spectre de l’étude à une population atteinte de diabète de type 1.
Financement
Aucun financement en lien avec le présent article n’a été déclaré par les auteurs.
Conflits d’intérêts
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêt en relation avec le présent article.
Références
1. Rosenstock J, Bajaj HS, Janež A, Silver R, Begtrup K, Hansen MV et al. Once-weekly insulin for type 2 diabetes without previous insulin treatment. N Engl J Med 2020;383: 2107–16.

2. Diabète Québec. Le diabète en chiffres. [en ligne] https://www.diabete.qc.ca/fr/diabete-quebec/a-propos/salle-de-presse/le-diabete-en-chiffres/ (site visité le 2 avril 2021).
3. Lipscombe L, Booth G, Butalia S, Dasgupta K, Eurich DT, Goldenberg R et al. Pharmacologic glycemic management of type 2 diabetes in adults. Can J Diabetes 2018;42(Suppl. 1): S88–S103.

4. Polonsky WH, Fisher L, Hessler D, Bruhn D, Best JH. Patient perspectives on once-weekly medications for diabetes. Diabetes Obes Metab 2011;13:144–9.

5. Nishimura E, Kjeldsen T, Hubalek F, Glendore T, Stidsen CE, Hansen BF et al. 236-OR: Molecular and biological properties of insulin icodec, a new insulin analog designed to give a long half-life suitable for once-weekly dosing. Diabetes 2020;9:e002301.
6. Mody R, Huang Q, Yu M, Zhao R, Patel H, Grabner M et al. Adherence, persistence, glycaemic control and costs among patients with type 2 diabetes initiating dulaglutide compared with liraglutide or exenatide once weekly at 12-month follow-up in a real-world setting in the United States. Diabetes Obes Metab 2019;21:920–9.

7. UK Prospective Diabetes Study Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group. Lancet 1998; 352:837–53.

8. The Diabetes Control and Complications Trial Research Group. The relationship of glycemic exposure (HbA1c) to the risk of development and progression of retinopathy in the diabetes control and complications trial. Diabetes 1995; 44:968–83.

9. Stratton IM, Adler AI, Neil HA, Matthews DR, Manley SE, Cull CA et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. BMJ 2000; 321:405–12.

10. Little RR, Rohlfing CL. The long and winding road to optimal HbA1c measurement. Clin Chim Acta 2013;418:63–71.

11. Imran SA, Argarwal G, Bajaj HS, Ross S. Cibles pour la maîtrise glycémique. Can J Diabetes 2018 :1499–2671.
12. Berard L, Siemens R, Woo V. Surveillance de la maîtrise glycémique. Can J Diabetes 2018;42(Suppl. 1):S47–53.

13. The European Diabetes Epidemiology Group. Glucose tolerance and cardiovascular mortality: comparison of fasting and 2-hour diagnostic criteria. Arch Intern Med 2001;161:397–405.

14. Cavalot F, Pagliarino A, Valle M, Di Martino L, Bonomo K, Massucco P et al. Postprandial blood glucose predicts cardiovascular events and all-cause mortality in type 2 diabetes in a 14-year follow-up: lessons from the San Luigi Gonzaga Diabetes Study. Diabetes Care 2011; 34:2237–43.

15. Battelino T, Danne T, Bergenstal RM, Amiel SA, Beck R, Biester T et al. Clinical targets for continuous glucose monitoring data interpretation: recommendations from the international consensus on time in range. Diabetes Care 2019;42:1593–603.

16. Beck RW, Bergenstal RM, Riddlesworth TD, Kollman C, Li Z, Brown AS et al. Validation of time in range as an outcome measure for diabetes clinical trials. Diabetes Care 2019;42: 400–5.

17. Diabète Québec. L’hypoglycémie chez la personne diabétique. [en ligne] https://www.diabete.qc.ca/fr/vivre-avec-le-diabete/soins-et-traitements/hypoglycemie-et-hyperglycemie/lhypoglycemie-chez-la-personne-diabetique/ (site visité le 2 avril 2021).
18. Yale JF, Paty B, Senior PA. Hypoglycémie. Can J Diabetes 2018;42(Suppl. 1):S104–8.

19. Clinical Trials.gov. A research study to compare two types of insulin, a new insulin, insulin icodec and an available insulin, insulin glargine, in people with type 2 diabetes who have not used insulin before (ONWARDS 1). [en ligne] https://www.clinicaltrials.gov/ct2/show/NCT04460885 (site visité le 2 avril 2021).
20. Minze MG, Will KJ, Terrell BT, Black RL, Irons BK. Benefits of SGLT2 inhibitors beyond glycemic control - a focus on metabolic, cardiovascular and renal outcomes. Curr Diabetes Rev 2018; 14:509–17.

21. Lipscombe L, Bootj G, Butalia S, Dasgupta K, Eurich DT, Goldenberg R et al. Prise en charge pharmacologique de la glycémie chez les adultes atteints de diabète de type 2. Can J Diabetes 2018;42(Suppl. 1):S88–103.

Pour toute correspondance: Jessica Le Blanc, Centre intégré universitaire de santé et de services sociaux de l’Est-de-l’Île-de-Montréal, Hôpital Maisonneuve-Rosemont, 5415, boulevard de l’Assomption, Montréal (Québec) H1T 2M4, CANADA; Téléphone : 514 252-3400; Courriel : jessica.le.blanc.ssss@gouv.qc.ca
(Return to Top)
PHARMACTUEL, Vol. 55, No. 2, 2022




