Mélanie
Lachapelle,
Pharm.D., M.Sc.1,2,3*,
Catherine
Poitras,
Pharm.D., M.Sc.1,2,4*,
Hugo
Roy,
Pharm.D., M.Sc.4,
Catherine Ste-Marie
Paradis,
B.Pharm., M.Sc.4,
Sébastien
Fortin,
B.Sc., M.Sc., Ph.D.5,6
Reçu le 4 juillet 2021: Accepté après révision par les pairs le 6 août 2021
Résumé
Objectif : Décrire les réactions indésirables à médiation immunitaire liées aux inhibiteurs du point de contrôle immunitaire chez les patients suivis en hémato-oncologie à l’Hôpital régional de Rimouski.
Méthode : Étude descriptive de population longitudinale avec collecte de données rétrospective. Les patients ayant débuté un inhibiteur du point de contrôle immunitaire entre le 1 er septembre 2017 et le 30 novembre 2019 ont été inclus. Ceux sous protocole de recherche, transférés dans une autre installation ou un autre établissement de santé et traités en clinique privée de perfusion ont été exclus.
Résultats : Un total de 94 patients, majoritairement atteints d’un cancer du poumon non à petites cellules, a été inclus. Trente-huit patients ont présenté au moins une réaction indésirable à trois mois (40 %), alors que 51 ont rapporté une toxicité durant l’étude (54 %). Un total de 74 réactions indésirables a été collecté, les plus fréquentes étant endocriniennes (35 %), cutanées (22 %) et gastro-intestinales (19 %). Découlant de celles-ci, 101 épisodes de réactions indésirables ont été répertoriés, dont 31 sont apparus après l’arrêt du traitement (31 %). Treize toxicités étaient de grade 3 ou 4 (18 %), nécessitant majoritairement une hospitalisation, une suspension de l’immunothérapie ou les deux.
Conclusion : La plupart des réactions indésirables à médiation immunitaire surviennent dans les trois mois suivant le début du traitement. Une proportion importante des épisodes se déclare après son arrêt. Afin d’améliorer la prise en charge actuelle de ces réactions indésirables, le rôle du pharmacien à l’Hôpital régional de Rimouski réside potentiellement dans la consolidation de l’enseignement initial aux patients après environ deux mois de traitement.
Mots clés : Immunothérapie, inhibiteur du point de contrôle immunitaire, oncologie, réaction indésirable à médiation immunitaire
Abstract
Objective : To describe immune-related adverse events of checkpoint inhibitors in patients followed in hematologic oncology at the Hôpital régional de Rimouski.
Method : A longitudinal, population-based, descriptive study with retrospective data collection. Patients who started an immune checkpoint inhibitor between September 1, 2017 and November 30, 2019 were included. Those in a research study, transferred to another Centre intégré de santé et des sevices sociaux du Bas-Saint-Laurent facility or to another healthcare institution, or treated at a private infusion clinic were excluded.
Results : A total of 94 patients, mostly with non-small-cell lung cancer, were included. Thirty-eight patients experienced at least one adverse event at three months (40%), and 51 reported toxicity during the study (54%). A total of 74 adverse events were identified, the most common being endocrine (35%), skin (22%) and gastrointestinal (19%). For these, 101 adverse event episodes were noted, 31 of which occurred after the treatment was stopped (31%). Thirteen toxicities were Grade 3 or 4 (18%), most requiring hospitalization, suspension of the immunotherapy or both.
Conclusion : Most immune-related adverse events occur within the three months following the start of treatment. A significant proportion of the episodes occur after the treatment is stopped. To improve the current management of these events, the role of the pharmacist at the Hôpital régional de Rimouski is potentially to reinforce the initial patient education after approximately two months of treatment.
Keywords : Immune checkpoint inhibitor, immune-related adverse event, immunotherapy, oncology
Le cancer est la principale cause de mortalité au Canada et représente 30 % des décès répertoriés en 20191. Approximativement, 225 800 nouveaux cas seront diagnostiqués en 2020 et 83 000 personnes en décéderont2. L’incidence et le nombre de décès par cancer augmentent chaque année compte tenu du vieillissement de la population et de la croissance démographique1,2.
L’immunothérapie constitue une option de traitement intéressante en oncologie qui a démontré des bénéfices significatifs concernant la survie globale, la survie sans progression et la durabilité de la réponse pour plusieurs types de cancer3,4. Les inhibiteurs du point de contrôle immunitaire (ICIs) sont des anticorps monoclonaux utilisés en oncologie. Ils permettent de contourner le mécanisme de défense des cellules cancéreuses, qui ont réussi à outrepasser le système immunitaire, et favorisent ainsi leur destruction. L’ipilimumab est un anticorps monoclonal inhibant le CTLA-4 (anti-CTLA-4)5,6. Le pembrolizumab, le nivolumab et le cémiplimab ciblent le PD-1 (anti-PD-1), alors que l’atézolizumab, l’avélumab et le durvalumab agissent sur le PD-L1 (anti-PD-L1)7–12.
Les ICIs sont susceptibles de mener à des réactions indésirables à médiation immunitaire (RIMI). Quoique peu fréquentes, les RIMI sévères peuvent nécessiter le report ou l’arrêt du traitement et même entraîner le décès3. La gravité des RIMI est classifiée selon le Common Terminology Criteria for Adverse Events (CTCAE)13–16. Les grades 1 et 2 représentent des symptômes légers à modérés, le grade 3 une réaction grave, le grade 4 une réaction potentiellement mortelle, tandis que le grade 5 correspond au décès16. Au cours des dernières années, un grand nombre d’articles en lien avec la tolérance des ICIs ont été publiés17–22. L’European Society for Medical Oncology (ESMO), l’American Society of Clinical Oncology (ASCO) et le National Comprehensive Cancer Network (NCCN) ont élaboré des lignes directrices pour guider les cliniciens dans la prise en charge des RIMI13–15. Le moment idéal du suivi de la tolérance des ICIs et le rôle du pharmacien au sein de l’équipe multidisciplinaire dans ce contexte sont peu abordés dans la littérature médicale23.
Actuellement, aucun suivi systématique des RIMI n’est effectué par les pharmaciens à l’Hôpital régional de Rimouski (HRR), soit une des installations du Centre intégré de santé et de services sociaux (CISSS) du Bas-Saint-Laurent. Alors que l’offre de soins pharmaceutiques y est bien établie en chimiothérapie, le moment optimal du suivi de la tolérance des patients sous immunothérapie n’est pas déterminé. Par ailleurs, l’incidence cumulée des patients présentant des RIMI est inconnue à l’HRR. Il est à noter que l’HRR est un centre secondaire ayant traité 548 usagers différents en 2020 pour un total de 3998 traitements administrés par voie intraveineuse. L’objectif principal de la présente étude consiste à calculer l’incidence cumulée des réactions indésirables liées aux ICIs, tous grades confondus. Les objectifs secondaires portent sur le calcul de l’incidence des différents types de RIMI, la détermination du grade de ces dernières selon le CTCAE, le calcul des délais avant leur apparition et leur prise en charge, en plus de la description de la gestion des RIMI.
La présente étude est de nature descriptive et longitudinale avec collecte de données rétrospective. La population étudiée comprend tous les patients suivis en hémato-oncologie à l’HRR ayant débuté leur ICI entre le 1er septembre 2017 et le 30 novembre 2019. Les patients recevant leur traitement d’immunothérapie dans le cadre d’un protocole de recherche, transférés définitivement dans une autre installation du CISSS du Bas-Saint-Laurent ou dans un autre établissement de santé, et ceux traités dans une clinique privée de perfusion ont été exclus. La sélection des sujets a été menée par séries consécutives grâce à une revue d’utilisation des médicaments générée à partir du logiciel SyPhaCMD. Un échantillon de 125 patients était attendu. Une période de suivi minimale de six mois après le début du traitement et maximale d’un an après son arrêt a été prévue.
Outre les données démographiques, les variables suivantes reliées au patient ont été recueillies : diagnostic, stade du cancer, ligne de traitement, statut tabagique, comorbidités auto-immunes, présence de corticothérapie ou d’immunomodulateur. Les variables collectées quant au traitement étaient les suivantes : ICI(s), date de début du traitement, dose, fréquence d’administration en plus de radiothérapie, chimiothérapie et thérapie ciblée concomitantes. Les variables ci-après relatives aux RIMI ont été colligées : présence, type, grade de sévérité selon le CTCAE, date de survenue, intervention en lien avec l’immunothérapie, consultation d’un spécialiste, hospitalisation ainsi que traitements immunomodulateur et symptomatique ajoutés. Les dates de décès du patient, de fin d’immunothérapie, de fin de suivi, en plus de la raison de l’arrêt le cas échéant, ont été rassemblées. Les informations provenaient principalement de la feuille de suivi informatisée de la pharmacie, du logiciel MédiClinicMD et des dossiers-patients archivés. L’outil de collecte de données utilisé est disponible sur demande. Un prétest de l’outil a été effectué en avril 2020 sur cinq dossiers, puis la collecte de données s’est déroulée du 8 juin au 10 juillet 2020.
Les données recueillies sont présentées sous forme de statistiques descriptives. Les variables quantitatives discrètes et continues sont exprimées par des mesures de tendance centrale (moyennes et médianes) ainsi que par des mesures de dispersion (étendues et écarts-types). L’incidence cumulée des RIMI, correspondant au nombre de patients ayant présenté des réactions indésirables par rapport au nombre total de sujets à risque, a été calculée à trois, six et 12 mois. Aucun formulaire de consentement n’a été nécessaire puisque l’étude n’impliquait aucun risque direct pour les patients. Le principal risque consistait en un bris potentiel de confidentialité. Des mesures ont été mises en place pour limiter cette éventualité, dont l’utilisation de mots de passe pour restreindre l’accès aux fichiers utilisés. Le projet de recherche a été approuvé par le Comité d’éthique et de la recherche du CISSS du Bas-Saint-Laurent et une autorisation a été obtenue auprès de la Direction des services professionnels de l’établissement pour la consultation des dossiers-patients archivés.
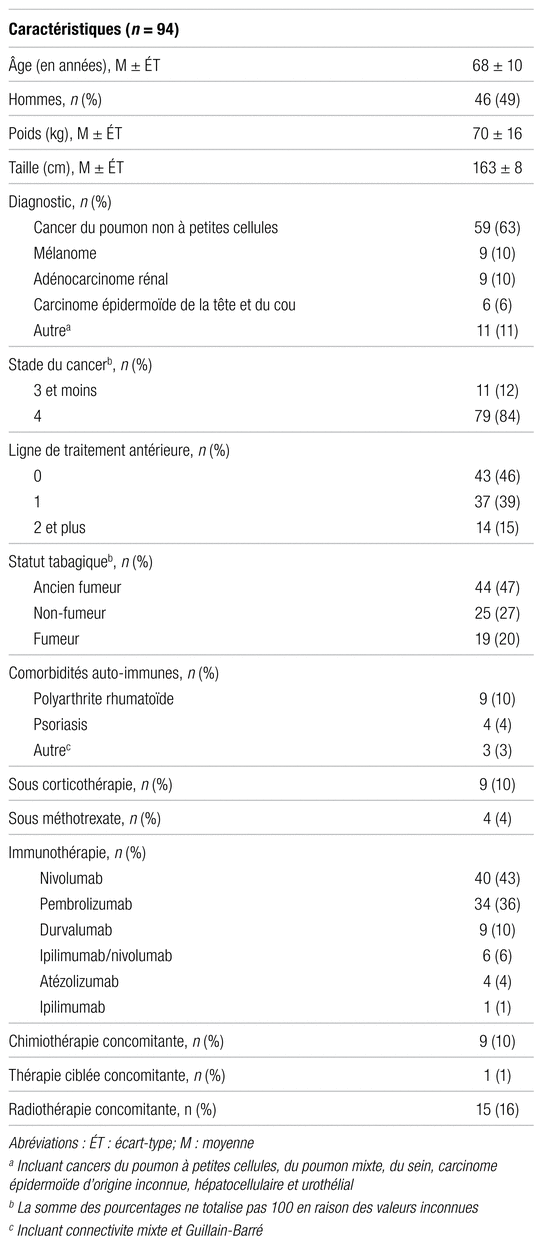
Cent vingt-trois patients suivis en hémato-oncologie à l’HRR ont reçu au moins une dose d’ICI entre le 1er septembre 2017 et le 30 novembre 2019. Parmi ceux-ci, 29 présentaient au moins un critère d’exclusion (figure 1 de l’annexe). Les caractéristiques initiales des 94 patients inclus dans l’étude sont présentées au tableau I. L’âge moyen des sujets était de 68 ans et la population était constituée d’hommes à 49 %. Les diagnostics les plus fréquents étaient le cancer du poumon non à petites cellules (CPNPC) (63 %), le mélanome (10 %) et l’adénocarcinome rénal (10 %). La majorité des patients sous immunothérapie étaient atteints d’un cancer de stade 4 (84 %). Dans 46 % des cas, aucune ligne de traitement antérieure n’avait été reçue. Seulement 15 % des sujets (14/94) présentaient au moins une comorbidité auto-immune. Parmi les 94 patients inclus, 40 ont reçu du nivolumab (43 %), 34 du pembrolizumab (36 %), neuf du durvalumab (10 %), six l’association ipilimumab/nivolumab (6 %), quatre de l’atézolizumab (4 %) et un seul de l’ipilimumab (1 %). Aucun patient n’a reçu du cémiplimab. Concomitamment à l’immunothérapie, 15 patients ont reçu des traitements de radiothérapie (16 %), neuf de chimiothérapie (10 %), et un seul, une thérapie ciblée (1 %).
Tableau I
Caractéristiques initiales des patients

Parmi les 94 patients, 38 ont présenté au moins une réaction indésirable à médiation immunitaire à trois mois (40 %), alors que 51 ont rapporté une toxicité durant la période à l’étude (54 %). Il est à noter qu’afin de simplifier la présentation des résultats, les toxicités hépatiques ont été comptabilisées dans les toxicités gastro-intestinales, telles que classifiées par l’ASCO et le NCCN14–15. L’incidence cumulée des RIMI à six mois était de cinq patients (5/56, 9 %), alors qu’elle était de six patients à 12 mois (6/51, 12 %). La durée médiane de suivi était de 246 jours (étendue : 6 à 992). La figure 1 présente la proportion de patients ayant rapporté au moins une RIMI en fonction du délai d’apparition. Il est possible de constater que, parmi l’ensemble des patients ayant présenté au moins une RIMI, 75 % de ces réactions sont survenues durant les trois premiers mois de traitement.
|
|
||
|
Figure 1
Proportion de patients ayant présenté au moins une réaction indésirable à médiation immunitaire en fonction du délai d’apparition
|
||
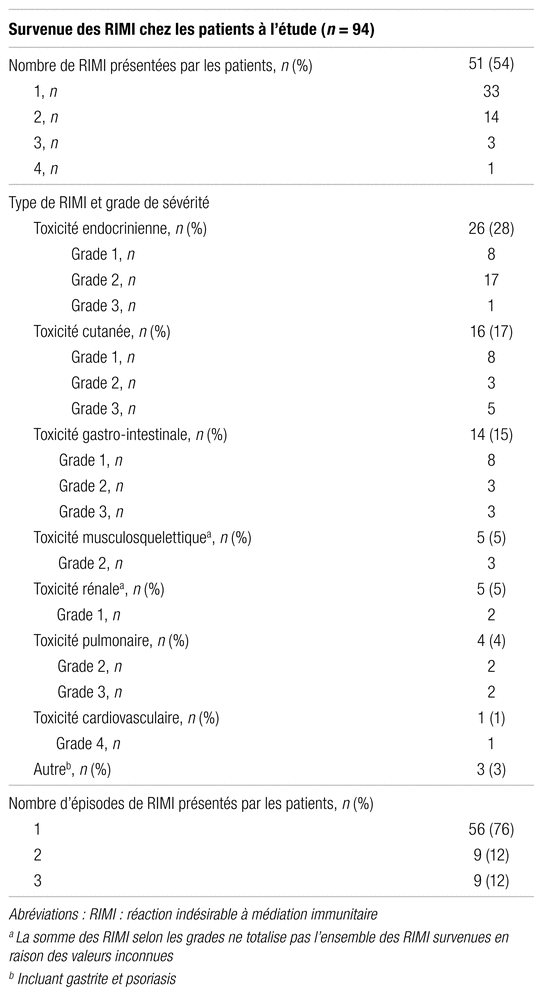
Les réactions indésirables apparues chez les patients à l’étude sont présentées au tableau II. Trente-trois sujets ont eu une seule RIMI (33/94, 35 %), alors que 18 en ont subi deux ou plus (18/94, 19 %). Ainsi, un total de 74 réactions indésirables a été collecté, les plus fréquentes étant les toxicités endocriniennes (26/74, 35 %), cutanées (16/74, 22 %) et gastro-intestinales (14/74, 19 %), touchant respectivement 28 % (26/94), 17 % (16/94) et 15 % (14/94) des patients. Les toxicités musculosquelettiques, rénales, pulmonaires, cardiovasculaires et autres sont survenues dans une plus faible proportion (18/74, 24 %). Un patient pouvait expérimenter plus d’un épisode de la même RIMI. Conséquemment, 101 épisodes distincts de réactions indésirables ont été recueillis. Dix-huit patients ont présenté deux épisodes ou plus d’une même toxicité (19 %). Il est à noter que le grade des RIMI collectées est le plus grave parmi tous les épisodes survenus. La majorité des toxicités étaient de grade 1 ou 2 (56/74, 76 %), alors que 18 % (13/74) étaient de grade 3 ou 4. La gravité des RIMI restantes (5/74, 7 %) est inconnue.
Tableau II
Réactions indésirables à médiation immunitaire présentées par les patients
Respectivement 21 % et 5 % des patients ont présenté une hypothyroïdie (20/94) ou une hyperthyroïdie (5/94). Les hypothyroïdies survenues étaient de grade 2 chez 85 % des patients (17/20), nécessitant l’ajout ou l’ajustement d’un supplément hormonal. L’ensemble des hyperthyroïdies était de grade 1, c’est-à-dire asymptomatiques, et ont évolué vers une hypothyroïdie de grade 2. Ces toxicités étaient alors comptabilisées comme deux RIMI distinctes. Par ailleurs, une insuffisance surrénalienne de grade 3 est survenue (1/94, 1 %).
Dix et cinq patients ont rapporté respectivement une éruption cutanée (10/94, 11 %) et du prurit (5/94, 5 %). Quatre individus ont présenté une éruption cutanée de grade 3 (4/10, 40 %), avec une atteinte de plus de 30 % de leur surface corporelle. Les six autres ont présenté une éruption cutanée de grade 1 ou 2 (6/10, 60 %). La majorité des prurits étaient légers ou localisés (4/5, 80 %). Une dermatite bulleuse est survenue chez un seul patient (1/94, 1 %), évoluant vers un grade 3 lors du troisième épisode.
Sept patients ont souffert d’une colite et sept d’une hépatite (7/94, 7 % chacun). Cinq patients ayant présenté une colite ont eu des symptômes de grade 1 ou 2 (5/7, 71 %). Deux patients traités par anti-PD-1 ont présenté une toxicité de grade 3 (2/7, 29 %). La majorité des hépatites étaient légères à modérées. Un seul patient a fait une hépatite de grade 3 (1/7, 14 %). Ce dernier a expérimenté trois épisodes nécessitant l’arrêt de l’immunothérapie dès le premier épisode et trois hospitalisations. Enfin, un patient a présenté trois épisodes de gastrite, tous de grade 3.
Cinq patients ont présenté une toxicité musculosquelettique (5/94, 5 %), dont quatre sous la forme d’arthrite inflammatoire (4/94, 4 %) et un sous la forme de myalgie de grade 2 (1/94, 1 %). Les symptômes d’arthrite inflammatoire étaient modérés pour deux patients (2/4, 50 %), alors que les autres données étaient manquantes. Cinq patients ont présenté une toxicité rénale (5/94, 5 %), dont quatre insuffisances rénales aiguës (4/94, 4 %) et une néphrite (1/94, 1 %). Deux RIMI rénales étaient de grade 1 (2/5, 40 %), alors que la gravité était inconnue pour les autres. Quatre patients ont rapporté une pneumonite, soit la seule toxicité pulmonaire rencontrée en cours de suivi (4/94, 4 %). Les évènements étaient de grade 2 chez deux patients (2/4, 50 %) et de grade 3 pour les deux autres (2/4, 50 %). Un patient ayant présenté une pneumonite de grade 3 est décédé deux jours après le constat des symptômes. La cause immunologique n’a pu être établie avec certitude puisqu’une pneumonie bactérienne était également suspectée. Enfin, un seul patient a présenté une toxicité cardiaque (1/94, 1 %). La myocardite était de grade 4 et le patient est décédé le lendemain de l’apparition des premiers symptômes. L’origine auto-immune n’a pu être confirmée puisqu’aucune biopsie n’a été réalisée.
Parmi l’ensemble des RIMI rencontrées, les anti-PD-1 et anti-PD-L1 ont été responsables de 88 % (65/74) des toxicités, alors que la combinaison anti-CTLA-4/anti-PD-1 a induit 11 % (8/74) d’entre elles. Le seul patient sous anti-CTLA-4 a présenté une réaction indésirable. Le tableau I en annexe rapporte les RIMI manifestées par les patients en fonction du traitement d’immunothérapie reçu.
Parmi les comorbidités auto-immunes préexistantes chez 14 des patients à l’étude, les ICIs ont mené à une augmentation de la symptomatologie dans 25 % des cas (4/16). Deux patients ont noté une légère exacerbation de leur psoriasis, mais aucune intervention en lien avec l’immunothérapie n’a été nécessaire. Deux patients connus pour une polyarthrite rhumatoïde ont eu une décompensation de leur maladie. La gravité des symptômes était de grade 2 pour l’un d’entre eux, qui a poursuivi son ICI sans récidive. Le second, dont le grade de RIMI était inconnu, a cessé son traitement. Le tableau II présenté en annexe rapporte les RIMI survenues chez les patients atteints d’une maladie auto-immune préexistante.
Le délai médian avant l’apparition du premier épisode d’une réaction indésirable, tous types et grades confondus, est de 63 jours (étendue : 0 à 463). Le délai médian est de 58 jours pour les toxicités endocriniennes, de 44 jours pour les toxicités cutanées et de 169 jours pour les toxicités gastro-intestinales. La figure 2 illustre le délai médian avant l’apparition des différents types de RIMI selon la gravité. Il est à noter que tous les épisodes ont été pris en considération pour le délai avant l’apparition d’une RIMI de grade 3 ou 4. Cette méthode donne un aperçu du moment d’apparition des RIMI les plus sévères, indépendamment du délai avant le premier épisode.
|
|
||
|
Figure 2
Délai médian avant l’apparition des différents types de réactions indésirables à médiation immunitaire selon la gravité
|
||
Le moment de la prise en charge des RIMI correspond à la date à laquelle une intervention en lien avec l’immunothérapie a été effectuée : modification de dose, suspension ou arrêt définitif du traitement. Le délai médian avant une intervention en lien avec l’immunothérapie lors du premier épisode de RIMI est de zéro jour (étendue : 0 à 28), alors que la moyenne est de quatre jours (écart-type [ÉT] : 8).
La description de la prise en charge des RIMI est présentée dans le tableau III. Parmi l’ensemble des 101 épisodes, 36 interventions en lien avec l’immunothérapie ont été recensées, dont 25 suspensions (25/101, 25 %) et 11 arrêts définitifs de traitement (11/101, 11 %). Aucune intervention en lien avec l’immunothérapie n’a été consignée pour les 65 autres épisodes (65/101, 64 %). L’immunothérapie a été suspendue lors de trois épisodes de réactions indésirables de grade 1 (3/25, 12 %), de 11 de grade 2 (11/25, 44 %), de 10 de grade 3 (10/25, 40 %) et d’un de gravité inconnue (1/25, 4 %). À la suite de ces suspensions, seulement 12 patients ont repris l’immunothérapie (12/25, 48 %) et sept ont présenté une récidive de leur toxicité initiale (7/12, 58 %). Les arrêts de traitement ont été notés à six reprises au moment d’un épisode de réaction indésirable de grade 1 et 2 (6/11, 55 %) et à deux reprises pour des épisodes de grade 3 et 4 (2/11, 18 %). Les trois autres grades de toxicité ayant entraîné un arrêt de traitement étaient inconnus. Les épisodes de RIMI pour lesquels aucune intervention en lien avec l’immunothérapie n’a été effectuée étaient majoritairement de grade 1 et 2 (55/65, 85 %). Aucune modification de dose n’a été réalisée sur la base d’une réaction indésirable liée aux ICIs.
Tableau III
Description de la prise en charge des épisodes de réactions indésirables à médiation immunitaire
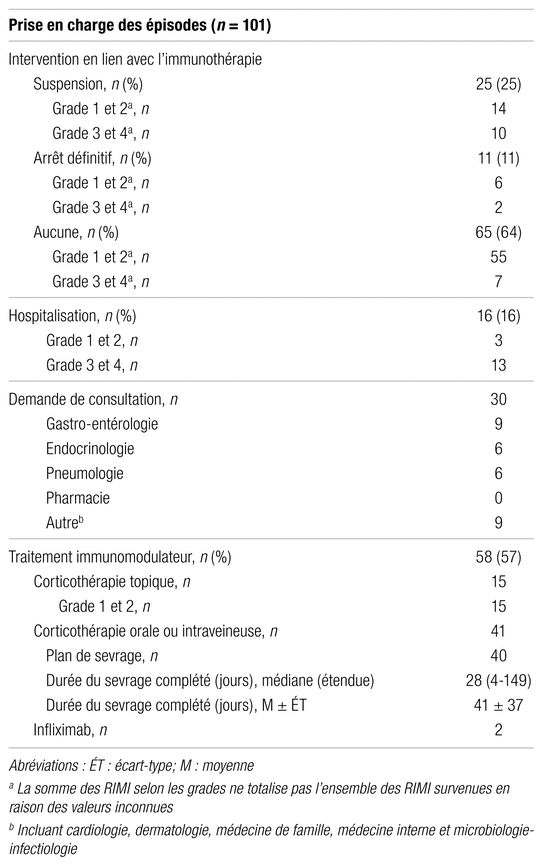
Seize hospitalisations liées aux RIMI ont été enregistrées (16/101, 16 %), dont 13 sont survenues lors de réactions indésirables de grade 3 et 4 (13/16, 81 %). Parmi les épisodes comptabilisés, 30 spécialistes ont été demandés en consultation, principalement des gastro-entérologues, des endocrinologues et des pneumologues. Aucun pharmacien n’a été formellement demandé en consultation.
Par ailleurs, 15 épisodes de RIMI (15/101, 15 %), tous cutanés de grade 1 ou 2, ont nécessité l’ajout d’une corticothérapie topique. Un total de 41 épisodes a mené à un traitement immunomodulateur à base de corticostéroïdes par voie orale ou intraveineuse (41/101, 41 %). Seulement deux épisodes de grade 3 ont entraîné la prescription d’infliximab (2/101, 2 %), soit une colite et une gastrite. Aucun traitement immunomodulateur n’a été ajouté lors de 43 épisodes, dont 41 de grade 1 ou 2. Un plan de sevrage de la corticothérapie a été établi pour 40 des 41 épisodes rencontrés. La durée médiane des sevrages complétés était de 28 jours (étendue : 4 à 149) et la moyenne, de 41 jours (ÉT : 37). En outre, 61 épisodes de RIMI ont nécessité la prescription d’un ou plusieurs traitements symptomatiques. Par exemple, 17 épisodes ont entraîné l’ajout ou la modification d’une dose de lévothyroxine pour le traitement d’une hypothyroïdie.
Au total, 11 patients ont cessé leur traitement en raison d’une toxicité immunologique (11/94, 12 %), mais aucun n’en est décédé. La progression du cancer et le passage en soins de confort expliquent en majorité les raisons de l’arrêt de l’immunothérapie (49/94, 52 %). La durée moyenne de l’immunothérapie pour les patients l’ayant discontinuée est de 133 jours (étendue : 6 à 791). Il est à noter que 31 % des épisodes sont survenus après la discontinuation des ICIs (31/101). Enfin, 55 patients sont décédés en cours de suivi, dont 27 durant les six premiers mois de traitement. Au terme de l’étude, 16 patients étaient encore sous immunothérapie.
L’objectif général de l’étude était de décrire les réactions indésirables liées aux ICIs chez les patients suivis en hémato-oncologie à l’HRR. L’incidence des RIMI, tous grades confondus, s’élève à 51 patients pour une durée médiane de suivi de 246 jours. L’incidence cumulée à trois mois est de 38 individus, à six mois, de cinq individus, et à 12 mois, de six individus. Compte tenu de la durée de suivi des patients à l’étude, l’incidence cumulée à un an peut être sous-estimée. Les RIMI ont majoritairement affecté les systèmes endocrinien, tégumentaire et digestif, ce qui corrèle avec la littérature scientifique sur le sujet13–15.
Un peu plus de 75 % des patients ont reçu un anti-PD-1, soit le nivolumab ou le pembrolizumab. Ces agents sont les principaux ICIs indiqués en CPNPC métastatique7,8,24. Ce type de cancer est d’ailleurs le plus fréquent dans l’étude, touchant près des deux tiers des sujets. L’immunothérapie représentait une première ligne de traitement pour près de la moitié de la population, à majorité atteinte du stade 4 de la maladie. L’absence de patients sous cémiplimab n’est pas surprenante, puisqu’il n’était pas inscrit sur la Liste des médicaments fournis en établissement au moment de l’étude9,24. Cette liste comprend, entre autres, les indications pour lesquelles les ICIs sont remboursés par la Régie de l’assurance maladie du Québec24.
Les toxicités cutanées constituent les RIMI les plus fréquemment rapportées dans la littérature médicale, touchant 17 à 40 % des patients sous anti-PD-1 ou anti-PD-L1 et 37 à 70 % sous l’association anti-CTLA-4/anti-PD-1. Ces toxicités prennent principalement la forme d’une éruption cutanée ou de prurit et sont généralement de gravité légère13,15,25–27. Bien que les toxicités cutanées ne soient pas les plus fréquentes dans cette étude, 16 patients en ont été atteints (16/94, 17 %). Quinze d’entre eux ont présenté une éruption cutanée ou du prurit (15/16, 94 %) et dix avaient des symptômes légers à modérés (10/16, 63 %), ce qui concorde avec les données publiées13,15,25,26. La majorité des patients atteints d’une toxicité cutanée recevaient un anti-PD-1 ou un anti-PD-L1 (14/16, 88 %). De ce fait, l’incidence des RIMI cutanées chez les patients sous anti-PD-1 ou anti-PD-L1 (14/87, 16 %) se rapproche de celle rapportée dans la littérature médicale13,15,25,26. Seulement un patient sur les six recevant l’association anti-CTLA-4/anti-PD-1 a manifesté du prurit (1/6, 17 %). Ce résultat diffère de celui attendu, étant donné que l’association d’ICIs constitue un facteur de risque de présenter une toxicité cutanée15,25–27. La faible proportion d’individus sous l’association anti-CTLA-4/anti-PD-1 dans cette étude peut expliquer la divergence notée. Les RIMI cutanées surviennent généralement dans les premières semaines de traitement, soit après environ deux cycles d’immunothérapie13,15,25,26. Ces toxicités sont approximativement apparues en six semaines, ce qui était attendu compte tenu de la fréquence d’administration des cycles variant entre deux et quatre semaines.
Les troubles thyroïdiens sont les toxicités endocriniennes les plus souvent rapportées avec les ICIs13,15,28,29. L’incidence des troubles thyroïdiens est de moins de 10 % avec les anti-PD-1 et les anti-PD-L1, alors qu’elle grimpe jusqu’à 20 % avec l’association anti-CTLA-4/anti-PD-1. Généralement, une hyperthyroïdie asymptomatique est suivie d’une hypothyroïdie nécessitant l’ajout ou l’ajustement de lévothyroxine13,15,28–30. Dans l’étude, 27 % des patients ont souffert d’un trouble de la thyroïde non sévère (25/94). Les anti-PD-1 ont principalement été responsables de ces toxicités (20/25, 80 %), représentant 23 % des patients sous anti-PD-1 et anti-PD-L1 (20/87). Ces résultats divergent de ceux attendus, car l’incidence correspond à plus du double de celle rapportée chez les patients sous anti-PD-1 et anti-PD-L1, et aucun patient traité par l’association anti-CTLA-4/anti-PD-1 n’a présenté ce type de toxicité. Comme les troubles thyroïdiens préexistants n’ont pas été collectés, les résultats peuvent toutefois avoir été surestimés. Parmi les RIMI endocriniennes, cinq hypothyroïdies de grade 2 ont été précédées d’une hyperthyroïdie asymptomatique. Les toxicités endocriniennes surviennent généralement dans un délai médian de six semaines après le début d’un anti-PD-117. Ces toxicités sont survenues dans un délai médian de 58 jours, soit environ huit semaines. Ainsi, le moment d’apparition des toxicités endocriniennes se rapproche des délais rapportés dans la littérature scientifique.
Les toxicités gastro-intestinales secondaires aux ICIs se présentent majoritairement sous forme de colite et de diarrhée. Les anti-CTLA-4, seuls ou combinés, sont les plus souvent impliqués, avec une incidence de 27 à 54 % pour la diarrhée et jusqu’à 22 % pour la colite. Ces RIMI sont moins fréquentes avec les anti-PD-1 et les anti-PD-L1, soit de l’ordre de 1 à 2 % pour les grades 3 ou 413,15,30–32. Au terme du suivi, sept patients ont présenté une colite (7 %); six d’entre eux étaient traités par un anti-PD-1 ou un anti-PD-L1. Les symptômes étaient de grade 3 chez deux patients sous anti-PD-L1, ce qui correspond à 2 % des sujets sous anti-PD-1 et anti-PD-L1 (2/87). Ce résultat est similaire à l’incidence rapportée dans la littérature scientifique. Par ailleurs, seulement un patient traité par l’association anti-CTLA-1/anti-PD-1 a présenté une colite (1/6, 17 %), ce qui est légèrement inférieur à l’incidence attendue. Les hépatites sont normalement moins fréquentes et se manifestent surtout par une augmentation asymptomatique des enzymes hépatiques (moins de 2 % des patients sous anti-PD-1 et anti-PD-L1)15,32. L’incidence d’hépatite à l’HRR est plus élevée qu’attendue, touchant 7 % des patients (7/94), tous sous anti-PD-1 (7/87, 8 %). Cependant, aucune autre cause d’augmentation des enzymes hépatiques n’a été collectée, ce qui limite l’imputabilité des ICIs dans ces toxicités. Les symptômes de colite et de diarrhée se manifestent typiquement dans les six à huit premières semaines de traitement, alors que les toxicités hépatiques surviennent environ cinq à six semaines après le début du traitement13,15. L’ensemble des toxicités gastro-intestinales dans cette étude est survenu plus tardivement avec un délai d’apparition médian de 169 jours, soit environ 24 semaines.
Les réactions indésirables fatales des ICIs sont rares, de l’ordre de 0,3 à 1,3 %, et touchent généralement les systèmes neurologique et cardiaque13,15,17. Une seule toxicité cardiaque, soit une myocardite de grade 4, est survenue en cours de suivi (1/94, 1 %).
Les patients atteints d’une maladie auto-immune préexistante seraient plus à risque de présenter des RIMI3,17. Typiquement, ces sujets ayant été exclus des essais cliniques, les données sont limitées14,15. Parmi les 16 comorbidités auto-immunes préexistantes collectées, quatre ont été exacerbées en cours de suivi (25 %). Des RIMI sont survenues à huit reprises sans être en lien avec la maladie auto-immune sous-jacente (8/16, 50 %). Dans tous les cas, les symptômes des toxicités rapportées étaient considérés comme peu sévères.
Les RIMI se présentent majoritairement en quelques semaines à six mois après le début du traitement, mais peuvent apparaître jusqu’à un an après sa fin13,17,18. Les résultats obtenus dans le cadre du présent projet de recherche concordent avec les données de la littérature sur le sujet. En effet, la moitié des premiers épisodes de RIMI rencontrées est survenue dans une fenêtre d’approximativement deux mois. Parmi l’ensemble des épisodes de RIMI, 31 sont apparus après l’arrêt du traitement (31 %). À la lumière des résultats obtenus, il apparaît essentiel d’assurer un suivi étroit de la tolérance des ICIs dans les premiers mois de traitement, puis d’être vigilant quant à toute manifestation de nouveaux symptômes après l’arrêt de l’immunothérapie.
Les recommandations pour la prise en charge des RIMI légères à modérées selon les lignes directrices de l’ESMO, de l’ASCO et du NCCN consistent en une gestion symptomatique et un suivi étroit des patients. L’arrêt du traitement et l’ajout d’une corticothérapie peuvent s’avérer nécessaires pour certaines RIMI de grade 2, ou si aucune amélioration n’est notée malgré des soins standards. En présence de toxicité de grade 3, l’immunothérapie devrait être suspendue, puis une corticothérapie à haute dose débutée. Une thérapie immunosuppressive additionnelle et une hospitalisation peuvent être requises pour les cas réfractaires ou sévères. La réduction de dose des ICIs en cas de RIMI n’est pas recommandée par manque de preuves d’efficacité et de sécurité. Une suspension du traitement ou son arrêt devrait plutôt être privilégié. En présence de toxicité de grade 4, le traitement est généralement cessé de façon définitive. Toutefois, certains désordres endocriniens font exception et peuvent être maîtrisés avec une thérapie hormonale13–15.
La moitié des premiers épisodes de RIMI pour lesquels une intervention en lien avec l’immunothérapie a été effectuée a été prise en charge dès l’apparition de la toxicité. En moyenne, le délai avant la suspension ou l’arrêt définitif du traitement est de quatre jours. Ces résultats illustrent la rapidité avec laquelle les cliniciens réagissent lorsqu’une RIMI est suspectée. Aucune modification de dose n’a été réalisée sur la base d’une réaction indésirable liée aux ICIs, tel que recommandé par les lignes directrices. En outre, la majorité des épisodes pour lesquels aucune intervention en lien avec l’immunothérapie n’a été effectuée sont de grade 1 (55/65, 85 %). Les épisodes de grade 3 et 4 pour lesquels aucune intervention n’a été notée s’expliquent en majorité par le fait que l’ICI avait déjà été suspendu ou arrêté lors du premier épisode de RIMI. La suspension ou l’arrêt définitif du traitement est principalement rapporté lors d’épisodes de RIMI de grade 2 et 3 (28/36, 78 %), ce qui correspond à la prise en charge recommandée13–15.
Des corticostéroïdes topiques ont été ajoutés pour la gestion de l’ensemble des épisodes de réactions indésirables cutanées légères à modérées. Presque la totalité des épisodes n’ayant pas nécessité l’ajout d’un traitement immunomodulateur était de grade 1 ou 2 (41/43, 95 %). Les deux seuls épisodes de RIMI ayant entraîné la prescription d’infliximab étaient une colite et une gastrite de grade 3. Enfin, la majorité des épisodes de RIMI ayant mené à une hospitalisation sont survenus lors de réactions indésirables de grade 3 ou 4 (13/16, 81 %). L’ensemble de ces résultats correspond à la prise en charge recommandée dans la littérature scientifique13–15.
Un plan de sevrage est primordial lorsqu’une corticothérapie systémique est prescrite chez les patients ayant présenté des RIMI13–15. Seul un épisode n’a pas mené à l’élaboration d’un plan de sevrage parmi les 41 où une corticothérapie par voie orale ou intraveineuse a été entreprise. Cet événement s’explique par le décès, deux jours après l’administration de méthylprednisolone intraveineuse, du patient ayant présenté une pneumonie d’origine inconnue. Les durées médiane et moyenne des sevrages complétés étaient respectivement de 28 et 41 jours (ÉT : 37). Les lignes directrices font majoritairement référence à un schéma de diminution graduelle sur une période de quatre à six semaines13–15. La pratique actuelle à l’HRR quant au sevrage de la corticothérapie systémique est donc adéquate.
Alors que le rôle du pharmacien est bien établi dans la littérature scientifique pour la prise en charge des patients sous chimiothérapie, peu d’études concernant le suivi des patients sous immunothérapie ont été publiées23. Les quelques articles sur le sujet laissent présager que le pharmacien en oncologie détient une place de choix au sein de l’équipe multidisciplinaire afin d’optimiser la prise en charge et de minimiser les RIMI33–36. Cependant, aucune demande de consultation officielle auprès d’un pharmacien n’a été formulée dans le cadre de cette étude. Il est possible que les hémato-oncologues aient réquisitionné verbalement l’avis du pharmacien présent dans l’aire médicale et que l’information n’ait pas pu être colligée dans le dossier-patient compte tenu du devis rétrospectif de l’étude.
Cette étude présente certaines limites. Tout d’abord, la période de suivi n’était pas la même pour l’ensemble des patients. Le suivi médian étant inférieur à un an, l’incidence cumulée des RIMI à 12 mois pourrait s’avérer sous-estimée. Malgré tout, 75 % des RIMI sont survenues dans les trois mois suivant le début du traitement et les patients ont tous été suivis minimalement pendant six mois, ce qui permet d’améliorer la validité interne de l’étude. Par ailleurs, des biais d’information sont présents : une des chercheuses a réalisé un stage clinique en hémato-oncologie lors de la période de suivi à l’étude, et la collecte de données a été réalisée par deux personnes. Un prétest de l’outil a été réalisé afin de limiter l’impact de ce biais. Il est important de noter que les variables liées aux patients ont été comptabilisées en double pour deux sujets, puisqu’ils ont reçu plus d’un schéma de traitement comportant un ICI lors de la période à l’étude. Toutefois, les répercussions de cet élément sont jugées minimes puisque ces patients représentent seulement 2 % de l’échantillon. L’impact des traitements anticancéreux concomitants reçus par les patients n’a pas été analysé et constitue un facteur confondant quant à l’incidence de certaines toxicités. Par ailleurs, des données sont manquantes pour quelques RIMI, entre autres en ce qui concerne le grade de sévérité (5/74, 7 %). Ce constat était attendu compte tenu du devis rétrospectif de l’étude. Lorsque le grade d’une RIMI était absent, mais que des résultats d’examen ou de laboratoire permettaient son interprétation, les chercheurs l’ont extrapolé, ce qui peut avoir entraîné un biais d’information. Les données quant à la prise en charge des RIMI traitées en externe n’ont pas toutes pu être collectées en raison notamment de l’accès refusé au Dossier santé Québec dans le cadre d’une recherche rétrospective. Cet élément peut limiter la description de la gestion de certaines réactions indésirables. En raison du devis rétrospectif, il est attendu que le délai avant l’apparition des RIMI soit surestimé et que celui avant la prise en charge soit sous-estimé. Concrètement, il est possible que des symptômes de RIMI soient apparus largement avant leur constat par l’équipe traitante et que la gestion des toxicités ait été retardée. Enfin, la petite taille de l’échantillon affecte la validité externe de l’étude en limitant la généralisation des résultats, puisque certains traitements étaient représentés en plus faible proportion.
Cette étude comporte également plusieurs forces. Les patients ont été choisis par séries consécutives, ce qui limite le biais de sélection. Le biais d’information est atténué puisque le devis rétrospectif est moins à risque de modifier la pratique des professionnels. D’un autre côté, le faible nombre de critères d’exclusion augmente les validités interne et externe de l’étude. Les résultats pourront vraisemblablement être généralisés à d’autres établissements de santé et de services sociaux au Québec ayant une population et une offre de soins similaires à celles de l’HRR. L’intérêt de ce projet réside particulièrement dans la recherche de pistes de solution afin d’améliorer le suivi par les pharmaciens et la prise en charge actuelle des RIMI à l’HRR. Cette étude pourra contribuer à l’enrichissement de la littérature sur le sujet et à l’amélioration de la pratique dans divers établissements de santé où le suivi par les pharmaciens n’est pas clairement établi.
Au total, 51 patients suivis en hémato-oncologie à l’HRR (54 %) ont présenté au moins une RIMI entre le 1er septembre 2017 et le 30 novembre 2019. Parmi les 94 sujets à l’étude, 28 % ont présenté une toxicité endocrinienne, 17 %, une toxicité cutanée et 15 %, une toxicité digestive. Plus d’un épisode d’une même RIMI est survenu chez 18 patients. La majorité des RIMI étaient de grade 1 ou 2, alors que moins de 20 % des patients ont été affectés par une toxicité de grade 3 ou 4. Onze patients ont dû cesser leur traitement en raison d’une RIMI, mais aucun n’en est décédé. Le délai médian calculé avant l’apparition d’un premier épisode de RIMI était de 63 jours. De manière plus générale, les toxicités sont apparues après l’arrêt de l’immunothérapie dans 31 % des cas. À la lumière des résultats obtenus, le rôle du pharmacien à l’HRR réside potentiellement dans la consolidation de l’enseignement initial auprès des patients après environ deux mois de traitement. Ce suivi permettra d’améliorer la prise en charge des individus sous immunothérapie. En effet, une reconnaissance et un traitement précoce des RIMI réduisent le risque de complications pouvant menacer la vie du patient, de même que l’arrêt prématuré des ICIs. Enfin, une étude concernant les facteurs de risque de présenter des RIMI pourrait justifier la sélection de patients pour lesquels un suivi étroit de la pharmacothérapie est nécessaire, puisque ces facteurs demeurent controversés dans la littérature scientifique.
Cet article comporte une annexe; elle est disponible sur le site de Pharmactuel (www.pharmactuel.com).
Les auteurs ont reçu un financement pour effectuer cette étude. Sébastien Fortin détient une bourse de chercheur junior 1 du Fonds de recherche du Québec–Santé. Mélanie Lachapelle et Catherine Poitras sont lauréates de bourses étudiantes du ministère de la Santé et des Services sociaux.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
1. Comité consultatif des statistiques canadiennes sur le cancer. Statistiques canadiennes sur le cancer. [en ligne] http://www.cancer.ca/~/media/cancer.ca/CW/cancer%20information/cancer%20101/Canadian%20cancer%20statistics/Canadian-Cancer-Statistics-2019-FR.pdf?la=fr-CA (site visité en janvier 2020).
2. Brenner DR, Weir HK, Demers AA, Ellison LF, Louzado C, Shaw A et al. Projected estimates of cancer in Canada in 2020. CMAJ 2020;192: E199–e205.

3. Comont T, Belliere J, Sibaud V, Alric L, Meyer N, Mazieres J et al. Immune-related adverse events after immune checkpoints inhibitors in 2019: An update. Rev Med Interne 2020; 41:37–45.
4. Seidel JA, Otsuka A, Kabashima K. Anti-PD-1 and anti-CTLA-4 therapies in cancer: Mechanisms of action, efficacy, and limitations. Front Oncol 2018;8:86.

5. Buchbinder EI, Desai A. CTLA-4 and PD-1 pathways: Similarities, differences, and implications of their inhibition. Am J Clin Oncol 2016;39:98–106.

6. Bristol-Myers Squibb Canada. Monographie de produit : Yervoy. [en ligne] https://www.bms.com/assets/bms/ca/documents/productmonograph_fr/YERVOY_FR_PM.pdf (site visité en janvier 2020).
7. Merck Canada. Monographie de produit : Keytruda. [en ligne] https://www.merck.ca/static/pdf/KEYTRUDA-PM_F.pdf (site visité en janvier 2020).
8. Bristol-Myers Squibb Canada. Monographie de produit : Opdivo. [en ligne] https://www.bms.com/assets/bms/ca/documents/productmonograph_fr/OPDIVO_FR_PM.pdf (site visité en janvier 2020).
9. Sanofi-Aventis. Monographie de produit : Libtayo. [en ligne] http://products.sanofi.ca/fr/libtayo.pdf (site visité en janvier 2020).
10. Hoffman-La Roche Limitée. Monographie de produit : Tecentriq. [en ligne] https://www.rochecanada.com/PMs_Fr/Tecentriq/Tecentriq_PM_F.pdf (site visité en janvier 2020).
11. EMD Serrono. Monographie de produit : Bavencio. [en ligne] https://www.pfizer.ca/sites/default/files/201911/BAVENCIO_PM_225974_06Nov2019_FR.pdf (site visité en janvier 2020).
12. AstraZeneca Canada. Monographie de produit : Imfinzi. [en ligne] https://www.astrazeneca.ca/content/dam/az-ca/frenchassets/Ourmedicines/imfinzi-product-monograph-fr.pdf (site visité en janvier 2020).
13. Haanen J, Carbonnel F, Robert C, Kerr KM, Peters S, Larkin J et al. Management of toxicities from immunotherapy : ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017;28:iv119–iv42.
14. Brahmer JR, Lacchetti C, Schneider BJ, Atkins MB, Brassil KJ, Caterino JM et al. Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy: American society of clinical oncology clinical practice guideline. J Clin Oncol 2018;36:1714–68.

15. National Comprehensive Cancer Network. Management of immunotherapy-related toxicities: NCCN clinical practice guidelines in oncology. [en ligne] https://www.nccn.org/professionals/physician_gls/pdf/immunotherapy.pdf (site visité en janvier 2020).
16. National Institute of Health and National Cancer Institute. Common terminology criteria for adverse events (CTCAE). [en ligne] https://ctep.cancer.gov/protocoldevelopment/electronic_applications/docs/CTCAE_v5_Quick_Reference_5x7.pdf (site visité en janvier 2020).
17. Martins F, Sofiya L, Sykiotis GP, Lamine F, Maillard M, Fraga M et al. Adverse effects of immune-checkpoint inhibitors: Epidemiology, management and surveillance. Nat Rev Clin Oncol 2019;16:563–80.
18. Michot JM, Bigenwald C, Champiat S, Collins M, Carbonnel F, Postel-Vinay S et al. Immune-related adverse events with immune checkpoint blockade: A comprehensive review. Eur J Cancer 2016;54:139–48.
19. Bertrand A, Kostine M, Barnetche T, Truchetet ME, Schaeverbeke T. Immune related adverse events associated with anti-CTLA-4 antibodies: Systematic review and meta-analysis. BMC Med 2015;13:211.

20. Wang PF, Chen Y, Song SY, Wang TJ, Ji WJ, Li SW et al. Immune-related adverse events associated with anti-PD-1/PD-L1 treatment for malignancies: A meta-analysis. Front Pharmacol 2017;8:730.

21. Kumar V, Chaudhary N, Garg M, Floudas CS, Soni P, Chandra AB. Current diagnosis and management of immune related adverse events (irAEs) induced by immune checkpoint inhibitor therapy. Front Pharmacol 2017;8:49.

22. Naidoo J, Page DB, Li BT, Connell LC, Schindler K, Lacouture ME et al. Toxicities of the anti-PD-1 and anti-PD-L1 immune checkpoint antibodies. Ann Oncol 2015;26:2375–91.

23. Shank BR, Schwartz RN, Fortner C, Finley RS. Advances in oncology pharmacy practice. Am J Health Syst Pharm 2015;72:2098–100.
24. Régie de l’assurance maladie du Québec. Liste des médicaments - Établissements. [en ligne] https://www.ramq.gouv.qc.ca/sites/default/files/documents/liste-med-etab-2020-09-30-fr.pdf (site visité le 4 octobre 2020).
25. Sibaud V. Dermatologic reactions to immune checkpoint inhibitors: Skin toxicities and immunotherapy. Am J Clin Dermatol 2018;19:345–61.
26. Si X, He C, Zhang L, Liu X, Li Y, Wang H et al. Management of immune checkpoint inhibitor-related dermatologic adverse events. Thorac Cancer 2020;11:488–92.
27. Wolchok JD, Chiarion-Sileni V, Gonzalez R, Rutkowski P, Grob JJ, Cowey CL et al. Overall survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med 2017;377:1345–56.

28. Osorio JC, Ni A, Chaft JE, Pollina R, Kasler MK, Stephens D et al. Antibody-mediated thyroid dysfunction during T-cell checkpoint blockade in patients with non-small-cell lung cancer. Ann Oncol 2017;28:583–9.
29. Barroso-Sousa R, Barry WT, Garrido-Castro AC, Hodi FS, Min L, Krop IE et al. Incidence of endocrine dysfunction following the use of different immune checkpoint inhibitor regimens: A systematic review and meta-analysis. JAMA Oncol 2018;4:173–82.

30. Groupe OnCible. Guide OnCible. [en ligne] https://ontargetonco.com/fr (site visité le 5 novembre 2020).
31. Wang Y, Abu-Sbeih H, Mao E, Ali N, Ali FS, Qiao W et al. Immune-checkpoint inhibitor-induced diarrhea and colitis in patients with advanced malignancies: retrospective review at MD Anderson. J Immunother Cancer 2018;6:37.

32. Cramer P, Bresalier RS. Gastrointestinal and hepatic complications of immune checkpoint inhibitors. Curr Gastroenterol Rep 2017;19:3.
33. Renna CE, Dow EN, Bergsbaken JJ, Leal TA. Expansion of pharmacist clinical services to optimize the management of immune checkpoint inhibitor toxicities. J Oncol Pharm Pract 2019;25:954–60.
34. Gazze G. Combination therapy for metastatic melanoma: a pharmacist’s role, drug interactions & complementary alternative therapies. Melanoma Manag 2018;5:MMT07.
35. Gazze G. Pharmacist’s role in optimizing therapy of the newer agents for the treatment of metastatic melanoma. Melanoma Manag 2015; 2:75–82.
36. Medina P, Jeffers KD, Trinh VA, Harvey RD. The role of pharmacists in managing adverse events related to immune checkpoint inhibitor therapy. J Pharm Pract 2020;33:338–49.

*Mélanie Lachapelle et Catherine Poitras ont contribué de façon équivalente à la rédaction de cet article ( Return to Text )
PHARMACTUEL , Vol. 55 , No. 1 , 2022