Asma Ghorbaniyanamirkhiz, Pharm.D.1,2*, Sophie Léveillé, Pharm.D.1,2,3*, Danielle Fany Ngontié Tcheudjio, Pharm.D.1,2,4*, Sandra Savignac, Pharm.D.1,2,5*, Noémie Parent6, Thi Phuong Thao Luu, B.Pharm., M.Sc.7
Reçu le 10 mai 2021: Accepté après révision par les pairs le 30 octobre 2021
Résumé
Objectif : Décrire un cas de rhabdomyolyse avec insuffisance rénale aiguë possiblement attribuable à la prise d’abiratérone en association avec la rosuvastatine.
Résumé du cas : Un patient de 81 ans s’est présenté à l’urgence en raison d’une altération de son état général depuis trois semaines. Les analyses de laboratoire ont révélé une créatine phosphokinase à plus de 7000 unités internationales par litre et une créatinine sérique allant jusqu’à 400 μmol/L, soit plus de quatre fois sa valeur de base. Le patient prenait de l’abiratérone depuis quelques mois et une statine depuis plusieurs années. Ses signes cliniques et ses symptômes ont commencé à se résorber quelques jours après l’arrêt des deux médicaments et l’instauration d’une hydratation par voie intraveineuse.
Discussion : On trouve près d’une dizaine de rapports de cas de rhabdomyolyse associée à la prise d’abiratérone dans la littérature. Selon l’algorithme de Naranjo, il est possible que la réaction indésirable du patient soit liée à la prise d’abiratérone, mais la contribution d’un autre médicament, comme la rosuvastatine, ou d’un autre facteur, comme l’hypokaliémie ou l’âge avancé, ne peut être exclue. Pour traiter une rhabdomyolyse, l’arrêt des médicaments potentiellement en cause et de ceux pouvant précipiter une insuffisance rénale aiguë, l’instauration d’une hydratation par voie intraveineuse et la correction des déséquilibres électrolytiques sont souvent nécessaires. Ce cas réitère l’importance d’être prudent lors de l’association de l’abiratérone avec d’autres médicaments pouvant engendrer des myopathies ou une rhabdomyolyse.
Conclusion : L’utilisation concomitante d’abiratérone et d’une statine nécessite un suivi étroit, particulièrement chez les patients présentant des facteurs de risque de rhabdomyolyse.
Mots clés : Abiratérone, cancer de la prostate métastatique, créatine phosphokinase, insuffisance rénale aiguë, rhabdomyolyse, statine
Abstract
Objective : To describe a case of rhabdomyolysis with acute renal failure possibly associated with the use of abiraterone and rosuvastatin.
Case summary : An 81-year-old patient presented to the emergency department because his health had been deteriorating for the past 3 weeks. Laboratory tests revealed a creatine phosphokinase of more than 7000 IU/L and a serum creatinine of up to 400 μmol/L, which was more than four times his baseline value. The patient had been taking abiraterone for several months and a statin for several years. His clinical signs and his symptoms began to resolve a few days after the two drugs had been discontinued and intravenous hydration initiated.
Discussion : There are about a dozen case reports of rhabdomyolysis associated with the use of abiraterone in the literature. According to Naranjo’s algorithm, it is possible that the patient’s adverse reaction was related to his use of abiraterone. However, the contribution of another drug, such as rosuvastatin, or another factor, such as hypokalemia or advanced age, cannot be ruled out. To treat rhabdomyolysis, withdrawing the potentially culprit drugs and those that can precipitate acute renal failure, initiating intravenous hydration, and correcting the electrolyte imbalances are often necessary. This case serves as a reminder of the importance of exercising caution when combining abiraterone with other drugs that can cause myopathies or rhabdomyolysis.
Conclusion : The concomitant use of abiraterone and a statin requires close monitoring, especially in patients with rhabdomyolysis risk factors.
Keywords : Abiraterone, acute renal failure, creatine phosphokinase, metastatic prostate cancer, rhabdomyolysis, statin
L’abiratérone est un inhibiteur de la biosynthèse des androgènes qui exerce son effet par l’entremise de l’inhibition de l’isoenzyme CYP171. Elle engendre ainsi une réduction de la production d’androgènes dans les testicules, les glandes surrénales et les tissus tumoraux1. L’abiratérone est indiquée au Canada dans le traitement du cancer de la prostate métastatique résistant à la castration en association avec la prednisone à la dose de 5 mg deux fois par jour2–4. Elle est aussi indiquée dans le traitement du cancer de la prostate métastatique hormono-sensible nouvellement diagnostiqué et à risque élevé en association avec la prednisone à la dose de 5 mg une fois par jour et avec un traitement anti-androgénique5.
Les effets indésirables les plus signalés dans les essais cliniques de phase 3 sont l’hypertension, la rétention liquidienne, l’hypokaliémie ainsi qu’une augmentation de la concentration d’alanine aminotransférase (ALT) et/ou d’aspartate aminotransférase (AST)3–5. Au niveau des glandes surrénales, l’inhibition de l’isoenzyme CYP17 par l’abiratérone engendre aussi une production plus importante de minéralocorticoïdes, ce qui explique la fréquence accrue des effets indésirables associés aux minéralocorticoïdes, y compris l’hypertension et l’hypokaliémie, dans le groupe prenant l’abiratérone comparativement au groupe témoin, indépendamment de la prise de prednisone1,5. Le fabricant indique également que des cas de rhabdomyolyse avec insuffisance rénale ont été signalés après la commercialisation du médicament1.
Le cas présenté dans cet article porte sur un homme de 81 ans ayant présenté une augmentation de sa créatine phosphokinase (CPK) de plus de 7000 unités internationales par litre (UI/L) et de sa créatinine sérique allant jusqu’à 400 μmol/L, soit plus de quatre fois sa valeur de base. Ces analyses de laboratoire ont mené à un diagnostic de rhabdomyolyse avec insuffisance rénale aiguë (IRA) plusieurs mois après l’instauration de l’abiratérone prescrite pour traiter un cancer de la prostate avec métastases osseuses. Le délai d’apparition de l’effet indésirable est l’aspect qui distingue ce cas des autres signalés dans la littérature6–11.
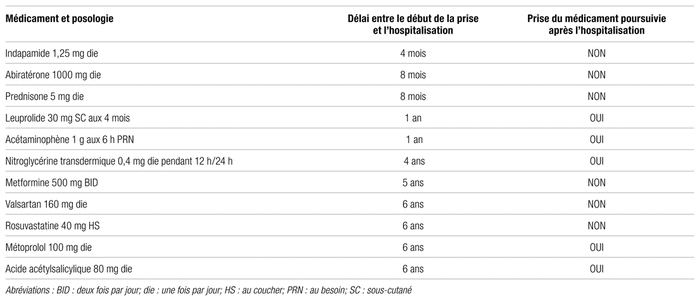
Le patient, un homme caucasien de 81 ans mesurant 168 cm et pesant 86 kg au moment de l’hospitalisation, n’a pas d’allergie connue, consomme de l’alcool occasionnellement et ne fume pas. Il est connu pour de l’hypertension artérielle, un diabète de type 2 et une maladie coronarienne athérosclérotique avec angine instable ayant mené à la pose d’une endoprothèse vasculaire environ six ans avant l’événement. Il est également traité pour un cancer de la prostate avec métastases osseuses dont le diagnostic remonte à un peu plus d’un an. Avant de commencer l’hormonothérapie, le patient a subi deux séances de radiothérapie. La liste des médicaments qu’il prenait au moment de l’événement et la date approximative du début de la prise de chacun sont détaillées dans le tableau I. Il ne prenait aucun médicament en vente libre ni aucun produit de santé naturel à ce moment.
Tableau I Médicaments du patient à l’arrivée à l’urgence

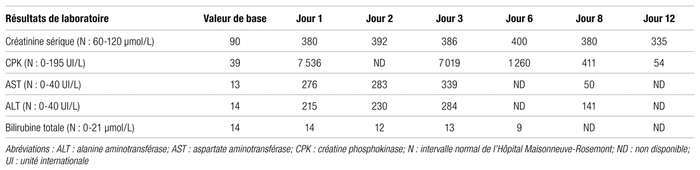
L’homme s’est présenté à l’urgence à la suite des recommandations de son omnipraticien. Il se plaignait alors de fatigue, d’une perte d’appétit et de faiblesse musculaire depuis trois semaines. Il avait de la difficulté à marcher et présentait un œdème au niveau des membres inférieurs. Le patient a été évalué à l’urgence et, après l’obtention des résultats des analyses de laboratoire pertinentes, principalement le dosage de la CPK et de la créatinine sérique, un diagnostic de rhabdomyolyse avec IRA a été posé. À son arrivée à l’urgence, une hydratation par voie intraveineuse a été instaurée ainsi qu’une réplétion du potassium sérique, dont le taux était alors de 2,8 mmol/L, par la prise orale de chlorure de potassium. Les autres électrolytes étaient dans les valeurs normales. Le valsartan, l’indapamide, la metformine, la rosuvastatine et l’abiratérone ont été cessés le lendemain de l’admission. Une diminution progressive des signes cliniques et des symptômes s’en est suivie. La prednisone, quant à elle, a été arrêtée dix jours plus tard. Le patient a finalement pu quitter l’hôpital après 15 jours d’hospitalisation. L’évolution des résultats de laboratoire pertinents se trouve dans le tableau II. On peut constater que la créatinine sérique du patient n’est jamais retournée à sa valeur de base. En effet, quatre mois après l’événement, elle était toujours à 230 μmol/L. Enfin, comme on peut le voir dans le tableau I, plusieurs médicaments ont été retirés définitivement de la pharmacothérapie du patient. Après évaluation, l’équipe traitante a jugé que la réadministration de l’abiratérone n’était pas justifiée. Au moment du congé de l’hôpital, aucun traitement en remplacement de l’abiratérone n’avait été prescrit au patient.
Tableau II Évolution des principaux résultats de laboratoire
Une autorisation écrite a été obtenue de la Directrice des services professionnels du Centre intégré universitaire de santé et de services sociaux de l’Est-de-l’Île-de-Montréal pour la publication de ce cas.
La rhabdomyolyse est un syndrome clinique caractérisé par la destruction et la nécrose du tissu musculaire. Il en résulte un relargage du contenu des cellules musculaires striées, dont la CPK, la myoglobine, le sodium, le potassium, le calcium et le phosphate, dans la circulation sanguine12. Ce phénomène peut engendrer, entre autres, une myoglobinurie, un déséquilibre électrolytique et une IRA12,13. Les manifestations cliniques et la gravité de la rhabdomyolyse peuvent varier d’un patient à l’autre. Ce syndrome cause typiquement des symptômes tels que des myalgies, une faiblesse musculaire et une pigmenturie, mais peut également être asymptomatique ou entraîner des symptômes non spécifiques12. C’est la valeur de la CPK qui permet de diagnostiquer une rhabdomyolyse12. En effet, le diagnostic est posé lorsque la valeur de celle-ci dépasse d’au moins cinq fois la limite supérieure de la normale12,13. La rhabdomyolyse peut être d’origine traumatique, comme dans le cas d’une immobilisation prolongée et d’un syndrome d’écrasement, ou non traumatique, comme dans le cas d’une infection et de variations thermiques12. Plusieurs facteurs de risque tels que l’âge avancé, l’obésité, l’insuffisance rénale chronique, le diabète, l’hypothyroïdie, la déshydratation, un trouble électrolytique, l’abus d’alcool et la consommation de drogues récréatives peuvent provoquer une rhabdomyolyse6,13,14. Certains cas sont d’origine médicamenteuse et sont engendrés par des agents comme les statines, les fibrates et les corticostéroïdes13,15. Bien que la myotoxicité des statines soit bien établie, l’incidence de la rhabdomyolyse causée par cette classe de médicaments demeure faible. Outre les facteurs de risque de rhabdomyolyse propres au patient, la dose, le type de statine, les interactions médicamenteuses, la fonction hépatique et les variations génétiques devraient être considérés afin de prévenir les toxicités musculaires liées à cette classe de médicaments16.
La monographie de l’abiratérone mentionne que des cas de myopathie et de rhabdomyolyse avec insuffisance rénale ont été signalés1. Ces événements surviennent généralement pendant le premier mois d’utilisation du médicament et disparaissent à l’arrêt de celui-ci. Bien que le mécanisme conduisant à la toxicité musculaire demeure inconnu, le fabricant recommande la prudence chez les patients prenant d’autres médicaments pouvant entraîner des myopathies ou une rhabdomyolyse1.
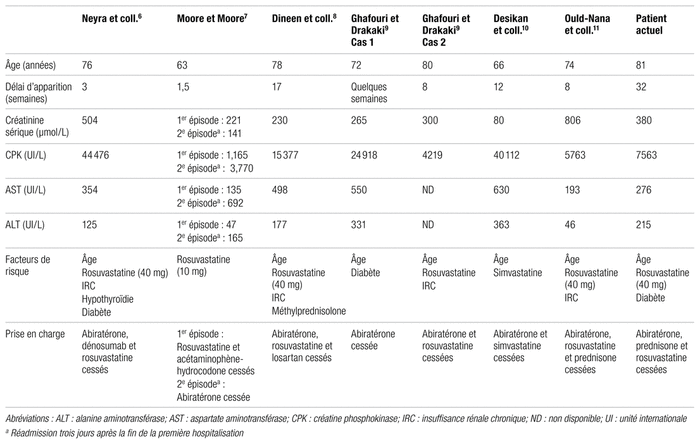
Une revue de la littérature a permis d’identifier sept rapports de cas de rhabdomyolyse induite par l’abiratérone6–11. Ils sont survenus chez des patients de 63 à 80 ans, entre dix jours et quatre mois après l’instauration de l’abiratérone6–11. La plupart de ces patients prenaient aussi une statine. Le seul changement récent à leur traitement médicamenteux consistait en l’ajout d’abiratérone et de prednisone. Comme pour le patient actuel, les patients présentaient plusieurs facteurs de risque de rhabdomyolyse, et leurs signes et symptômes se résolvaient après le début d’une hydratation par voie intraveineuse et l’arrêt des médicaments potentiellement responsables. Il est à noter que, dans l’un des cas mentionnés par Ghafouri et Drakaki ainsi que dans celui de Moore et Moore, seule la statine a été initialement cessée7,9. Comme les valeurs de CPK ont continué d’augmenter, l’abiratérone a ensuite été arrêtée. Dans l’autre cas mentionné par Ghafouri et Drakaki, le patient ne prenait pas de statine, et ses symptômes ont disparu moment du retrait de l’abiratérone9. Le tableau III compare de façon plus détaillée les différents rapports de cas trouvés dans la littérature avec le patient du présent article.
Tableau III Comparaison des rapports de cas de rhabdomyolyse induite par l’abiratérone
Moore et Ringley ont effectué une revue des données du Food and Drug Administration Adverse Event Reporting System (FAERS) de 2011 à 2017. Ils ont ainsi répertorié 44 cas de rhabdomyolyse chez des patients prenant l’abiratérone17. Environ le tiers de ces patients prenaient aussi une statine17. En outre, 24 patients ont développé une néphrotoxicité, et 36 ont requis une hospitalisation. Cependant, peu de détails sur ces cas sont disponibles dans le système FAERS. Il est donc difficile d’établir un lien de causalité entre le médicament et l’événement indésirable17.
Plusieurs hypothèses ont été avancées pour expliquer la survenue d’une rhabdomyolyse induite par l’abiratérone. Selon le fabricant, ce médicament est métabolisé au niveau hépatique par les isoenzymes CYP3A4 et SULT2A11. Des données in vitro ont révélé que l’abiratérone et ses métabolites peuvent inhiber le transporteur d’influx hépatique OATP1B1 et, par conséquent, diminuer le métabolisme des médicaments éliminés par cette voie1. Il est à noter que les polymorphismes d’OATP1B1 influencent la capacité de ce transporteur à éliminer les médicaments, ce qui risque d’augmenter l’exposition à ces derniers18,19. Ainsi, une des hypothèses émises par les auteurs des rapports de cas est que l’abiratérone inhiberait le métabolisme des statines en raison de l’inhibition du transporteur OATP1B16,11. Ould-Nana et coll. ont analysé le polymorphisme du variant OATP1B1*15, mais leur patient n’en était pas porteur11. Dans leur rapport de cas, Dineen et coll. suggèrent que la prise concomitante d’une statine et d’abiratérone pourrait entraîner une hépatotoxicité, provoquant à son tour une réduction du métabolisme des deux médicaments et donc une plus grande exposition à ces molécules, ce qui entraînerait une rhabdomyolyse8. Dans le même ordre d’idées, Desikan et coll. mentionnent la survenue possible d’un événement comme l’obstruction des voies biliaires qui compromettrait l’élimination de ces médicaments et pourrait aussi mener à une rhabdomyolyse10.
À notre connaissance, il s’agit du premier rapport de cas mentionnant une rhabdomyolyse attribuable à l’abiratérone survenue aussi tardivement, soit environ huit mois après l’instauration du médicament. En effet, dans les autres cas, l’apparition a été plus rapide, soit de quelques semaines à au plus quatre mois après le début du traitement6–11.
Dans la plupart des rapports de cas, l’abiratérone était prise de façon concomitante à la prednisone et à une statine6–11. Tel que mentionné précédemment, l’abiratérone est un inhibiteur sélectif et irréversible de l’isoenzyme CYP17 qui participe à la synthèse des androgènes. L’inhibition de cette dernière réduit la formation de la déhydroépiandrostérone et de l’androstènedione, deux précurseurs de la testostérone, ce qui favorise la production de minéralocorticoïdes. Une augmentation de minéralocorticoïdes entraîne alors, entre autres, une rétention hydrique, une hypertension et une hypokaliémie1,20. Le traitement du cancer de la prostate métastatique avancé par l’abiratérone nécessite donc la prise concomitante de prednisone2–5. En effet, l’ajout d’un corticostéroïde à faible dose engendre une suppression de l’hormone adrénocorticotrope, ce qui diminue la fréquence et l’intensité des effets indésirables minéralocorticoïdes, dont l’hypokaliémie, un facteur de risque de rhabdomyolyse1,6,13,14. Bien que les glucocorticoïdes puissent aussi causer des myopathies, la prednisone présenterait un risque plus faible comparativement à d’autres corticostéroïdes, particulièrement à des doses inférieures ou égales à 10 mg par jour21. D’ailleurs, aucun cas de rhabdomyolyse associée à la prednisone n’est signalé dans la monographie de la prednisone ni dans la littérature22. Quant à la rosuvastatine, la fréquence de rhabdomyolyse est inférieure à 1 %23. En fait, le risque que cet effet indésirable survienne avec les statines dépend surtout de la dose et des interactions16. Dans le cas du patient présenté, la dose de 40 mg de rosuvastatine qu’il prenait est considérée comme élevée23. De plus, comme il prenait cette statine depuis plusieurs années, on ne peut exclure une augmentation de la concentration de cette dernière causée par une interaction avec l’abiratérone.
Des cas de rhabdomyolyse sont aussi mentionnés avec l’indapamide, la metformine et le valsartan, soit les trois autres médicaments qui ont été cessés chez ce patient dans le contexte d’IRA. Dans le cas de l’indapamide, on soupçonnait qu’une hypokaliémie grave inférieure à 2 mmol/L était responsable de la rhabdomyolyse24–26. Quant à la metformine, les patients se présentaient en état d’acidose lactique, un autre facteur de risque de rhabdomyolyse27–29. Le valsartan, quant à lui, était associé au sacubitril avec ou sans statine30–32. Les circonstances entourant la rhabdomyolyse chez le patient actuel ne concordent donc pas avec celles de ces rapports de cas. En outre, l’état du patient s’est amélioré malgré la poursuite des autres médicaments, soit le leuprolide, l’acétaminophène, la nitroglycérine, le métoprolol et l’acide acétylsalicylique, ce qui réduit leur contribution potentielle. Enfin, le patient était d’un âge avancé et souffrait de diabète de type 2, deux autres facteurs de risque de rhabdomyolyse6,13,14.
En tenant compte du tableau clinique et des caractéristiques du patient, le score de Naranjo obtenu est de quatre, ce qui signifie que la rhabdomyolyse pourrait être attribuable à la prise d’abiratérone33. En effet, il existe plusieurs rapports de cas sur le sujet. Par ailleurs, la rhabdomyolyse est apparue après l’instauration de l’abiratérone et a été confirmée par des données cliniques. Cependant, on ne peut exclure d’autres causes. Bien qu’il y ait eu une amélioration de l’état du patient à la suite du retrait de l’abiratérone, la statine a également été cessée au moment de l’admission, ce qui laisse planer un doute quant à sa possible contribution à l’événement. De plus, comme la condition oncologique du patient s’est peu amélioré avec l’abiratérone, sa réadministration n’était pas justifiée. L’évaluation du lien de causalité devient alors encore plus difficile.
Lors d’une présomption ou d’une confirmation de rhabdomyolyse, il faut retirer les agents potentiellement en cause et les médicaments pouvant précipiter une IRA. Afin de prévenir l’apparition ou la détérioration d’une IRA, une hydratation par voie intraveineuse est commencée dès que possible14,34. Étant donné le risque de rétention liquidienne, il est recommandé d’alterner entre un soluté physiologique salin à 0,9 % et une solution de glucose à 5 % et d’ajouter du bicarbonate de sodium35. L’objectif de l’hydratation est d’obtenir une diurèse entre 200 mL/h et 300 mL/h35. Le pH urinaire devrait être maintenu à plus de 6,5 pour réduire la toxicité des pigments de l’hème35. Il est également important de suivre de près et de corriger rapidement les déséquilibres électrolytiques et métaboliques. Dans l’objectif de prévenir l’hypercalcémie et la précipitation phosphocalcique, les suppléments de calcium doivent être suspendus à moins de nécessité clinique, comme dans le cas d’une hypocalcémie symptomatique. Dans les cas plus graves, une thérapie de remplacement rénal pourrait être indiquée35.
Ce cas décrit l’apparition, plusieurs mois après l’instauration du traitement, d’une rhabdomyolyse accompagnée d’une IRA chez un patient âgé prenant de l’abiratérone. L’arrêt des médicaments potentiellement en cause et de ceux pouvant contribuer à la détérioration de la fonction rénale, accompagné de l’instauration d’une hydratation par voie intraveineuse et de la correction des troubles électrolytiques ont contribué à la résolution progressive des signes cliniques et des symptômes du patient. Plusieurs cas semblables sont répertoriés dans la littérature, mais la rhabdomyolyse est survenue plus rapidement chez l’ensemble des patients6–11. De plus, la majorité d’entre eux prenaient aussi une statine. Ainsi, la contribution de la rosuvastatine ne peut être exclue dans le cas présent. Il est même possible que son association avec l’abiratérone ait augmenté le risque de rhabdomyolyse. Pour l’instant, il n’est pas nécessaire d’éviter complètement la prise concomitante de ces deux agents chez tous les patients. Toutefois, ce cas souligne l’importance de faire preuve de prudence, particulièrement en présence d’autres facteurs de risque de rhabdomyolyse tels que l’âge avancé, l’obésité, l’insuffisance rénale chronique et le diabète6,13,14. À cette fin, un suivi plus étroit des signes et symptômes de myopathies et de rhabdomyolyse serait tout indiqué chez ces patients.
Cet article a été écrit dans le cadre du cours PHA6210 – Communication scientifique en pharmacie de la Faculté de pharmacie de l’Université de Montréal. Les auteures tiennent à remercier les responsables du cours ainsi que les collaborateurs pour leurs commentaires ayant permis de soumettre une version améliorée du manuscrit. Une autorisation écrite a été obtenue de ces personnes.
Les auteurs n’ont déclaré aucun financement pour la rédaction de cet article.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
1. Janssen. Monographie de produit : Zytiga (4 janvier 2021). [en ligne] https://www.janssen.com/canada/sites/www_janssen_com_canada/files/prod_files/live/zytiga_cpmf.pdf (site visité le 24 janvier 2021).
2. Santé Canada. Sommaire des motifs de décision - ZytigaMC - Santé Canada. [en ligne] https://hpr-rps.hres.ca/reg-content/sommaire-motif-decision-detailOne.php?linkID=SBD00169 (site visité le 14 février 2021).
3. de Bono JS, Logothetis CJ, Molina A, Fizazi K, North S, Chu L et al. Abiraterone and increased survival in metastatic prostate cancer. N Engl J Med 2011;364:1995–2005.

4. Ryan CJ, Smith MR, Fizazi K, Saad F, Mulders PFA, Sternberd CN et al. Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer (COU-AA-302): final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol 2015;16:152–60.

5. Fizazi K, Tan NP, Fein L, Matsubara N, Rodriguez-Antolin A, Alekseev BY et al. Abiraterone plus prednisone in metastatic, castration-sensitive prostate cancer. N Engl J Med 2017;377: 352–60.

6. Neyra JA, Rocha NA, Bhargava R, Vaidya OU, Hendricks AR, Rodan AR. Rhabdomyolysis-induced acute kidney injury in a cancer patient exposed to denosumab and abiraterone: a case report. BMC Nephrol 2015;16:1–6.

7. Moore DC, Moore A. Abiraterone-induced rhabdomyolysis: a case report. J Oncol Pharm Pract 2017;23:148–51.

8. Dineen M, Hansen E, Guancial E, Sievert L, Deepak S. Abiraterone-induced rhabdomyolysis resulting in acute kidney injury: a case report and review of the literature. J Oncol Pharm Pract 2018;24:314–8.

9. Ghafouri S, Drakaki A. Abiraterone-induced rhabdomyolysis in prostate cancer: a report of two cases and review of the literature. Ann Clin Case Rep 2018;3:1–3.
10. Desikan SP, Sobash P, Fisher A, Desikan R. Statin-induced rhabdomyolysis due to pharmacokinetic changes from biliary obstruction in a patient with metastatic prostate cancer. J Investig Med High Impact Case Rep 2020;8:1–4.
11. Ould-Nana I, Cillis M, Gizzi M, Gillion V, Hantson P, Gerard L. Rhabdomyolysis and acute kidney injury induced by the association of rosuvastatin and abiraterone: a case report and review of the literature. J Oncol Pharm Pract 2021;27:216–9.

12. Long B, Koyfman A, Gottlieb M. An evidence-based narrative review of the emergency department evaluation and management of rhabdomyolysis. Am J Emerg Med 2019;37:518–23.

13. Zimmerman JL, Shen MC. Rhabdomyolysis. Chest 2013;144:1058–1065.

14. Bosch X, Poch E, Grau JM. Rhabdomyolysis and acute kidney injury. N Engl J Med 2009; 361:62–72.

15. Zutt R, van der Kooi AJ, Linthorst GE, Wanders RJA, de Visser M. Rhabdomyolysis: review of the literature. Neuromuscul Disord 2014;24:651–9.

16. Tournadre A. Statines, myalgies et rhabdomyolyse. Rev Rhum Ed Fr 2019;86:344–9.

17. Moore DC, Ringley JT. Rhabdomyolysis with abiraterone exposure: a brief review of the Food and Drug Administration Adverse Event Reporting System (FAERS). Ann Pharmacother 2018;52:1160–1.

18. van de Steeg E, Greupink R, Schreurs M, Nooijen IHG, Verhoeckx KCM, Hanemaaijer R et al. Drug-drug interactions between rosuvastatin and oral antidiabetic drugs occurring at the level of OATP1B1. Drug Metab Dispos 2013;41:592–601.

19. Rose RH, Neuhoff S, Abduljalil K, Chetty M, Rostami-Hodjegan A, Jamei M. Application of a physiologically based pharmacokinetic model to predict OATP1B1-related variability in pharmacodynamics of rosuvastatin. CPT Pharmacometrics Syst Pharmacol 2014;3:1–9.

20. Ang JE, Olmos D, de Bono JS. CYP17 blockade by abiraterone: further evidence for frequent continued hormone-dependence in castration-resistant prostate cancer. Br J Cancer 2009;100:671–5.

21. Pereira RM, Freire de Carvalho J. Glucocorticoid-induced myopathy. Joint Bone Spine 2011; 78:41–4.

22. Teva Canada Limitée. Monographie de produit : Teva-prednisone (7 décembre 2020). [en ligne] https://pdf.hres.ca/dpd_pm/00059253.PDF?fbclid=IwAR0L47Rmih1g5nhC1HKUVfHw2PsKOLMhH8cNE9LWJV1py4Wv6Vt8HrK5LuA (site visité le 27 octobre 2021).
23. Lexi-Drugs. Monographie de la rosuvastatine. Ann Arbor (MI): Truven Health Analytics, 1978–2021. [en ligne] https://online.lexi.com/lco/action/home?refid=4& (site visité le 24 janvier 2021).
24. Antoniadis DJ, Vavouranakis EM, Tsioufis KP, Toutouzas PK. Rhabdomyolysis due to diuretic treatment. Hellenic J Cardiol 2003;44:80–2.
25. Alamin MA, Ahmed A, Suliman AM. Severe electrolyte disturbances complicated by seizures and acute kidney injury within 10 days of starting indapamide. Cureus 2020;12:1–4.
26. Horwitz H, Woeien VA, Wiuff Petersen L, Jimenez-Solem E. Hypokalemia and rhabdomyolysis. J Pharmacol Pharmacother 2015;6:98–9.

27. Ursini F, Succurro E, Grembiale A, Arturi F. Acute rhabdomyolysis during treatment with amisulpride and metformin. Eur J Clin Pharmacol 2010;66:321–2.

28. Galea M, Jelacin N, Bramham K, White I. Severe lactic acidosis and rhabdomyolysis following metformin and ramipril overdose. Br J Anaesth 2007;98:213–5.

29. Sánchez-Rubio Ferrández L, Martínez Iturriaga S, Hurtado Gómez MF, Apiñaniz Apiñaniz R. Suicide due to massive ingestion of metformin (85 g): lactic acidosis followed by rhabdomyolysis with fatal heart damage. Farm Hosp 2013;37:166–72.
30. Faber ES, Gavini M, Ramirez R, Sadovsky R. Rhabdomyolysis after coadministration of atorvastatin and sacubitril/valsartan (EntrestoTM) in a 63-year-old woman. Drug Saf - Case Rep 2016;3:1–4.

31. Rawla P, Pradeep Raj J, George SM, Nathala P, Vellipuram AR. A rare adverse event of rhabdomyolysis caused by sacubitril/valsartan. Diseases 2019;7:1–4.

32. Previsdomini M, Graziano E, Decosterd L, Courlet P, Perren A, Ceschi A. Severe rosuvastatin accumulation with rhabdomyolysis due to drug interactions and low cardiac output syndrome. Br J Clin Pharmacol 2019;85:1616–8.

33. Naranjo CA, Busto U, Sellers EM, Sandor P, Ruiz I, Roberts E et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther 1981;30:239–45.

34. Torres PA, Helmstetter JA, Kaye, AM, Kaye AD. Rhabdomyolysis: pathogenesis, diagnosis, and treatment. Ochsner Journal 2015;15:58–69.

35. Cervellin G, Comelli I, Benatti M, Sanchis-Gomar F, Bassi A, Lippi G. Non-traumatic rhabdomyolysis: background, laboratory features, and acute clinical management. Clin Biochem 2017;50:656–62.

*Asma Ghorbaniyanamirkhiz, Sophie Léveillé, Danielle Fany Ngontié Tcheudjio et Sandra Savignac ont contribué de façon équivalente à la rédaction de cet article. ( Return to Text )
PHARMACTUEL, Vol. 55, No. 2, 2022