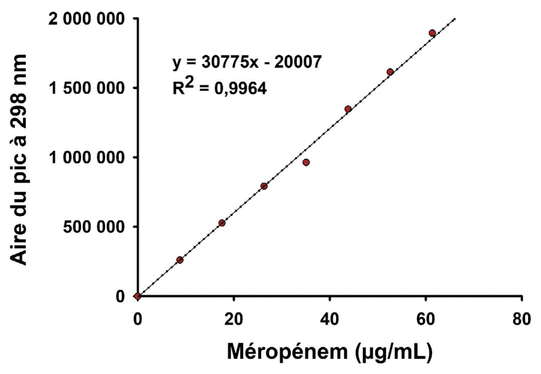
Figure 1 Courbe standard de méropénem
Audrey Vachon, B.Pharm., M.Sc.1,2, Sylvie Pilote, M.Sc.3, Érika Grimard, B.Sc.4, Benoît Drolet, B.Pharm., Ph.D.5,6, Julie Racicot, B.Pharm., M.Sc.1,2,7, Chantale Simard, B.Pharm., M.Sc., Ph.D.1,5,6
Reçu le 25 juin 2021: Accepté après révision par les pairs le 25 octobre 2021
Résumé
Objectif : Évaluer la stabilité du méropénem dilué dans le chlorure de sodium à 0,9 % en seringue de 30 mg/mL et de 40 mg/mL. Vérifier si la dilution dans l’eau stérile, aux mêmes concentrations, permettrait une stabilité supérieure et décrire la stabilité de l’antibiotique conditionné en sac de polychlorure de vinyle à des concentrations supérieures à celles ayant fait l’objet d’études.
Méthode : Le méropénem a été dilué dans le chlorure de sodium à 0,9 % ou dans l’eau stérile et mis en seringue à deux concentrations, soit 30 mg/mL et 40 mg/mL. Il a aussi été dilué dans le chlorure de sodium à 0,9 % et conditionné en sac de polychlorure de vinyle pour produire des solutions de 20,7 mg/mL et de 25 mg/mL. Tous les échantillons ont été réfrigérés, analysés et quantifiés aux temps 0, 24, 36, 42, 48, 60, 72, 84, 96, 108 et 120 heures par chromatographie liquide à haute performance.
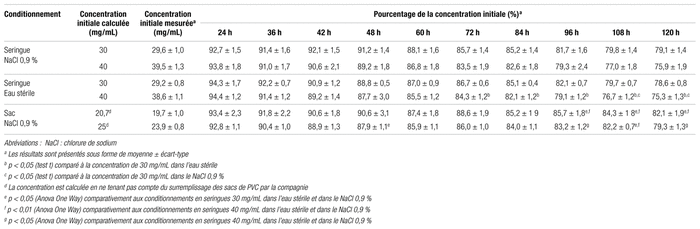
Résultats : Après une période de conservation des échantillons de 48 heures au réfrigérateur, les pourcentages de la concentration initiale étaient de 91,2 % et de 89,2 % pour les seringues de 30 mg/mL et de 40 mg/mL diluées dans le chlorure de sodium à 0,9 % contre 90,6 % et 87,9 % pour les concentrations de 20,7 mg/mL et de 25 mg/mL en sac de polychlorure de vinyle. Dans les seringues, la stabilité du méropénem dilué dans l’eau stérile n’était pas différente de celle du chlorure de sodium à 0,9 % pour chacune des concentrations analysées (p > 0,05).
Conclusion : Le méropénem conditionné en seringues et dilué dans le chlorure de sodium à 0,9 %, comme le prépare l’IUCPQ–UL, est stable d’un point de vue physico-chimique lorsqu’il est conservé au réfrigérateur et administré dans les 48 heures suivant la préparation.
Mots clés : Méropénem, préparation de médicament, stabilité de médicament
Abstract
Objective : To assess the stability of meropenem diluted in 0.9% sodium chloride in 30 and 40 mg/mL syringes. To verify whether dilution in sterile water at the same concentrations would provide better stability and to describe the stability of the antibiotic when packaged in polyvinyl chloride bags at concentrations greater than those investigated in studies.
Method : Meropenem was diluted with 0.9% sodium chloride or with sterile water and put in syringes for two concentrations: 30 mg/mL and 40 mg/mL. It was also diluted in 0.9% sodium chloride and packaged in polyvinyl chloride bags to produce 20.7 mg/mL and 25 mg/mL solutions. All the samples were refrigerated, analyzed, and quantified at times 0, 24, 36, 42, 48, 60, 72, 84, 96, 108 and 120 hours with high-performance liquid chromatography.
Results : After 48 hours of refrigeration, the percentages of the initial concentration were 91.2% and 89.2% for the 30 mg/mL and 40 mg/mL syringes diluted in 0.9% sodium chloride, and 90.6% and 87.9% for the 20.7 mg/mL and 25 mg/mL concentrations in polyvinyl chloride bags. When packaged in syringes, meropenem diluted in sterile water did not differ in stability compared to 0.9% sodium chloride for each concentration analyzed (p > 0.05).
Conclusion : Meropenem packaged in syringes and diluted in 0.9% sodium chloride, as currently prepared at the IUCPQ-UL, is physicochemically stable when stored in a refrigerator and administered within 48 hours of preparation.
Keywords : Drug preparation, drug stability, meropenem
Bien qu’ils aient été créés dans les années 1970, les antibiotiques de la classe des carbapénèmes ne sont utilisés en clinique que depuis 1986. À l’époque, leur instabilité chimique avait, entre autres, constitué un enjeu important1. Le méropénem est le deuxième agent de cette classe d’antibiotiques que la Food and Drug Administration des États-Unis a approuvé en juillet 19961. Depuis, plusieurs études de stabilité ont été effectuées dans le monde avec divers diluants, à différentes températures et concentrations. Bien que les résultats puissent varier un peu en fonction du fabricant et des préparations utilisées, il reste difficile de définir une durée de conservation du méropénem à la température ambiante et au réfrigérateur qui garantisse un traitement efficace et sûr à une concentration se situant entre 20 et 50 mg/mL2–6.
Lorsqu’il est conditionné en seringue, le méropénem a une stabilité physico-chimique qui varie notamment selon la concentration et la température d’entreposage. Des études ont montré que lorsqu’il est conditionné dans des seringues de polypropylène, qu’il est dilué dans le chlorure de sodium à 0,9 % (NaCl 0,9 %) et qu’il est conservé à 25°C, le méropénem demeure stable pendant 12 heures aux concentrations de 10 mg/mL ou de 20 mg/mL et pendant huit heures à 40 mg/mL. Ces études n’apportaient pas plus d’information sur sa stabilité lorsqu’il est réfrigéré2,3. Selon des données internes de la compagnie RMS Medical Products publiées dans le recueil Extended stability for parenteral drugs, le méropénem en seringue de 50 mg/mL dilué dans l’eau stérile, le NaCl 0,9 % ou le dextrose à 5 % (D5 %) reste stable de cinq à huit heures à température ambiante et de 23,5 à 44 heures au réfrigérateur2. La période de stabilité est, par ailleurs, plus courte lorsque le méropénem est dilué dans le D5 % et plus longue quand il est dilué dans l’eau stérile2. En somme, ces données révèlent que le diluant a aussi un effet sur la stabilité du produit conditionné en seringue.
Lorsque le méropénem est préparé dans des sacs de polychlorure de vinyle (PVC), les données sur sa stabilité physico-chimique sont disponibles presque exclusivement pour la dilution dans le NaCl 0,9 %. Encore une fois, la stabilité varie grandement selon la concentration utilisée et la température de conservation2. En 1997, Patel et Cook ont montré que le méropénem en sac de PVC dilué dans du NaCl 0,9 % à une concentration de 20 mg/mL affichait toujours 92,1 % de sa concentration initiale après 10 heures à température ambiante (de 21 °C à 26 °C) et 95,6 % après 48 heures au réfrigérateur (de 4 °C à 5 °C)4. Sept ans plus tard, Smith et coll. ont étudié le méropénem en sac de PVC, dilué dans du NaCl 0,9 %, aux concentrations de 4 mg/mL, 10 mg/mL et 20 mg/mL, et conservé au réfrigérateur. Ils ont constaté que sa stabilité atteignait sept jours à 4 mg/mL et quatre jours à 10 mg/mL ou à 20 mg/mL5. En sac de PVC, la concentration la plus élevée jamais étudiée de méropénem dilué dans le NaCl 0,9 % est de 22 mg/mL. Les auteurs ont observé que la solution contenait encore 90 % de sa concentration initiale après quatre jours au réfrigérateur, mais après seulement 17 heures à température ambiante6. Ainsi, lorsque le méropénem est prescrit en antibiothérapie intraveineuse à domicile, il ne peut être administré en sac pour perfusion continue ni en mode intermittent à l’aide d’une pompe à perfusion ambulatoire, car sa stabilité à la température ambiante ne permet pas de changer le sac une fois par 24 heures. Actuellement, seule l’administration en seringue ou en perfuseur élastomérique peut être envisagée.
À l’Institut universitaire de cardiologie et de pneumologie de Québec–Université Laval (IUCPQ–UL), le méropénem est administré aux patients hospitalisés à l’aide de seringues de polypropylène et est préparé en lots sous hotte stérile. Pour préparer les doses de 1000 mg, de 1500 mg et de 2000 mg, les fioles de 1 g sont reconstituées avec de l’eau stérile, puis diluées dans le NaCl 0,9 % et mises en seringue pour un volume final de 50 mL à des concentrations finales de 20 mg/mL, de 30 mg/mL et de 40 mg/mL, respectivement.
À l’interne, sans référence robuste, une stabilité de quatre jours au réfrigérateur était attribuée à ces préparations stériles. Toutefois, après révision de la littérature scientifique préalablement citée, on ne trouve aucune donnée appuyant une telle pratique. L’objectif de la présente étude était donc d’évaluer la stabilité, lors de l’entreposage au réfrigérateur, du méropénem préparé selon les protocoles de l’IUCPQ–UL : soit en seringues de polypropylène diluées dans du NaCl 0,9 %, à des concentrations finales de 30 mg/mL (1500 mg) et de 40 mg/mL (2000 mg). La concentration de 20 mg/mL n’a pas été incluse par souci d’économie et aussi parce qu’elle ne permettrait pas l’administration de toutes les doses recommandées par seringue (la seringue de plus gros calibre étant de 50 mL). À des fins de recherche, nous avons également étudié la stabilité du méropénem lorsque l’antibiotique était dilué dans l’eau stérile aux mêmes concentrations afin de vérifier si ce diluant permettait réellement d’accroître la période de stabilité. Parallèlement, nous avons évalué la stabilité du méropénem conditionné en sac de PVC et conservé au réfrigérateur pour vérifier si cette avenue offrait une stabilité satisfaisante, mais à des concentrations différentes de celles qui ont préalablement fait l’objet d’études; soit en sac de PVC contenant 100 mL de NaCl 0,9 % à des concentrations de 20,7 mg/mL (3000 mg/145 mL) et de 25 mg/mL (4000 mg/160 mL). Les solutés commerciaux comprennent toujours un surplus de volume qui varie d’un fabricant à l’autre. Les sacs de 100 mL de NaCl 0,9 % produits par la compagnie Baxter contiennent 110 mL ± 5 mL7. Ce surplus varie d’un échantillon à l’autre et n’a pas été pris en considération dans le calcul de la concentration des solutés de méropénem.
Les fioles commerciales de méropénem trihydraté contenant l’équivalent de 1000 mg de méropénem anhydre (Fresenius Kabi Canada, lot MCA1037) ont été reconstituées avec 14,5 mL d’eau stérile (Baxter Corporation, lot W7K22A0). Mesuré après reconstitution, le volume final totalisait 15 mL, la poudre de méropénem contenue dans la fiole de 1 g occupant un volume de 0,5 mL. Après une dilution ultérieure de l’antibiotique avec de l’eau stérile ou du NaCl 0,9 % (Baxter Corporation, lot W7L11M0), les solutions ont été conditionnées en seringues de polypropylène de 50 mL (Becton, Dickinson and Company) ou en sacs de PVC contenant 100 mL de NaCl 0,9 % (Baxter Corporation, lot P368027).
En tout, nous avons préparé six reconstitutions de méropénem en triple exemplaire sous hotte stérile à flux laminaire.
Nous avons reconstitué deux fioles de 1 g de méropénem, chacune avec 14,5 mL d’eau stérile (concentration finale de 66,7 mg/mL). À l’aide d’une seringue de 50 mL, nous avons d’abord prélevé 27,5 mL de NaCl 0,9 % ou d’eau stérile, puis 22,5 mL de la solution de méropénem reconstituée (soit 1500 mg) pour compléter le volume à 50 mL. La seringue contenait alors une quantité totale de 1500 mg de méropénem dans le diluant souhaité pour une concentration finale de 30 mg/mL.
Nous avons reconstitué deux fioles de 1 g de méropénem de la façon indiquée dans le paragraphe précédent. À l’aide d’une seringue de 50 mL, nous avons d’abord prélevé 20 mL de NaCl 0,9 % ou d’eau stérile, puis 30 mL de la solution de méropénem reconstituée (soit 2000 mg) pour compléter le volume à 50 mL. La seringue contenait alors une quantité totale de 2000 mg de méropénem dans le diluant souhaité pour une concentration finale de 40 mg/mL.
Nous avons reconstitué trois fioles de 1 g de méropénem avec 14,5 mL d’eau stérile, puis nous avons prélevé 45 mL de la solution de méropénem reconstituée (soit 3000 mg) et les avons injectés dans le sac de PVC de 100 mL. Le sac contenait alors une quantité totale de 3000 mg de méropénem dans un volume total de 145 mL. Puisque nous n’avons retiré aucun liquide du sac avant l’ajout de l’antibiotique, le volume total correspondait au volume du soluté (100 mL) et de l’antibiotique ajouté (45 mL), pour une concentration finale de 20,7 mg/mL.
Nous avons reconstitué quatre fioles de 1 g de méropénem avec 14,5 mL d’eau stérile. Nous avons ensuite prélevé 60 mL de la solution de méropénem reconstituée (soit 4000 mg), puis nous les avons injectés dans le sac de PVC de 100 mL. Le sac contenait alors une quantité de 4000 mg de méropénem dans un volume total de 160 mL, pour une concentration finale de 25 mg/mL.
Toutes les préparations ont été entreposées au réfrigérateur à une température oscillant entre 4 °C et 6 °C jusqu’au moment de l’analyse.
La concentration de méropénem a été déterminée par chromatographie liquide à haute performance (HPLC) selon la méthode décrite et validée par Mendez et coll. à l’aide du système Prominence de Shimadzu (Columbia MD) composé d’un échantillonneur automatique SIL-20AC maintenu à 6°C, d’une pompe LC-20AD et d’un détecteur UV-visible SPD-20A8. La séparation chromatographique du méropénem a été effectuée en isocratique, à 1 mL/min, en utilisant une colonne Ultrasphere ODS 5μm, 250 × 4,6 mm (Canadian Life Technologies) et une précolonne μ-Bondapack C18 (Waters). La phase mobile était constituée d’un tampon de phosphate monobasique 30 mM à un pH de 3 et d’acétonitrile (dans une proportion de 90:10). La détection a été faite à 298 nm (le pic de méropénem éluant au bout de 10 minutes).
Nous avons prélevé un échantillon de chaque préparation de méropénem, en triple exemplaire, puis l’avons dilué par un facteur de 1 pour 1000 immédiatement avant l’analyse, et à chacun des temps suivants : 0, 24, 36, 42, 48, 60, 72, 84, 96, 108 et 120 heures. Nous avons ensuite injecté 50 μL dans l’appareil. Les aires sous la courbe du pic de méropénem mesurées pour chacune des préparations aux temps de 24 à 120 heures ont été comparées à leur temps 0 respectif afin de déterminer les pourcentages encore disponibles. La pharmacopée américaine (USP) définit la stabilité d’un produit comme sa capacité à retenir au moins 90 % de la concentration initiale de l’ingrédient actif, à l’intérieur de limites spécifiques et au cours de sa période d’entreposage et d’utilisation9.
Une courbe standard (0 μg/mL–70 μg/mL) de méropénem trihydraté (Toronto Research Chemicals) a été préparée pour évaluer la linéarité de la méthode dans l’intervalle des concentrations attendues pour les dosages à venir. De même, la réplicabilité de la méthode a été déterminée en injectant et en quantifiant, le même jour, 10 échantillons de la même concentration.
Nous avons effectué les analyses statistiques du test t (deux groupes comparés) et de la variance à un facteur (Anova One-Way) (trois groupes comparés) avec le logiciel SigmaPlot 12.5 (Systat Software). Une valeur p < 0,05 était considérée comme significative. Nous avons calculé les écarts-types totaux des pourcentages de la concentration initiale en prenant la racine carrée de la somme des différentes incertitudes élevées au carré.
La linéarité de la méthode d’analyse du méropénem trihydraté a été confirmée (voir la figure 1). Un coefficient de détermination R2 de 0,9964 a été calculé pour la zone quantifiable variant de 0 à 70 μg/mL, ce qui respecte le critère de limite de linéarité pour lequel le coefficient de détermination doit être supérieur à 0,99. La courbe a ensuite été corrigée pour permettre la quantification du méropénem anhydre (sans trihydrate). La réplicabilité de la méthode d’analyse a aussi été évaluée. Un écart de moins de 5 % a été obtenu (1,9 %).
|
| ||
|
Figure 1 Courbe standard de méropénem | ||
Le tableau I regroupe plusieurs données de stabilité du méropénem réfrigéré aux concentrations étudiées. Pour le méropénem dilué dans le NaCl 0,9 %, la seringue de 30 mg/mL contenait 91,2 ± 1,4 % de la concentration initiale après 48 heures, tandis que celle de 40 mg/mL contenait 89,2 ± 1,8 % de la concentration initiale au même moment (p = 0,19). De plus, pour chacune des concentrations analysées, la stabilité du méropénem est la même qu’il soit dilué dans l’eau stérile ou dans le NaCl 0,9 % (p > 0,05). Pour le conditionnement en sac de PVC contenant du NaCl 0,9 %, le soluté concentré à 20,7 mg/mL contenait 90,6 ± 3,1 % de la concentration initiale contre 87,9 ± 1,1 % pour le soluté à 25 mg/mL après 48 heures au réfrigérateur (p >0,05).
Tableau I Stabilité du méropénem réfrigéré à une température de 4 °C à 6 °C
En outre, quels que soient le conditionnement, la concentration ou le diluant utilisé, aucune différence significative n’a été observée dans le pourcentage de la concentration initiale de méropénem jusqu’à 72 heures (p > 0,05). Toutefois, la dégradation semble plus importante pour les solutions plus concentrées : à 120 heures, la seringue de 40 mg/mL diluée dans l’eau stérile contient un pourcentage moindre de la concentration initiale de méropénem que les seringues de 30 mg/mL préparées avec le NaCl 0,9 % et l’eau stérile [75,3 ± 1,3 % vs 79,1 ± 1,4 % et 78,6 ± 0,8 %, respectivement (p < 0,05 Anova One-Way)]. Cette observation se confirme aussi lorsqu’on compare les sacs de PVC aux seringues. Après 120 heures, la préparation en sac de PVC de 25 mg/mL contient 79,3 ± 1,3 % de la concentration initiale contre seulement 75,9 ± 1,8 % et 75,3 ± 1,3 % respectivement pour les seringues de NaCl 0,9 % et d’eau stérile à 40 mg/mL (p < 0,05, Anova One-Way). Après 120 heures, la préparation en sac de PVC de 20,7 mg/mL contient 82,1 ± 1,9 % de la concentration initiale alors que les préparations en seringue de NaCl 0,9 % et d’eau stérile à 40 mg/mL ne contiennent que 75,9 ± 1,8 % et 75,3 ± 1,3 %, respectivement (p < 0,01, Anova One-Way) et celles à 30 mg/mL ne contiennent que 79,1± 1,4 % et 78,6 ± 0,8 % de la concentration initiale, respectivement (p < 0,05, Anova One-Way).
Comme on peut le voir sur la figure 2, le pourcentage de la concentration initiale de méropénem est inversement proportionnel à la durée d’entreposage au réfrigérateur (4°C à 6°C) pour les différentes préparations et concentrations testées.
|
| ||
|
Figure 2 Pourcentage de la concentration initiale de méropénem mesuré en fonction du temps d’entreposage à une température de 4 °C à 6 °Ca,b,c
| ||
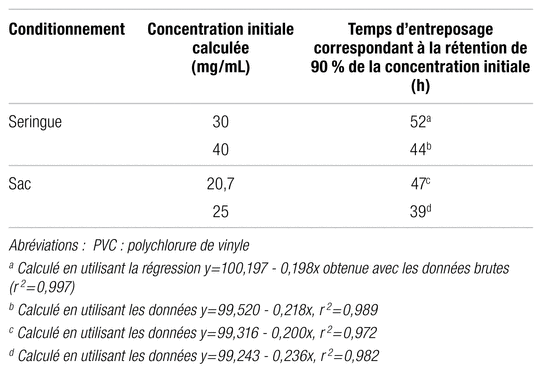
La pharmacopée américaine définit la stabilité comme la capacité d’un produit à retenir au moins 90 % de la concentration initiale de l’ingrédient actif, à l’intérieur de limites spécifiques et au cours de sa période d’entreposage et d’utilisation9. Le tableau II regroupe les différentes durées d’entreposage permettant la rétention de 90 % de la concentration initiale. Elles ont été évaluées à l’aide d’une courbe de régression linéaire calculée avec les données des 60 premières heures, lesquelles englobent la zone linéaire d’intérêt. Pour le méropénem conditionné en seringue et dilué dans le NaCl 0,9 %, la durée de stabilité calculée est de 44 et de 52 heures pour les concentrations de 40 mg/mL et de 30 mg/mL respectivement, soit une stabilité clinique extrapolée de 48 heures à des fins pratiques.
Tableau II Stabilité finale au réfrigérateur du méropénem dilué dans le NaCl 0,9 % conditionné en seringue de polypropylène et en sac de PVC, calculée à l’aide d’une courbe de régression linéaire
Le méropénem, un antibiotique à large spectre, présente une efficacité clinique contre un grand éventail d’infections à bactéries Gram négatif multirésistantes et a un bon profil d’innocuité, ce qui en fait un traitement de choix pour plusieurs indications1,5,10. Les résultats obtenus dans cette étude confirment que ce carbapénème, selon la préparation en seringue utilisée à l’IUCPQ–UL, est stable d’un point de vue physico-chimique lorsqu’il est conservé à une température de 4°C à 6°C et est administré dans les 48 heures suivant sa préparation. La période de stabilité de quatre jours utilisée auparavant devra donc être réduite à 48 heures, car les pourcentages de la concentration initiale restants dans la seringue sont alors de 91,2 % et de 89,2 % contre seulement de 81,7 % et 79,3 % à 96 heures pour les concentrations de 30 mg/mL et de 40 mg/mL, respectivement. Cette courte période de stabilité de 48 heures doit également être prise en compte dans le contexte d’une antibiothérapie par voie intraveineuse à domicile, car elle nécessite la préparation de seringues tous les deux jours par la pharmacie, sans compter les délais de livraison, ce qui peut complexifier le traitement pour certains patients.
À la lumière des données préalablement publiées, la stabilité du méropénem semble influencée par le temps d’entreposage, la concentration, le diluant utilisé et la température de conservation3–6. Dans notre étude, nous avons observé que le méropénem conservé à une température de 4°C à 6°C pendant 120 heures à une concentration plus faible est plus stable que le méropénem plus concentré, peu importe le conditionnement (seringue ou sac de PVC). Par contre, contrairement aux données de RMS Medical Products, sa stabilité quand il est dilué dans l’eau stérile n’est pas plus longue que dans le NaCl 0,9 %2. Aussi, nous avons constaté que la dégradation du méropénem est plus rapide lorsque le produit est plus concentré. Enfin, contrairement aux données de Smith et coll. et de Walker et coll., la stabilité du méropénem à 20,7 mg/mL en sac de PVC est de 48 heures, et non de quatre jours5,6.
Selon une étude récente s’étant penchée sur l’effet du pH de la solution antibiotique sur sa stabilité, le choix de l’agent tampon utilisé exerce aussi une influence sur la stabilité10. Jamieson et coll. ont étudié la stabilité du méropénem à 6,25 mg/mL et à 25 mg/mL dilué dans du NaCl 0,9 % comparativement à d’autres diluants à base de citrate de sodium et de phosphate de sodium, à différents pH et conservé à 32 °C durant 24 heures, dans le but d’obtenir une stabilité suffisante pour permettre une administration en perfusion continue dans un contexte d’antibiothérapie par voie intraveineuse à domicile. Dans cette étude, le diluant le plus stable était constitué d’un tampon de citrate à 1 % et le pH optimal approximatif était de 710. Malgré tout, pour la concentration de 6,25 mg/mL, le pourcentage de la concentration initiale de méropénem toujours présent après 24 heures s’élevait à seulement 85,6 %, comparativement à 65,8 % lorsque le méropénem était préparé de façon standard dans le NaCl 0,9 %; ce qui est nettement sous la barre des 90 % et qui en fait un mauvais choix pour la perfusion continue ou pour l’antibiothérapie par voie intraveineuse à domicile10. Bref, la conservation optimale du méropénem constitue un réel défi en raison de sa dégradation rapide une fois reconstitué et dilué.
Notre étude comporte certaines limites. Tout d’abord, les concentrations des solutions de méropénem en seringue différaient de celles des solutions en sac de PVC, ce qui rend la comparaison entre les deux modalités de conditionnement plus difficile. Cette façon de faire se voulait en fait un reflet plus fidèle de la pratique au quotidien. Lorsque des médicaments préparés sous hotte stérile sont conditionnés en sac de PVC, un effort doit être fait pour réduire le nombre de manipulations au minimum en évitant, entre autres, de retirer un volume du sac avant d’injecter le médicament lorsque la situation le permet. C’est pourquoi nous avons opté pour des concentrations de 20,7 mg/mL (1500 mg/72,5 mL ou 3000 mg/145 mL) et de 25 mg/mL (2000 mg/80 mL ou 4000 mg/160 mL). Pour le méropénem conditionné en seringue, il a été étudié tel qu’il est actuellement préparé sous hotte stérile, soit en format de 1500 mg/50 mL et de 2000 mg/50 mL. Par souci d’économie, les analyses par HPLC ont été restreintes à deux concentrations par mode d’administration, et l’analyse de la seringue à la concentration de 20 mg/mL a été exclue. Le méropénem étant plus stable lorsqu’il est plus dilué, les concentrations plus élevées ont été priorisées (worst case scenario). Il sera toujours possible d’adapter la préparation de la seringue de 1000 mg à la lumière des données obtenues.
Par ailleurs, les sacs de PVC contenant du NaCl 0,9 % provenant de l’industrie pharmaceutique présentent toujours un certain surremplissage, qui peut varier légèrement d’une compagnie à l’autre, mais qui respecte les normes USP en vigueur. Dans le cas de Baxter, le sac de 100 mL de NaCl 0,9 % contient 110 ± 5 mL7. Ce surplus n’a pas été pris en compte dans les calculs de concentration des solutés de méropénem, ce qui explique pourquoi les concentrations calculées du tableau I sont différentes de celles du laboratoire. Pour que les concentrations calculées et mesurées correspondent, il aurait fallu utiliser des sacs de PVC vides, y injecter l’antibiotique, puis le NaCl 0,9 % jusqu’à un volume final prédéterminé. Toutefois, cette technique de préparation ne reflète pas la réalité en pratique. C’est pourquoi elle a été exclue.
Les données de cette étude confirment que le méropénem conditionné en seringues de 30 mg/mL et de 40 mg/mL, actuellement préparées à l’IUCPQ–UL, est stable d’un point de vue physico-chimique lorsqu’il est conservé à une température de 4°C à 6°C et administré dans les 48 heures suivant sa préparation. Ces données pourront désormais servir de référence pour d’autres établissements qui souhaiteraient conditionner le méropénem de cette façon. Il serait intéressant de mener un projet visant à analyser les données de stabilité lorsque le méropénem est dilué dans une solution à pH d’environ 7, tamponnée avec du citrate de sodium, afin de déterminer s’il serait possible de réfrigérer les seringues durant quelques heures supplémentaires lors de préparation en lots pour des usagers hospitalisés.
Les auteurs souhaitent remercier Mme Mélina Paré-Lacroix, assistante technique au Département de pharmacie de l’IUCPQ–UL, pour sa contribution au projet. Cette personne a donné son autorisation écrite.
Ce projet a été entièrement financé par le Fonds Pharmacie de la Fondation IUCPQ–UL.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
1. Fish DN, Singletary TJ. Meropenem, a new carbapenem antibiotic. Pharmacotherapy 1997;17: 644–69.
2. Bing CD, Nowobilski-Vasilios A. Extended stability for parenteral drugs. 6e éd. Bethesda: American Society of Health-System Pharmacists Publications; 2017. 340 pages.
3. Carlier M, Stove V, Verstraete AG, De Waele JJ. Stability of generic brands of meropenem reconstituted in isotonic saline. Minerva Anestesiol 2015;81:283–7.
4. Patel PR, Cook SE. Stability of meropenem in intravenous solutions. Am J Health-Syst Pharm 1997;54:412–21.

5. Smith DL, Bauer SM, Nicolau DP. Stability of meropenem in polyvinyl chloride bags and an elastomeric infusion device. Am J Health-Syst Pharm 2004;61:1682–5.

6. Walker SE, Varrin S, Law S. Stability of meropenem in saline and dextrose solutions and compatibility with potassium chloride. Can J Hosp Pharm 1998;51:156–68.
7. Corporation Baxter. Données internes, Service d’Information médicale, lettre 118942, 3 mars 2020.
8. Mendez ASL, Steppe M, Schapoval EES. Validation of HPLC and UV spectrophotometric methods for the determination of meropenem in pharmaceutical dosage form. J Pharm Biomed Anal 2003;33:947–54.

9. Allen LV Jr. Basics of compounding: potency and stability testing. Int J Pharm Compd 2013; 17:220–4.
10. Jamieson C, Allwood MC, Stonkute D, Wallace A, Wilkinson AS, Hills T; BSAC Drug Stability Working Party. Investigation of meropenem stability after reconstitution: the influence of buffering and challenges to meet the NHS yellow cover Document compliance for continuous infusions in an outpatient setting. Eur J Hosp Pharm 2020;27(e1):e53–e57.

PHARMACTUEL, Vol. 55, No. 2, 2022