Sarahan
Dussautl,
Pharm.D.1,2,
Luc
Bergeron,
B.Pharm., M.Sc., FCSHP3,4
Reçu le 1 juillet 2021: Accepté après révision le 7 novembre 2021
L’endométrite est une infection polymicrobienne de l’endomètre qui survient chez les femmes à la suite d’un accouchement1. Les bactéries impliquées sont variées et incluent les Gram positifs et les Gram négatifs aérobies, ainsi que les anaérobies2. Le traitement standard de l’endométrite repose sur l’association de clindamycine et de gentamicine3,4. Les données récentes des antibiogrammes cumulatifs pour le CHU de Québec – Université Laval démontrent une sensibilité réduite de Streptococcus agalactiae (streptocoque du groupe B) et de Bacteroides fragilis à la clindamycine5. En réponse à l’augmentation de la résistance bactérienne à la clindamycine, quelles sont nos options de traitement empiriques chez la femme atteinte d’endométrite ?
L’endométrite est une infection post-partum de la muqueuse utérine1. Des études observationnelles récentes menées dans deux pays industrialisés ont rapporté des taux d’incidence de l’endométrite d’environ 2 % dans la population générale6,7. Les symptômes habituels de l’endométrite sont les douleurs abdominales basses, l’hyperthermie, la sensibilité utérine et la présence de pertes vaginales malodorantes3. Parmi les autres symptômes rapportés figurent la tachycardie, la leucocytose, l’anorexie et la sensation de malaise, bien qu’ils soient moins spécifiques8. Traditionnellement, l’endométrite était classifiée précoce si les symptômes apparaissaient dans les 48 heures post-partum et tardive dans le cas où les symptômes apparaissaient deux jours à six semaines plus tard1. Les cas tardifs sont associés à une étiologie bactérienne différente comme Chlamydia trachomatis 2. Les facteurs de risque de cette infection sont la chorioamnionite, un travail prolongé et une rupture prématurée des membranes, puisqu’ils favorisent la colonisation bactérienne9–11. L’accouchement par césarienne a longtemps été considéré comme le facteur de risque principal de l’endométrite12. Cependant, l’utilisation de l’antibiothérapie prophylactique a permis de réduire son risque de 60 à 70 %13.
Le traitement standard de l’endométrite consiste en l’association de clindamycine à raison de 2400 à 2700 mg par jour par voie intraveineuse (IV), divisés en trois ou quatre doses, et de gentamicine 1,5 mg/kg IV toutes les huit heures, ou encore 4,5 mg/kg en une dose uniquotidienne, pour une période de 24 à 48 heures après la résolution clinique de l’infection3. Bien que les essais cliniques aient été réalisés avec la gentamicine, la tobramycine administrée de la même façon et aux mêmes doses pourrait constituer une option de rechange tout à fait adéquate à la gentamicine. Une méta-analyse du groupe Cochrane réalisée en 2015 a conclu que cette combinaison d’antibiotiques était supérieure à d’autres traitements4. Or, les données récentes des antibiogrammes cumulatifs pour le CHU de Québec – Université Laval démontrent une résistance des souches de Streptococcus agalactiae et de Bacteroides fragilis à la clindamycine qui atteignent respectivement 33 % et 27 %5. Des tendances similaires ont été observées ailleurs au Québec et au Canada au cours de la dernière décennie14,15. Dans ce contexte, l’exploration d’options de remplacement est nécessaire afin d’assurer une prise en charge optimale de l’endométrite.
Une revue systématique a mis en évidence la variété importante des pathogènes rencontrés dans l’endométrite16. Les bactéries des genres Bacteroides, Staphylococcus, Streptococcus, Escherichia et Enterococcus sont les plus fréquentes. La grande variété des pathogènes justifie la nécessité d’utiliser une couverture antibiotique à large spectre couvrant à la fois les bactéries aérobies Gram positif, les Gram négatifs et les anaérobies, ce qui est le cas avec la combinaison standard4,17. L’augmentation des résistances bactériennes a cependant permis de tracer un portrait moins reluisant quant à l’usage de la clindamycine. À la sensibilité réduite de Streptococcus agalactiae et des espèces de Bacteroides mentionnée précédemment s’ajoute le Staphylococcus aureus sensible à la méthicilline, dont environ 25 % des souches sont résistantes à la clindamycine5,15. Parmi les éléments à considérer dans le choix des antibiotiques, notons par ailleurs l’importance de la couverture des espèces de Bacteroides pour lesquels une méta-analyse a démontré moins d’échecs au traitement lorsqu’une couverture anti-anaérobies adéquate est assurée4. À noter que le rôle pathogénique de l’entérocoque est souvent considéré comme controversé, voire douteux, d’autant qu’on retrouve rarement cette bactérie comme seul pathogène isolé, mais plutôt dans un contexte d’infection polymicrobienne18. Le traitement standard de l’endométrite (clindamycine en association avec un aminoside) ne couvre incidemment pas adéquatement cette bactérie.
Ces informations permettent de bien comprendre les bases sur lesquelles devront reposer les options de traitement afin de répondre à notre question initiale. De plus, ajoutons que, comme l’endométrite est une infection post-partum, il est nécessaire de s’assurer que les options de traitement suggérées sont compatibles avec l’allaitement. Malheureusement, jusqu’à présent, peu d’études ont identifié des options de traitement avec un taux d’efficacité similaire à la combinaison standard4.
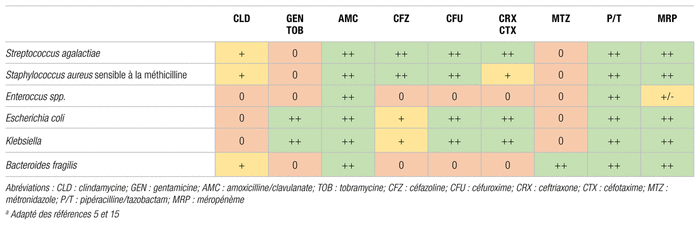
Les céphalosporines de première, deuxième et troisième générations dont on peut disposer au Canada offrent généralement une couverture adéquate des cocci Gram positifs aérobies (tels que les espèces de Streptococcus et Staphylococcus ) ainsi que de la plupart des bacilles Gram négatifs aérobies (en particulier Escherichia coli ) dans ces infections19. L’activité in vitro des céphalosporines de troisième génération contre les bacilles Gram négatifs aérobies, comme Escherichia coli ou les espèces de Klebsiella , est généralement meilleure et moins fluctuante que celle observée avec les céphalosporines de première ou, dans une moindre mesure, de deuxième génération (tableau I). Une méta-analyse regroupant huit études et un total de 872 patientes a conclu de justesse à une proportion significativement plus grande d’échecs du traitement pour les céphalosporines seules, comparativement à l’association clindamycine et gentamicine (rapport de risques [RR] 0,69; intervalle de confiance : 95 % [IC 95 %] 0,49–0,99)4. Parmi les études incluses, deux ont été réalisées avec des céphalosporines de deuxième génération (céfamandole et céfoxitine), cinq avec des céphalosporines de troisième génération (ceftazidime, céfotaxime, moxalactame) et une avec des céphalosporines de deuxième et troisième générations (céfoxitine et ceftizoxime )20–27. De façon individuelle, aucune de ces études n’a permis de démontrer une différence statistiquement significative entre la céphalosporine utilisée et la combinaison standard. De plus, les deux études pour lesquelles plus d’échecs du traitement ont été observés employaient un traitement comparatif qui n’offrait pas une couverture adéquate des anaérobies (ciprofloxacine et pénicilline). Cela renforce l’idée que l’association d’une céphalosporine de deuxième ou troisième génération avec le métronidazole pourrait s’avérer un choix de traitement efficace contre l’endométrite. De plus, le céfotaxime, une céphalosporine de troisième génération incluse dans ces études, n’a pas démontré une efficacité moindre en comparaison avec la combinaison standard26. Les céphalosporines sont compatibles avec l’allaitement28,29.
Tableau I
Spectre comparatif des antibiotiques envers les pathogènes rencontrés couramment dans l’endométritea
Le métronidazole offre une couverture large des anaérobies, ce qui rend son utilisation intéressante lorsque associé à un autre antibiotique permettant de couvrir les Gram positifs et les Gram négatifs aérobies19. Dans le contexte de l’endométrite, la principale préoccupation avec l’utilisation du métronidazole concerne le manque de données scientifiques confirmant son innocuité en allaitement29. Bien que les données actuelles accessibles fassent état d’un passage élevé du métronidazole dans le lait maternel, seul un rapport de cas fait état de diarrhées et d’une possible intolérance au lactose secondaire d’un nourrisson, et mentionne que l’association entre le médicament et les effets indésirables n’est pas clairement établie30–32. Le métronidazole est par ailleurs un médicament utilisé en néonatalogie à une dose pouvant atteindre 7,5 mg/kg/dose toutes les huit heures chez un enfant dont l’âge postmenstruel est de 34 semaines ou plus33. Les organisations sont également divisées sur le sujet. L’American Academy of Pediatrics (AAP) recommande de ne pas allaiter durant une période de 12 à 24 heures suivant une dose de 2 g de métronidazole28. Alors que, plus récemment, le National Health Service (NHS) britannique soutient que l’usage du métronidazole à la dose de 500 mg par voie orale trois fois par jour durant une période de sept à 10 jours est compatible avec l’allaitement34. Dans ce contexte, il est raisonnable d’envisager l’utilisation du métronidazole chez les patientes qui allaitent.
Une seconde option de traitement serait l’amoxicilline-clavulanate. Cet antibiotique, maintenant offert sous formulation IV, dispose d’une couverture microbienne étendue et adéquate pour l’endométrite. Une étude à répartition aléatoire prospective ( n = 101) a comparé l’usage d’amoxicilline-clavulanate à la combinaison ampicilline, métronidazole avec ou sans aminoglycoside dans le traitement de l’endométrite35. Celle-ci a conclu à une efficacité comparable entre les deux régimes pour le traitement de l’endométrite, et aucun échec du traitement n’a été constaté dans le groupe amoxicilline-clavulanate. L’association amoxicilline et clavulanate était administrée aux patientes selon un régime posologique de 500/62,5 mg par voie orale toutes les huit heures pour une infection jugée légère et de 1,2 g IV toutes les huit heures pour une infection dite sévère. Avec une température entre 37,9 et 38,4 °C l’infection était considérée comme légère, alors qu’avec une température égale ou supérieure à 38,5 °C, elle était classée parmi les infections sévères. Une méta-analyse a suggéré l’usage de l’amoxicilline-clavulanate à la dose de 875/125 mg par voie orale deux fois par jour pour le traitement de l’endométrite16. Cette suggestion se base sur la précédente étude et l’extrapolation de données concernant l’association ampicilline-sulbactam. D’autres études se sont également intéressées à l’usage de l’amoxicilline-clavulanate en dose unique comme traitement préventif de l’endométrite36,37. La plus récente laisse entrevoir un bénéfice à cette utilisation37. À noter qu’au Canada, il y a encore peu d’expérience clinique avec la formulation IV de cette molécule, et il reste difficile de définir un régime posologique pour cette infection avec cet antibiotique. L’amoxicilline-clavulanate semble compatible avec l’allaitement, bien que l’on dispose de peu de données quant à l’usage des inhibiteurs bêta-lactamases chez les nouveau-nés29.
On pourrait également penser à l’association pipéracilline-tazobactam ou encore aux carbapénèmes, qui couvrent généralement très bien tous les pathogènes d’intérêt pour l’endométrite. Il s’agit toutefois d’options offrant une couverture antibactérienne beaucoup plus large que celle des combinaisons mentionnées précédemment, et on les réservera aux cas plus graves, par exemple lors de symptômes de sepsie (p. ex., fièvre supérieure à 38 °C, tachycardie, leucocytose supérieure à 12 × 109/L) ou en présence de germes résistants aux antibiotiques de première ou seconde intention.
Il n’existe malheureusement pas d’études confirmant l’efficacité de la combinaison suggérée de céphalosporines de deuxième ou troisième génération et de métronidazole pour le traitement de l’endométrite, en comparaison avec le traitement de première intention. La base théorique et l’extrapolation des données scientifiques permettent cependant de croire qu’il serait raisonnable de suggérer cette association aux posologies habituelles comme option de traitement empirique pour l’endométrite chez une femme qui ne pratique pas l’allaitement ou ayant mené une grossesse à terme. D’un point de vue pratique toutefois, une céphalosporine de troisième génération sera possiblement plus facile à introduire comme option de rechange, plutôt qu’une céphalosporine de deuxième génération (céfuroxime). Ces dernières ont beaucoup été délaissées au profit de celles de troisième génération au cours des 15 à 20 dernières années, et plusieurs cliniciens conservent l’impression que l’activité antibactérienne des céphalosporines de deuxième génération est inférieure à celle des générations supérieures, alors que ce n’est pas complètement vrai.
En réponse à la recherche d’options de traitement en raison de l’augmentation des résistances face à la combinaison standard, il est raisonnable de suggérer l’association d’une céphalosporine de deuxième ou troisième génération avec le métronidazole comme traitement de l’endométrite. L’ajout du métronidazole permet de compléter la couverture anaérobie nécessaire à l’efficacité du traitement4,19. L’amoxicilline-clavulanate pourrait également constituer une option intéressante. Force est toutefois de constater qu’outre la combinaison de clindamycine et d’un aminoside, très peu de données ont été publiées sur l’efficacité comparative des combinaisons de remplacement. Il serait utile de combler éventuellement ce besoin pour permettre au clinicien de faire un choix éclairé quant aux options les plus appropriées et sécuritaires à offrir pour le traitement de l’endométrite.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
1. Williams KL, Pastorek Ii JG. Postpartum endomyometritis. Infect Dis Obstet Gynecol 1995;3:210–6.


2. Rosene K, Eschenbach DA, Tompkins LS, Kenny GE, Watkins H. Polymicrobial early postpartum endometritis with facultative and anaerobic bacteria, genital mycoplasmas, and Chlamydia trachomatis: treatment with piperacillin or cefoxitin. J Infect Dis 1986;153:1028–37.

3. Faure K, Dessein R, Vanderstichele S, Subtil D. Endométrites du post-partum. RPC infections génitales hautes CNGOF et SPILF. Gynecol Obstet Fertil Senol 2019;47:442–50.
4. Mackeen AD, Packard RE, Ota E, Speer L. Antibiotic regimens for postpartum endometritis. Cochrane Database Syst Rev 2015;CD001067.

5. Sous-comité de surveillance et d’utilisation des antibiotiques (SCSUA). Antibiogrammes cumulatifs. [en ligne] https://www.chudequebec.ca/chudequebec.ca/files/d8/d8428f8f-a8b9-48eb-89e3-e0c38336065a.pdf (site visité le 1er juillet 2021).
6. Ahnfeldt-Mollerup P, Petersen LK, Kragstrup J, Christensen RD, Sørensen B. Postpartum infections: occurrence, healthcare contacts and association with breastfeeding. Acta Obstet Gynecol Scand 2012;91:1440–4.

7. Axelsson D, Blomberg M. Prevalence of postpartum infections: a population-based observational study. Acta Obstet Gynecol Scand 2014;93:1065–8.

8. King TL, Brucker MC, Jevitt C, Osborne K. Varney’s midwifery. 6e éd. Burlington, Massachusetts: Jones & Bartlett; 2019. 1320 p.
9. Chaim W, Bashiri A, Bar-David J, Shoham-Vardi I, Mazor M. Prevalence and clinical significance of postpartum endometritis and wound infection. Infect Dis Obstet Gynecol 2000;8:77–82.


10. Stephansson O, Sandström A, Petersson G, Wikström AK, Cnattingius S. Prolonged second stage of labour, maternal infectious disease, urinary retention and other complications in the early postpartum period. BJOG 2016;123: 608–16.
11. Gilstrap LC, 3rd, Cunningham FG. The bacterial pathogenesis of infection following cesarean section. Obstet Gynecol 1979;53:545–9.
12. Wager GP, Martin DH, Koutsky L, Eschenbach DA, Daling JR, Chiang WT et al. Puerperal infectious morbidity: relationship to route of delivery and to antepartum Chlamydia trachomatis infection. Am J Obstet Gynecol 1980; 138:1028–33.

13. Smaill FM, Grivell RM. Antibiotic prophylaxis versus no prophylaxis for preventing infection after cesarean section. Cochrane Database Syst Rev 2014;CD007482.

14. Karlowsky JA, Walkty AJ, Adam HJ, Baxter MR, Hoban DJ, Zhanel GG. Prevalence of antimicrobial resistance among clinical isolates of Bacteroides fragilis group in Canada in 2010–2011: CANWARD surveillance study. Antimicrob Agents Chemother 2012;56:1247–52.

15. Institut national de santé publique du Québec (INSPQ). Antibiogramme cumulatif de pathogènes d’intérêt au Laboratoire de santé publique du Québec : rapport annuel 2016. [en ligne] https://www.inspq.qc.ca/en/node/10256 (site visité le 1er juillet 2021).
16. Meaney-Delman D, Bartlett LA, Gravett MG, Jamieson DJ. Oral and intramuscular treatment options for early postpartum endometritis in low-resource settings: a systematic review. Obstet Gynecol 2015;125:789–800.

17. Word Health Organization. WHO recommendations for prevention and treatment of maternal peripartum infections. Genève : World Health Organization; 2015. 70 p.
18. Sanders JM, Tessier JM, Sawyer R, Dellinger EP, Miller PR, Namias N et al. Does isolation of enterococcus affect outcomes in intra-abdominal infections? Surg Infect 2017;18:879–85.
19. Gilbert DN, Chambers HF, Eliopoulos GM. The Sanford guide to antimicrobial therapy 2014. 44th ed. Sperryville, Va.: Antimicrobial Therapy; 2014. 243 p.
20. Gibbs RS, Blanco JD, Castaneda YS, St Clair PJ. A double-blind, randomized comparison of clindamycin-gentamicin versus cefamandole for treatment of post-cesarean section endomyometritis. Am J Obstet Gynecol 1982;144:261–7.

21. Herman G, Cohen AW, Talbot GH, Coghlan R, Faidley-Mangen P, MacGregor RR. Cefoxitin versus clindamycin and gentamicin in the treatment of postcesarean section infections. Obstet Gynecol 1986;67:371–6.
22. Blanco JD, Gibbs RS, Duff P, Castaneda YS, St Clair PJ. Randomized comparison of ceftazidime versus clindamycin-tobramycin in the treatment of obstetrical and gynecological infections. Antimicrob Agents Chemother 1983;24:500–4.


23. Gibbs RS, Blanco JD, Duff P, Castaneda YS, St Clair PJ. A double-blind, randomized comparison of moxalactam versus clindamycin-gentamicin in treatment of endomyometritis after cesarean section delivery. Am J Obstet Gynecol 1983;146:769–72.

24. Knodel LC, Goldspiel BR, Gibbs RS. Prospective cost analysis of moxalactam versus clindamycin plus gentamicin for endomyometritis after cesarean section. Antimicrob Agents Chemother 1988;32:853–7.


25. Pastorek JG, 2nd, Faro S, Aldridge KE, Nicaud SK. Moxalactam versus clindamycin plus tobramycin for the treatment of puerperal infections. South Med J 1987;80:1116–9.

26. Hemsell DL, Cunningham FG, DePalma RT, Nobles BJ, Heard M, Hemsell PG. Cefotaxime sodium therapy for endomyometritis following cesarean section: dose-finding and comparative studies. Obstet Gynecol 1983;62:489–97.
27. Apuzzio JJ, Ganesh V, Pelosi MA, Landau I, Kaminetzky HA, Kaminski Z et al. Comparative clinical evaluation of ceftizoxime with clindamycin and gentamicin and cefoxitin in the treatment of postcesarean endomyometritis. Surg Gynecol Obstet 1985;161:518–22.
28. American Academy of Pediatrics Committee on Drugs: The transfer of drugs and other chemicals into human milk. Pediatrics 1994;93:137–50.

29. Briggs GG, Freeman RK, Towers, CV, Forinash AB. Drugs in Pregnancy and Lactation. 11th ed. Philadelphia : Lippincott Williams & Wilkins; 2017. 1646 p.
30. Heisterberg L, Branebjerg PE. Blood and milk concentrations of metronidazole in mothers and infants. J Perinat Med 1983;11:114–20.

31. Passmore CM, McElnay JC, Rainey EA, D’Arcy PF. Metronidazole excretion in human milk and its effect on the suckling neonate. Br J Clin Pharmacol 1988;26:45–51.


32. Clements CJ. Metronidazole and breast feeding. N Z Med J 1980;92:329.
33. Cohen-Wolkowiez M, Sampson M, Bloom BT, Arrieta A, Wynn JL, Martz K et al. Determining population and developmental pharmacokinetics of metronidazole using plasma and dried blood spot samples from premature infants. Pediatr Infect Dis J 2013;32:956–61.


34. Chapman V. Metronidazole – is it safe to use with breastfeeding? National Health Service. [en ligne] https://www.sps.nhs.uk/wp-content/uploads/2017/02/QA39_5_MetronidazoleBM_Final.pdf (site visité le 11 octobre 2011).
35. Fernandez H, Claquin C, Guibert M, Papiernik E. Suspected postpartum endometritis: a controlled clinical trial of single-agent antibiotic therapy with Amox-CA (Augmentin) vs. ampicillin-metronidazole +/− aminoglycoside. Eur J Obstet Gynecol Reprod Biol 1990;36:69–74.

36. Fernandez H, Gagnepain A, Bourget P, Peray P, Frydman R, Papiernik E et al. Antibiotic prophylaxis against postpartum endometritis after vaginal delivery: a prospective randomized comparison between Amox-CA (Augmentin) and abstention. Eur J Obstet Gynecol Reprod Biol 1993;50:169–75.

37. Knight M, Chiocchia V, Partlett C, Rivero-Arias O, Hua X, Hinshaw K et al. Prophylactic antibiotics in the prevention of infection after operative vaginal delivery (ANODE): a multicentre randomised controlled trial. Lancet 2019;393: 2395–403.


PHARMACTUEL , Vol. 55 , No. 1 , 2022