Sémaglutide en injection pour les adultes en surpoids ou obèses: étude STEP-1
Yannick Harvey, Pharm.D., M.Sc.1,2,3,*, Alexandrine Frappier, Pharm.D., M.Sc.1,4,*, Jade Albert, Pharm.D., M.Sc.1,2,6,*, Laurence Guimond, Pharm.D., M.Sc.1,2,3,*
1Candidat à la maîtrise en pharmacothérapie avancée au moment de la rédaction, Faculté de pharmacie, Université Laval, Québec (Québec) Canada;
2Résident en pharmacie au moment de la rédaction, Centre intégré universitaire de santé et de services sociaux du Saguenay–Lac-Saint-Jean, Hôpital de Chicoutimi, Saguenay (Québec) Canada;
3Pharmacien, Centre intégré universitaire de santé et de services sociaux du Saguenay–Lac-Saint-Jean, Hôpital de Jonquière, Jonquière (Québec) Canada;
4Résidente en pharmacie au moment de la rédaction, Centre intégré de santé et de services sociaux de l’Outaouais, Hôpital de Gatineau, Gatineau (Québec) Canada;
5Pharmacienne, Centre intégré de santé et de services sociaux de Lanaudière, Centre Hospitalier de Lanaudière, Saint-Charles-Borromée (Québec) Canada;
6Pharmacienne, Centre intégré de santé et de services sociaux de Lanaudière, Hôpital de Joliette, Joliette (Québec) Canada
Reçu le 30 septembre 2021: Accepté après révision par les pairs le 17 août 2022
Titre : Once-weekly semaglutide in adults with overweight or obesity. N Engl J Med 2021;384:989-10021.
Auteurs : Wilding JPH, Batterham RL, Calanna S, Davies M, Van Gaal LF, Lingvay I et coll. pour le groupe de chercheurs de l’étude STEP-1..
Commanditaire : Cette étude a été financée par Novo Nordisk, qui a participé à son développement, à sa conduite ainsi qu’à la vérification et à l’analyse des données recueillies dans les différentes installations, mais qui n’a pas contribué à la collecte des données.
Cadre de l’étude : L’obésité fait l’objet de plusieurs études et demeure un défi important pour la santé des populations dû à ses complications métaboliques et cardiovasculaires diminuant l’espérance de vie2–5. Les mesures non pharmacologiques, soit la saine alimentation et l’activité physique, sont au centre du traitement3,6. Une pharmacothérapie adjuvante peut être envisagée chez les patients ayant un indice de masse corporelle (IMC) plus grand ou égal à 30 kg/m2 ou plus grand ou égal à 27 kg/m2 en présence de maladies concomitantes liées au poids3,6,7. Toutefois, les médicaments actuellement disponibles comportent plusieurs limitations, notamment leur efficacité limitée, leurs effets indésirables considérables et leur coût mensuel élevé2.
Le sémaglutide, un agoniste du récepteur du glucagon-like peptide-1 (GLP-1), est indiqué dans le traitement du diabète de type 28. Une étude de phase II chez des patients atteints de diabète de type 2 a révélé son efficacité pour la perte de poids9–11. L’étude STEP-1 a alors été menée pour évaluer l’efficacité et l’innocuité d’une dose hebdomadaire de 2,4 mg par voie sous-cutanée chez les patients présentant un surplus de poids ou souffrant d’obésité sans diabète, comparativement au placebo et à l’association de mesures non pharmacologiques.
Protocole de recherche : Il s’agit d’un essai clinique à répartition aléatoire et à double insu d’une durée de 68 semaines regroupant 1961 sujets atteints d’obésité ou présentant un surpoids sans diabète. Les sujets ont été répartis dans un ratio de 2 pour 1 dans le groupe recevant le sémaglutide ou dans le groupe témoin pendant 68 semaines. Les deux groupes ont évolué en parallèle. L’analyse s’est faite en intention de traiter, mais une sous-analyse en intention de traiter modifiée a été effectuée pour les données sur l’innocuité. Les analyses statistiques pour les critères d’évaluation principaux et secondaires ont une puissance de 99 % avec l’échantillon actuel et ont été faites en ordre hiérarchique. L’étude STEP-1 a pris place dans 129 centres, répartis dans 16 pays d’Asie, d’Europe, d’Amérique du Nord et d’Amérique du Sud.
Patients : Les patients admissibles devaient avoir 18 ans et plus et devaient déclarer avoir fait un ou plusieurs efforts alimentaires infructueux pour perdre du poids. Leur IMC devait être plus grand ou égal à 30 kg/m2 ou plus grand ou égal à 27 kg/m2 avec des maladies concomitantes liées au poids, traitées ou non (hypertension, dyslipidémie, apnée du sommeil ou maladie cardiovasculaire). Les principaux critères d’exclusion étaient: un diagnostic de diabète, une hémoglobine glyquée supérieure ou égale à 6,5 %, des antécédents de pancréatite chronique, une pancréatite aiguë dans les 180 jours précédant le recrutement, un traitement chirurgical antérieur de l’obésité, la prise de médicaments contre l’obésité dans les 90 jours avant le début de l’étude, un changement autodéclaré du poids corporel de plus de 5 kg dans les 90 jours précédant le dépistage et une contre-indication au sémaglutide.
Interventions : Les patients se voyaient administrer par voie sous-cutanée une dose hebdomadaire de 2,4 mg de sémaglutide ou un placebo équivalent pendant 68 semaines, suivi de sept semaines sans traitement. L’ensemble des participants ont aussi été soumis à des mesures non pharmacologiques. Le sémaglutide était administré à une dose hebdomadaire initiale de 0,25 mg pendant le premier mois, puis était ensuite augmenté toutes les quatre semaines pour atteindre une dose d’entretien hebdomadaire de 2,4 mg à la seizième semaine. Des doses plus faibles étaient autorisées en cas d’intolérance à la dose ciblée.
Les mesures non pharmacologiques consistaient en des rencontres toutes les quatre semaines pour aider les patients à adhérer à un régime hypocalorique et à accroître leur degré d’activité physique. Ces données étaient recueillies quotidiennement dans un journal ou dans une application pour téléphone intelligent et étaient examinées lors des rencontres.
Points évalués : Les critères d’évaluation principaux étaient la différence en pourcentage entre le poids initial et celui à la semaine 68 ainsi qu’une réduction de 5 % ou plus du poids initial. Les critères secondaires, quant à eux, étaient une perte de poids plus grande ou égale à 10 % et à 15 % du poids initial, la différence du tour de taille, de la pression artérielle systolique, du score 36-item short form health survey (SF-36) et du score Impact of weight on quality of life-lite clinical trials version (IWQOL-Lite-CT). Les valeurs possibles de ces deux scores de fonction physique varient respectivement de 19,03 à 57,60 et de 0 à 10012–13. Dans les deux cas, un score plus élevé témoigne d’une meilleure fonction physique12–13. Les critères d’évaluation de l’innocuité comprennent la fréquence des effets indésirables, de même que les effets indésirables graves jusqu’à la semaine 75. À cette fin, un comité externe d’évaluation effectuait la révision des événements graves signalés.
Résultats : Entre juin et novembre 2018, 1961 participants ont été répartis aléatoirement dans les groupes témoin (n = 655) et sémaglutide (n = 1306): 94,3 % ont terminé l’étude, 91,2 % ont eu un suivi de poids à la semaine 68 et 81,1 % ont respecté le traitement. Dans le groupe sémaglutide, 89,6 % des participants ont reçu la dose de 2,4 mg contre 98,0 % des sujets témoins qui ont reçu la dose équivalente maximale. Les principales caractéristiques des sujets sont présentées dans le tableau I. Les deux groupes étaient similaires: environ 74 % étaient des femmes, 75 % étaient blancs, et l’âge moyen des sujets était de 46 ans. Le poids moyen était de 105,3 kg, l’IMC moyen de 37,9 kg/m2 et le tour de taille moyen de 114,7 cm. Environ 75 % présentaient au moins une maladie concomitante et 43,7 % étaient prédiabétiques.
Tableau I Principales caractéristiques de base des patients inclus dans l’étude STEP-1a
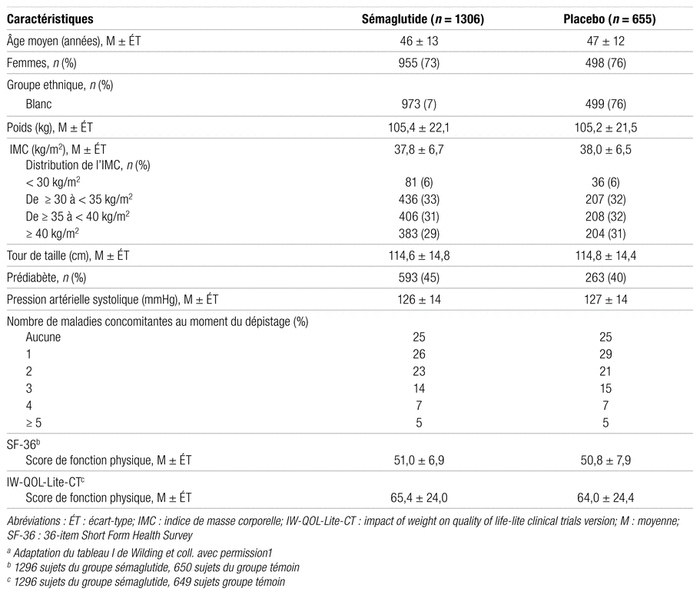
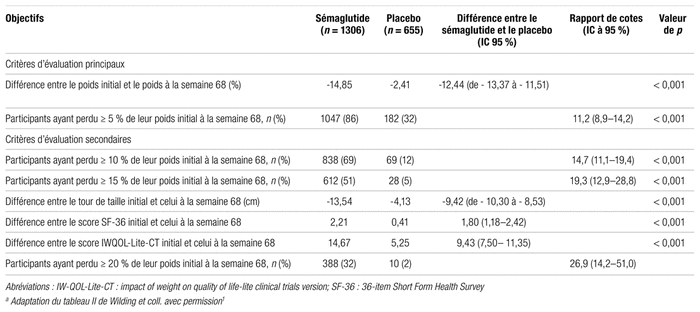
Tableau II Principaux résultats d’efficacité de l’étude STEP-1a
Grille d’évaluation critique


Le pourcentage d’effets indésirables était similaire dans chaque groupe, soit 89,7 % et 86,4 %. La prévalence d’effets digestifs était plus élevée dans le groupe sémaglutide, soit 74,2 % vs 47,9 %. La présence d’effets importants était respectivement de 9,8 % vs 6,4 %. La différence était cependant plus marquée pour les effets digestifs et hépatiques. Il y a eu plus d’arrêts dans le groupe sémaglutide dû aux effets indésirables (7,0 % vs 3,1 %). Des calculs biliaires ont été observés dans les deux groupes (2,6 % vs 1,2 %), et trois patients dans le groupe sémaglutide ont présenté des pancréatites aiguës de faible gravité, mais se sont rétablis complètement en cours d’étude.
Discussion
L’étude STEP-1 a montré que le sémaglutide permet à des patients atteints d’obésité ou en surpoids présentant des maladies concomitantes de perdre du poids de manière cliniquement et statistiquement significative. Au Canada, trois médicaments sont approuvés pour la perte de poids, soit l’orlistat, le liraglutide et l’association bupropion-naltrexone. Le liraglutide est un agoniste du récepteur du GLP-1 administré quotidiennement. Dans l’étude SCALE, il a entraîné une diminution significative du poids de 8,0 %15. La proportion de patients ayant perdu 5 % de leur poids ou plus s’élevait à 63,2 %15. Les caractéristiques de ces études sont similaires, ce qui permet de les comparer. Les résultats de l’étude STEP-1 demeurent plus intéressants. L’avantage du sémaglutide est son administration une seule fois par semaine. Pour le bupropion-naltrexone, la proportion de patients dans l’étude COR-1 ayant perdu 5 % ou plus de leur poids s’élevait à 39 % avec la dose de 16 mg et à 48 % avec celle de 32 mg19. Le bupropion-naltrexone a entraîné une diminution significative du poids de 5,0 % pour la dose de 16 mg et de 6,1 % pour celle de 32 mg19. Le potentiel d’interactions médicamenteuses est plus important pour le bupropion-naltrexone que pour le sémaglutide. Il est cependant moins cher que les agonistes du récepteur du GLP-1. L’orlistat est peu utilisé de nos jours, notamment en raison de son profil d’effets indésirables peu intéressant, comme la stéatorrhée, l’incontinence fécale et les flatulences17. Quand on compare ces résultats, le sémaglutide semble un bon choix pour son efficacité et sa fréquence d’administration, mais il demeure cher. Actuellement, le sémaglutide n’est pas remboursé par la Régie de l’assurance maladie du Québec pour cette indication.
Parmi les points forts de l’étude STEP-1, son protocole permet une bonne maîtrise des biais possibles. La répartition aléatoire dans un ratio de 2 pour 1 augmente la puissance pour détecter les événements indésirables. Le respect du double insu et la mise en place d’un comité externe indépendant pour examiner les effets indésirables et les décès augmentent la validité interne. Les deux groupes à l’étude étaient très similaires. Plusieurs éléments pertinents autour de la perte de poids ont été évalués, dont certains facteurs de risque cardiométabolique ainsi que les scores de fonction physique. Par ailleurs, le score IWQOL-Lite-CT a été validé par la Food and Drug Administration tandis que le SF-36 est largement utilisé dans les études cliniques12. Enfin, le médicament est relativement bien toléré, car peu de patients ont arrêté le traitement à l’étude prématurément à cause d’un effet indésirable (7 % dans le groupe sémaglutide vs 3 % dans le groupe témoin).
En contrepartie, la validité externe de l’étude est limitée. La population à l’étude contient des groupes surreprésentés, soit les femmes (73,1 %) et les blancs (74,5 %). Par ailleurs, 94 % des sujets avaient un IMC de 30 kg/m2 ou plus, ce qui limite l’extrapolation des données aux patients ayant un IMC de 27 kg/m2 ou plus et au moins une maladie concomitante. De plus, puisque 44 % étaient prédiabétiques, on peut se poser des questions sur son efficacité chez les patients normoglycémiques. Par ailleurs, aucune sous-analyse n’a vérifié si le sémaglutide apportait davantage de bienfaits pour un certain IMC. Certains patients ont changé de traitement ou ont subi une chirurgie bariatrique, ce qui peut aussi avoir influencé les bienfaits dans une analyse en intention de traiter. Toutefois, le nombre de patients en cause (7 dans le groupe sémaglutide et 13 dans le groupe témoin) semble insuffisant pour être significatif. Compte tenu de la durée relativement courte de l’essai, les résultats ne peuvent être généralisés à long terme, d’autant plus que l’obésité est une maladie chronique. Il est aussi impossible de savoir si la perte de poids sera maintenue après l’arrêt ni de connaître la durée optimale du traitement. Enfin, l’étude a été fortement dirigée par la compagnie Novo Nordisk qui commercialise le sémaglutide en injection, ce qui constitue un biais.
Par ailleurs, la volonté des sujets de participer à un essai clinique peut refléter un engagement plus élevé, engendrant un biais de sélection. Ce biais est toutefois présent dans les deux groupes. On peut également douter de l’adhésion quotidienne du patient à la saisie des informations concernant les mesures non pharmacologiques au long cours. Ces données n’ont d’ailleurs pas été présentées. Il est aussi possible que la motivation à appliquer ces mesures ait diminué avec le temps chez les patients dont la perte de poids était moindre, plus particulièrement dans le groupe témoin, ce qui a pu affecter les résultats. En outre, dans l’étude, les patients bénéficiaient d’un suivi mensuel étroit et personnalisé pendant un an. On peut donc se demander si la perte de poids aurait été aussi importante dans le contexte clinique actuel du système de santé québécois, soit avec des suivis beaucoup plus espacés. Ce type de service est souvent offert par différents professionnels de santé, dont l’accessibilité mensuelle dans le réseau public n’est pas nécessairement à la portée de tous les patients qui peuvent parfois hésiter à aller au privé. Cette diminution des services personnalisés pourrait réduire la motivation et l’intensité de la perte de poids.
Enfin, l’étude STEP-1 ne mesure pas les événements cardiovasculaires habituels. Les bienfaits sur le plan cardiovasculaire pour les patients atteints de diabète de type 2 sont toutefois connus. De surcroît, l’étude SELECT évalue actuellement le sémaglutide auprès de patients non diabétiques atteints d’obésité et de maladies cardiovasculaires afin d’en permettre une utilisation plus large20. Les questions qui restent donc à explorer sont le maintien de la perte de poids ainsi que la réversibilité des maladies cardiovasculaires concomitantes à long terme.
Conclusion
L’étude STEP-1 a révélé que le sémaglutide entraîne une perte de poids significative, de même qu’une régression des facteurs de risque cardiovasculaire. Le sémaglutide est à ce jour le traitement pharmacologique le plus efficace dans un contexte de perte de poids. Cependant, il n’est présentement pas couvert par la Régie de l’assurance maladie du Québec pour cette indication, et son coût élevé en limite l’utilisation. Les pratiques actuelles ne devraient pas changer à court terme pour la plupart des patients. L’arrivée de l’étude SELECT pourrait toutefois modifier la pratique en élargissant les indications du sémaglutide.
Remerciements
Cet article a été écrit dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université Laval. Les auteurs en remercient la responsable.
Financement
Les auteurs n’ont déclaré aucun financement lié au présent article.
Conflits d’intérêts
Tous les auteurs ont soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts lié au présent article.
Références
1. Wilding JPH, Batterham RL, Calanna S, Davies M, Van Gaal LF, Lingvay I et coll. Once-weekly semaglutide in adults with overweight or obesity. N Engl J Med 2021;384:989–1002.

2. Bessesen DH, Van Gaal LF. Progress and challenges in anti-obesity pharmacotherapy. Lancet Diabetes Endocrinol 2018;6:237–48.

3. Yumuk V, Tsigos C, Fried M, Schindler K, Busetto L, Micic D et coll. European guidelines for obesity management in adults. Obes Facts 2015;8:402–24.


4. Guh DP, Zhang W, Bansback N, Amarsi Z, Birmingham CL, Anis AH. The incidence of co-morbidities related to obesity and overweight: a systematic review and meta-analysis. BMC Public Health 2009;9:88.


5. Whitlock G, Lewington S, Sherliker P, Clarke R, Emberson J, Halsey J et coll. Body-mass index and cause-specific mortality in 900 000 adults: collaborative analyses of 57 prospective studies. Lancet 2009;373:1083–96.


6. Garvey WT, Mechanick JI, Brett EM, Garber AJ, Hurley DL, Jastreboff AM et coll. American Association of Clinical Endocrinologists and American College of Endocrinology comprehensive clinical practice guidelines for medical care of patients with obesity. Endocr Pract 2016;22:1–203.

7. Wharton S, Lau DCW, Vallis M, Sharma AM, Biertho L, Campbell-Scherer D et coll. Obesity in adults: a clinical practice guideline. CMAJ 2020;192:E875–91.


8. Novo Nordisk Canada. Monographie de produit incluant les renseignements pour le patient sur le médicament Ozempic (4 janvier 2018). [en ligne] https://caf.novonordisk.ca/content/dam/nncorp/ca/fr/products/ozempic-product-monograph-fr.pdf (site visité le 13 juillet 2022).
9. Aroda VR, Ahmann A, Cariou B, Chow F, Davies MJ, Jódar E et coll. Comparative efficacy, safety, and cardiovascular outcomes with once-weekly subcutaneous semaglutide in the treatment of type 2 diabetes: insights from the SUSTAIN 1–7 trials. Diabetes Metab 2019;45:409–18.

10. Nauck MA, Meier JJ. Management of endocrine disease: are all GLP-1 agonists equal in the treatment of type 2 diabetes? Eur J Endocrinol 2019;181:R211–34.

11. O’Neil PM, Birkenfeld AL, McGowan B, Mosenzon O, Pederson SD, Wharton S et coll. Efficacy and safety of semaglutide compared with liraglutide and placebo for weight loss in patients with obesity: a randomised, double-blind, placebo and active controlled, dose-ranging, phase 2 trial. Lancet 2018;392:637–49.

12. Kolotkin RL, Williams VSL, Ervin CM, Williams N, Meincke HH, Qin S et coll. Validation of a new measure of quality of life in obesity trials: impact of weight on quality of life-lite clinical trials version. Clin Obes 2019;9:e12310.


13. Ware JE, Gandek B. Overview of the SF-36 Health Survey of International Quality of Life Assessment (IQOLA) Project. J Clin Epidemiol 1998;51:903–12.

14. Tak YJ, Lee SY. Anti-obesity drugs: long-term efficacy and safety: an updated review. World J Mens Health 2021;39:208–22.


15. Pi-Sunyer X, Astrup A, Fujioka K, Greenway F, Halpern A, Krempf M et coll. A randomized, controlled trial of 3.0 mg of liraglutide in weight management. N Engl J Med 2015;373:11–22.

16. Wadden TA, Foreyt JP, Foster GD, Hill JO, Klein S, O’Neil PM et coll. Weight loss with naltrexone SR/bupropion SR combination therapy as an adjunct to behavior modification: the COR-BMOD trial. Obsesity 2011;19:110–20.

17. Colak R, Ozcelik O. Effects of short-period exercise training and orlistat therapy on body composition and maximal power production capacity in obese patients. Physiol Res 2004; 53:53–60.

18. Wolfe BM, Kvach E, Eckel RH. Treatment of obesity: weight loss and bariatric surgery. Circ Res 2016;118:1844–55.


19. Greenway FL, Fujioka K, Plodkowski RA, Mudaliar S, Guttadauria M, Erickson J et coll. Effect of naltrexone plus bupropion on weight loss in overweight and obese adults (COR-I): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2010;376:595–605.

20. National Library of Medicine. Semaglutide effects on heart disease and stroke in patients with overweight or obesity (SELECT). [en ligne] https://clinicaltrials.gov/ct2/show/study/NCT03574597 (site visité le 13 juillet 2022).
Pour toute correspondance: Yannick Harvey, Centre intégré universitaire de santé et de services sociaux du Saguenay–Lac-Saint-Jean, Hôpital de Jonquière, 2230, rue de l’Hôpital, Jonquière (Québec) G7X 7X2, CANADA; Téléphone: 418 695-7700 poste: 2226; Courriel: yannick.harvey.reg02@ssss.gouv.qc.ca
*Yannick Harvey, Alexandrine Frappier, Jade Albert et Laurence Guimond ont contribué de façon équivalente à la rédaction de cet article ( Return to Text )
(Return to Top)
PHARMACTUEL, Vol. 55, No. 4, 2022