Activation de la myosine cardiaque avec l’omécamtiv mécarbil en cas d’insuffisance cardiaque avec fraction d’éjection réduite : étude GALACTIC-HF
Laelia Caron, Pharm.D., M.Sc.1,2,3*, Anne Bélanger, Pharm.D., M.Sc.1,4,5*, Isabelle Boudreau, Pharm.D., M.Sc.1,2,6*, Jacynthe Ouellette, Pharm.D., M.Sc.1,4,7*, Cédric Pageau, Pharm.D., M.Sc.1,2,8*, Vincent Leclerc, B.Pharm., M.Sc.9,10
1Candidat à la maîtrise en pharmacothérapie avancée au moment de la rédaction, Faculté de pharmacie, Université Laval, Québec (Québec) Canada;
2Résident en pharmacie au moment de la rédaction, Centre intégré universitaire de santé et de services sociaux de la Capitale-Nationale, Québec (Québec) Canada;
3Pharmacienne, Centre intégré universitaire de santé et de services sociaux de la Capitale-Nationale, Hôpital de La Malbaie, La Malbaie (Québec) Canada;
4Résidente en pharmacie au moment de la rédaction, Centre intégré de santé et de services sociaux de la Montérégie-Est, Québec (Québec) Canada;
5Pharmacienne, Centre intégré universitaire de santé et de services sociaux de la Capitale-Nationale, Centre d’hébergement Christ-Roi, Québec (Québec) Canada;
6Pharmacienne, Centre intégré universitaire de santé et de services sociaux de la Capitale-Nationale, Hôpital Jeffery Hale, Québec (Québec) Canada;
7Pharmacienne, Centre intégré de santé et de services sociaux de la Montérégie-Est, Hôpital Honoré-Mercier, Saint-Hyacinthe (Québec) Canada;
8Pharmacien, Centre intégré universitaire de santé et de services sociaux de la Capitale-Nationale, Institut universitaire en santé mentale de Québec, Québec (Québec) Canada;
9Pharmacien, Institut de cardiologie et de pneumologie de Québec–Université Laval, Québec (Québec) Canada;
10Chargé d’enseignement clinique, Faculté de pharmacie, Université Laval, Québec (Québec) Canada
Reçu le 18 octobre 2021: Accepté après révision par les pairs le 7 mars 2022
Titre : Cardiac myosin activation with omecamtiv mecarbil in systolic heart failure. N Engl J Med 2021;384:105-611.
Auteurs : Teerlink JR, Diaz R, Felker GM, McMurray JJV, Metra M, Solomon SD et coll. pour les chercheurs de GALACTIC-HF.
Commanditaires : L’étude a été financée par les entreprises Amgen, Cytokinetics et Servier, qui ont participé à sa conception ainsi qu’à l’analyse et à l’interprétation des données.
Cadre de l’étude : Le traitement pharmacologique optimal de l’insuffisance cardiaque avec fraction d’éjection du ventricule gauche réduite (ICFER) repose, selon le dernier consensus canadien, sur quatre classes de médicaments bloquant chacun différents chemins neurohormonaux néfastes pour la fonction cardiaque2. Cependant, certains symptômes ressentis par les patients atteints d’ICFER sont liés à la baisse du débit cardiaque engendrée par la maladie3. Il serait donc logique que les médicaments qui augmentent la contractilité myocardique soient bénéfiques pour l’ICFER. Pourtant, jusqu’à maintenant, aucun inotrope positif augmentant le taux de calcium intracellulaire dans les myocytes cardiaques n’a entraîné suffisamment de bienfaits sur la fonction systolique à long terme. Les agents de cette classe actuellement disponibles au Canada, soit la milrinone et la dobutamine, peuvent même être nuisibles et causer un accroissement de la morbimortalité4. Comme ils sont administrés uniquement par voie intraveineuse, ils ne constituent pas non plus une option optimale à long terme3. La digoxine, figurant également dans cette classe et ayant longtemps été utilisée comme traitement de fond, possède un rôle controversé depuis l’évolution des connaissances entourant le traitement moderne de l’ICFER2,5,6. L’omécamtiv mécarbil est un nouvel inotrope dont le mécanisme d’action différent agit directement sur le sarcomère cardiaque7,8. À ce jour, l’administration d’omécamtiv mécarbil par voie intraveineuse s’est révélée prometteuse à court terme pour accroître les performances cardiaques9–11. L’étude de phase II COSMIC-HF a d’ailleurs montré que l’administration d’omécamtiv mécarbil par voie orale pendant 20 semaines pouvait mener à un remodelage inverse du ventricule gauche bénéfique chez certains patients atteints d’ICFER, en plus d’améliorer plusieurs paramètres cardiaques (p. ex. : augmentation du volume d’éjection systolique du ventricule gauche et réduction des taux plasmatiques du fragment amino-terminal du propeptide natriurétique cérébral de type B ou NT-proBNP ainsi que de la fréquence cardiaque)12. L’étude GALACTIC-HF vise à évaluer, dans cette même population, si le traitement par l’omécamtiv mécarbil permet de réduire les risques d’événements et la mortalité cardiovasculaire attribuables à l’ICFER.
Protocole de recherche : Il s’agit d’un essai clinique à répartition aléatoire contre placebo qui s’est déroulé dans 945 établissements de 35 pays. Les deux groupes ont été évalués à double insu et en affectation parallèle. Les analyses d’efficacité ont été menées en intention de traiter et celles d’innocuité en intention de traiter modifiée (patients répartis aléatoirement et ayant reçu au moins une dose d’omécamtiv mécarbil ou un placebo). Des calculs statistiques ont permis d’estimer qu’environ 8000 patients seraient nécessaires pour atteindre une puissance de 90 % et qu’une cible d’environ 1590 décès cardiovasculaires serait requise pour cette étude.
Patients : La population à l’étude était constituée de patients de 18 à 85 ans, dont la classe fonctionnelle de la New York Heart Association (NYHA) se situait entre II et IV et dont la fraction d’éjection du ventricule gauche (FEVG) était de 35 % ou moins. Pour faire partie de l’étude, les sujets devaient soit être hopitalisés au moment de l’étude ou avoir consulté à l’urgence ou avoir été hospitalisés pour insuffisance cardiaque (IC) dans l’année précédant leur sélection. Ils devaient avoir un taux de NT-proBNP d’au moins 400 pg/mL ou de 1200 pg/mL avec flutter ou fibrillation auriculaire. Ils devaient aussi suivre un traitement pharmacologique ou porter un dispositif médical contre l’insuffisance cardiaque (stimulateur cardiaque ou défibrillateur implantable) optimisé et conforme aux lignes directrices locales. Les patients dont l’état hémodynamique ou clinique instable qui nécessitait un soutien mécanique et l’utilisation de médicaments par voie intraveineuse ou d’un antiarythmique à long terme (à l’exception de l’amiodarone) étaient exclus. Ceux dont la pression artérielle systolique était inférieure à 85 mmHg ou supérieure à 140 mmHg ou dont la pression diastolique dépassait 90 mmHg, ainsi que ceux dont le débit de filtration glomérulaire était inférieur à 20 mL/min/1,73 m2, qui avaient eu un syndrome coronarien récent ou une intervention coronarienne récente ou prévue, se voyaient également exclus. Enfin, un problème valvulaire grave non corrigé, une cardiomyopathie hypertrophique ou infiltrative, une myocardite active, une péricardite constrictive ou une cardiopathie congénitale constituaient aussi des critères d’exclusion.
Interventions : Les patients ont été assignés au hasard dans un rapport de 1:1 dans un groupe recevant soit l’omécamtiv mécarbil (25 mg, 2 deux fois par jour), soit un placebo. Des évaluations post-répartition aléatoire ont été faites aux semaines 2, 4, 6, 8, 12, 24, 36 et 48, puis toutes les 16 semaines par la suite. Au suivi de la semaine deux, une ponction veineuse était effectuée dans le but d’ajuster la dose (37,5 mg deux fois par jour, puis 50 mg deux fois par jour, au besoin) pour atteindre une concentration plasmatique d’omécamtiv mécarbil de 300 à 1000 ng/mL. Ni les patients ni les chercheurs n’étaient avisés des concentrations plasmatiques ou de la dose administrée. À la semaine 12, 1192 patients (28,9 %) recevaient une dose de 25 mg deux fois par jour; 559 patients (13,6 %) une dose de 37,5 mg; et 1961 patients (47,6 %), une dose de 50 mg. Les 409 patients restants (9,9 %) n’étaient pas inclus dans l’analyse en raison de l’arrêt du traitement, de données manquantes ou d’autres raisons. L’administration du traitement était temporairement suspendue en cas d’apparition de signes cliniques ou de symptômes compatibles avec ceux d’un infarctus aigu du myocarde ou d’une ischémie.
Points évalués : L’objectif primaire était un composite d’un premier événement d’insuffisance cardiaque ou de décès d’origine cardiovasculaire, selon une analyse temporelle des événements. Un événement d’insuffisance cardiaque était défini comme une consultation urgente dans une clinique ou à l’urgence, ou comme une hospitalisation pour une aggravation subjective et objective de l’insuffisance cardiaque menant à une intensification du traitement au-delà d’un changement du diurétique par voie orale.
Les objectifs secondaires étaient la mortalité d’origine cardiovasculaire, la modification du résultat au score du Kansas City Cardiomyopathy Questionnaire (KCCQ) sur les symptômes du temps zéro à la semaine 24, une première hospitalisation pour insuffisance cardiaque et la mortalité toutes causes confondues. Tous les événements composant le critère d’évaluation principal ainsi que les événements ischémiques majeurs étaient révisés à l’insu par un comité clinique externe qui était indépendant.
Résultats : La population à l’étude a été recrutée entre janvier 2017 et juillet 2019. Des 11 121 patients ciblés, 8256 d’entre eux ont été sélectionnés et suivis pour une durée médiane de traitement de 21,8 mois. Leurs caractéristiques de base sont présentées dans le tableau I. Les patients inclus étaient comparables dans les deux groupes au moment de la répartition aléatoire.
Tableau I Caractéristiques de base des patients inclus dans l’étude GALACTIC-HFa

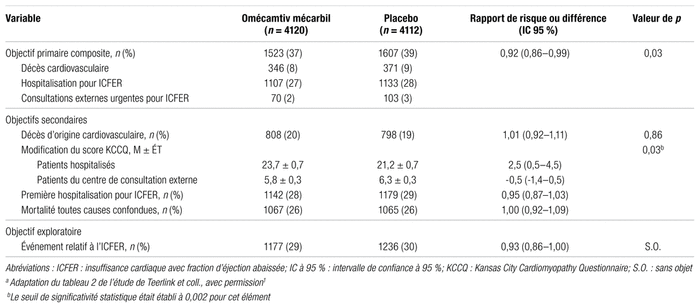
Un total de 41 patients sous omécamtiv mécarbil et 50 patients sous placebo ont cessé leur participation en cours d’étude. Le statut vital de 16 patients était inconnu à la fin de l’étude. Un événement de l’objectif primaire composite est survenu chez 1523 patients (37,0 %) du groupe expérimental comparativement à 1607 patients (39,1 %) du groupe témoin (rapport de risque [RR] : 0,92; intervalle de confiance à 95 % [IC 95 %] : 0,86–0,99; p = 0,03). La réduction du risque absolu avec le traitement étudié était de 2,1 % et le nombre de patients à traiter (NNT) durant 21,8 mois, de 41. L’effet de l’omécamtiv mécarbil apparaît constant dans les différents sous-groupes analysés, sauf chez les patients présentant une FEVG inférieure à la médiane (28 % ou moins) qui semblent en bénéficier davantage.
En ce qui concerne les objectifs secondaires, l’étude n’a montré aucune différence significative, ni pour la mortalité d’origine cardiovasculaire (omécamtiv mécarbil : 19,6 %; placebo : 19,4 %; RR : 1,01; IC 95 % : 0,92–1,11), ni pour la variation du score total KCCQ, ni pour la survenue d’une première hospitalisation pour insuffisance cardiaque (omécamtiv mécarbil : 27,7 %; placebo : 28,7 %; RR: 0,95; IC 95 % : 0,87–1,03). Enfin, aucune différence significative n’a été constatée non plus pour la mortalité toutes causes confondues. Les résultats complets sont présentés dans le tableau II.
Tableau II Principaux résultats d’efficacité de l’étude GALACTIC-HFa
Quant à l’innocuité, 20,6 % des participants du groupe expérimental comparativement à 21,9 % des sujets du groupe témoin ont cessé leur traitement. Dans le groupe prenant l’omécamtiv mécarbil, 9,0 % des patients ont abandonné en raison d’effets indésirables vs 9,3 % des patients du groupe témoin. Une présomption d’infarctus ou d’ischémie active du myocarde a conduit à l’arrêt du traitement chez 103 patients prenant l’omécamtiv mécarbil et chez 101 patients recevant le placebo. Aucune différence significative n’est ressortie entre les groupes sur le plan des effets indésirables cardiaques malgré une légère hausse des troponines de 4 ng/L dans le groupe expérimental. Aucune différence dans les taux d’arythmie ventriculaire n’a été détectée. Les taux de créatinine et de potassium sérique sont demeurés inchangés, tandis qu’une légère réduction de la fréquence cardiaque ainsi qu’une baisse de 10 % du taux de NT-proBNP ont été notées dans le groupe traité.
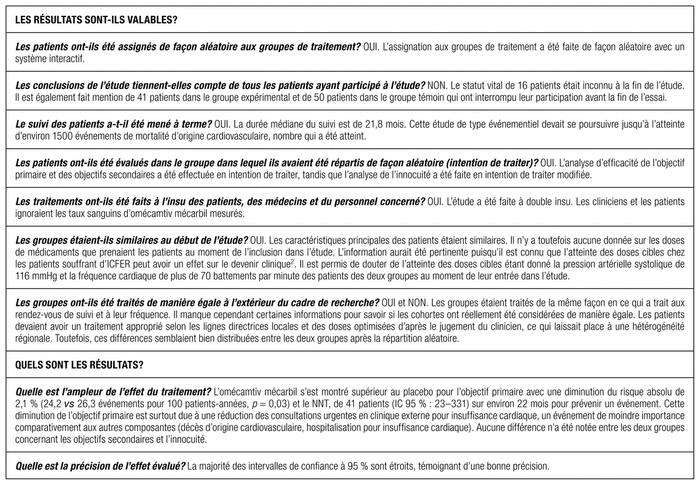
Grille d’évaluation critique

Discussion
La présente étude a montré qu’un traitement par l’omécamtiv mécarbil est plus efficace que le placebo en diminuant la survenue d’un événement de l’objectif primaire composite (décès d’origine cardiovasculaire ou premier événement d’insuffisance cardiaque) de manière significative chez des patients qui en souffrent et recevant une pharmacothérapie conforme aux lignes directrices. Les caractéristiques des deux groupes étaient similaires. Les patients étaient atteints sensiblement des mêmes maladies concomitantes et avaient majoritairement une classe fonctionnelle NYHA II ou III. Les signes vitaux et les valeurs de laboratoire étaient semblables dans les deux groupes.
L’étude GALACTIC-HF comporte plusieurs forces, dont sa méthodologie. Il s’agit d’un essai clinique multicentrique à double insu contre placebo. Les patients ont été stratifiés selon leur région et selon qu’ils étaient hospitalisés ou non. Les données sont objectives (concentrations sériques du médicament, NT-proBNP, fréquence cardiaque, etc.), pertinentes et fiables. Les objectifs cliniques sont appropriés et semblables à ceux employés dans le domaine. Les analyses statistiques sont adaptées à la méthodologie.
Cette étude présente néanmoins plusieurs limites. Les critères d’inclusion et d’exclusion étaient représentatifs de la majorité des patients atteints d’ICFER, quoique certains ont pu limiter la généralisation des résultats. Les patients de 85 ans et plus, ceux prenant un traitement chronique pour le contrôle du rythme (à l’exception de l’amiodarone) ou ceux dont l’état était instable ont été exclus, ce qui restreignait la validité externe. Peu de femmes (21 %) et de personnes noires (moins de 7 %) étaient incluses, ce qui limite la généralisation des résultats à ces sous-groupes. Moins de 20 % des patients prenaient un antagoniste des récepteurs de l’angiotensine-inhibiteur de la néprilysine (ARNI) et moins de 3 % prenaient un inhibiteur du co-transporteur sodium-glucose de type 2 (iSGLT2).
Le recrutement ayant eu lieu entre janvier 2017 et juillet 2019, plusieurs études phares n’étaient pas encore publiées, ce qui peut expliquer pourquoi les iSGLT2 n’étaient pas employés fréquemment dans cette étude15,16. En 2021, la Société canadienne de cardiologie a ajouté les iSGLT2 et l’ARNI dans les médicaments de première intention. Les patients à l’étude étaient donc possiblement moins représentatifs de ceux actuellement rencontrés en pratique2.
Le mécanisme d’action de l’omécamtiv mécarbil est différent de celui des autres traitements disponibles. Comme les analyses de sous-groupes ne montraient pas d’hétérogénéité des résultats selon la prise ou non d’ARNI, les bienfaits de l’omécamtiv mécarbil devraient théoriquement se maintenir si son utilisation devenait plus répandue. Les compagnies ayant participé au financement de l’étude ont participé à sa réalisation. L’analyse des données a toutefois été effectuée par un statisticien indépendant, et les événements ont été révisés par un comité externe indépendant.
L’étude GALACTIC-HF, comme plusieurs autres portant sur les iSGLT2 contre l’ICFER chez les patients non diabétiques, s’intéresse aux nouvelles stratégies de traitement et de réduction de la mortalité liée à l’ICFER. L’étude DAPA-HF sur la dapagliflozine et l’étude EMPEROR-Reduced sur l’empagliflozine ont révélé des bienfaits cliniques convaincants : diminution des hospitalisations pour cause d’insuffisance cardiaque, de la mortalité d’origine cardiovasculaire et de la mortalité toutes causes confondues (DAPA-HF seulement)15,16. Ces études auront une influence importante, et les bienfaits cliniques des iSGLT2 sont supérieurs à ceux de l’omécamtiv mécarbil. Le recours aux bêtabloquants et aux inhibiteurs des récepteurs minéralocorticoïdes était similaire dans toutes ces études.
Plus de patients de l’étude GALACTIC-HF recevaient un ARNI (environ 20 %), comparativement à ceux de l’étude DAPA-HF (11 %) et d’autres études sur l’ICFER, comme l’étude VICTORIA (14,5 %) sur le vériciguat, un activateur de la guanylate cyclase employé chez des patients ayant présenté une décompensation de leur insuffisance cardiaque dans les six derniers mois17. L’étude VICTORIA a montré une réduction significative primaire composite (mortalité d’origine cardiovasculaire ou première hospitalisation pour insuffisance cardiaque) (RR : 0,9; IC 95 % : 0,82–0,98; p = 0,02)17. Le nombre de sujets à traiter avec cette molécule pendant un an pour prévenir un événement était de 24, alors que celui de l’omécamtiv mécarbil était de 41, pour un objectif primaire similaire. Les sujets de DAPA-HF avaient une FEVG moyenne légèrement plus élevée (31 %), en comparaison de ceux des études EMPEROR-Reduced. VICTORIA (28 %) et GALACTIC-HF (27 %)15–17. Ces deux dernières comprenaient aussi une proportion plus importante de patients ayant une classe fonctionnelle NYHA III (plus de 40 %)17. Tout comme l’empagliflozine et le vériciguat, l’omécamtiv mécarbil n’a pas entraîné de réduction de la mortalité d’origine cardiovasculaire.
Bien que GALACTIC-HF soit intéressante puisqu’elle propose une option thérapeutique au mode d’action novateur, il est peu probable qu’elle se taille une place prochainement comme agent de première intention. Les résultats significatifs pour le critère d’évaluation principal étaient surtout expliqués par la diminution des consultations externes urgentes en raison d’une exacerbation de l’insuffisance cardiaque, davantage que par la baisse des décès d’origine cardiovasculaire ou des hospitalisations pour insuffisance cardiaque, rendant les effets cliniques plutôt mineurs. En effet, malgré une réduction du taux de NT-proBNP, comme dans l’étude COSMIC-HF, aucune baisse des hospitalisations n’a été observée12. En raison de l’hétérogénéité des résultats en fonction de la FEVG, les chercheurs ont évalué plus en profondeur l’effet de l’omécamtiv mécarbil sur les événements cliniques selon la FEVG de base dans une sous-analyse distincte18. Pour les patients ayant une FEVG de 22 % ou moins, la réduction relative du critère d’évaluation principal composite atteignait 17 % alors qu’elle était nulle chez ceux ayant une FEVG de 33 % ou plus18. Ces résultats pourraient aider à bien choisir le type de patient chez qui l’omécamtiv mécarbil serait le plus bénéfique.
La mise à jour, en avril 2021, des lignes directrices de la Société canadienne de cardiologie sur l’ICFER positionne les iSGLT2 et les ARNI comme les traitements de première intention, en plus de la pharmacothérapie usuelle, en raison de leur effet sur la mortalité, contrairement à l’omécamtiv mécarbil qui présente notamment des effets cliniques modestes et qui n’est toujours pas commercialisé au Canada2. À noter que la compagnie Amgen a délaissé ses droits sur la molécule après la publication de l’étude GALACTIC-HF, laissant Cytokinetic propriétaire du brevet en Amérique du Nord19. De plus, étant donné que cette molécule doit être prise deux fois par jour, qu’elle nécessite des dosages plasmatiques pour les ajustements posologiques et qu’il est encore difficile de mesurer ses bienfaits en fonction des coûts associés, l’omécamtiv mécarbil sera probablement utilisé en deuxième intention dans une population bien définie.
Conclusion
En somme, l’étude GALACTIC-HF a montré que l’omécamtiv mécarbil chez les patients atteints d’ICFER a diminué de manière significative la survenue d’un événement composite en réduisant principalement les consultations externes urgentes. Cliniquement, l’effet de cette diminution semble significatif, bien que modeste. Le mode d’action de cette nouvelle classe de myotrope demeure néanmoins intéressant. Il serait avantageux d’explorer son effet dans certaines populations, comme chez les patients ayant une FEVG très abaissée, le sous-groupe qui semblait le plus en bénéficier.
Remerciements
Cet article a été réalisé dans le cadre du cours « Communication scientifique » de la Faculté de pharmacie de l’Université Laval. Les auteurs en remercient la responsable.
Financement
Les auteurs n’ont déclaré aucun financement lié au présent article.
Conflits d’intérêts
Tous les auteurs ont soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Vincent Leclerc est membre du comité de rédaction de Pharmactuel. Les auteurs n’ont déclaré aucun autre conflit d’intérêts lié à cet article.
Références
1. Teerlink JR, Diaz R, Felker GM, McMurray JJV, Metra M, Solomon SD et al. Cardiac myosin activation with omecamtiv mecarbil in systolic heart failure. N Engl J Med 2021;384:105–16.

2. McDonald M, Virani S, Chan M, Ducharme A, Ezekowitz JA, Giannetti N et al. CCS/CHFS heart failure guidelines update: Defining a new pharmacologic standard of care for heart failure with reduced ejection fraction. Can J Cardiol 2021;37:531–46.

3. Ahmad T, Miller PE, McCullough M, Desai NR, Riello R, Psotka M et al. Why has positive inotropy failed in chronic heart failure? Lessons from prior inotrope trials. Eur J Heart Fail 2019;21:1064–78.


4. Maack C, Eschenhagen T, Hamdani N, Heinzel FR, Lyon AR, Manstein DJ et al. Treatments targeting inotropy. Eur Heart J 2019;40: 3626–44.

5. Digitalis Investigation Group. The effect of digoxin on mortality and morbidity in patients with heart failure. N Engl J Med 1997;336:525–33.

6. Hood WB Jr, Dans AL, Guyatt GH, Jaeschke R, McMurray JJ. Digitalis for treatment of heart failure in patients in sinus rhythm. Cochrane Database Syst Rev 2014;2014:CD002901.
7. Psotka MA, Gottlieb SS, Francis GS, Allen LA, Teerlink JR, Adams KF Jr et al. Cardiac calcitropes, myotropes, and mitotropes: JACC review topic of the week. J Am Coll Cardiol 2019;73:2345–53.

8. Psotka MA, Teerlink JR. Direct myosin activation by omecamtiv mecarbil for heart failure with reduced ejection fraction. Handb Exp Pharmacol 2017;243:465–90.

9. Teerlink JR, Clarke CP, Saikali KG, Lee JH, Chen MM, Escandon RD et al. Dose-dependent augmentation of cardiac systolic function with the selective cardiac myosin activator, omecamtiv mecarbil: a first-in-man study. Lancet 2011;378:667–75.

10. Cleland JG, Teerlink JR, Senior R, Nifontov EM, Mc Murray JJ, Lang CC et al. The effects of the cardiac myosin activator, omecamtiv mecarbil, on cardiac function in systolic heart failure: a double-blind, placebo-controlled, crossover, dose-ranging phase 2 trial. Lancet 2011;378:676–83.

11. Teerlink JR, Felker GM, McMurray JJV, Ponikowski P, Metra M, Filippatos GS et al. Acute treatment with omecamtiv mecarbil to increase contractility in acute heart failure: the ATOMIC-AHF study. J Am Coll Cardiol 2016;67:1444–55.

12. Teerlink JR, Felker GM, McMurray JJ, Solomon SD, Adams KF Jr, Cleland JG et al. Chronic oral study of myosin activation to increase contractility in heart failure (COSMIC-HF): a phase 2, pharmacokinetic, randomised, placebo-controlled trial. Lancet 2016;388:2895–903.

13. Massamba VK, Rochette L, Trépanier PL, Blais C. Surveillance de l’insuffisance cardiaque au Québec : Prévalence, incidence et mortalité de 2005–2006 à 2015–2016. Bureau d’information et d’études en santé des populations. Québec : Institut national de santé publique du Québec; 2019. 26 pages.
14. Laflamme É, Vachon A, Gilbert S, Boisvert J, Leclerc V, Bernier M et al. Usefulness of a titration algorithm for de novo users of sacubitril/valsartan in a tertiary centre heart failure clinic. Cardiovasc J Afr 2018;29:352–6.

15. McMurray JJV, Solomon SD, Inzucchi SE, Køber L, Kosiborod MN, Martinez FA et al. Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med 2019; 381:1995–2008.

16. Packer M, Anker SD, Butler J, Filippatos G, Pocock SJ, Carson P et al. Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med 2020;383:1413–24.

17. Armstrong PW, Pieske B, Anstrom KJ, Ezekowitz J, Hernandez AF, Butler J et al. Vericiguat in patients with heart failure and reduced ejection fraction. N Engl J Med 2020;382:1883–93.

18. Teerlink JR, Diaz R, Felker GM, McMurray JJV, Metra M, Solomon SD et al. Effect of ejection fraction on clinical outcomes in patients treated with omecamtiv mecarbil in GALACTIC-HF. J Am Coll Cardiol 2021;78:97–108.

19. Amgen. Amgen to transition development and commercial rights for omecamtiv mecarbil and AMG 594 to Cytokinetics. [en ligne] https://www.amgen.com/newsroom/press-releases/2020/11/amgen-to-transition-development-and-commercial-rights-for-omecamtiv-mecarbil-and-amg-594-to-cytokinetics?fbclid=IwAR1NiQvTrC939teHnOyskZl_3S29bNJaz7trgvo9Xc9m2U6_0CcFgW1SNKw (site visité le 4 août 2021).
Pour toute correspondance: Laelia Caron, Centre intégré universitaire de santé et de services sociaux de la Capitale-Nationale, Hôpital de La Malbaie, 303, rue Saint-Étienne, La Malbaie (Québec) G5A 1T1, CANADA; Téléphone : 418 665-1700; Courriel : laelia.caron.ciussscn@ssss.gouv.qc.ca
*Laelia Caron, Anne Bélanger, Isabelle Boudreau, Jacynthe Ouellette et Cédric Pageau ont contribué de façon équivalente à la rédaction de cet article ( Return to Text )
(Return to Top)
PHARMACTUEL, Vol. 55, No. 3, 2022