Marc-Olivier Pilon, Pharm.D.1,2,3, Catherine Tremblay, Pharm.D.1,4,5, Catherine Gloutnez, Pharm.D.1,6, Geneviève White, Pharm.D.1,4,7, Simon de Denus, B.Pharm., M.Sc., Ph.D.8,9
Reçu le 3 novembre 2021: Accepté après révision le 8 février 2022
L’insuffisance cardiaque avec fraction d’éjection réduite (ICFER) et l’insuffisance cardiaque avec fraction d’éjection préservée (ICFEP) se distinguent entre autres par la fraction d’éjection du ventricule gauche (FEVG) du patient, qui est ≤ 40 % et ≥ 50 %, respectivement1. L’insuffisance cardiaque est un problème chronique dont l’incidence augmente depuis quelques années en raison de la plus grande survie après un infarctus du myocarde et du vieillissement de la population. Cette maladie entraîne un taux élevé d’hospitalisations et des séjours de plus longue durée, ce qui représente des ressources et des coûts importants pour le système de santé2,3. L’optimisation de la pharmacothérapie fait partie des stratégies mises en place pour améliorer la prise en charge des patients et alléger le fardeau sur le système de santé3,4. Le traitement de l’ICFER se compose actuellement d’un bêtabloquant, d’un inhibiteur de l’enzyme de conversion de l’angiotensine (IECA) ou d’un antagoniste des récepteurs de l’angiotensine (ARA) ou du sacubitril-valsartan, d’un antagoniste des récepteurs minéralocorticoïdes (ARM) et d’un inhibiteur du cotransporteur du sodium-glucose de type 2 (iSGLT2)1,2. Seul le traitement de l’ICFER est abordé dans le présent article.
Le sacubitril-valsartan est actuellement la seule association d’un inhibiteur de la néprilysine et d’un antagoniste des récepteurs AT1 de l’angiotensine II (ARNI) commercialisée au Québec. Les critères de remboursement du sacubitril-valsartan par la Régie de l’assurance maladie du Québec (RAMQ) incluent une période préalable de quatre semaines de traitement par IECA ou ARA, ce qui entraîne un délai minimal non négligeable avant l’instauration du sacubitril-valsartan, même si des données récentes semblent montrer une efficacité et un profil d’innocuité favorables comme traitement initial (tableau I). Devrait-on donner un ARNI en première intention chez les patients atteints d’insuffisance cardiaque qui n’ont jamais pris d’IECA ou d’ARA?
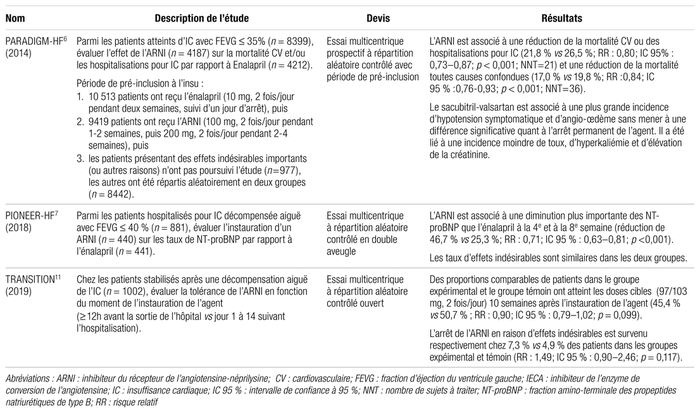
Tableau I Principales études portant sur l’efficacité et l’innocuité du sacubitril-valsartan

Seules les données portant sur une population atteinte d’ICFER dite hémodynamiquement stable ont été examinées. Ainsi, la récente publication de l’étude PARADISE-MI n’a pas été considérée. PARADISE-MI est un essai prospectif, mulicentrique, à double insu, à répartition aléatoire et contrôlé visant à montrer la supériorité du sacubitril-valsartan sur le ramipril en instauration précoce après un infarctus du myocarde chez une population présentant un risque élevé d’insuffisance cardiaque (FEVG ≤ 40 % et/ou congestion pulmonaire transitoire et au moins un des huit facteurs de risque supplémentaires)5. Aucun bienfait significatif n’a été observé pour le sacubitril-valsartan par rapport au ramipril dans cette étude.
L’étude PARADIGM-HF est un essai multicentrique prospectif à répartition aléatoire contrôlé avec période de pré-inclusion; il s’agit de l’étude la plus importante en matière de démonstration des bienfaits du sacubitril-valsartan en contexte ambulatoire par rapport à l’énalapril. Les patients devaient être traités par un IECA ou un ARA à dose stable depuis au moins quatre semaines ainsi que par un bêtabloquant6. Dans cette étude, la supériorité du sacubitril-valsartan face à l’énalapril en ce qui a trait à la réduction de la mortalité cardiovasculaire et des hospitalisations pour insuffisance cardiaque a été grandement considérée dans les mises à jour des lignes directrices portant sur l’insuffisance cardiaque1,2.
L’étude PIONEER-HF, un essai multicentrique à répartition aléatoire contrôlé à double insu, montre une réduction plus rapide de la fraction amino-terminale des propeptides natriurétiques de type B (NT-proBNP) lorsqu’un patient est traité par un ARNI par rapport à l’énalapril dans un contexte d’hospitalisation pour insuffisance cardiaque décompensée après stabilisation hémodynamique7. Le NT-proBNP est un biomarqueur faisant notamment fonction de mesure objective non effractive de la fonction cardiaque et de l’état volémique. Il s’agit d’ailleurs du biomarqueur pronostique le mieux établi pour l’insuffisance cardiaque. Un faible taux de NT-proBNP ou une diminution du NT-proBNP après une intervention est associé à un pronostic plus favorable chez les patients atteints d’insuffisance cardiaque décompensée ou chronique8.
Une analyse de sous-groupe portant sur l’efficacité du sacubitril-valsartan a été menée chez les participants sans exposition antérieure à un IECA ou à un ARA (n = 209) par rapport à ceux ayant été préalablement traités par un IECA ou un ARA (n = 170) et n’a révélé aucune différence significative quant à la réduction des NT-proBNP entre les deux groupes7.
Une revue récente de la littérature signale des bienfaits cliniques plus marqués, notamment sur la mortalité et le taux de réadmission, lorsque les agents utilisés contre l’insuffisance cardiaque sont amorcés à l’hôpital9. Par exemple, l’étude IMPACT-HF, une étude prospective à répartition aléatoire ouverte (n = 363), mentionne un taux plus élevé d’atteinte des doses cibles de bêtabloquant (11,5 % vs 3,2 %; p < 0,02). L’étude rapporte également une plus grande proportion de participants prenant un bêtabloquant (91,2 % vs 73,4 %; p < 0,0001) deux mois après leur congé de l’hôpital chez ceux ayant commencé le carvédilol durant l’hospitalisation (n = 165) comparativement à ceux ayant commencé le bêtabloquant après l’évaluation du médecin en consultation externe (n = 130; temps médian d’instauration du bêtabloquant après l’hospitalisation = 17 jours)10.
L’étude TRANSITION est la seule étude multicentrique à répartition aléatoire contrôlée ouverte d’envergure qui compare les bienfaits de l’instauration du sacubitril-valsartan en milieu hospitalier à son instauration en contexte ambulatoire11. Parmi la population à l’étude, près de 25 % des participants n’avaient jamais pris d’IECA ou d’ARA11. Toutefois, le temps médian d’instauration de l’ARNI entre les deux groupes ne diffère pas significativement, soit un jour précédant et un jour suivant la sortie de l’hôpital dans chacun des groupes respectifs. L’étude n’a donc pas été en mesure d’évaluer adéquatement l’existence d’une différence entre l’instauration d’un ARNI durant une hospitalisation et l’instauration tardive de quelques semaines ou quelques mois après l’hospitalisation. Sans surprise, aucune différence n’a été observée entre les groupes.
Une phase d’extension ouverte de quatre semaines suivant immédiatement les huit semaines d’évaluation de l’étude PIONEER-HF a par ailleurs apporté des résultats additionnels appuyant l’instauration d’un ARNI en milieu hospitalier. Pendant cette période, les patients recevant l’énalapril ont cessé l’IECA et ont commencé à prendre le sacubitril-valsartan (n = 415). Les patients sous sacubitril-valsartan ont conservé le même traitement (n = 417)12. Selon un critère d’évaluation exploratoire combinant la réhospitalisation pour insuffisance cardiaque et le décès cardiovasculaire, à partir de la répartition aléatoire jusqu’à la semaine 12, les résultats montrent que les patients qui prenaient l’ARNI depuis son instauration en milieu hospitalier présentaient un avantage clinique par rapport à ceux dont l’instauration s’est faite en contexte ambulatoire après une exposition de huit semaines à l’énalapril (13 % vs 18,1 %; rapport de risque [RR] : 0,69; intervalle de confiance à 95 % [IC 95 %] : 0,49–0,97; p = 0,03)12. Étant donné le devis de cette étude et la relativement petite taille de l’échantillon, ces résultats doivent cependant être interprétés avec prudence.
Dans la mise à jour 2021 des lignes directrices sur l’insuffisance cardiaque, la Société canadienne de cardiologie mentionne que l’utilisation du sacubitril-valsartan en première intention est à privilégier, entre autres chez les patients hospitalisés pour une insuffisance cardiaque de novo avec FEVG ≤ 40 %, sans qu’une exposition préalable à un IECA ou à ARA soit nécessaire. Il s’agit d’une recommandation faible associée à un niveau de preuve modéré selon le système GRADE2.
L’American College of Cardiology énonce dans la mise à jour 2021 du consensus d’experts de 2017 sur l’insuffisance cardiaque que l’instauration d’un ARNI sans traitement préalable à l’aide d’un IECA ou d’un ARA constitue une méthode considérée comme sécuritaire et efficace chez tous les patients atteints d’ICFER1.
Malgré les bienfaits précédemment énumérés, l’utilisation de ce médicament demeure peu fréquente au Québec et au Canada. La Société canadienne de cardiologie mentionne que seulement 12 % de la population admissible recevait l’association sacubitril-valsartan au Canada en 2018, ce pourcentage variant de 3 % à 18 % selon les provinces4. Aucune donnée plus récente n’est accessible pour l’instant à l’échelle provinciale ou nationale.
Le sacubitril-valsartan n’est généralement pas instauré au moment du diagnostic, possiblement en raison des critères actuels de la RAMQ. Selon l’Institut national d’excellence en santé et en services sociaux (INESSS), les patients qui changent pour l’ARNI ont pris en moyenne un IECA ou un ARA pendant 120 jours après leur diagnostic d’insuffisance cardiaque, soit trois mois de plus que la durée demandée pour la couverture3. La plupart des patients sont suivis par un médecin de famille ou un interniste, une faible proportion seulement le sont dans une clinique externe spécialisée3,4. Au Canada, il a été constaté que, contrairement aux médecins généralistes, les médecins spécialistes, dont les cardiologues, sont plus susceptibles de prescrire des médicaments plus récents pour le traitement de l’insuffisance cardiaque4.
Les données actuelles sont insuffisantes pour établir une efficacité supérieure à court terme lors de l’instauration de l’ARNI d’emblée3,7,11. En revanche, l’instauration de l’ARNI d’emblée lors d’une hospitalisation pour insuffisance cardiaque décompensée après stabilisation hémodynamique est considérée sûre et pourrait constituer une occasion d’en optimiser l’utilisation compte tenu de la variabilité importante des suivis des patients après le diagnostic1,2,4,7,9,11,12. Plusieurs études montrent les bienfaits d’instaurer des agents en milieu hospitalier chez les patients atteints d’insuffisance cardiaque9,10. Cette approche pourrait également diminuer le délai avant l’instauration de l’ARNI et permettre aux patients n’étant pas suivis par une clinique d’insuffisance cardiaque d’avoir un meilleur accès au traitement4.
En novembre 2020, l’INESSS a transmis une recommandation de modification d’indication reconnue pour le remboursement du sacubitril-valsartan. Ces experts considèrent comme raisonnable le retrait du critère d’utilisation préalable d’un IECA/ARA pendant quatre semaines si le fabricant contribue à alléger les coûts associés3.
Selon les calculs de l’INESSS, 83,3 M $ CA seront consacrés au traitement de cette maladie dans les trois prochaines années avec l’indication actuelle du sacubitril-valsartan. Si le critère de remboursement est modifié, des coûts bruts de 3,1 M $ CA s’y ajouteraient, ce chiffre tenant compte du coût du médicament, de la marge du grossiste et des honoraires professionnels du pharmacien3.
Une étude canadienne s’est également penchée sur l’analyse coût-utilité de différentes stratégies d’instauration du sacubitril-valsartan. Les coûts considérés incluent le médicament, l’imagerie diagnostique ainsi que les hospitalisations pour exacerbation de l’insuffisance cardiaque. L’utilité a été établie à l’aide de la méthode des années de vie pondérées par la qualité (QALY ou quality-adjusted life year)13. Les auteurs ont déterminé la norme de soins actuelle à partir des observations de l’étude américaine CHAMP-HF, qui préconise l’instauration et l’ajustement d’un bêtabloquant, d’un ARM et d’un IECA ou d’un ARA, suivis d’un changement vers l’ARNI chez environ 14 % des patients en neuf mois. Cette norme a été comparée avec trois scénarios dans lesquels tous les patients font présumément la transition vers l’ARNI : une instauration de l’ARNI sans prise d’IECA ou d’ARA préalable, une transition vers l’ARNI rapide en trois mois ou une transition tardive en neuf mois. La stratégie de soins actuelle est associée au coût le plus faible, mais aussi aux bienfaits les moins importants. L’analyse révèle que les trois stratégies, soit l’instauration de novo, rapide ou tardive, ont des bienfaits supérieurs (3,42, 3,41 et 3,38 années de vie pondérées par la qualité, respectivement) comparativement à la stratégie actuelle (3,28 QALY). L’instauration de l’ARNI de novo serait la stratégie présentant le meilleur coût par année de vie pondérée par la qualité (de novo : 34 727 $ CA, rapide : 35 871 $ CA, tardive : 40 234 $ CA)13.
L’étude comporte certaines limites rendant plus difficile la généralisation des résultats à la population réelle. Les données ont été extrapolées de diverses sources, notamment de l’étude américaine CHAMP-HF pour la norme actuelle de soins et de l’étude PARADIGM-HF pour la tolérance à l’ARNI. La complexité du schéma thérapeutique en cas d’insuffisance cardiaque complique également l’évaluation de la proportion de patients non adhérents qui risque d’avoir des bienfaits moindres13.
L’approche de prescription du sacubitril-valsartan en première intention chez les patients hospitalisés et nouvellement diagnostiqués dont l’état hémodynamique est stable présenterait un profil coût-efficacité et un profil d’innocuité favorables et augmenterait potentiellement son utilisation chez les patients admissibles. Il est donc à souhaiter que les critères de remboursement de ce médicament rendent une telle utilisation possible chez les patients.
La participation d’un pharmacien en milieu hospitalier pourrait se montrer avantageuse pour la surveillance et l’ajustement de l’ARNI qui demandent un suivi initial plus étroit que celui d’un IECA ou d’un ARA. Il serait intéressant d’évaluer l’influence du pharmacien sur les résultats du traitement.
Les auteurs n’ont déclaré aucun financement lié au présent article.
Tous les auteurs ont soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Simon de Denus a reçu des subventions de Pfizer, AstraZenaca et RMS/Dalcor. Les autres auteurs n’ont déclaré aucun conflit d’intérêts lié à cet article.
1. Maddox TM, Januzzi JL, Jr., Allen LA, Breathett K, Butler J, Davis LL et al. 2021 update to the 2017 ACC expert consensus decision pathway for optimization of heart failure treatment: answers to 10 pivotal issues about heart failure with reduced ejection fraction: a report of the American College of Cardiology solution set oversight committee. J Am Coll Cardiol 2021; 77:772–810.

2. McDonald M, Virani S, Chan M, Ducharme A, Ezekowitz JA, Giannetti N et al. CCS/CHFS heart failure guidelines update: defining a new pharmacologic standard of care for heart failure with reduced ejection fraction. Can J Cardiol 2021;37:531–46.

3. Institut national d’excellence en santé et en services sociaux. Avis transmis au ministre de la Santé et des Services sociaux, Entresto-insuffisance cardiaque. Québec : l’Institut; 2020.
4. Huitema AA, Daoust A, Anderson K, Poon S, Virani S, White M et al. Optimal usage of sacubitril/valsartan for the treatment of heart failure: the importance of optimizing heart failure care in Canada. CJC Open 2020;2:321–7.


5. Pfeffer MA, Claggett B, Lewis EF, Granger CB, Køber L, Maggioni AP et al. Angiotensin receptor-neprilysin inhibition in acute myocardial infarction. New Engl J Med 2021;385:1845–55.

6. McMurray JJV, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. New Engl J Med 2014;371:993–1004.

7. Velazquez EJ, Morrow DA, DeVore AD, Duffy CI, Ambrosy AP, McCague K et al. Angiotensin–neprilysin inhibition in acute decompensated heart failure. N Engl J Med 2018;380:539–48.

8. Greene SJ, Maggioni AP, Fonarow GC, Solomon SD, Böhm M, Kandra A et al. Clinical profile and prognostic significance of natriuretic peptide trajectory following hospitalization for worsening chronic heart failure: findings from the ASTRONAUT trial. Eur J Heart Fail 2015;17:98–108.

9. Gillette M, Bozkurt B. Ins and outs: perspectives of inpatient prescribing for sacubitril/valsartan. Ann Pharmacother 2021;55:805–13.

10. Gattis WA, O’Connor CM, Gallup DS, Hasselblad V, Gheorghiade M. Predischarge initiation of carvedilol in patients hospitalized for decompensated heart failure: Results of the initiation management predischarge: process for assessment of carvedilol therapy in heart failure (IMPACT-HF) trial. J Am Coll Cardiol 2004; 43:1534–41.

11. Wachter R, Senni M, Belohlavek J, Straburzynska-Migaj E, Witte KK, Kobalava Z et al. Initiation of sacubitril/valsartan in haemodynamically stabilised heart failure patients in hospital or early after discharge: primary results of the randomised TRANSITION study. Eur J Heart Fail 2019;21:998–1007.

12. DeVore AD, Braunwald E, Morrow DA, Duffy CI, Ambrosy AP, Chakraborty H et al. Initiation of angiotensin-neprilysin inhibition after acute decompensated heart failure: secondary analysis of the open-label extension of the PIONEER-HF trial. JAMA Cardiol 2020;5:202–7.


13. Grant ADM, Chew DS, Howlett JG, Miller RJH. Cost-effectiveness of earlier transition to angiotensin receptor neprilysin inhibitor in patients with heart failure and reduced ejection fraction. CJC Open 2020;2:447–53.


PHARMACTUEL, Vol. 55, No. 3, 2022