
François Métivier, Pharm.D., M.Sc.1,2,3, Audrey-Ann Pelletier-St-Pierre, Pharm.D., M.Sc.4,5, Jimmy Côté, B.Pharm., M.Sc.4,6, Julie Méthot, B.Pharm., M.Sc., Ph.D., FOPQ7,8
Reçu le 29 décembre 2021: Accepté après révision par les pairs le 8 mars 2022
Résumé
Objectif : Décrire l’évolution des thromboses veineuses superficielles 45 et 90 jours après le diagnostic initial chez des patients atteints d’un cancer recevant un ou des traitements antinéoplasiques.
Méthodologie : Étude descriptive rétrospective effectuée à l’Institut universitaire de cardiologie et de pneumologie de Québec–Université Laval auprès des patients de la clinique d’oncologie qui ont souffert d’une thrombose veineuse superficielle entre septembre 2016 et avril 2021. L’évolution des patients et les traitements entrepris ont été recueillis.
Résultats : Cinquante-cinq cas de thromboses veineuses superficielles ont été inclus. Le quart des patients ont présenté au moins une complication à la suite de leur thrombose veineuse superficielle, principalement des récurrences et des extensions de thrombose veineuse superficielle. Trois thromboses veineuses profondes ont été répertoriées. Aucune embolie pulmonaire n’a été répertoriée. Aucun décès lié à une complication des thromboses veineuses profondes n’a été signalé. La majorité des complications sont survenues dans les 45 jours suivant le diagnostic initial (n = 9). La plupart des patients recevaient un anticoagulant au moment de la complication (n = 8). Le traitement le plus fréquemment instauré a été une héparine de faible poids moléculaire à dose réduite.
Conclusion : Les complications thrombo-emboliques ont été fréquentes, mais étaient majoritairement mineures. Elles sont survenues principalement dans les 45 premiers jours, même chez des patients prenant un anticoagulant. La plupart des traitements prescrits divergeaient des recommandations actuelles. Ainsi, il sera possible de réviser la pratique locale afin qu’elle reflète mieux les données actuelles.
Mots clés : Anticoagulant, cancer, complication, thrombose veineuse superficielle, traitement
Abstract
Objective : To describe the course of superficial venous thromboses 45 and 90 days after initial diagnosis in cancer patients receiving one or more antineoplastics.
Methodology : A retrospective descriptive study conducted at the Institut universitaire de cardiologie et de pneumologie de Québec–Université Laval in oncology clinic patients with superficial venous thrombosis between September 2016 and April 2021. The patients’ outcomes and treatments were collected.
Results : Fifty-five cases of superficial venous thrombosis were included. One-fourth of the patients experienced at least one complication following their superficial venous thrombosis, mainly recurrence and extension of superficial venous thrombosis. Three deep-vein thromboses were reported. No pulmonary embolisms were reported, nor were any deaths associated with a complication of deep-vein thrombosis. Most of the complications occurred within 45 days of initial diagnosis (n = 9). Most of the patients were receiving an anticoagulant when the complication occurred (n = 8). The treatment most commonly initiated was reduced-dose, low-molecular-weight heparin.
Conclusion : Thromboembolic complications were frequent but mostly minor. They occurred mainly within the first 45 days, even in patients taking an anticoagulant. Most of the treatments prescribed were not in line with the current recommendations. Thus, it will be possible to revise local practice to better reflect the current data.
Keywords : Anticoagulant, cancer, complication, superficial venous thrombosis, treatment
La thrombose veineuse superficielle engendre de la douleur, de la chaleur, de l’érythème et une pression palpable sur la veine touchée1. Son taux d’incidence annuel est estimé à 0,64 %, et sa prévalence serait deux fois plus élevée que celle des thromboses veineuses profondes et des embolies pulmonaires1,2. À la suite d’un diagnostic de thrombose veineuse superficielle, les patients auraient un risque quatre fois plus élevé de développer une embolie pulmonaire qu'un patient non atteint3.
Plusieurs facteurs de risque sont associés au développement d’une thrombose veineuse superficielle, comme l’âge avancé, l’obésité, le tabagisme, les antécédents de thrombo-embolie, les maladies auto-immunes et le cancer1,2,4,5. Chez la clientèle atteinte de cancer, le type et le stade du cancer ainsi que les traitements employés influeraient sur le risque de thrombose6–11.
La thrombose veineuse superficielle étant depuis longtemps considérée comme un problème de santé bénin, sa prise en charge s’est longtemps limitée à des traitements de soutien et à des anti-inflammatoires non stéroïdiens (AINS) malgré les faibles bienfaits et les données limitées sur leur efficacité4,12.
Afin d’en prévenir les complications, quelques études ont été effectuées pour déterminer la place des anticoagulants dans le traitement. En 2010, CALISTO a été la première étude d’envergure à répartition aléatoire contrôlée à double insu à comparer le fondaparinux par voie sous-cutanée (une dose de 2,5 mg pendant 45 jours) à un placebo chez des patients présentant une thrombose veineuse superficielle d’au moins 5 cm à un membre inférieur. Les patients inclus ne devaient pas présenter certains facteurs de risque de complications thrombo-emboliques, tels qu’un cancer. Les résultats ont montré des bienfaits avec le fondaparinux, dont une réduction de l’incidence de thrombose veineuse profonde et d’embolie pulmonaire, le nombre de sujets à traiter pour prévenir l’un de ces deux événements étant de 8813.
En 2017, l’étude SURPRISE a comparé le rivaroxaban (10 mg) au fondaparinux (2,5 mg) administré pendant 45 jours. Le critère d’évaluation principal était la non-infériorité du rivaroxaban à l’aide d’un composite d’événements qui incluait l’apparition d’une thrombose veineuse profonde ou d’une embolie pulmonaire, une progression ou une récurrence de thrombose veineuse superficielle ou le décès. Il a été montré que le rivaroxaban n’était pas inférieur au fondaparinux. Dans cette étude, la population étudiée incluait uniquement des patients présentant au moins un facteur de risque de thrombose, tel qu’un cancer14.
Plusieurs petites études de faible qualité ont évalué l’efficacité des héparines de faible poids moléculaire (HFPM). Elles ont seulement montré une diminution de l’extension et de la récurrence des thromboses veineuses superficielles12. En 2012, les lignes directrices de l’American College of Chest Physicians (CHEST) recommandaient d’ailleurs d’utiliser de préférence le fondaparinux plutôt qu’une HFPM en raison des meilleures preuves d’efficacité15. Cette recommandation fait toujours partie des lignes directrices de 202116.
Malgré la prédisposition des patients atteints d’un cancer et présentant une thrombose veineuse superficielle à développer des complications thrombo-emboliques, il existe peu de données sur leur évolution17. Dans l’étude SURPRISE, les résultats indiquaient que le sous-groupe de patients atteints d’un cancer présentait une incidence de thrombose veineuse profonde et d’embolie pulmonaire plus élevée que les autres sous-groupes14.
Les lignes directrices actuelles de CHEST et de Thrombose Canada suggèrent d’envisager une anticoagulation à dose réduite chez les patients atteints de cancer en raison de leur risque accru de développer des complications thrombo-emboliques2,16. Par ailleurs, lorsque la thrombose veineuse superficielle mesure 5 cm ou plus, Thrombose Canada recommande de commencer d’emblée une anticoagulation à dose réduite2.
En septembre 2016, la clinique ambulatoire d’oncologie de l’Institut universitaire de cardiologie et de pneumologie de Québec affilié à l’Université Laval (IUCPQ–UL) a révisé sa conduite pour favoriser le recours aux anticoagulants à dose réduite en cas de thromboses veineuses superficielles. Depuis, aucune étude n’a été effectuée pour connaître l’évolution générale des patients traités. La littérature étant restreinte sur le sujet, il est pertinent de décrire l’évolution des patients pour valider la pratique locale ou l’améliorer.
L’objectif principal de cette étude était de décrire, chez les patients suivis à la clinique ambulatoire d’oncologie de l’IUCPQ-UL, l’incidence des éléments suivants 45 et 90 jours après le diagnostic initial de thrombose veineuse superficielle : la récurrence de thrombose veineuse superficielle, l’extension de la thrombose veineuse superficielle, la progression vers une thrombose veineuse profonde et/ou vers une embolie pulmonaire ainsi que la mortalité toutes causes confondues.
Les objectifs secondaires étaient de décrire les traitements employés contre les thromboses veineuses superficielles en les mettant en relation avec l’objectif principal, de décrire la thrombose veineuse superficielle au moment du diagnostic et de décrire les effets indésirables et l’observance des traitements prescrits.
Le devis choisi était une étude descriptive rétrospective de population longitudinale. La population cible étant celle des patients suivis à la clinique ambulatoire d’oncologie de l’IUCPQ–UL, les patients recrutés sont ceux qui, entre septembre 2016 et avril 2021, ont présenté une thrombose veineuse superficielle pendant qu’ils recevaient un traitement antinéoplasique. L’approbation du comité d’éthique de l’IUCPQ–UL a été obtenue. Le Directeur des services professionnels a donné son autorisation pour la consultation des dossiers médicaux.
Pour être inclus dans l’étude, les patients devaient avoir été suivis par la clinique ambulatoire d’oncologie de l’IUCPQ–UL entre septembre 2016 et avril 2021 et avoir été traités au moyen d’un ou de plusieurs antinéoplasiques au moment de leur thrombose veineuse superficielle. Le diagnostic de thrombose veineuse superficielle devait avoir été confirmé par une échographie Doppler. Les critères d’exclusion étaient la présence d’une thrombose veineuse superficielle se trouvant à moins de 3 cm d’une veine profonde ou de présenter une thrombose veineuse profonde ou une embolie pulmonaire concomitante à la thrombose veineuse superficielle, ce qui nécessitait l’instauration d’une anticoagulation à dose thérapeutique. Les patients recevant déjà une anticoagulation pour une autre indication étaient aussi exclus.
L’échantillon a été obtenu par série consécutive. Les résultats ont été compilés en consultant les dossiers archivés. L’outil de collecte utilisé a été préalablement testé par deux chercheurs auprès de trois patients. Parmi les variables permettant de décrire la population, on trouve le sexe, l’âge, le poids, la taille et l’indice de masse corporelle. Les facteurs de risque de thrombose veineuse superficielle et de complications thrombo-emboliques ont aussi été recueillis : patient de plus de 65 ans, obésité, antécédents de thrombo-embolie, utilisation de contraceptifs hormonaux ou de traitements de remplacement hormonaux, intervention chirurgicale dans les trois mois précédents, présence d’une maladie auto-immune, tabagisme, type de cancer, stade du cancer et traitements antinéoplasiques.
Afin d’atteindre l’objectif principal, les variables recueillies étaient qualitatives et dichotomiques. On y trouvait la récurrence de thrombose veineuse superficielle, l’extension de la thrombose veineuse superficielle, la progression vers une thrombose veineuse profonde, la progression vers une embolie pulmonaire et le décès. Toutes ces variables étaient évaluées 45 et 90 jours après la date du diagnostic initial de thrombose veineuse superficielle.
Pour l’objectif secondaire, les traitements prescrits ainsi que leur dose et leur durée étaient compilés. Lorsqu’une complication survenait, l’outil de collecte permettait d’indiquer si le patient recevait ou non un anticoagulant à ce moment. Afin de décrire la thrombose veineuse superficielle lors du diagnostic, sa longueur ainsi que l’emplacement de la veine atteinte ont été recueillis. Pour les effets indésirables, la présence d’un saignement majeur ou mineur ou de tout autre effet indésirable important était recueillie. Un saignement était considéré comme majeur s’il respectait la définition de l’International Society on Thrombosis and Haemostasis (ISTH) pour les patients prenant des antithrombotiques et qui n’ont pas subi d’intervention chirurgicale18. Les saignements ne respectant pas les critères de l’ISTH étaient considérés comme mineurs. Les effets indésirables importants recueillis étaient ceux ayant engendré une hospitalisation. Pour décrire l’observance au traitement, la présence d’une note au dossier relevant une inobservance était collectée. Enfin, si une thrombopénie justifiant l’arrêt temporaire du traitement anticoagulant (plaquettes < 50 000/mL) conformément aux recommandations de l’American Society of Clinical Oncology survenait, l’information était recueillie19.
Les logiciels IBM SPSS Statistics PremiumMD version 27.0 et ExcelMD ont été utilisés pour les analyses. Des analyses statistiques descriptives ont été effectuées afin de détailler les caractéristiques des sujets inclus ainsi que les thromboses veineuses superficielles au moment du diagnostic. Pour comparer les caractéristiques des patients ayant subi une complication thrombo-embolique à la suite de la thrombose veineuse superficielle de ceux n’en ayant pas eu, les mêmes statistiques descriptives ont été effectuées. Les variables qualitatives ont été présentées à l’aide de proportions et les variables quantitatives, à l’aide de moyennes et d’écarts types. Pour déterminer s’il existait des différences entre le groupe de patients ayant eu une complication et à ceux n’en ayant pas eu, le test de Student était appliqué aux variables quantitatives et le test exact de Fisher, aux variables qualitatives. Pour chacun des tests, le seuil de signification statistique était fixé à 5 %. Pour l’objectif principal et les objectifs secondaires, des analyses statistiques descriptives ont été menées. Les variables recueillies étaient qualitatives et ont été présentées à l’aide de proportions.
Parmi les 242 dossiers de patients suivis à la clinique ambulatoire d’oncologie de l’IUCPQ–UL consultés, 54 respectaient les critères d’inclusion et d’exclusion. Tous les patients souffraient d’un cancer du poumon. Un patient a eu deux thromboses veineuses superficielles à des moments distincts. Ainsi, 55 thromboses veineuses superficielles ont été retenues. Les patients exclus avaient principalement eu une échographie Doppler normale (n = 90) et d’autres avaient besoin d’une anticoagulation pour une indication autre que le traitement d’une thrombose veineuse superficielle (n = 60).
Le tableau I présente les caractéristiques des patients inclus. La majorité des patients avaient plus de 65 ans, étaient des hommes, avaient un score de l’Eastern Cooperative Oncology Group de 1 et présentaient un cancer du poumon non à petites cellules de stade IV traité à l’aide d’anticancéreux administrés par voie intraveineuse. Les caractéristiques des patients ayant connu une complication thrombo-embolique de leur thrombose veineuse superficielle à 90 jours par rapport à ceux n’en ayant pas eu étaient similaires, sauf pour le tabagisme (36 % vs 10 %, valeur de p = 0,04). Au moment du diagnostic initial, les thromboses veineuses superficielles se présentaient principalement dans les membres supérieurs et étaient d’une longueur de 5 cm ou plus. Les patients victimes d’une complication thrombo-embolique de leur thrombose veineuse superficielle avaient une prévalence supérieure de thrombose veineuse superficielle de 5 cm ou plus lors du diagnostic initial par rapport à ceux n’ayant pas eu de complications (100% vs 66 %, valeur de p = 0,01).
Tableau I Caractéristiques de la population générale selon l’évolution de la thrombose veineuse superficielle

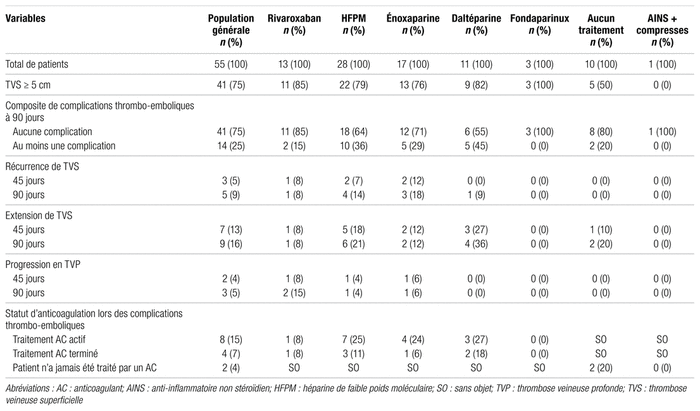
Le tableau II présente l’évolution des thromboses veineuses superficielles dans la population générale ainsi qu’en fonction des traitements entrepris. Concernant l’évolution des thromboses veineuses superficielles dans la population générale, 14 patients (25 %) ont eu au moins une complication thrombo-embolique et deux d’entre eux ont présenté de multiples complications (un patient a eu une extension et une récurrence de sa thrombose veineuse superficielle et un autre a eu une extension et une récurrence de sa thrombose veineuse superficielle ainsi qu’une thrombose veineuse profonde). Au total, 17 complications thrombo-emboliques sont survenues. Trois patients (5 %) ont subi une thrombose veineuse profonde, et aucun n’a souffert d’embolie pulmonaire. Des 14 patients ayant été victimes d’au moins une complication thrombo-embolique, neuf l’ont eu dans les 45 premiers jours. Six décès sont survenus dans l’intervalle de temps collecté. Toutefois, aucun n’était lié à une complication thrombo-embolique.
Tableau II Description de l’évolution des thromboses veineuses superficielles dans l’ensemble de la population et selon le traitement entrepris
À propos des traitements, les pratiques étaient très hétérogènes. Ainsi, 15 approches différentes ont été constatées (voir l’annexe). Ces approches se démarquaient l’une de l’autre par le choix de traitement, la durée et la dose. En raison de l’hétérogénéité importante des traitements préconisés, les résultats ont été analysés de trois façons distinctes afin de former de plus grands groupes de comparaison et d’ainsi mieux répondre au premier objectif secondaire. L’évolution des patients a été analysée en fonction du choix de traitement, de la durée de l’anticoagulation et de l’intensité de la dose d’anticoagulant. Les résultats de chaque analyse sont présentés dans les tableaux II, III et IV respectivement.
Tableau III Description de l’évolution des thromboses veineuses superficielles en fonction de la durée prescrite d’anticoagulation
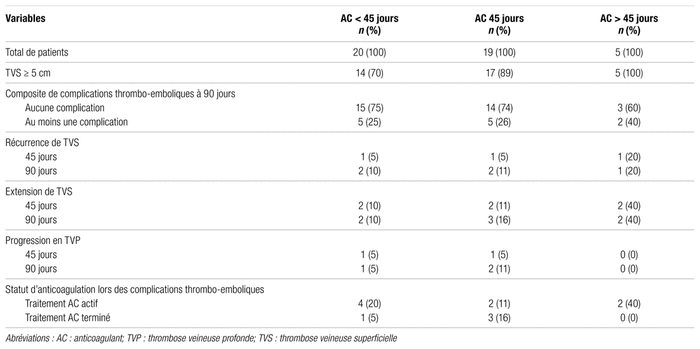
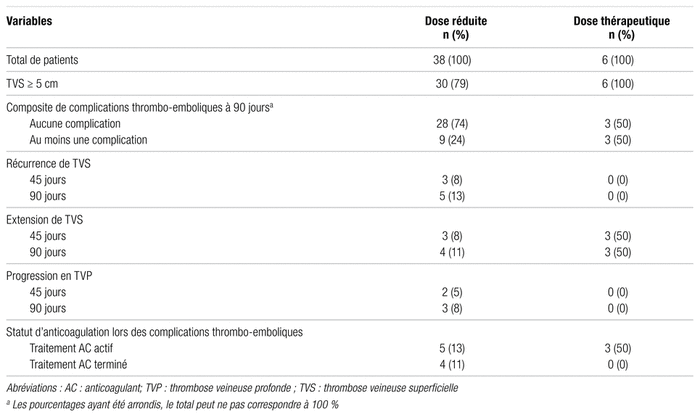
Tableau IV Description de l’évolution des thromboses veineuses superficielles en fonction de la dose prescrite d’anticoagulation
Dans le tableau II, on peut constater que 44 patients (80 %) ont reçu initialement un anticoagulant. Des 14 patients ayant connu au moins une complication thrombo-embolique, 8 recevaient un anticoagulant lorsque la complication a été diagnostiquée. Les patients ayant reçu une HFPM ont développé plus fréquemment une complication thromboembolique avec 10 des 28 patients (36 %). De ces 10 patients, 7 ont connu une complication thrombo-embolique bien qu’ils recevaient une HFPM à ce moment, dont un qui a développé une thrombose veineuse profonde. Deux des patients recevant du rivaroxaban (15 %) ont eu une complication thrombo-embolique ayant causé chacun une thrombose veineuse profonde. En outre, une thrombose veineuse profonde est survenue pendant que le patient recevait le rivaroxaban. Seulement trois patients ont reçu le fondaparinux, et aucun n’a développé de complication thrombo-embolique. À propos des patients n’ayant pas reçu d’anticoagulant lors du diagnostic initial de thrombose veineuse superficielle, seulement deux (18 %) ont eu une complication thrombo-embolique. Ceux-ci présentaient une thrombose veineuse superficielle de 5 cm ou plus au moment du diagnostic initial.
Le tableau III illustre l’évolution des patients en fonction de la durée d’anticoagulation prescrite. Chez les patients recevant un traitement de moins de 45 jours, la durée moyenne de traitement était de 34 jours. Parmi ces derniers, cinq (25 %) ont subi des complications thrombo-emboliques, dont quatre pendant qu’ils recevaient toujours un anticoagulant, y compris un patient ayant subi une thrombose veineuse profonde. Cinq patients recevant un traitement de 45 jours (26 %) ont développé des complications thrombo-emboliques, dont deux pendant qu’ils recevaient toujours un anticoagulant. De ces cinq patients, deux ont subi une thrombose veineuse profonde, dont l’une pendant le traitement anticoagulant. Enfin, deux des cinq patients recevant un traitement de plus de 45 jours (40 %) ont connu des complications thrombo-emboliques dans les 45 premiers jours.
Le tableau IV illustre l’évolution des patients en fonction de la dose d’anticoagulant prescrite au moment du diagnostic. La majorité des patients ont reçu une dose réduite. Seulement six ont reçu une dose thérapeutique, et ils avaient tous une thrombose veineuse superficielle de 5 cm ou plus initialement; trois (50 %) ont eu une complication thrombo-embolique se traduisant par des extensions de thrombose veineuse superficielle survenues pendant qu’ils recevaient un anticoagulant.
Aucun effet indésirable n’a engendré d’hospitalisation. Aucun saignement majeur n’est survenu. Cinq saignements mineurs ont été signalés chez les patients prenant un anticoagulant, soit chez un patient (8 %) prenant le rivaroxaban, chez deux patients (12 %) recevant l’énoxaparine et chez deux patients (18 %) prenant la daltéparine. Tous les saignements ont été signalés dans les 45 premiers jours suivant le diagnostic de thrombose veineuse superficielle. Quant à la dose, quatre patients (11 %) recevant une dose réduite et un (17 %) recevant une dose thérapeutique ont mentionné un saignement mineur.
En ce qui a trait à l’observance aux traitements, un patient avait eu une inobservance inscrite dans les notes d’évolution deux semaines après le début du traitement. Le patient a mentionné à l’équipe avoir des oublis occasionnels avec sa prise du rivaroxaban, mais n’a pas subi de complication thrombo-embolique. Trois patients ont dû arrêter temporairement leur traitement anticoagulant en raison d’une thrombopénie (plaquettes < 50 000/mL). Un des trois patients a eu une extension de sa thrombose veineuse superficielle dans les jours suivants.
Dans cette étude rétrospective, l’évolution des thromboses veineuses superficielles chez les patients atteints d’un cancer a été évaluée. Plusieurs patients ont présenté des complications thrombo-emboliques mineures, comme des récurrences et des extensions de thrombose veineuse superficielle. La majorité des traitements prescrits ont été des HFPM à dose réduite. Les complications sont principalement survenues dans les 45 premiers jours, la plupart pendant que les patients étaient sous anticoagulant.
Parmi les 55 thromboses veineuses superficielles, 17 ont mené à des complications thrombo-emboliques. Les patients ayant développé au moins une complication thrombo-embolique présentaient plusieurs caractéristiques du groupe sans complications (tableau I). Notamment, l’utilisation de cisplatine et carboplatine, étant deux antinéoplasiques associés à une augmentation des thromboembolies veineuses utilisés fréquemment chez les patients inclus, était retrouvée dans chaque groupe avec des prévalences similaires11. Plusieurs facteurs de risque associés aux complications thrombo-emboliques n’étaient pas plus fréquents dans le groupe ayant connu ce type de complications. Ce résultat peut s’expliquer par le faible nombre de patients inclus et par le fait que tous les patients étaient atteints d’un cancer, ce qui en soi constitue un facteur de risque considérable de complications thrombo-emboliques4,17. Les seules caractéristiques retrouvées plus fréquemment chez les patients ayant subi des complications thrombo-emboliques sont le tabagisme (valeur de p = 0,04) et une thrombose veineuse superficielle de 5 cm ou plus au moment du diagnostic (valeur de p = 0,01), ce qui constituerait un risque accru de complications chez ces patients. Ainsi, il semble d’autant plus important d’appliquer, chez les patients atteints de cancer, la recommandation de Thrombose Canada d’utiliser un anticoagulant chez tous les patients dont la thrombose veineuse superficielle est de 5 cm ou plus2. À propos du tabagisme, ce résultat souligne le risque accru de thrombo-embolie chez les fumeurs, ce qui a déjà été mentionné dans la littérature20.
À propos de l’objectif principal, une majorité de patients n’ont pas eu de complications thrombo-emboliques. Toutefois, un nombre important, soit 14 (25 %), ont connu au moins une complication thrombo-embolique à la suite du diagnostic de thrombose veineuse superficielle (tableau II). Il est toutefois rassurant de savoir que la majorité des complications étaient des récurrences et des extensions de thrombose veineuse superficielle. Des 14 patients ayant développé au moins une complication, 8 recevaient un traitement anticoagulant au moment de la complication, dont deux des trois patients ayant développé une thrombose veineuse profonde. Par ailleurs, 12 des 17 complications thrombo-emboliques, sont survenues dans les 45 premiers jours. Ainsi, ces résultats soulignent l’importance d’effectuer un suivi auprès des patients, particulièrement dans les premières semaines, même si un anticoagulant est commencé.
À notre connaissance, une seule autre étude descriptive a évalué l’évolution des patients atteints d’un cancer présentant une thrombose veineuse superficielle. Le traitement le plus fréquent dans cette étude était aussi une HFPM. Comme nos résultats, ceux de cette étude montrent que les principales complications thrombo-emboliques observées étaient des extensions et des récurrences de thrombose veineuse superficielle survenues chez 11 % des patients après 90 jours et que les complications thrombo-emboliques pouvaient survenir durant la prise d’un anticoagulant21.
Nos résultats sur les incidences de thrombose veineuse profonde chez la clientèle oncologique ressemblent à ceux de l’étude SURPRISE. Dans l’étude SURPRISE, des 45 patients atteints d’un cancer, 6,7 % avaient eu une thrombose veineuse profonde après 90 jours contre 5 % dans notre étude14. On se serait attendu que l’incidence de thrombose veineuse profonde soit plus élevée dans notre étude puisque les patients n’ont pas tous reçu un traitement anticoagulant comparativement aux patients de l’étude SURPRISE. Toutefois, cette dernière n’incluait que des patients présentant une thrombose veineuse superficielle de 5 cm ou plus alors que, parmi les patients de notre étude, 15 % présentaient une thrombose veineuse superficielle de moins de 5 cm et 10 % présentaient une thrombose veineuse superficielle dont la longueur ne pouvait être obtenue à l’échographie Doppler. C’est ce qui expliquerait potentiellement la différence observée. Les études CALISTO et SURPRISE n’ont signalé aucune embolie pulmonaire chez l’ensemble des patients recevant un traitement anticoagulant13,14. Bien que notre population à l’étude soit différente, nos résultats vont dans le même sens et semblent indiquer que le risque d’embolie pulmonaire à la suite d’un diagnostic de thrombose veineuse superficielle demeure faible, même chez les patients atteints de cancer.
Concernant les traitements entrepris, il est possible de constater qu’il existe une grande hétérogénéité dans les prises en charge préconisées. Bien que le recours aux anticoagulants ait été favorisé lors de la révision de la pratique locale en septembre 2016, 11 des 55 patients de l’étude n’ont pas reçu d’anticoagulant au moment du diagnostic de thrombose veineuse superficielle, dont cinq mesuraient 5 cm ou plus. Chez les patients ayant reçu un anticoagulant, plusieurs en ont pris moins longtemps ou plus longtemps que 45 jours. De plus, plusieurs ont reçu des doses thérapeutiques. Pour la période étudiée, ces durées et ces doses n’étaient pas appuyées par les lignes directrices du CHEST15.
Lorsque les choix de traitement sont mis en relation avec l’objectif principal, on voit que l’incidence la plus élevée de complications thrombo-emboliques est survenue chez les patients ayant reçu une HFPM (tableau II). Les résultats indiquent que 10 des 28 patients (36 %) recevant une HFPM ont présenté une complication thrombo-embolique, dont sept qui recevaient toujours le traitement au moment de la complication. Comme 18 des 28 patients ayant reçu une HFPM ont eu des traitements de moins de 45 jours, un traitement trop court pourrait être à l’origine de ce résultat. Or, des cinq patients ayant pris le traitement moins de 45 jours et ayant subi une complication, seulement un a présenté une complication thrombo-embolique après la fin de son traitement d’HFPM. Les quatre autres ont présenté une complication pendant qu’ils prenaient leur HFPM. Ces résultats semblent donc indiquer qu’un traitement par une HFPM présenterait une incidence supérieure de complications thrombo-emboliques par rapport au fondaparinux et au rivaroxaban, sans égard à la durée de traitement. CHEST recommande d’ailleurs de privilégier le fondaparinux par rapport aux HFPM à la lumière des données actuelles16.
Parmi les autres résultats liés à l’évolution des patients selon le traitement choisi, deux résultats inattendus ont été obtenus. Premièrement, les patients recevant le rivaroxaban ont connu plus de thrombose veineuse profonde que ceux prenant une HFPM, soit 15 % et 4 % respectivement (tableau II). Bien que les HFPM n’aient jamais été associées à une diminution des thromboses veineuses profondes à la suite d’un diagnostic de thrombose veineuse superficielle, le rivaroxaban quant à lui ne serait pas inférieur au fondaparinux et réduirait l’incidence de thrombose veineuse profonde12. Ce résultat semble contraire aux données de la littérature. Toutefois, étant donné le faible nombre de patients dans cette étude, le hasard pourrait être à l’origine de cette divergence. Deuxièmement, les patients n’ayant pas reçu de traitement anticoagulant ont eu moins de complications thrombo-emboliques que ceux ayant reçu une HFPM. Ce résultat pourrait s’expliquer en partie par le fait que la moitié des patients n’ayant pas reçu de traitement anticoagulant présentaient une thrombose veineuse superficielle de moins de 5 cm alors que la majorité des patients recevant une HFPM (79 %) avaient une thrombose de 5 cm ou plus.
Lorsque la durée de traitement a été mise en relation avec l’objectif principal, on se serait attendu qu’un traitement anticoagulant de moins de 45 jours présente une incidence plus élevée de complications thrombo-emboliques par rapport aux durées plus longues. Or, les résultats obtenus ne vont pas en ce sens puisque l’incidence des complications thrombo-emboliques à 90 jours est respectivement de 25 %, de 26 % et de 40 % pour les durées de traitement de moins de 45 jours, de 45 jours et de plus de 45 jours (tableau III). Par ailleurs, bien que cinq complications soient survenues chez les patients recevant un anticoagulant pendant moins de 45 jours, quatre patients ont présenté la complication alors qu’ils recevaient toujours le traitement mentionné précédemment. Ainsi, un traitement plus court ne semble pas être la cause des complications thrombo-emboliques observées. Pour les traitements de plus de 45 jours, les cinq patients de ce groupe avaient tous reçu un anticoagulant pendant au moins 90 jours. Aucune complication n’est survenue entre le 46e et le 90e jour, ce qui semble indiquer qu’une durée plus longue pourrait réduire les complications plus tardives. Cette hypothèse était d’ailleurs aussi soulevée par les auteurs de l’étude SURPRISE à partir de leurs résultats14.
En ce qui concerne l’effet de la dose des anticoagulants utilisés, trois des six patients ayant reçu des doses thérapeutiques ont présenté une complication thrombo-embolique (tableau IV). Ces trois complications sont toutes survenues pendant le traitement anticoagulant, et la complication a été dans les trois cas une extension de la thrombose veineuse superficielle. Ainsi, malgré une dose thérapeutique, une complication thrombo-embolique peut survenir.
À propos de la tolérance aux traitements anticoagulants, aucune hospitalisation n’a été associée au traitement, aucun saignement majeur n’a été signalé et un faible nombre de saignements mineurs a été répertorié. Les traitements ont ainsi été bien tolérés. Concernant l’adhésion, seulement un cas d’inobservance a été signalé. Il faut toutefois souligner que les résultats concernant l’adhésion et les saignements mineurs sont potentiellement sous-estimés, car ils ne sont pas toujours consignés systématiquement dans les notes au dossier.
À la lumière de nos résultats, il semble raisonnable de revoir la pratique locale en la faisant reposer sur les données actuelles. Les HFPM étant le choix de traitement le plus fréquent, elles n’ont jamais été associées à une réduction de l’incidence de thrombose veineuse profonde et d’embolie pulmonaire comparativement au fondaparinux et au rivaroxaban12. Ainsi, le fondaparinux ou le rivaroxaban devrait être préconisé lorsqu’un anticoagulant est nécessaire. Les recommandations 2021 du CHEST vont d’ailleurs dans ce sens16. Quant à la durée de traitement à privilégier, elle devrait être de 45 jours conformément aux recommandations des lignes directrices de Thrombose Canada et du CHEST2,16. En pratique, l’accessibilité et la simplicité d’utilisation du fondaparinux (2,5 mg) ressemblent à celles des HFPM. Les deux sont remboursés par la Régie de l’assurance maladie du Québec (RAMQ) et s’administrent chacun une fois par jour par voie sous-cutanée. Comme solution par voie orale, le rivaroxaban (10 mg) pris une fois par jour est intéressant. Il n’est toutefois pas remboursé par la RAMQ pour le traitement de la thrombose veineuse superficielle.
La principale force de cette étude est qu’elle apporte de nouvelles données concernant l’évolution des thromboses veineuses superficielles chez les patients atteints d’un cancer. Les résultats obtenus permettront d’ailleurs d’améliorer la pratique locale et de fournir de meilleurs soins aux patients.
Plusieurs limites sont à souligner. D’abord, le devis descriptif ne permet pas d’établir le meilleur traitement à préconiser chez les patients atteints de cancer. D’autres études comparatives sont requises pour répondre à cette question. Le faible nombre de patients de l’étude favorise quant à lui l’effet du hasard sur nos résultats. Certains facteurs de confusion n’ayant pas été pris en compte pourraient aussi avoir influencé nos résultats. Enfin, comme il s’agit d’une étude rétrospective, il est possible que certains résultats soient sous-estimés si certaines données recueillies n’étaient pas consignées au dossier des patients.
Les résultats obtenus seront utiles pour les cliniciens de l’IUCPQ-UL. Ils semblent d’ailleurs indiquer un besoin de revoir la pratique locale. Bien que notre patientèle regroupe uniquement des patients atteints de cancer du poumon, d’autres centres d’oncologie pourraient s’inspirer de la présente étude pour évaluer leur pratique locale afin de l’améliorer.
Le quart des patients atteints de cancer ayant présenté une thrombose veineuse superficielle ont subi une complication thrombo-embolique, principalement des extensions et des récurrences de thrombose veineuse superficielle. La plupart des complications sont survenues dans les 45 jours suivant le diagnostic initial et pendant que les patients étaient sous traitement anticoagulant. Nos résultats soulignent l’importance d’assurer le suivi des patients atteints d’un cancer qui présentent une thrombose veineuse superficielle afin d’en assurer la bonne évolution, même si un anticoagulant est commencé. Parmi les traitements prescrits, la majorité des patients ont reçu une HFPM et très peu ont reçu le fondaparinux, un traitement dont l’efficacité contre les thromboses veineuses superficielles est pourtant davantage appuyée par des données probantes. Afin de standardiser et de faciliter la prise en charge des patients présentant une thrombose veineuse superficielle, la création d’une ordonnance préimprimée sera envisagée. Par la suite, une étude subséquente pourrait avoir lieu afin d’évaluer l’évolution des patients recevant des traitements qui reflètent mieux les recommandations actuelles.
Cet article comporte une annexe; elle est disponible sur le site de Pharmactuel (www.pharmactuel.com).
Les auteurs n’ont déclaré aucun financement lié au présent article.
Tous les auteurs ont soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Julie Méthot est rédactrice adjointe de Pharmactuel. Les auteurs n’ont déclaré aucun autre conflit d’intérêts lié à cet article.
1. Decousus H, Frappe P, Accassat S, Bertoletti L, Buchmuller A, Seffert B et coll. Epidemiology, diagnosis, treatment and management of superficial-vein thrombosis of the legs. Best Pract Res Clin Haematol 2012;25:275–84.

2. Thrombose Canada. Thrombophlébite superficielle et thrombose veineuse superficielle. (29 août 2020). [en ligne] https://thrombosiscanada.ca/wp-content/uploads/2021/02/47.-Thrombophlébite-superficielle_thrombose-veineuse-superficielle_29Aug2020.pdf (site visité le 3 octobre 2021).
3. van Langevelde K, Lijfering WM, Rosendaal FR, Cannegieter SC. Increased risk of venous thrombosis in persons with clinically diagnosed superficial vein thrombosis: Results from the mega study. Blood 2011;118:4239–41.

4. Beyer-Westendorf J. Controversies in venous thromboembolism: To treat or not to treat superficial vein thrombosis. Hematology Am Soc Hematol Educ Program 2017;2017:223–30.


5. Quenet S, Laporte S, Décousus H, Leizorovicz A, Epinat M, Mismetti P. Factors predictive of venous thrombotic complications in patients with isolated superficial vein thrombosis. J Vasc Surg 2003;38:944–9.

6. Gade IL, Braekkan SK, Naess IA, Hansen JB, Cannegieter SC, Overvad K et coll. The impact of initial cancer stage on the incidence of venous thromboembolism: The Scandinavian thrombosis and cancer (stac) cohort. J Thromb Haemost 2017;15:1567–75.

7. Ogren Mats M. Trousseau’s syndrome–What is the evidence? A population-based autopsy study. Thromb Haemost 2006;95:541–5.

8. Oppelt P, Betbadal A, Nayak L. Approach to chemotherapy-associated thrombosis. Vasc Med 2015;20:153–61.


9. Ploton G, Pistorius MA, Raimbeau A, Denis Le Seve J, Bergere G, Ngohou C et coll. A strobe cohort study of 755 deep and superficial upper-extremity vein thrombosis. Medicine (Baltimore) 2020;99:e18996.


10. Baumann Kreuziger Lisa L. Epidemiology, diagnosis, prevention and treatment of catheter-related thrombosis in children and adults. Thrombosis Research 2017;157:64–71.

11. Grover SP, Hisada YM, Kasthuri RS, Reeves BN, Mackman N. Cancer therapy-associated thrombosis. Arterioscler Thromb Vasc Biol 2021;41:1291–305.


12. Di Nisio M, Wichers IM, Middeldorp S. Treatment for superficial thrombophlebitis of the leg. Cochrane Database Syst Rev 2018;2:CD004982.

13. Decousus H, Prandoni P, Mismetti P, Bauersachs RM, Boda Z, Brenner B et coll. Fondaparinux for the treatment of superficial-vein thrombosis in the legs. N Engl J Med 2010;363:1222–32.

14. Beyer-Westendorf J, Schellong SM, Gerlach H, Rabe E, Weitz JI, Jersemann K et coll. Prevention of thromboembolic complications in patients with superficial-vein thrombosis given rivaroxaban or fondaparinux: The open-label, randomised, non-inferiority surprise phase 3b trial. Lancet Haematol 2017;4:e105–e13.

15. Kearon C, Akl EA, Comerota AJ, Prandoni P, Bounameaux H, Goldhaber SZ et coll. Antithrombotic therapy for vte disease: Antithrombotic therapy and prevention of thrombosis, 9e éd.: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2012;141:e419S–e96S.

16. Stevens SM, Woller SC, Baumann Kreuziger L, Bounameaux H, Doerschug K, Geersing GJ et coll. Executive summary: Antithrombotic therapy for VTE disease: Second update of the chest guideline and expert panel report. Chest 2021;160:2247–59.

17. Heit JA. Epidemiology of venous thromboembolism. Nat Rev Cardiol 2015;12:464–74.


18. Schulman S, Kearon C, Subcommittee on Control of Anticoagulation of the Scientific and Standardization Committee of the International Society on Thrombosis and Haemostasis. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in non-surgical patients. J Thromb Haemost 2005;3:692–4.

19. Key NS, Khorana AA, Kuderer NM, Bohlke K, Lee AYY, Arcelus JI et coll. Venous thromboembolism prophylaxis and treatment in patients with cancer: Asco clinical practice guideline update. J Clin Oncol 2020;38:496–520.

20. Cheng YJ, Liu ZH, Yao FJ, Zeng WT, Zheng DD, Dong YG et coll. Current and former smoking and risk for venous thromboembolism: A systematic review and meta-analysis. PLoS Med 2013;10:e1001515.


21. Ghenassia-Fouillet L, Morel A, Frappe P, Le Hello C, Lerche V, Sevestre MA et coll. Management of superficial venous thrombosis in unevaluated situations: Cancer, severe renal impairment, pregnancy and post-partum. Phlebology 2021;36:464–72.

PHARMACTUEL, Vol. 55, No. 4, 2022