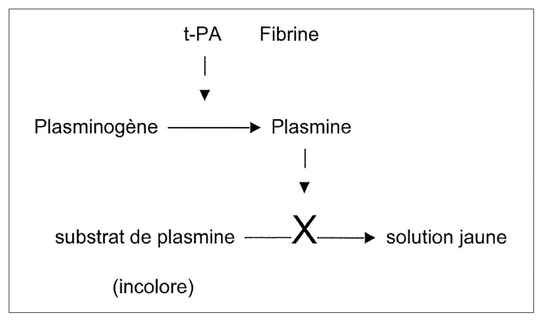
Figure 1 Schéma de la réaction produite lors de la mesure de l’activité de l’alteplase
Jean-Marc Forest1, B.Pharm., DPH, M.Sc., Georges-Étienne Rivard2, MD, Patrice Hildgen3, B.Pharm., Ph.D.
1Pharmacien, Secteur fabrication, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec) Canada
2Hématologue-oncologue, directeur médical du programme sur l’hémophilie et du laboratoire d’hémostase, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec) Canada
3Professeur titulaire retraité, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada
Reçu le 31 décembre 2021; Accepté après révision le 23 décembre 2022
Résumé
Objectifs: Au début des années 2000, seules les fioles d’alteplase (RTP-A) en formats de 50 mg et de 100 mg étaient offertes sur le marché. L’emploi de l’alteplase pour le déblocage des cathéters centraux a rapidement gagné en popularité selon les besoins. Toutefois, l’emploi d’une fiole entière pour n’utiliser que 1 mg ou 2 mg était très dispendieux. La stabilité de l’altéplase diluée n’était que de quelques heures selon la monographie, et il existait peu de données de stabilité dans la littérature. L’idée de diluer, puis de lyophiliser de nouveau l’alteplase en aliquotes, de manière magistrale, correspondant à la dose voulue a alors été proposée, puis testée.
Méthode: L’alteplase a été diluée, toujours en milieu stérile, dans de l’eau stérile à raison de 1 mg/mL. La solution a ensuite été reconditionnée en format de 2 mL par seringue ou de 2 mL par fiole ouverte, puis scellée comme produit injectable. Une partie des seringues a été placée au réfrigérateur, soit entre 2 et 8 °C, et une autre au congélateur à −20 °C. Les fioles ont ensuite été passées au lyophilisateur, puis scellées et conservées à la température ambiante, soit entre 20 et 22 °C. L’activité de l’alteplase a été mesurée au laboratoire d’hématologie du Centre hospitalier universitaire (CHU) Sainte-Justine à l’aide d’une trousse commerciale de réactif de marque Spectrolyse t-PA/PAI. Des analyses ont ensuite été effectuées.
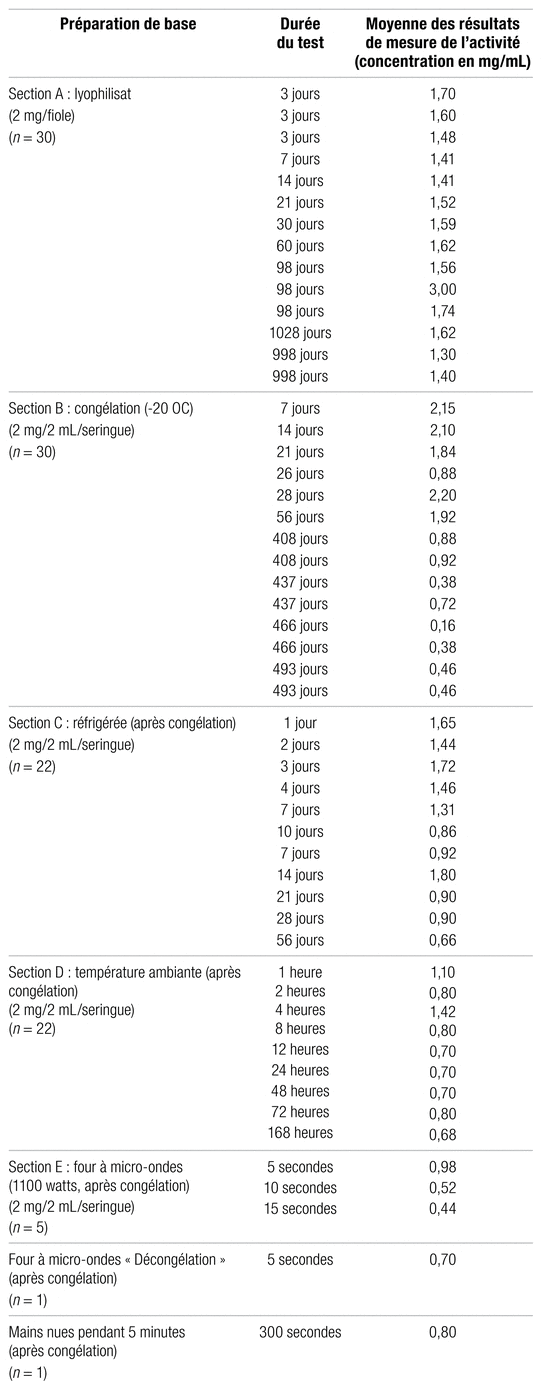
Résultats: La totalité des résultats de l’activité biologique de l’alteplase est présentée dans le tableau I. La première section, la A, traite de la faisabilité du procédé d’obtention de l’alteplase lyophilisée en fiole. La deuxième, la B, donne l’activité en fonction du temps de conservation de l’alteplase conditionnée en seringues congelées a −20 °C. La section C montre l’activité de l’alteplase en seringues réfrigérées après une période de congélation, alors que la section D présente l’activité de l’alteplase en seringues à température ambiante après décongélation. Enfin, la section E donne l’activité de l’alteplase en seringues décongelées au four à micro-ondes.
Conclusion: L’arrivée sur le marché du CathfloMD a rendu caduque l’étude en cours sur le procédé par lyophilisation. Toutefois, en période de rupture d’approvisionnement de ce format, il a été estimé qu’une seringue de 1 mg/mL préparée à partir d’une fiole de 50 mg ou de 100 mg conserve son activité pendant au moins 11 mois lorsqu’elle est congelée à la température de −20 °C, pendant 30 jours si elle est conservée au réfrigérateur et pendant 12 heures à la température ambiante, selon une rationalisation la plus pratique possible des résultats obtenus. Cette solution offre donc un dépannage facile pour le traitement des patients.
Mots-clés Alteplase, cathéter intraveineux, cathéter central inséré par voie périphérique, lyophilisation, rt-PA
Abstract
Objectives: In the early 2000s, only 50-mg and 100-mg vials of alteplase (rtPA) were commercially available. The use of alteplase to unblock central lines quickly gained in popularity in response to needs. However, opening an entire vial for only 1 mg or 2 mg was very expensive. Diluted alteplase was stable for only a few hours, according to the product monograph, and there was little stability data in the literature. The idea of diluting and then lyophilizing alteplase again in compounded aliquots with the desired dose was proposed and then tested.
Method: Alteplase was diluted, always under sterile conditions, in sterile water to 1 mg/mL. The solution was then repackaged, with 2 mL per syringe or 2 mL per open vial and sealed as an injectable. Some of the syringes were placed in the refrigerator at 2 °C to 8 °C, and others were placed in the freezer at −20 °C. The vials were then run through the lyophilizer, sealed, and stored at room temperature, that is, between 20 °C and 22 °C. Alteplase activity was measured in the Centre hospitalier universitaire (CHU) Sainte-Justine’s hematology laboratory using a commercial Spectrolyse tPA/PAI reagent kit. Assays were then performed.
Results: All the results for alteplase bioactivity are presented in Table I. The first section, A, concerns the feasibility of the process of obtaining lyophilized alteplase in vials. The second, B, shows the activity as a function of storage time for alteplase packaged in syringes frozen at −20 °C. Section C shows the activity of the alteplase in refrigerated syringes after a period of freezing, and Section D shows the activity of alteplase in room-temperature syringes after thawing. Lastly, section E shows the activity of the alteplase in syringes thawed in the microwave oven.
Conclusion: With the introduction of Cathflo®, the current study of the lyophilization process became irrelevant. However, in the event of a Cathflo®supply shortage, it was estimated that a 1 mg/mL syringe prepared from a 50-mg or 100-mg vial retains its activity for at least 11 months when frozen at −20 °C, for 30 days if stored in the refrigerator and for 12 hours at room temperature, based on the most practical rationalization possible of the results obtained. Therefore, this solution constitues an easy work-around for treating patients.
Keywords: Altepase, peripherally inserted central catheter, intravenous catheter, lyophilization, rtPA
L’alteplase, aussi appelée rt-PA (Activase rt-PAMD, Roche Canada), a d’abord été commercialisée comme agent antithrombotique dans le traitement de l’infarctus aigu du myocarde principalement, du choc ischémique aigu, puis de l’embolie pulmonaire aiguë massive également1,2. Ce n’est que quelque temps après sa mise en marché que certains praticiens ont commencé à s’en servir en dose de 1 à 2 mg pour le déblocage des voies veineuses centrales. Cette procédure avait toutefois l’inconvénient de nécessiter la dilution d’une fiole de 50 mg ou de 100 mg pour n’en utiliser que 2 mg tout au plus. Le prix d’achat d’environ 1400 $ CA la fiole de 50 mg au moment de l’étude, soit au début du présent millénaire, représentait un montant important pour simplement déboucher une voie centrale obstruée. Certains pharmaciens hospitaliers ont alors eu l’idée de reconditionner le contenu d’une fiole de 50 mg après sa dilution dans 50 mL d’eau (ou de 100 mg dans 100 mL d’eau) conformément aux recommandations de la compagnie, en seringues de 1 mL ou de 2 mL pour ensuite les congeler à −80 °C3. Quelques études ont déterminé la stabilité en seringues congelées afin d’appuyer cette idée d’économie budgétaire et d’accessibilité du traitement3–7. Néanmoins, la conservation à −80 °C n’est pas des plus conviviales en pratique courante, car les congélateurs qui atteignent cette température sont plutôt rares dans les départements de pharmacie hospitaliers, du moins à l’époque. De plus, cette façon de procéder ne permettait en aucune façon l’accès au produit en cas d’urgence ou pendant la nuit en raison du recours à des cabinets décentralisés. Les auteurs de l’article ont alors eu l’idée de proposer un procédé par dilution, puis relyophilisation en aliquotes de 2 mg d’alteplase commerciale afin de desservir les cabinets décentralisés et les armoires de nuit. Accessoirement, la stabilité de l’alteplase en seringue réfrigérée et à température ambiante serait également évaluée afin d’appuyer les données existantes8–10.
Ce sont d’ailleurs les résultats de stabilité obtenus qui ont milité pour leur publication, car les données de stabilité en seringue sont particulièrement pratiques lors des ruptures de stock de CathfloMD qui nécessitent le retour à la préparation en seringues congelées. C’est pourquoi, bien que la préparation par lyophilisation d’aliquotes à 2 mg d’alteplase soit devenue inutile depuis la commercialisation du CathfloMD, les données de stabilité de l’alteplase en seringues congelées, réfrigérées ou à température ambiante demeurent d’actualité pour répondre aux ruptures d’approvisionnement.
Deux fioles d’alteplase commerciale de la compagnie Roche (50 mg/fiole, numéro de lot L9507A et 100 mg/fiole numéro de lot N9037AA) ont été employées durant l’étude. Les préparations ont été faites en milieu stérile. L’alteplase a été diluée, conformément aux recommandations du fabricant, dans l’eau stérile à une concentration de 1 mg/mL, puis reconditionnée en format de 2 mL par seringue ou par fiole ouverte comme préparation injectable. Une partie des seringues a été conservée au réfrigérateur (de 2 à 8 °C normativement) et une autre au congélateur a −20 °C. Les fioles ouvertes ont, pour leur part, été lyophilisées. Après 48 heures, une fois le processus terminé, elles ont été capuchonnées, baguées, étiquetées et enfin conservées à température ambiante. Le processus de lyophilisation des échantillons s’effectuait en milieu stérile à la Faculté de pharmacie de l’Université de Montréal (au pavillon principal, maintenant appelé Roger-Gaudry), dans des fioles de 2 mL vides au départ, avec bouchon de caoutchouc et bague d’aluminium stérilisés à l’autoclave avant d’y recevoir l’alteplase diluée. L’étude complète visait à tester une durée de conservation d’un an (12 mois franc).
Le protocole initial prévoyait un dosage de la concentration par chromatographie liquide à haute performance (HPLC) et une mesure de l’activité à l’aide d’une trousse commerciale. L’alteplase étant une protéine constituée de 527 acides aminés, il est plus facile d’en mesurer l’activité biologique que la concentration. D’ailleurs, toutes les tentatives de dosage par HPLC, selon les techniques citées dans la documentation scientifique courante, soit les travaux de Nguyen ou de Werner, ont malheureusement échoué10,11. Un tel dosage a donc été abandonné pour les présents travaux et ne fera pas l’objet de plus d’explications.
L’activité de l’alteplase a été mesurée au laboratoire d’hématologie du CHU Sainte-Justine avec une trousse commerciale de réactif de marque Spectrolyse t-PA/PAIMD, puis le résultat a été comparé à l’intervalle d’activité de 90 à 115 % prévu par l’USP12. À noter que c’est la version 1996 de la monographie qui a été utilisée, car c’est celle qui avait cours au moment de l’étude1. Le procédé utilisé permet de doser l’activité fibrinolytique exercée par l’activateur du plasminogène tissulaire humain13. La réaction finale est obtenue à partir de plasminogène, de fibrine et d’un substrat de plasmine. Elle permet l’activation du plasminogène par l’alteplase; la plasmine obtenue scinde le substrat de plasmine, ce qui produit une coloration jaune dont l’intensité d’absorption est mesurée au spectrophotomètre par densité optique, à une longueur d’onde de 405 nm. Cette intensité est proportionnelle à l’activité de l’alteplase et quantifiée par comparaison à une courbe d’étalonnage. La figure 1 donne un schéma de la réaction. Toutes les analyses ont été faites en duplicata, et les moyennes ont été utilisées pour les calculs subséquents.
La trousse Spectrolyse TPA/PAI d’American Diagnostica, no 452, numéro de lot 990623, comprenait les éléments suivants :
La figure 2 montre une partie de la trousse et quelques fioles lyophilisées résultant du processus.
En cours d’étude, les seringues ont été entreposées à diverses températures : −80 °C, −20 °C, de 2 à 8 °C (au réfrigérateur) et de 20 à 22 °C (température ambiante). Dans tous les cas, les échantillons n’ont subi qu’une séance de conservation (surcongelé, congelé, réfrigéré ou température ambiante), puis étaient laissés à température ambiante le temps de se liquéfier avant l’analyse.
|
| ||
|
Figure 1 Schéma de la réaction produite lors de la mesure de l’activité de l’alteplase | ||
Tout le processus de reconditionnement, que ce soit en seringue ou en fiole pour lyophilisation, s’est déroulé en environnement stérile, respectant l’esprit de la norme de préparation stérile de l’Ordre des pharmaciens du Québec14. Afin de s’assurer que les préparations étaient bien stériles, quelques tests microbiologiques ont été effectués simultanément aux diverses analyses et dans divers milieux :
Les résultats fragmentaires obtenus par suite du dosage par HPLC ne sont pas présentés ici, comme déjà mentionné, car ils ne sont pas reproductibles. Il serait inutile de tenter de les interpréter et d’en tirer des conclusions, la technique nécessitant davantage de raffinement. Les résultats bruts moyens des mesures de l’activité de l’alteplase sont présentés dans le tableau I. Ce dernier est séparé en sections différentes pour en faciliter la lecture, chacune présentant un aspect du questionnement posé. Il contient tous les résultats d’activité de l’alteplase pour les différents lyophilisats en fonction du temps et regroupe les trois années de l’étude. La section A décrit l’objectif initial de l’étude, soit déterminer la faisabilité de créer des aliquotes l’alteplase lyophilisée en portions de 2 mg à partir de la reconstitution des fioles de 50 mg ou de 100 mg. D’une durée initiale prévue d’un an, l’étude a finalement nécessité trois années consécutives pour arriver aux différents résultats, selon la capacité d’analyse et de préparation des échantillons du laboratoire.
La section B donne l’activité en fonction du temps de conservation de l’alteplase conditionné en seringues congelées à −20 °C. L’objectif était alors de vérifier si la congélation à −80 °C était nécessaire pour la stabilité ou si une congélation plus courante, à −20 °C, était suffisante. Les départements de pharmacie hospitaliers disposent en général plus facilement de congélateurs atteignant −20 °C que −80 °C.
La section C présente l’activité de l’alteplase en seringues réfrigérées après congélation. L’objectif était de connaître la durée de conservation des seringues au réfrigérateur quand la dose n’est pas immédiatement administrée au patient (ou plus exactement injectée dans son cathéter) de manière à réduire les pertes lors de laps de temps plus ou moins long entre la décongélation et l’emploi.
|
| ||
|
Figure 2 trousse d’analyse commerciale de l’alteplase (à gauche) et quelques fioles produites par lyophilisation (à droite). | ||
Tableau I Résultats des analyses d’activité de l’alteplase lyophilisée, congelée, réfrigérée, à température ambiante ou décongelée
La section D présente cette fois l’activité de l’alteplase en seringues à température ambiante après décongélation. Ici encore, c’est un souci d’économie et d’efficience qui est recherché en déterminant la stabilité à température ambiante.
Enfin, la section E du tableau I donne l’activité de l’alteplase en seringues décongelées dans un four à micro-ondes. Il est de pratique relativement courante dans nos départements de pharmacie d’utiliser ce type d’appareil pour accélérer la disponibilité de certains médicaments congelés. Toutefois, ce type d’onde peut endommager, voire inactiver certaines molécules. Comme ce matériel était disponible pour la vérification de ce contexte, les tests furent exécutés dans la foulée de l’étude.
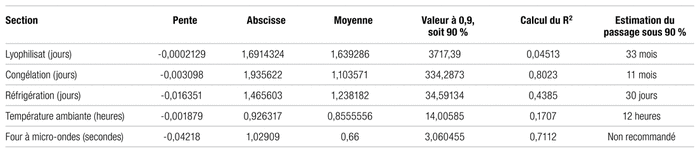
Tableau II Résultats des analyses statistiques d’activité de l’alteplase lyophilisée, congelée, réfrigérée, à température ambiante ou décongelée (par régression linéaire des valeurs obtenues)
À noter que chaque dose de 2 mg (en seringue ou en fiole) contenait pour 74 $ CA d’alteplase au prix en vigueur au moment de l’étude. Avec les réactifs et le temps d’exécution, le coût de chaque test dépassait donc une centaine de dollars, ce qui est relativement cher pour chaque valeur obtenue. Parallèlement, tous les tests microbiologiques se sont révélés négatifs, les lyophilisats étant entre autres tous stériles.
Les résultats bruts des analyses statistiques des données sont indiqués dans le tableau II et sont nettement sous les attentes. Le nombre de points de mesure disponible s’est avéré insuffisant pour établir une analyse statistique en bonne et due forme. De plus, un ou deux points aberrants ou hors norme suffisent pour entacher et discréditer automatiquement toutes les mesures, ce qui est le cas presque partout. Tout au plus, une estimation grossière du moment du passage sous les 90 % de la valeur initiale, soit le seuil habituellement utilisé pour une préparation magistrale, a pu être faite. Il n’est possible de calculer formellement une régression linéaire des valeurs obtenues afin d’en tirer des conclusions formelles. Ces résultats ne permettent donc que d’estimer sommairement, et non formellement, la stabilité de l’alteplase dans différentes conditions d’entreposage. Les seuils requis sont estimés pour obtenir au moins 90 % de l’activité initiale d’alteplase, ce qui donne plus de 10 ans pour la préparation lyophilisée, plus de 10 mois au congélateur à −20 °C, plus de 30 jours au réfrigérateur et plus de 12 heures à la température ambiante. Malgré tous les soins apportés aux phases expérimentales à l’époque, la revisitation statistique formelle des résultats lors de la rédaction du présent article a révélé toutes ces lacunes, ce qui a été une grande source de déception.
L’idée de base était de rendre l’alteplase disponible en format de 2 mg partout où elle pouvait être utilisée (p. ex. : cabinets de médicaments, chariots d’urgence ou encore tout simplement département de pharmacie lors des services au nom des patients). Avec une stabilité minimale d’un à deux ans en format lyophilisé, la préparation n’aurait eu lieu qu’une fois par année, voire tous les 2 ans, ce qui aurait simplifié de beaucoup la planification de la production. Ce processus aurait rendu viable ce format très particulier de préparation magistrale stérile. Toutefois, l’arrivée sur le marché du CathfloMD a rendu inutile la poursuite des travaux. Il n’en demeure pas moins que les données recueillies sur la congélation, la réfrigération, la conservation à température ambiante et la décongélation sont toujours pertinentes.
L’incapacité de mettre au point une technique de dosage par HPLC conforme est regrettable, mais n’empêche pas le déroulement de l’étude. La mesure de l’activité de l’alteplase par colorimétrie suffit pour en caractériser le comportement et demandait déjà un budget substantiel. Faute de moyens, la partie de l’étude portant sur le dosage par HPLC a été abandonnée.
Les résultats de la section A du tableau I se rapportent à la seconde lyophilisation des échantillons, soit celle effectuée pour l’étude, la première ayant été faite par la compagnie lors de la confection du médicament. Ces résultats sont quelque peu erratiques et donnent en général une valeur de concentration d’une à deux fois plus importante que celle qui était attendue, ce qui laisse croire à une augmentation d’activité par suite du processus de lyophilisation secondaire exécuté lors de la formulation magistrale. Il s’agit ici d’une variation d’activité très intéressante. La stabilité de l’alteplase diluée puis lyophilisée de nouveau dépasserait ainsi 33 mois, soit plus de deux ans et demi, selon les résultats fragmentaires de l’étude. Il n’est pas possible d’affirmer que cette stabilité pourrait atteindre 10 ans et plus selon l’extrapolation trouvée par la régression linéaire avec un seuil d’activité fixé à 90 % de la valeur de départ, car des processus de relaxations lentes de la molécule peuvent se produire. Encore une fois, la commercialisation totalement inattendue du CathFloMD en format de 2 mg, qui n’était pas envisagée par la compagnie au début de l’étude, a rendu cette analyse des résultats moins pertinente. Comme aucune autre publication n’a fait état d’une telle tentative de relyophilisation de l’alteplase, il n’est pas possible de comparer les résultats. Néanmoins, le phénomène est des plus intéressants, notamment l’apparente augmentation de l’activité. Le coefficient de régression linéaire plutôt désastreux suppose une grande dispersion des résultats et rend encore plus hasardeuse toute tentative d’interprétation formelle. Il serait donc périlleux d’en faire une utilisation clinique sans approfondir la question au préalable. Sur ce point, la présente étude est nettement insuffisante et défaillante et n’atteint pas l’un de ses objectifs initiaux.
Pour la stabilité de l’alteplase congelée à −20 °C, la section B du tableau I permet, toujours avec le seuil d’activité de 90 % de l’USP, d’obtenir une durée de conservation de 334 jours (déterminé par analyse de régression linéaire), soit un peu plus de 11 mois1. Cette valeur se trouvant dans l’intervalle d’analyse en temps réel des échantillons, sa valeur est d’autant plus appréciable. L’étude de référence pour la stabilité en seringue congelée, soit celle de Calis et coll., donne pour sa part une stabilité d’environ 6 mois en seringue de plastique, l’étude ayant été stoppée après l’atteinte de cette période de conservation3. Pour sa part, Davis et coll. avaient obtenu une stabilité d’au moins 14 jours, mais le design de l’étude ne permettait pas d’aller au-delà4. Il en va de même de l’étude de Cutshall et coll. qui indiquait huit jours de stabilité des échantillons congelés, mais qui n’allait pas plus loin5. Il faut mentionner aussi l’étude d’Alkatheri et coll. qui révèle trois mois de stabilité pour les échantillons congelés, sans aucun problème6. À noter enfin que Shaw et coll. notent, pour leur part, une stabilité de plus de sept ans à une température de −80 °C7. Il est délicat de tenter d’extrapoler formellement des stabilités de −20 °C à −80 °C sans disposer d’études formelles en ce sens.
La section C du tableau I conclut à une activité conforme à la pharmacopée, pour un seuil de 90 %, à une stabilité de 34 jours au réfrigérateur pour l’alteplase diluée à raison de 1 mg/mL et entreposée en seringues. C’est plus du double des 14 jours de Davis et coll.4. C’est également beaucoup plus que les huit heures indiquées dans la monographie du produit, mais cette durée est plus que conservatrice et relève d’une norme sans observation scientifique formelle1. L’étude de Semba et coll. montre aussi une stabilité de huit heures au réfrigérateur lorsque la dilution est effectuée dans le chlorure de sodium à 0,9 %, mais ne prévoyait pas de tester une analyse plus tardive8. La valeur obtenue demeure dans l’intervalle de temps réellement étudié par la présente étude et n’est pas extrapolée à partir de cette dernière. Le coefficient de corrélation obtenu étant plutôt moyen, le résultat final proposé, soit 30 jours, est très conservateur.
La section D du tableau I montre une activité conforme pendant seulement 14 heures à température ambiante si le seuil inférieur strict de 90 % de la pharmacopée est appliqué. Cette valeur est aussi dans la fenêtre de temps étudiée et non extrapolée par l’analyse statistique. L’étude de Semba et coll. donne huit heures de stabilité à température ambiante à une dilution de 1 et 2 mg/mL dans le chlorure de sodium à 0,9 %, mais jusqu’à 24 heures si la dilution est de 0,5 mg/mL8. Le coefficient de corrélation étant plutôt faible et montrant une grande dispersion des résultats, possiblement provoquée par une décongélation plus ou moins uniforme, la valeur obtenue est aussi à utiliser avec circonspection, d’où sa diminution à 12 heures.
Dans la section E du tableau I, l’emploi du four à micro-ondes pour la décongélation des seringues est à proscrire sous peine de dénaturer grandement le produit. Même la chaleur de la main peut occasionner une perte notable d’activité de l’alteplase. Naturellement, la chaleur de la main varie grandement d’une personne à l’autre. Aucune autre étude ne semble s’être penchée sur l’utilisation du four à micro-ondes pour la décongélation des seringues d’alteplase. Il est donc impossible de faire des comparaisons.
Suite à la commercialisation du CathFloMD, ces différents résultats d’étude n’ont jamais été analysés statistiquement et encore moins publiés et sont demeurés lettre morte dans le fond d’un classeur, faute de temps et d’intérêt pour rédiger l’article. Toutefois, il appert qu’en période de rupture d’approvisionnement et compte tenu de l’emploi de cette préparation, soit le déblocage des cathéters, ces données de stabilité peuvent s’avérer des plus utiles. De fait, depuis son lancement, le CathFloMD est tombé deux ou trois fois en rupture d’approvisionnement, ce qui a obligé les départements de pharmacie à revenir à l’ancienne technique de préparation en seringues congelées afin de répondre aux besoins de leurs patients.
Les durées sont calculées en minorant légèrement les résultats obtenus afin d’arrondir les valeurs à des nombres pratiques facilitant l’emploi au quotidien. Ces stabilités brutes sont de 334 jours au congélateur, de 34 jours au réfrigérateur et de 14 heures à température ambiante si l’on adopte un seuil normatif franc de 90 % d’activité seulement. Enfin, rappelons que pour obtenir des données beaucoup plus formelles, notamment sur la relyophilisation, un nombre d’échantillons beaucoup plus important est nécessaire. Si cette étude d’il y a plus de 20 ans était refaite avec les techniques analytiques actuelles, les résultats seraient probablement plus solides. Toutefois, l’aspect sporadique des ruptures d’approvisionnement ne justifie pas l’affectation des ressources analytiques requises pour arriver à des résultats formels. Ces résultats n’étant requis qu’en cas de rupture d’approvisionnement, il serait contre-productif d’investir davantage de ressources dans de telles études, ces ressources étant limitées. Bien d’autres projets sont plus indiqués pour améliorer les soins aux patients.
Puisque le format de 2 mg d’alteplase est maintenant commercialisé, notamment pour le déblocage des cathéters, sa fabrication par préparation magistrale d’aliquote lyophilisée n’est plus requise. La préparation magistrale est un moyen de dépannage qui ne doit pas remplacer un produit commercial disponible. Toutefois, il est bon de savoir qu’en cas de rupture d’approvisionnement, des seringues de 1 mg/mL préparées en milieu stérile à partir d’une fiole de 50 mg ou de 100 mg gardent leur activité pendant au moins 10 mois lorsqu’elles sont conservées à −20 °C, pendant 30 jours au réfrigérateur et pendant 12 heures à température ambiante. Il est également bon de savoir que l’emploi du four à micro-ondes pour la décongélation n’est pas recommandé. Bien que toutes ces valeurs ne soient que des estimations, car l’étude n’a pu les établir de façon statistiquement formelle, elles sont des guides utiles en période de rupture d’approvisionnement. D’autres travaux sont nécessaires pour bien comprendre toutes les facettes du comportement de cette molécule relyophilisée selon les divers processus de reconditionnement, de stockage et d’utilisation. De tels travaux relèvent toutefois davantage de la recherche fondamentale universitaire et dépassent les besoins de nos départements de pharmacie, dont l’objectif premier demeure les soins aux patients. Un tel travail serait d’autant plus complexe que, comme l’a montré la présente étude, l’alteplase est une molécule difficile à analyser.
Tout le matériel, y compris les médicaments, a été fourni par le département de pharmacie ou les laboratoires du CHU Sainte-Justine.
Tous les auteurs ont soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts lié au présent article.
Les auteurs remercient le laboratoire d’hématologie du CHU Sainte-Justine pour son soutien et son leadership tout au long de l’étude, notamment Mme Danielle Côté-Lepage, technicienne chargée des analyses; le Département de pharmacie du CHU Sainte-Justine pour tous les médicaments; la Faculté de pharmacie de l’Université de Montréal pour l’équipement de lyophilisation nécessaire ainsi que feu Mme Lucie Racine, technicienne à la Faculté de pharmacie de l’Université de Montréal, pour son aide inestimable et inaliénable. Mme Danielle Côté-Lepage a donné son autorisation écrite aux remerciements.
1. Monographie de l’ActivaseMD, Alteplase poudre lyophilisée pour injection, compagnie Roche, 23 juillet 1996.
2. Taketomo CK, Hodding JH, Kraus DM. Pediatric Dosage Handbook. 24th ed. Hudson : Lexi-Comp., 2017–2018: 2219 pages.
3. Calis KA, Cullinane AM, Horne MD. Bioactivity of cryopreserved alteplase solutions. Am J Health-Syst Pharm 1999;56: 2056–7.

4. Davis SN, Vermeulen L, Banton J, Schwartz BS, Williwms EC. Activity and dosage of alteplase dilution for clearing occlusions of venous-access devices. Am J Health-Syst Pharm 2000;57:1039–45.

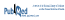
5. Cutshall BT, Gorman GS, Freeman MK, Kyle JA. Enzymatic stability of alteplase solution for injection: effect of various methods of thawing frozen solutions. Hosp Pharm 2016;51:246–51.

6. Alkatheri A. Stability of recombinant tissue plasminogen activator at −30C over one year. Pharmaceuticals 2013,6:25–31.

7. Shaw GJ, Sperling M, Meunier JM. Long-term stability of recombinant tissue plasminogen activator at −80 C. BMC Research Notes 2009; 2:117.

8. Semba CP, Weck S, Patapoff T. Alteplase: stability and bioactivity after dilution in normal saline solution. J Vasc Radiol 2003;14:99–102.

9. Lam XM, Ward CA, Du Mée CP. Stability and activity of alteplase with injectable drugs commonly used in cardiac therapy. Am J Health-Syst Pharm 1995;52: 1904–9.

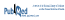
10. Nguyen TH, Ward C. Stability characterization and formulation development of alteplase, recombinant tissue plasminogen activator. In: Stability and Characterization of Protein and Peptide Drugs, Pharmaceutical Biotechnology, volume 5; 1992 – 2002. p. 91–134.

11. Werner RG, Bassarab S, Hoffmann H, Schluter M. Quality aspects of fibrinolytic agents on biochemical characterization. Arzneimittel-forschung 1991; 41:1196–200.
12. Alteplase for injection, official monograph. In: United States Pharmacopeia. USP 36. Rockville, MD; United States Pharmacopeia; 2021. p.75–6
13. Molinaro G, Gervais N, Adam A. Biochemical basis of angioedema associated with recombinant tissues plasminogen activator treatment an in vitro experimental approach. Stroke 2002; 1712–6.

14. Ordre des pharmaciens du Québec. Norme 2014.01–Préparation de produits stériles non dangereux en pharmacie. 104 pages. [en ligne] https://www.opq.org/wp-content/uploads/2020/03/1827_38_fr-ca_0_norme201401_prod_steriles_non_dang_oct2017.pdf site visité le 17 juin 2020).
PHARMACTUEL, Vol. 56, No. 2, 2023