Danielle Fany Ngontié Tcheudjio, Pharm.D., M.Sc.1,3, Michel Savoie, B.Pharm., M.Sc.2,3, Jean-François Tessier, B.Pharm., M.Sc .2,3
Reçu le 12 mars 2022: Accepté après révision par les pairs le 2 octobre 2022
Résumé
Objectif : Présenter un cas d’augmentation du rapport normalisé international et du temps de céphaline possiblement lié à l’association de céfazoline et de rifampicine.
Résumé du cas : Une patiente de 81 ans, ayant une prothèse au coude gauche, est traitée pendant quatre semaines par de la céfazoline pour une ostéite du coude à Staphylococcus aureus sensible à l’oxacilline. La rifampicine est ajoutée au 36e jour du début de l’antibiothérapie par voie intraveineuse. Neuf jours plus tard, son temps de céphaline augmente jusqu’à 178 secondes, et le rapport normalisé international atteint une valeur de 1,58. Les paramètres de coagulation retournent dans les valeurs normales dans les jours suivants l’administration de vitamine K et l’arrêt de la rifampicine.
Discussion : L’altération des paramètres de la coagulation observée est possiblement attribuable à l’association « céfazoline-rifampicine ». La patiente présente plusieurs facteurs de risque, tels qu’une dose élevée de céfazoline, une hospitalisation de longue durée ainsi qu’une intervention chirurgicale récente. Ses autres médicaments sont peu susceptibles d’être en cause. Plusieurs rapports de cas d’hypoprothrombinémie associée à la prise simultanée des deux antibiotiques montrent un tableau clinique et un délai de résolution assez semblables au cas présenté.
Conclusion : Une surveillance des paramètres de la coagulation est nécessaire lors de l’usage concomitant de la céfazoline et de la rifampicine, surtout en présence de facteurs de risque de saignement et lorsqu’une poursuite de l’antibiothérapie à domicile est prévue.
Mots clés : Céfazoline, coagulation, interaction, PTT, rapport normalisé international, rifampicine, RNI, temps de céphaline
Abstract
Objective : To present a case of increased international normalized ratio and partial thromboplastin time possibly related to the combined use of cefazolin and rifampin.
Case summary : An 81-year-old female patient with a left elbow prosthesis was treated for 4 weeks with cefazolin for oxacillin-susceptible Staphylococcus aureus osteitis of the elbow. Rifampicin was added on day 36 after the start of intravenous antibiotic therapy. Nine days later, her partial thromboplastin time increased to 178 seconds, and her international normalized ratio reached 1.58. Her coagulation parameters returned to normal in the days following the administration of vitamin K and the discontinuation of rifampicin.
Discussion : The observed alteration of coagulation parameters was possibly due to the combined use of cefazolin and rifampicin. The patient had several risk factors, such as a high dose of cefazolin, long-term hospitalization, and recent surgery. Her other medications were unlikely to be the cause. Several case reports of hypoprothrombinemia associated with the concomitant use of the two antibiotics show a clinical picture and time to resolution quite similar to those in the present case.
Conclusion : Monitoring coagulation parameters is necessary when cefazolin and rifampicin are administered concomitantly, especially in the presence of risk factors for bleeding and when the antibiotic therapy is to be continued at home.
Keywords : Cefazolin, coagulation, INR, interaction, international normalized ratio, partial thromboplastin time, PTT, rifampicin
La céfazoline est une céphalosporine de première génération administrée par voie parentérale. Elle présente une activité principalement contre les bactéries à Gram positif comme le Staphylococcus aureus sensible à l’oxacilline (SASO) ainsi que contre certaines bactéries à Gram négatif comme l’Escherichia coli. La céfazoline est indiquée dans certains types d’infection, dont les infections de la peau et des tissus mous, les infections ostéo-articulaires, et aussi en antibioprophylaxie chirurgicale1. Ses effets indésirables potentiels incluent des réactions cutanées, du prurit, et des troubles gastro-intestinaux2. Des leucopénies, neutropénies et thrombocytopénies sont des troubles rares associés à la céfazoline2. L’hypoprothrombinémie, un effet indésirable plus rare, a fait l’objet de plusieurs rapports de cas1,3–5.
La rifampicine, un antibiotique de la classe des rifamycines, est un inhibiteur de l’acide ribonucléique polymérase6. Son spectre d’activité englobe plusieurs agents pathogènes, dont le Staphylococcus aureus et certaines mycobactéries7. Lors d’une infection à S. aureus chez un patient portant une prothèse ou un autre matériel exogène, elle peut être donnée en association avec un autre antimicrobien pour augmenter les chances de succès thérapeutiques8. La rifampicine peut causer une hépatotoxicité, une agranulocytose ainsi que des troubles de la coagulation7. D’ailleurs, quelques cas de troubles de la coagulation graves ont été observés dans des études de pharmacovigilance sur la rifampicine lors de l’administration concomitante de céfazoline à fortes doses et de rifampicine9. L’interaction peut être mortelle dans certains cas. En outre, la monographie américaine recommande d’éviter cette association chez les patients présentant des risques de saignement9. La monographie canadienne ne fait pas mention de l’interaction entre les deux médicaments6.
Le présent article décrit le cas d’une patiente traitée pour une ostéite à SASO par l’association céfazoline-rifampicine, chez qui une augmentation du temps de céphaline (PTT) et du rapport normalisé international (RNI), sans saignement, a été constatée. Cet exemple illustre l’importance d’un suivi approprié des paramètres de coagulation, surtout lorsqu’une antibiothérapie à domicile par ces deux agents est prévue.
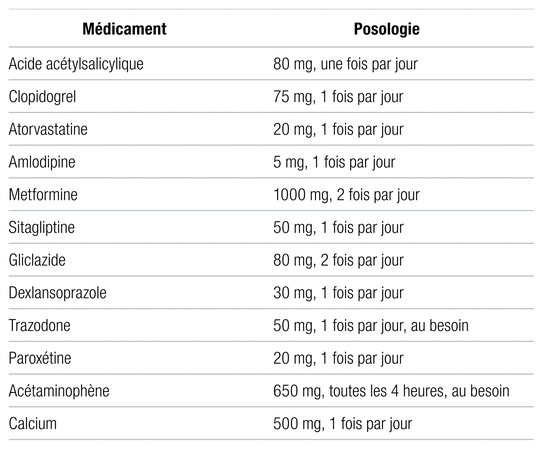
Une femme de 81 ans (56 kg) sans allergie connue est transférée d’un centre de réadaptation à une unité de chirurgie à la suite de la découverte d’une plaie ulcérée avec exposition de l’os du coude gauche. La patiente souffre de dystonie cervicale, de diabète de type 2, d’hypertension artérielle et a des antécédents de cancer du sein avec mastectomie. Il y a trois ans, elle a subi une intervention chirurgicale au coude gauche qui avait nécessité l’implantation d’une prothèse. Les médicaments d’intérêt sont : l’acide acétylsalicylique, le clopidogrel et l’héparine non fractionnée en thromboprophylaxie. La liste des médicaments à domicile est détaillée dans le tableau I. Le reste des médicaments était principalement constitué d’antiémétiques, de laxatifs ou d’analgésiques à prendre au besoin. La céfazoline par voie intraveineuse à raison de 2 g, trois fois par jour, est commencée pour couvrir le SASO découvert dans les cultures préliminaires de la prothèse du coude. Les fonctions hépatique et rénale sont normales à l’admission et tout au long de l’hospitalisation (tableau II).
Tableau I Liste des médicaments de la patiente à l’admission

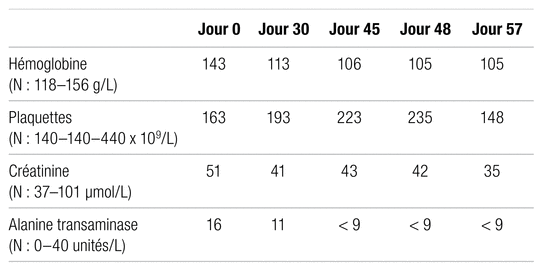
Tableau II Évolution d’autres paramètres de laboratoire pertinents
Au 10e jour de son hospitalisation, la patiente subit un débridement avec lavage des tissus infectés en salle d’opération. Le protocole d’antibiothérapie locale à l’aide de sulfate de calcium imprégné d’antibiotiques (vancomycine, 1 g et tobramycine, 240 mg) est utilisé en complément de la céfazoline à l’induction de l’anesthésie. La biopsie du tissu de l’épitrochlée revient positive pour le SASO. La céfazoline est donc poursuivie. Près de trois semaines après l’opération, la guérison de la plaie n’étant pas satisfaisante, une deuxième séance de débridement et de lavage a lieu (30e jour), avec positionnement d’un dispositif pour le traitement des plaies par pression négative, aussi appelé vaccum assisted closure. Une seconde biopsie du tissu du coude gauche ne révèle pas de croissance microbienne. Par ailleurs, une consultation en nutrition est ouverte au jour 29 pour optimiser les apports en contexte de dénutrition et de difficulté à guérir la plaie chirurgicale.
Au 31e jour d’hospitalisation, l’apparition d’une neutropénie et d’une leucopénie entraîne le remplacement de la céfazoline par la daptomycine (9 mg/kg, soit 500 mg) par voie intraveineuse une fois par jour. En ce qui a trait aux paramètres de la coagulation, le PTT est labile depuis l’admission, mais le RNI reste dans les valeurs normales à ce stade de l’hospitalisation (figure 1). Au 34e jour, l’équipe médicale, après réévaluation, juge qu’il est peu probable que la céfazoline soit en cause dans la diminution des globules blancs. La daptomycine est donc remplacée par la céfazoline. Deux jours plus tard, la rifampicine (300 mg par voie orale, deux fois par jour) est ajoutée en raison de la présence d’une prothèse et de l’évolution lente de la maladie. Les bilans de laboratoire de la patiente étant normaux au 44e jour, l’équipe commence les démarches pour le congé.
|
| ||
|
Figure 1 Évolution du temps de céphaline et du rapport normalisé international
| ||
Au 45e jour, le PTT (178,5 secondes) et le RNI (1,42) dépassent les valeurs usuelles depuis l’admission et les valeurs de référence, respectivement (figure 1). Une dose de vitamine K (5 mg par voie orale) est alors administrée, et l’héparine sous-cutanée est cessée. Il n’y a pas de contrôle pour évaluer l’évolution des paramètres dans les 24 heures suivant l’administration de la vitamine K. Ces paramètres restent élevés jusqu’au 48e jour, sans baisse d’hémoglobine (tableau II) ni saignement. Le jour prévu du congé (49e jour), la rifampicine est cessée, car les risques liés au saignement dépassent les bienfaits. Lors du suivi en consultation externe, six jours après le congé (57e jour), le PTT et le RNI sont redevenus normaux et le sont restés lors des visites subséquentes. La céfazoline a été poursuivie seule à domicile jusqu’au 70e jour.
Une autorisation du Directeur des services professionnels du Centre intégré universitaire de santé et de services sociaux de l’Est-de-l’Île-de-Montréal a été obtenue pour la publication de cet article.
L’hypoprothrombinémie est caractérisée par la baisse des concentrations sériques de prothrombine ou de facteur II, une composante importante dans la cascade de coagulation10. Cette affection peut se manifester par de légers saignements (ecchymose, saignement des muqueuses) et par des symptômes plus graves (saignements intra-articulaires ou intracrâniens). L’hypoprothrombinémie peut être héréditaire ou acquise, la forme acquise étant attribuable à une atteinte hépatique, à une carence en vitamine K, à la prise de warfarine ou à une maladie auto immune10.
L’hypoprothrombinémie attribuable à une carence en vitamine K est rare11. Dans la littérature, des rapports de cas qui remontent aux années 1950 décrivent l’hypoprothrombinémie associée à l’usage d’antibiotiques12. C’est en 1980 que l’incidence de ce trouble de la coagulation connaît une augmentation qui coïncide avec l’usage des bêta-lactamines11. Il est cependant difficile d’évaluer avec exactitude l’incidence de cet effet indésirable lié aux antibiotiques, entre autres à cause des diverses définitions dans la littérature et de l’absence d’études comparatives12. Les céphalosporines de deuxième et de troisième générations, principalement celles comportant la chaîne latérale N-méthylthiotétrazole (MTT), sont les molécules les plus souvent en cause (céfamandole, céfopérazone, moxalactame)12,13–15. La céfazoline, qui contient une chaîne latérale méthylthiadiazole (MTD), est aussi associée à un risque d’hypoprothrombinémie5,15,16. Une revue de la littérature de 1990 signale une incidence de 3,7 % à 64 % avec les traitements antibiotiques comptant une chaîne MTT contre de 0 % à 24 % avec ceux sans chaîne MTT12.
Dans le cas particulier des céphalosporines, deux mécanismes potentiels sont proposés. D’une part, la chaîne latérale MTT ou MTD peut causer une inhibition de l’enzyme vitamine K époxyde réductase (VKOR) et de l’enzyme gamma-glutamyl carboxylase, deux protéines importantes dans le métabolisme des facteurs de coagulation dépendant de la vitamine K13,16–18. D’autre part, ces molécules peuvent diminuer la flore bactérienne intestinale productrice de vitamine K12. Il en résulte alors une baisse de la production des facteurs de coagulation dépendant de la vitamine K15. La chaîne latérale MTD est plus stable in vivo que la MTT et est métabolisée plus rapidement par méthylation5,15. Ces deux particularités réduiraient le risque de troubles de la coagulation chez les patients recevant la céfazoline15. Cependant, le risque d’hypoprothrombinémie s’accroît chez ces patients en cas d’insuffisance rénale15. En effet, l’enzyme de méthylation devient moins efficace, ce qui engendre une accumulation de la chaîne MTD15. L’administration de doses élevées de céfazoline ainsi qu’une longue durée de traitement peuvent également augmenter le risque de troubles de la coagulation16,19. Il existe d’autres facteurs de risque, comme l’âge avancé, une altération de la fonction hépatique, la malnutrition, une carence en vitamine K, un cancer, une hospitalisation prolongée et une intervention chirurgicale récente3–5,12,19.
L’interaction entre la céfazoline et la rifampicine peut engendrer une coagulopathie liée à la vitamine K et augmenter le risque de saignement15,19,20. Il est important de souligner que malgré les rapports de cas et le fait que la monographie américaine de la rifampicine ne recommande pas cette association, l’interaction n’est pas reconnue par tous les logiciels d’interactions médicamenteuses9. Ainsi, RxVigilance et Lexi-Interact recommandent d’éviter l’association, alors que Drug Interactions de Micromedex et Drug Interaction Checker de Medscape ne mentionnent aucune interaction21–24. Tout comme la céfazoline, la rifampicine affecte la flore intestinale et inhibe la VKOR25,26. Ainsi, on trouve dans la littérature des cas d’hypoprothrombinémie associée à la céfazoline ou à la rifampicine employée seule, mais aussi avec leur association3–5,15,19,20,25,27.
Les posologies des deux molécules peuvent varier selon l'indication et l'évaluation clinique de chaque usager. Cependant, les posologies fréquemment mentionnées dans les rapports de cas sont de 2 g par voie intraveineuse toutes les 8 heures pour la céfazoline et de 600 mg par voie orale toutes les 12 heures pour la rifampicine. Lorsqu’elle survient, l’hypoprothrombinémie apparaît en général dans les deux semaines suivant le début de cette association15,19,20. Les symptômes caractéristiques sont une altération importante du temps de prothrombine ou du RNI, une diminution de certains facteurs de coagulation, dont le facteur II, et des manifestations cliniques15,19,20. Angles et coll. présentent quatre cas d’hypoprothrombinémie accompagnée de complications graves (tamponnade hémorragique, choc cardiogénique, méléna, ulcère duodénal) chez des patients sous céfazoline et rifampicine, dont deux mortels15. Il est à noter qu’aucun des patients ne recevait d’anticoagulant. Chez l’un des patients décédés, la céfazoline a été remplacée par la daptomycine, et les troubles de la coagulation ont été découverts trois jours après le changement15. Kouki et coll. mentionnent quant à eux une œsophagite nécrosante avec ulcère nécrotique tandis que Gay et coll. font état d’un saignement dans la région opérée19,20.
Le temps de résolution de l’hypoprothrombinémie n’est pas toujours spécifié. Dans l’un des cas décrits par Angles et coll., les antibiotiques ont été poursuivis, et les paramètres de coagulation se sont normalisés rapidement après une dose de vitamine K. Toutefois, le patient a été réadmis à l’hôpital le lendemain pour du méléna15. Dans le cas de Gay et coll., le patient a connu une diminution du temps de prothrombine 48 heures après le remplacement de la céfazoline par la pénicilline20. Étant donné la présence de saignements actifs, en plus de la vitamine K, la prise en charge a nécessité l’administration de culots globulaires ou de complexe prothrombinique15,19.
Cet article présente le cas d’une patiente dont le PTT et le RNI ont possiblement été affectés par la prise simultanée de céfazoline et de rifampicine. Lorsque la céfazoline était employée en monothérapie, le PTT (temps de céphaline) oscillait entre 30 et 100 secondes, et le RNI était dans les valeurs normales. Bien que l’héparine non fractionnée à dose prophylactique ne devrait pas faire augmenter le PTT, il peut parfois se produire une hausse d’au plus 1,5 fois la valeur normale pendant son administration28. Les patients atteints d’insuffisance rénale, ayant un faible poids ou un faible taux de protéines sériques sont potentiellement plus à risque28. Quant à la daptomycine, elle peut causer un allongement apparent du temps de prothrombine ou une élévation du RNI par interaction avec certains réactifs utilisés pour les analyses de laboratoire29. Cependant, le trouble de la coagulation était déjà présent au moment où la daptomycine a été introduite à la thérapie. De plus, la daptomycine a été ajoutée, puis cessée (jours 31 à 34) plus d’une semaine avant l’apparition de l’augmentation du RNI (jour 45).
Dans les neuf jours qui ont suivi l’ajout de la rifampicine, le RNI a dépassé les valeurs normales pour la première fois depuis l’hospitalisation, et le PTT, la limite supérieure usuelle (100 secondes) observée chez la patiente depuis son admission (figure 1). Comme le RNI et le PTT étaient suivis tous les trois ou quatre jours, il est difficile de déterminer avec exactitude le moment où le déséquilibre s’est produit. Il n’en demeure pas moins que, tout comme dans les rapports de cas présentés précédemment, les troubles de la coagulation sont apparus moins de deux semaines après le début de l’association céfazoline-rifampicine.15,19,20 Puisque l’analyse spécifique du facteur II n’a pas été effectuée, il n’est pas possible d’affirmer, comme dans les autres rapports, qu’il s’agit d’un cas d’hypoprothrombinémie.
L’évaluation du lien de causalité avec la grille de Naranjo donne un score de 4, ce qui indique que l’association céfazoline-rifampicine est possiblement la cause de l’effet indésirable observé30. En effet, le lien temporel observé dans le cas présenté est semblable à celui qu’on retrouve dans la littérature. Bien qu’il n’y ait pas eu de réexposition à la molécule, le PTT et le RNI sont revenus à la normale après l’administration de vitamine K et l’arrêt de la rifampicine. Les concentrations sériques de céfazoline et de rifampicine n’ont pas été mesurées. Cependant, Kouki et coll., qui ont mesuré la concentration de la céfazoline chez leur patient atteint d’hypoprothrombinémie, n’ont pas trouvé de valeur suprathérapeutique19.
Notre patiente présentait certains facteurs de risque de trouble de la coagulation associé à la céfazoline, soit une dose élevée (6 g/j) et l'administration sur plusieurs semaines19. Cependant, sa fonction rénale était normale. De plus, le RNI n’a augmenté qu’après l’ajout de la rifampicine. Il n’est pas possible d’éliminer hors de tout doute les autres causes possibles. Parmi les facteurs non iatrogéniques, on trouve l’âge avancé, l’intervention chirurgicale récente et l’hospitalisation sur une longue période12,19. Quant à la malnutrition, la patiente était suivie par le service de nutrition. Elle ne s’alimentait pas bien dès le début de l’hospitalisation, mais le RNI est resté dans les valeurs normales jusqu’au 45e jour. Concernant les médicaments, mis à part l’héparine non fractionnée et la daptomycine, la présomption est très faible pour les autres molécules puisque la patiente les prenait avant l’hospitalisation.
La patiente ne s’est pas présentée à l’hôpital avant la date prévue de son suivi en consultation externe, qui n’a révélé aucune anomalie. On note donc une distinction par rapport aux autres cas répertoriés dans la littérature où des complications hémorragiques diverses se sont produites et ont souvent été repérées après le congé du patient. Le prompt retrait de la rifampicine avant le départ de la patiente a potentiellement aidé à prévenir les complications. En effet, dans certains rapports de cas, les patients obtenaient parfois leur congé avec une prescription de l’association des deux antibiotiques après l’administration de vitamine K15.
En présence de troubles de la coagulation sans saignement important pour lesquels une carence en vitamine K est soupçonnée, comme dans le cas présenté, l’administration de vitamine K par voie orale est privilégiée10. La voie intraveineuse est utilisée si l’état clinique du patient nuit à l’absorption intestinale10. En cas de saignement aigu, du plasma congelé ou un concentré de complexe prothrombinique peut être utilisé. L’acide tranexamique constitue une option à considérer en présence de saignement des muqueuses10. L’usage d’un concentré de complexe prothrombinique exige de la prudence puisqu’il contient des concentrations importantes d’autres facteurs de coagulation activés et qu’il peut ainsi engendrer des événements thrombo-emboliques31. Dans des rapports de cas, des culots de globules rouges ainsi qu’un traitement à base de réducteurs d'acidité gastro-intestinale étaient d’autres modalités utilisées15,19. Lorsqu’une origine iatrogénique est soupçonnée, il faut idéalement suspendre l’agent en cause ou au moins en réduire la dose32. Si l’agent est poursuivi, la vitamine K peut être instaurée au besoin avec un suivi étroit des paramètres de coagulation5,15. Si l’association céfazoline-rifampicine est administrée, l’un ou l’autre des agents peut être cessé ou remplacé5,15–20.
Cet article présente le cas d’une patiente qui a subi des troubles de la coagulation sans saignement dans les neuf jours suivant l’ajout de la rifampicine à la céfazoline. Lorsque la patiente recevait la céfazoline en monothérapie et l’héparine non fractionnée en thromboprophylaxie, le PTT fluctuait entre des valeurs normales et suprathérapeutiques. Il serait donc prudent de surveiller les paramètres de coagulation chez les patients recevant la céfazoline avec cet anticoagulant et de resserrer le suivi en cas d’ajout de la rifampicine. Il est important de garder en tête que si la patiente avait reçu son congé de l’hôpital avec une ordonnance de ces deux antibiotiques, les risques de complication auraient pu être plus importants. Un suivi étroit (une ou deux fois par semaine) du RNI et du PTT dans les deux premières semaines de la prise de l’association est à considérer. Par la suite, la fréquence du suivi peut être ajustée selon le jugement de l’équipe médicale. En outre, ce suivi devrait s’ajouter aux bilans de contrôle en consultation externe, et le patient doit être avisé de surveiller tout signe de saignement. L’importance clinique de l’interaction peut varier d’une personne à l’autre. La décision de commencer et de poursuivre l’association céfazoline-rifampicine doit donc tenir compte des facteurs de risque propres à chaque patient.
Les auteurs n’ont déclaré aucun financement lié au présent article.
Tous les auteurs ont soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts potentiel lié à cet article.
1. Sterimax. Monographie de produit : céfazoline pour injection. [en ligne] https://pdf.hres.ca/dpd_pm/00061131.PDF (site visité le 9 janvier 2022).
2. Micromedex Healthcare Series. Monographie de la céfazoline. Thomson Micromedex, 1974–2022. [en ligne] www.micromedexsolutions.com (site visité le 9 janvier 2022).
3. Ngiam JN, Liong TS, Tham SM, Pramotedham T, AlAgha R, Yong J et al. Deranged coagulation profile secondary to cefazolin use: case report. Infect Dis Rep 2021;13:187–90.


4. Barnes T, Yan S, Kaakeh Y. Necrotizing esophagitis and bleeding associated with cefazolin. Ann Pharmacother 2014;48:1214–8.

5. Chung AH, Watson K. Cefazolin-induced hypoprothrombinemia. Am J Health Syst Pharm 2008;65:823–6.

6. Bausch Health. Renseignements thérapeutiques incluant les renseignements pour le patient sur le médicament: Rofact. [en ligne] https://pdf.hres.ca/dpd_pm/00051996.PDF (site visité le 9 janvier 2022).
7. Micromedex Healthcare Series. Monographie de la rifampicine. Thomson Micromedex, 1974–2022. [en ligne] www.micromedexsolutions.com (site visité le 9 janvier 2022).
8. The Infectious Diseases Society of America. Diagnosis and management of prosthetic joint infection: clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis 2013;56:e1–e25.

9. Dailymed. Rifadin IV Novaplus–Rifampin injection, powder, lyophilized, for solution. National Institute of Health, 2021. [en ligne] https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=87839f65-cb33-412e-929e-564136501a84 (site visité le 9 janvier 2022).
10. Meeks SL, Abshire TC. Abnormalities of prothrombin: a review of the pathophysiology, diagnosis, and treatment. Haemophilia 2008; 14:1159–63.

11. Combs G, Mclung JJ. Vitamin K. Dans : Combs G, Mclung JJ, rédacteurs. The vitamins. fundamental aspects in nutrition and health. 5e éd. Academic press; 2017. p.243–65.
12. Shevchuk YM, Conly JM. Antibiotic-associated hypoprothrombinemia: a review of prospective studies, 1966–1988. Rev Infect Dis 1990;12: 1109–26.

13. Shearer MJ, Bechtold H, Andrassy K, Koderisch J, McCarthy PT, Trenk D et al. Mechanism of cephalosporin-induced hypoprothrombinemia: relation to cephalosporin side chain, vitamin K metabolism, and vitamin K status. J Clin Pharmacol 1988;28:88–95.

14. Park GH, Kim S, Kim MS, Yu YM, Kim GH, Lee JS et al. The association between cephalosporin and hypoprothrombinemia: a systematic review and meta-analysis. Int J Environ Res Public Health 2019;16:3937.


15. Angles E, Mouton C, Perino J. Hypoprothrombinemia and severe perioperative haemorrhagic complications in cardiac surgery patients treated with high-dose cefazolin for infective endocarditis. Anaesth Crit Care Pain Med 2018;37:167–70.

16. Lipsky J. N-methyl-thio-tetrazole inhibition of the gamma carboxylation of glutamic acid: possible mechanism for antibiotic-associated hypoprothrombinaemia. Lancet 1983;322: 192–3.

17. De Vilder EY, Debacker J, Vanakker OM. GGCX-associated phenotypes: an overview in search of genotype-phenotype correlations. Int J Mol Sci 2017;18:240.


18. Loriot MA, Beaune P. La vitamine K époxyde réductase: du sang neuf dans les traitements anticoagulants oraux. Rev Med Interne 2006; 27:979–82.

19. Kouki I, Montagner C, Mauhin W, London J, Lazard T, Grimbert S et al. Coagulation disorders during treatment with cefazolin and rifampicin: rare but dangerous. J Bone Jt Infect 2021;6:131–4.


20. Gay E, Barthel A, Rouzic N, Henriot B, Quélennec B, Lorleac’h A et al. Céfazoline et troubles de la coagulation : à propos d’un cas. Ann Biol Clin (Paris) 2018;76:104–6.
21. RxVigilance : pharmacological profile analysis. Quebec (QC) : Vigilance santé.
22. Lexi-interact online [database on the Internet]. Hudson (OH): Lexicomp. http://online.lexi.com. (site visité le 9 janvier 2022).
23. Micromedex Healthcare Series. Drug Interactions. Thomson Micromedex, 1974–2022. [en ligne] www.micromedexsolutions.com (site visité le 9 janvier 2022).
24. Medscape Database. Drug Interaction Checker. [en ligne] https://reference.medscape.com/ (site visité le 9 janvier 2022).
25. Sampaziotis F, Griffiths WJ. Severe coagulopathy caused by rifampicin in patients with primary sclerosing cholangitis and refractory pruritus. Br J Clin Pharmacol 2012; 73:826–7.


26. Van Steenbergen W, Vermylen J. Reversible hypoprothrombinemia in a patient with primary biliary cirrhosis treated with rifampicin. Am J Gastroenterol 1995;90:1526–8.
27. Kobayashi K, Haruta T, Maeda H. Cerebral hemorrhage associated with vitamin K deficiency in congenital tuberculosis treated with isoniazid and rifampin. Pediatr Infect Dis J 2002;21:1088–90.

28. Fiebig EW, Jones M, Logan A. Unexpectedly high PTT values after low-dose heparin prophylaxis. Arch Intern Med 2011;171:702–3.

29. Sandoz Canada. Monographie avec renseignements destinés aux patients: daptomycine pour injection. [en ligne] https://pdf.hres.ca/dpd_pm/00058666.PDF (site visité le 30 juillet 2022).
30. Naranjo CA, Busto U, Sellers EM, Sandor P, Ruiz I, Roberts E et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther 1981;30: 239–45.

31. Peyvandi F, Duga S, Akhavan S. Rare coagulation deficiencies. Haemophilia 2002;8: 308–21.

32. Dailymed. Mephyton–Phytonadione tablet. National Institute of Health, 2021. [en ligne] https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=5be7bb0a-dddb-4cb4-bf89-a8fafb726c83 (site visité le 9 janvier 2022).
PHARMACTUEL, Vol. 56, No. 1, 2023