Maria Macoviciuc1, Christina Nguyen, B.Pharm. M.Sc.2, Jean-Marc Forest, B.Pharm., DPH, M.Sc.2, Grégoire Leclair, B.Pharm., Ph.D.3
Reçu le 19 mars 2022: Accepté après révision par les pairs le 20 juillet 2022
Résumé
Objectif : Déterminer la compatibilité physique de l’acétaminophène injectable avec 102 autres médicaments lors d’une administration en Y.
Méthode : L’acétaminophène (10 mg/mL) a été associé (ratio 1:1) à 102 médicaments injectables non dilués à température ambiante. Chaque préparation a été faite en double. Le premier échantillon a été soumis à une évaluation visuelle à l’æil nu, puis à un test de dénombrement de particules par obscurcissement de la lumière à l’aide d’un compteur de particules immédiatement après le mélange. Les deux tests ont été répétés quatre heures plus tard avec le deuxième échantillon. Un mélange était considéré comme incompatible s’il y avait un changement d’apparence visuelle (précipité, changement de couleur, turbidité, viscosité, formation de bulles de gaz) ou s’il ne répondait pas à la norme USP <788> 1.B à tout moment durant l’expérience.
Résultats : En tout, 93 des 102 médicaments testés se sont avérés compatibles avec l’acétaminophène injectable sur le plan visuel et selon le décompte de particules. L’incompatibilité de six autres médicaments a été déterminée par examen visuel directement à la suite d’une incompatibilité grossière. Deux autres médicaments semblaient compatibles, mais ne répondaient pas à la norme USP <788> 1.B. Ils ont donc été classés incompatibles. La cyclosporine n’a pas pu être analysée correctement, car sa grande viscosité empêchait d’en établir la compatibilité.
Conclusion : Parmi les 102 médicaments testés, 93 se sont révélés physiquement compatibles et neuf, incompatibles ou considérés comme tels. Il faut cependant garder en tête que seuls les critères physiques ont été pris en compte dans cette étude.
Mots-clés : Acétaminophène, administration en Y, compatibilité, paracétamol
Abstract
Objective : To determine the physical compatibility of injectable acetaminophen with 102 other drugs in Y-site administration.
Method : Acetaminophen (10 mg/mL) was combined (1:1 ratio) with 102 undiluted injectable drugs at room temperature. Each preparation was duplicated. Immediately after mixing, the first sample was visually examined with the eye and was then subjected to a light obscuration particle count test using a particle counter. Both tests were repeated four hours later with the second sample. A mixture was considered incompatible if there was a change in visual appearance (precipitate, colour change, turbidity, viscosity or gas bubble formation) or if it did not meet standard USP <788> 1.B at any time during the experiment.
Results : A total of 93 of the 102 drugs tested were found to be compatible with injectable acetaminophen visually and by particle count. Six drugs were determined to be incompatible by visual inspection directly upon gross incompatibility. Two other drugs appeared to be compatible but did not meet standard USP <788> 1.B. They were therefore considered incompatible. Cyclosporine could not be properly tested because its high viscosity prevented its compatibility from being determined.
Conclusion : Of the 102 drugs tested, 93 were found to be physically compatible and nine were found to be or considered incompatible. However, it should be reminded that only physical criteria were considered in this study.
Keywords : Acetaminophen, compatibility, paracetamol, Y-site administration
L’acétaminophène, aussi appelé paracétamol, un antipyrétique et analgésique non opioïde, est indiqué dans le soulagement de la fièvre et de la douleur, seul ou avec d’autres agents1. Il est offert au Canada sous forme orale, intra rectale et, depuis septembre 2019, sous forme injectable2. Pour le moment, l’utilisation de l’acétaminophène injectable au Centre hospitalier universitaire (CHU) Sainte-Justine est restreinte à des indications spécifiques, telles que la douleur de modérée à importante chez les patients dont l’absorption entérale est compromise ou lorsqu’il existe un bienfait clinique potentiel à un début d’action plus rapide.
L’acétaminophène injectable est significativement beaucoup plus cher que les autres formes, mais présente quelques avantages, dont un début d’action plus rapide, une biodisponibilité plus élevée et plus fiable (en évitant certaines variabilités interindividuelles) et la possibilité d’être administrée quand la voie entérale n’est pas possible1,3. La littérature comporte certaines données sur la compatibilité de l’acétaminophène en injection lors d’administrations en Y, mais elles sont incomplètes. En outre, elles ont été établies, pour la plupart, pour des produits qui ne sont pas commercialisés au Canada pour le moment et qui contiennent des excipients différents de ceux que l’on trouve dans le produit offert ici, ce qui pourrait influencer la compatibilité physique2,4–9. Étant donné le contexte d’utilisation de l’acétaminophène injectable, il est pertinent d’effectuer une étude pour vérifier la compatibilité du produit lors d’une administration en Y. La présente étude porte donc sur la compatibilité de l’acétaminophène injectable avec 102 autres médicaments administrés par voie intraveineuse. L’étude comprenait un examen visuel ainsi qu’un décompte de particules par obscurcissement à l’aide d’un compteur de particules.
L’acétaminophène (Avir, lot 2090001) employé dans l’étude se présente en sacs de 100 mL contenant 10 mg/mL d’acétaminophène prêt à l’administration intraveineuse. Le médicament a été prélevé directement du sac, sans dilution supplémentaire.
L’acétaminophène injectable a été mélangé successivement à 102 autres médicaments. Les médicaments nécessitant une reconstitution ont été préparés avec de l’eau stérile pour injection USP (Pfizer, lot 14275DK), sauf quand la monographie indiquait de prendre du chlorure de sodium 0,9 % (Hospira, lot 19-094-DK). La majorité des médicaments ont été utilisés à leur concentration maximale, initiale ou originale, c’est-à-dire selon la concentration commerciale de départ, sans dilution supplémentaire, afin de simuler le risque maximal d’interaction potentielle. Certains antibiotiques (ampicilline, céfazoline, céfotaxime, céfoxitine, ceftazidime, ceftriaxone, céfuroxime et cloxacilline) ont été dilués à une concentration exacte de 100 mg/mL avec de l’eau stérile pour injection selon la pratique en cours au CHU Sainte-Justine. Cette pratique a pour but de simplifier le calcul des doses pédiatriques. L’amphothéricine B liposomale (AmbisomeMD), quant à elle, a plutôt été diluée à une concentration de 2 mg/mL dans le dextrose 5 %, car la concentration originale de 4 mg/mL était trop opaque (empêchant la lecture par le compteur de particules) et n’est pas utilisée directement auprès des patients.
Tous les médicaments ont été prélevés et mélangés à l’aide de seringues stériles pour injection en polypropylène (BD Luer-lock) de 30 mL. Les médicaments fournis en ampoules de verre ont été prélevés avec des aiguilles filtrantes munies d’un filtre de 5 μm, afin d’éviter de confondre les débris de verre avec des particules de précipité. Les autres médicaments fournis en fioles ou en seringues ont été prélevés avec des aiguilles stériles classiques.
Tous les tests ont été effectués à température ambiante contrôlée (21 ± 2 °C) dans une salle climatisée. Toutes les manipulations avec le compteur de particules ont été menées sous une hotte de laboratoire afin de réduire le plus possible la contamination par l’air, conformément à la norme USP <788>10. Au début de la première journée, un test de contrôle a été fait selon les recommandations du fabricant afin d’assurer la conformité de l’environnement et de l’appareil calibré17. Cinq échantillons d’eau purifiée ont été testés afin de calculer le nombre total de particules de 10 μm ou plus. Selon la norme USP <788>, ce nombre ne doit pas dépasser 25. Dans le cas contraire, les opérations de nettoyage doivent être effectuées de nouveau jusqu’à l’obtention d’un environnement propice aux tests de compatibilité10. Au début de chaque journée, un rinçage de l’appareil et un test de contrôle avec de l’eau purifiée ont été effectués pour s’assurer que l’environnement demeure propice à l’expérience. Si un nombre élevé de particules était présent dans l’échantillon d’eau purifiée, plusieurs rinçages supplémentaires et un changement de la verrerie ont eu lieu. Deux tests aux temps « zéro » et « quatre heures » ont été faits avec 20 mL d’acétaminophène seul afin de garantir la conformité initiale du produit.
Tous les échantillons ont été préparés en double en mélangeant 10 mL d’acétaminophène à 10 mL de chaque médicament à tester par inversion manuelle des seringues. Le nombre d’inversions pour assurer un mélange homogène était variable selon la miscibilité du mélange et était suivi d’un examen visuel sur fond blanc et noir sous lumière fluorescente et naturelle. Toute observation pertinente évoquant une incompatibilité physique (formation d’un précipité ou de bulles de gaz, changement de couleur, de turbidité ou de viscosité) était notée. Pour évaluer la viscosité, l’observateur agitait légèrement le mélange et observait le comportement. Ce test était répété après une heure et après quatre heures pour tous les médicaments. Les médicaments jugés incompatibles à l’examen visuel n’ont pas été testés avec le compteur de particules afin d’éviter d’endommager inutilement l’appareil. Pour les médicaments jugés compatibles à l’examen visuel, un des échantillons était testé immédiatement après le mélange et l’autre, quatre heures plus tard pour vérifier qu’il était toujours compatible à ce moment. Bien que l’acétaminophène injectable soit administré habituellement sur un délai de 15 minutes chez l’adulte, une plage de quatre heures permet de simuler, avec un léger excès, le temps de contact maximal que pourraient avoir deux médicaments lors d’une injection en Y11–14. Ce temps d’administration correspond à celui des injections simultanées à très faible débit parfois administrées aux nouveau-nés prématurés11–14. La durée de séjour maximale dans les tubulures de deux médicaments administrés en Y est d’environ trois heures dans ces cas11–14.
Dans la présente étude, la compatibilité visuelle était établie par l’absence de changements visibles à l’æil nu au temps initial ainsi qu’après une heure et après quatre heures, soit changement de couleur, augmentation de la turbidité ou de la viscosité et formation de précipité ou de bulles de gaz, selon l’observateur.
La compatibilité physique était assurée de manière normative à l’aide du compteur de particules LS-20 (Lighthouse Worldwide Solutions, Medford, Orégon, É.-U.). Cet appareil répond à la norme USP <788> pour les tests de décompte de particules par obscurcissement de la lumière15. La norme recommande de prélever quatre portions d’au moins 5 mL, d’éliminer la première lecture et de faire la moyenne des trois dernières afin de déterminer la compatibilité10. Dans cette étude, des échantillons de 20 mL en seringue étaient utilisés après le retrait du plongeur. Plus spécifiquement, une part de 4 mL était prélevée pour le rinçage initial de l’appareil, suivie de trois échantillons de 5 mL pour l’analyse, laissant 1 mL dans la seringue à la fin du test pour éviter l’aspiration de bulles d’air pouvant fausser les résultats11–14,16. Cette méthode facilite les manipulations et réduit la quantité de médicaments nécessaires11,12,14. Les fonctions de l’appareil produisant des données cumulatives et normalisées ont été appliquées, ce qui a permis d’analyser directement le nombre de particules par millilitre17. Pour les volumes de moins de 100 mL, la norme USP <788> 1.B doit être utilisée. Elle permet, au plus, 6000 particules d’une taille égale ou supérieure à 10 μm et au plus 600 particules d’une taille égale ou supérieure à 25 μm, en moyenne, par récipient10. Comme le volume testé dans cette étude était de 20 mL, le nombre permis de particules était d’au plus 300 particules/mL d’une taille égale ou supérieure à 10 μm et d’au plus 30 particules/mL d’une taille égale ou supérieure à 25 μm en moyenne11,13,14,16,18. Les mélanges ont été considérés comme compatibles s’ils respectaient les deux critères énoncés précédemment.
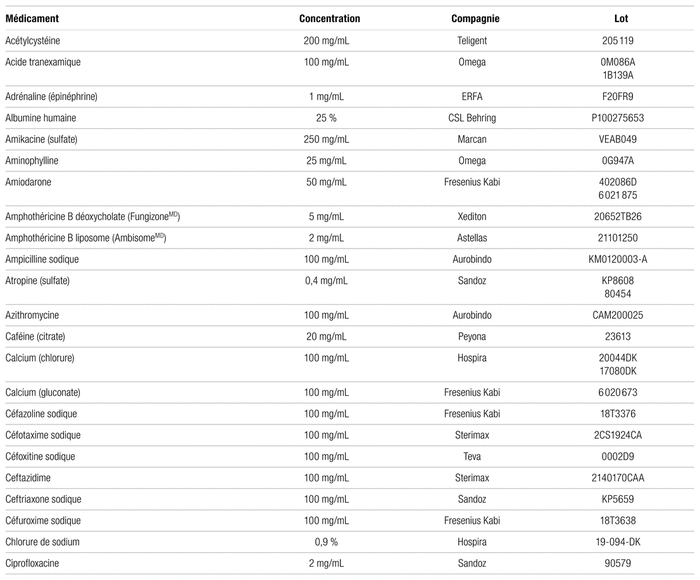
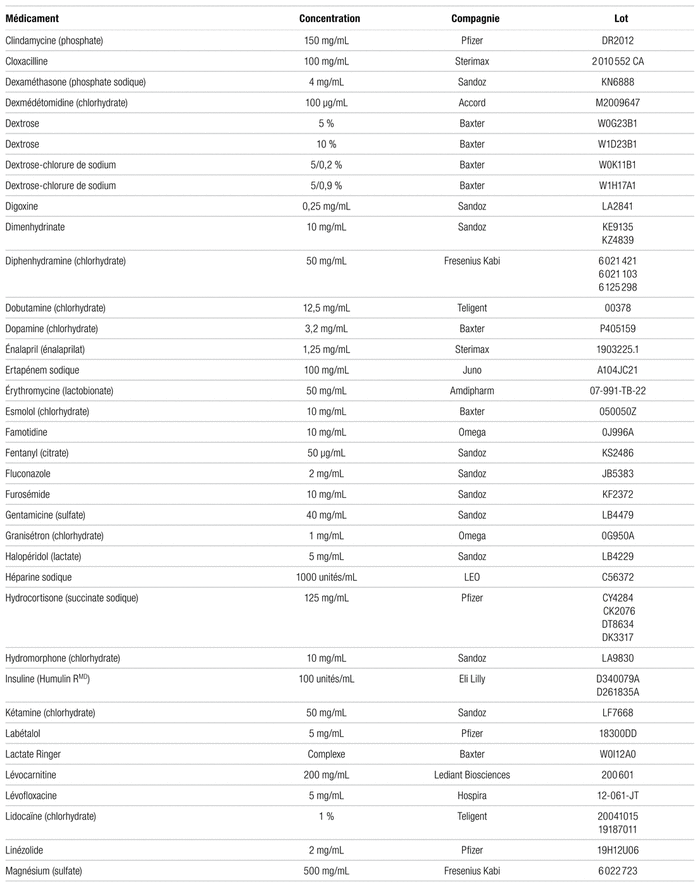
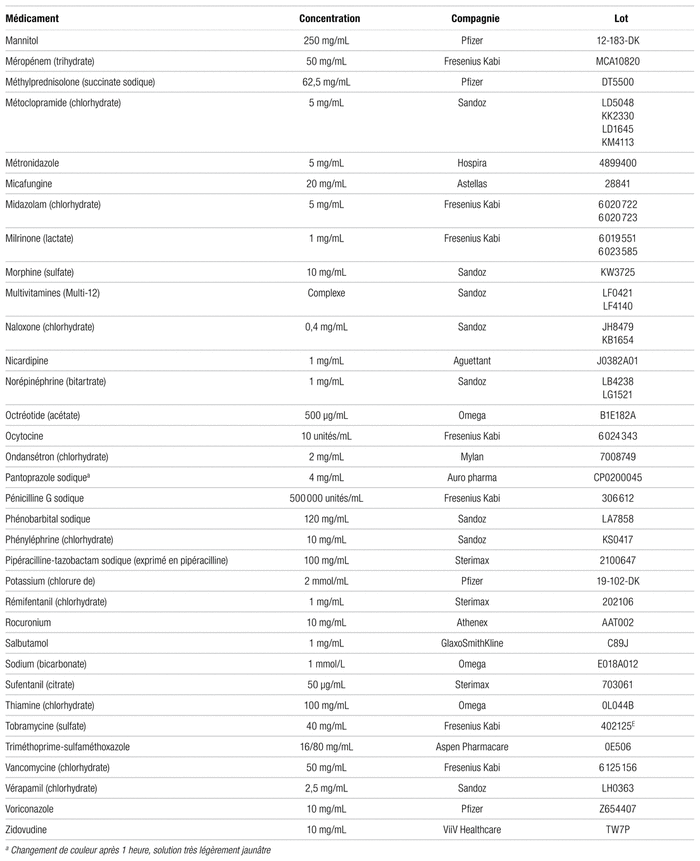
Parmi les 102 médicaments testés, 93 ont été considérés comme physiquement compatibles avec l’acétaminophène (tableau I). Ces médicaments ne se sont pas révélés incompatibles à l’examen visuel et respectaient le seuil limite établi par la norme USP <788> 1.B au temps initial et quatre heures plus tard. Au temps initial, le nombre moyen de particules de 10 μm et plus contenu dans les mélanges jugés compatibles était de 1,3 à 215,1 tandis que le nombre moyen de particules par millilitre de 25 μm et plus était de 0,0 à 10,9. Après quatre heures, le nombre moyen de particules de 10 μm et plus par millilitre variait de 0,3 à 52,9 tandis que le nombre moyen de particules de 25 μm et plus par millilitre allait de 0,0 et à 11,5.
Tableau I Médicaments compatibles avec l’acétaminophène injectable à 10 mg/mL pour administration en Y (respectant la norme USP <788> 1.B)



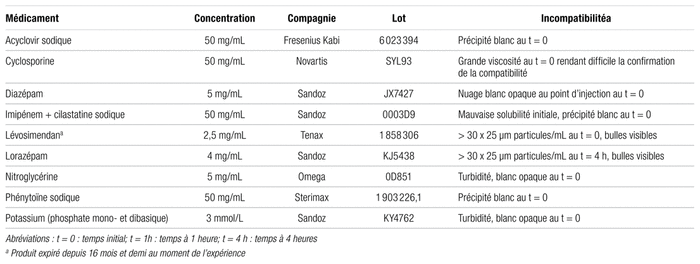
Neuf autres médicaments ont été considérés comme physiquement incompatibles avec l’acétaminophène injectable (tableau II), dont six étaient aussi jugés incompatibles à l’examen visuel (trois par formation de précipités et trois par apparition de turbidité). Deux autres médicaments étaient visuellement compatibles, mais ne respectaient pas le nombre maximal de particules permis par la norme USP <788> 1.B. Enfin, la cyclosporine n’a pu être analysée à l’aide du compteur de particules, car le mélange était trop visqueux, malgré la dilution 1:1 avec l’acétaminophène. Comme déjà mentionné, les médicaments ayant été déclarés visuellement incompatibles n’ont pas été analysés avec le compteur de particules en raison de l’incompatibilité franche observée. Pour deux autres médicaments, le lorazépam et le lévosimendan, le nombre moyen de particules de 10 μm et plus par millilitre variait de 8,7 à 64,8 au temps initial et de 20,9 à 104,5 après quatre heures. Le nombre moyen de particules de 25 μm et plus par millilitre était de 6,1 à 60,5 au temps initial et de 18,0 à 103,4 après quatre heures.
Tableau II Médicaments incompatibles (ou considérés comme tels) avec l’acétaminophène injectable à 10 mg/mL pour une administration en Y
Le protocole de simulation d’injection en Y utilisé dans cette étude est comparable à celui utilisé dans plusieurs autres études de compatibilité physique11–14,16,18–26. Le ratio 1:1 dans la seringue des médicaments testés simule le mélange des deux médicaments dans les tubulures en Y. Les médicaments ont tous été testés à leur concentration maximale, sauf les neuf antibiotiques mentionnés précédemment. Ce choix repose sur la faible probabilité qu’un médicament compatible à une concentration élevée soit incompatible à une concentration plus faible27,28.
Plus d’une soixantaine de résultats de tests de compatibilité sur les 102 combinaisons de cette étude sont inédits dans la littérature. La plupart des autres résultats concordent avec les données publiées dans la littérature pour d’autres fabricants. Le Trissel’s tables of physical compatibility, datant de 1996, et le King Guide n’avaient pas de données sur l’acétaminophène34,35. Les compatibilités de l’acétaminophène avec les médicaments suivants, déjà mentionnées dans la littérature, ont été confirmée : céfazoline, céfoxitine, ceftriaxone, clindamycine, dextrose 5 %, dextrose 10 %, dexaméthasone, dexmédétomidine, dextrose 5 % + chlorure de sodium 0,9 %, diphenhydramine, esmolol, gentamicine, granisétron, halopéridol, héparine, hydrocortisone, hydromorphone, kétamine, labétalol, lactate Ringer, lidocaïne, sulfate de magnésium, mannitol, méthylprednisolone, métoclopramide, midazolam, morphine, NaCl 0,9 %, ondansétron, ocytocine, pipéracilline-tazobactam, chlorure de potassium, rocuronium, sufentanil et vancomycine4,5,29. L’acyclovir, le diazépam et la phénytoïne sont incompatibles, conformément à ce qu’on trouve dans la littérature4,5,29.
Les réactions d’incompatibilité observées durant l’étude sont les mêmes que celles décrites dans la littérature pour le diazépam et la phénytoïne, mais pas pour l’acyclovir. Pour ce dernier cas, la littérature indique uniquement un nombre de particules trop élevé, sans changement visuel. Toutefois, un précipité blanc a clairement été observé durant la présente étude5,29. Cette divergence pourrait s’expliquer par la présence d’excipients différents dans l’acétaminophène et l’acyclovir utilisés dans les préparations4,6,30.
Les résultats de cinq médicaments diffèrent de ceux publiés dans la littérature : l’atropine, le fentanyl, le lorazépam, le métronidazole et le phénobarbital4,5,29. L’atropine est considérée comme incompatible dans la littérature5. L’étude en question consiste en un examen visuel, suivi d’un décompte par microscopie au temps initial, après quatre heures et après 24 heures31. L’incompatibilité décrite consistait en un nombre de particules supérieur à la limite USP après 24 heures, mais pas avant31. Ces résultats sont donc compatibles avec ceux de notre étude pour la valeur à 4 heures seulement. Les données au sujet de la comptabilité du fentanyl sont hétérogènes dans la littérature5,29. Les études faites avec l’acétaminophène provenant de la compagnie Cadence Pharmaceuticals révèlent une compatibilité tandis qu’une étude utilisant l’acétaminophène de la compagnie Finusol Prima déclare la formation de particules une heure après le mélange5. Ces résultats montrent l’influence des excipients dans la compatibilité des médicaments et la pertinence de mener des études lorsque les fabricants diffèrent.
Le lorazépam était visuellement compatible dans deux études publiées ainsi que dans la monographie du produit d’Avir Pharma4,5,29. Les observations montrent aussi une compatibilité visuelle et particulaire initiale, mais le mélange devient incompatible quatre heures plus tard en raison de l’apparition de bulles et d’un décompte de particules supérieur à la limite USP. Par contre, la grande viscosité du lorazépam a entraîné une mauvaise miscibilité initiale et a nécessité un nombre élevé d’inversions avant d’obtenir un mélange homogène. Par conséquent, l’introduction de plusieurs petites bulles en suspension dans le mélange était difficile à éviter. Étant donné la grande viscosité de la solution même après le mélange avec l’acétaminophène, les bulles sont demeurées en suspension et ont pu conduire à un faux positif à la lecture au compteur de particules. Le mélange avait un faible nombre de particules au décompte initial (8,7 mL−1 ≥ 10 μm; 6,1 mL−1 ≥ 25 μm) et un nombre plus élevé quatre heures plus tard (104,5 mL−1 ≥ 10 μm; 103,4 mL−1 ≥ 25 μm), ce qui semble indiquer l’apparition d’une réaction quelconque, possiblement un dégazage, rendant le mélange incompatible.
Le métronidazole n’était pas compatible avec l’acétaminophène dans une autre étude puisque le mélange était jaunâtre au temps initial et qu’une augmentation de la turbidité est survenue une heure plus tard5. Dans la présente étude, une teinte jaunâtre a aussi été observée initialement, mais la monographie du métronidazole mentionne qu’elle est normale. Par ailleurs, il n’a pas été observé de changement de turbidité ou autre durant l’expérience, le nombre de particules étant sous la limite USP au temps initial (1,5 mL−1 ≥ 10 μm; 0,0 mL−1 ≥ 25 μm) et quatre heures plus tard (0,9 mL−1 ≥ 10 μm; 0,0 mL−1 ≥ 25 μm)32. Le métronidazole provenait de la même compagnie dans les deux études, mais l’acétaminophène était fabriqué par une compagnie différente avec des excipients différents, ce qui peut expliquer la divergence des résultats.
Le phénobarbital était également incompatible avec l’acétaminophène dans la littérature. Selon les résultats existants, des particules ont été observées par microscopie une heure et quatre heures après le mélange des deux médicaments5. En revanche, aucune particule n’était visible à l’æil nu dans la présente étude, et le décompte de particules respectait les seuils établis par la norme USP <788> 1.B au temps initial (14,1 mL−1 ≥ 10 μm; 10,9 mL−1 ≥ 25 μm) et quatre heures plus tard (17,3 mL−1 ≥ 10 μm; 11,5 mL−1 ≥ 25 μm). Quelques bulles ont été notées sur les parois après une heure et après quatre heures, mais il est plus probable qu’elles soient le résultat des manipulations que d’une réaction entre les deux produits. Le phénobarbital étant plutôt visqueux, plusieurs inversions ont été nécessaires pour obtenir un liquide homogène. Les bulles d’air étaient ainsi plus susceptibles de rester piégées dans la solution, comme observé durant l’expérimentation. Les excipients de l’acétaminophène et du phénobarbital étaient différents dans les deux études, ce qui peut également expliquer, encore une fois, les résultats contradictoires5. De plus, la température ambiante à laquelle les tests ont été effectués était plus élevée dans l’autre étude (de 24 à 28 °C), ce qui peut aussi influencer la compatibilité5.
Finalement, trois des médicaments à l’étude pour lesquels aucune donnée n’est disponible dans la littérature nécessitent des explications supplémentaires. Le lévosimendan a été considéré comme incompatible avec l’acétaminophène puisque le nombre de particules de 25 μm et plus au temps initial était supérieur à 30 mL−1 (60,5 mL−1). Cependant, le mélange était visuellement compatible, et les autres décomptes de particules respectaient la norme USP <788> 1.B (64,8 mL−1 ≥ 10 μm au temps initial; 20,9 mL−1 ≥ 10 μm et 18,0 mL−1 ≥ 25 μm après quatre heures). Comme le lorazépam, la grande viscosité du lévosimendan rend l’introduction de bulles d’air difficile à éviter. La majorité de ces bulles d’air demeurent ensuite en suspension dans le mélange, ce qui les rend très difficiles à éliminer et peut, en conséquence, causer des faux positifs à la lecture avec le compteur de particules. Par précaution, il a été décidé de considérer le lévosimendan comme incompatible pour le moment, mais plus de données sont nécessaires pour confirmer ce résultat. De plus, le produit utilisé était expiré depuis 16 mois au moment de l’étude, ce qui pourrait avoir eu une influence sur les résultats. L’emploi d’un médicament expiré s’explique par la difficulté d’approvisionnement. Seul ce médicament était expiré durant cette étude.
Le pantoprazole a été considéré comme compatible avec l’acétaminophène puisque le nombre de particules au temps initial (172,9 mL−1 ≥ 10 μm; 5,7 mL−1 ≥ 25 μm) et après quatre heures (11,9 mL−1 ≥ 10 μm; 0,2 mL−1 ≥ 25 μm) respectait les limites de la norme USP <788> 1. B. Un changement de couleur a été noté durant l’examen visuel. Initialement, le mélange était incolore, mais a pris une très légère teinte jaunâtre quasiment imperceptible après une heure. La monographie du pantoprazole précise que le produit peut avoir une très légère teinte jaune après reconstitution, mais aucun changement de couleur dans le temps n’est mentionné33. Étant donné la compatibilité au décompte de particules et la mention de la possible couleur jaunâtre dans la monographie du produit, il a été décidé de considérer le pantoprazole comme compatible avec l’acétaminophène.
L’imipénem-cilastatine n’a pu être évalué de façon satisfaisante durant l’étude, car la solubilité initiale de ce médicament, avant même le mélange avec l’acétaminophène, était très mauvaise. Des particules demeuraient en suspension malgré une dilution avec le volume d’eau stérile pour injection recommandé dans la monographie et un temps d’attente de 30 minutes après le mélange. Des particules étant toujours visibles après l’ajout de l’acétaminophène, le mélange a été déclaré incompatible sans lecture au compteur de particules. Une dilution supplémentaire serait nécessaire pour pouvoir évaluer correctement la compatibilité de ce médicament avec l’acétaminophène. Il en va de même de la cyclosporine dont le mélange contenait une grande quantité de bulles d’air. Nous avons préféré la considérer comme incompatible par précaution, mais nous croyons que des études plus poussées sont requises afin d’inclure des tests aux concentrations cliniques usuelles ou maximales, et à celles du protocole actuel.
Les résultats de l’étude montrent les forces et les faiblesses du compteur de particules. Cet appareil permet de confirmer les résultats de l’examen visuel et de détecter les incompatibilités non visibles à l’æil nu. Cependant, il peut donner de faux positifs, notamment à la suite de l’introduction de bulles d’air dans le mélange durant les manipulations. Les résultats doivent donc être interprétés avec précaution.
Parmi les 102 médicaments testés, 93 se sont avérés compatibles avec l’acétaminophène en injection dans un mélange à un ratio de 1:1 à concentration maximale, initiale ou originale des deux médicaments (sauf pour neuf antibiotiques à concentration légèrement différente). Cependant, les tests effectués ne montrent que la compatibilité physique, ce qui ne garantit pas la compatibilité chimique ni l’efficacité clinique des associations compatibles.
Les auteurs tiennent à remercier Mme Mihaela Friciu, conseillère principale de recherche, Plateforme de biopharmacie, Faculté de pharmacie, Université de Montréal pour son aide tout au long de l’élaboration des tests. Cette personne a donné son autorisation écrite.
Tout le matériel, y compris les médicaments et l’acétaminophène, a été fourni par le département de pharmacie du CHU Sainte-Justine.
Tous les auteurs ont soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts lié à cet article.
1. Lexicomp. Monographie de l’acétaminophène (16 octobre 2021). Pediatric and Neonatal Lexi-Drugs, 2021. [en ligne]. https://online.lexi.com/lco/action/doc/retrieve/docid/pdh_f/129791?cesid=6glmwJzFENo&searchUrl=%2Flco%2Faction%2Fsearch%3Fq%3Dacetaminophen%26t%3Dname%26va%3Dacetaminophen#usep (site visité le 19 octobre 2021).
2. Santé Canada. Base de données sur les produits pharmaceutiques. Version 3.9.0. (3 juillet 2021). [en ligne] https://produits-sante.canada.ca/dpd-bdpp/newSearch-nouvelleRecherche.do?lang=fr (site visité le 19 octobre 2021).
3. Micromedex Healthcare Series. Monographie de l’acétaminophène (12 octobre 2021). [en ligne] https://www.micromedexsolutions.com/micromedex2/librarian/PFDefaultActionId/evidencexpert.DoIntegratedSearch?navitem=topHome&isToolPage=true# (site visité le 19 octobre 2021).
4. Avir Pharma. Monographie de produit : acétaminophène injectable (13 mai 2019). [en ligne] https://www.avirpharma.com/pdf/Product-Monograph-AcetaInj.pdf (site visité le 19 octobre 2021).
5. Micromedex Healthcare series. Compatibilité intraveineuse de l’acétaminophène. [en ligne] https://www.micromedexsolutions.com/micromedex2/librarian/ssl/true/PFActionId/evidencexpert.ShowIVCompResults?resultType=ysite&selectedDrugs=Acetaminophen&refinedDrugs=Acetaminophen&navitem=ivTabysite (site visité le 19 octobre 2021).
6. Cadence Pharmaceuticals. Monographie de produit : acétaminophène injectable (OfirmevMD) (novembre 2010). [en ligne]. https://www.accessdata.fda.gov/drugsatfda_docs/label/2010/022450lbl.pdf (site visité le 19 octobre 2021).
7. B. Braun Medical. Monographie de l’acétaminophène (mars 2020). [en ligne] https://www.bbraunusa.com/en/products/b5/acetaminophen-injection.html (site visité le 19 octobre 2021).
8. Panmedica. Monographie du paracétamol. [en ligne]. http://mri.cts-mrp.eu/download/FR_H_0355_001_FinalPL.pdf (site visité le 19 octobre 2021).
9. Bristol-Myers Squibb Pharmaceuticals. Liste des excipients du perfalgan 10 mg/mL solution pour perfusion (21 mai 2021). [en ligne] https://www.medicines.org.uk/emc/product/60/smpc (site visité le 19 octobre 2021).
10. Norme USP <788> Particulate matter in injections. Dans: United States Pharmacopeia. USP 36. Rockville, MD; United States Pharmacopeia; 2021. p. 350–3.
11. Audet MA, Forest E, Friciu M, Forest JM, Leclair G. Compatibilité du citrate de caféine injectable avec plusieurs autres médicaments. Pharmactuel 2016;50:27–34.
12. Lessard JJ, Caron E, Schérer H, Forest JM, Leclair G. Compatibility of Y-site injection of meropenem trihydrate with 101 other injectable drugs. Hosp Pharm 2020; 55:332–7.


13. Côté K, Correal F, Metras ME, Friciu M, Forest JM, Leclair G. Compatibilité physique des médicaments administrés en Y aux soins intensifs, en particulier la dexmédétomidine, le lévosimendan et la kétamine. Pharmactuel 2019;52:206–13.
14. Audet MA, Thompson-Desormeaux F, Forest JM, Leclair G. Compatibilité du soluté Plasmalyte-A avec plusieurs autres médicaments pour une administration en Y. Pharmactuel 2020;54:28–34.
15. Fiche technique du compteur de particules dans les liquides LS-20 (Lighthouse Worldwide Solutions, Medford, Orégon, É.-U.). 2008; 2 pages.
16. Sullivan T, Forest JM, Leclair G. Compatibility of cloxacillin sodium with selected intravenous drugs during simulated Y-site administration. Hosp Pharm 2015; 50:214–20.


17. Manuel d’instruction du compteur de particules dans les liquides LS-20 (Lighthouse Worldwide Solutions, Medford, Orégon, É.-U.). 2008; 52 pages.
18. Vallée M, Barthélémy I, Friciu M, Pelletier E, Forest JM, Benoit F et coll. Compatibility of Lactated Ringer’s injection with 94 selected intravenous drugs during simulates Y-site administration. Hosp Pharm 2019; 56:228–34.

19. Ferreira E, Forest JM, Hildgen P. Compatibilité du dimenhydrinate injectable pour l’administration en Y. Pharmactuel 2004;37:17–20.
20. Péré H, Chassé V, Forest JM, Hildgen P. Compatibilité du pantoprazole injectable lors d’administration en Y. Pharmactuel 2004;37: 193–6.
21. Pelletier É, Forest JM, Hildgen P. Compatibilité de la kétamine injectable lors de l’administration en dérivé avec d’autres médicaments usuels. Pharmactuel 2006;39:71–5.
22. Pelletier É, Forest JM, Hildgen P. Compatibilité des mélanges de morphine et de kétamine ou d’hydromorphone et de kétamine injectables lors de leur administration en dérivé avec d’autres médicaments usuels. Pharmactuel 2007;40(suppl. 2):23–7.
23. Legris ME, Valiquette ME, Lavoie A, Forest JM, Leclair G. Compatibilité physique par évaluation visuelle du salbutamol injectable lors de son administration en Y. Pharmactuel 2011;44:14–8.
24. Tollec S, Touzin K, Pelletier É, Forest JM. Évaluation visuelle de la compatibilité physique de la naloxone avec d’autres médicaments intraveineux usuels. Pharmactuel 2013;46:16–22.
25. Forest JM, Hildgen P. Compatibilité de l’acétylcystéine injectable lors d’administration en Y avec d’autres médicaments usuels. Pharmactuel 2014;47:161–6.
26. Legris ME, Lavoie A, Forest JM, Hildgen P. Compatibilité par évaluation visuelle du thiopental injectable lors de son administration en Y avec des médicaments usuels. Pharmactuel 2014;47:167–72.
27. Guignard B, Gschwind L, Fonzo-Christe C. Les incompatibilités médicamenteuses en 2015 : encore une mission du pharmacien d’établissement de santé? Pharmactuel 2015;48:132–4.
28. Newton DW. Drug incompatibility chemistry. Am J Health Syst Pharm 2009; 66:348–57.

29. American Society of Health-System Pharmacists. Handbook on injectable drugs. 20e éd. Bethesda (MD): American Society of Health-System Pharmacists; 2018. 1465 pages.
30. Anderson C, Boehme S, Ouellette J, Stidham C, Mackay M. Physical and chemical compatibility of injectable acetaminophen during simulated y-site administration. Hosp Pharm 2014; 49:42–7.


31. Hanifah S, Nugroho B, Chabib L. Compatibility of acetaminophen with central nervous system medications during simulated Y-site injection. Anaesthesiol Intensive Ther 2020; 52:23–7.

32. Pfizer. Monographie du métronidazole injectable (septembre 2018). [en ligne] https://www.pfizer.ca/sites/default/files/201810/2018.09.18_Metronidazole_PM_E_218433.pdf (site visité le 19 octobre 2021).
33. Auro Pharma. Monographie du pantoprazole injectable (août 2019). [en ligne] http://www.auropharma.ca/products/monograph/Pantoprazole%20for%20Injection%20PM.pdf (site visité le 20 octobre 2021).
34. Trissel LA. Trissel’s tables of physical compatibility. 1re éd. Lake Forest: Multimatrix;1996. 590 pages.
35. King Guide Publications. King guide to parenteral admixtures: acetaminophen (2021). [en ligne] www.https://kingguide.com/index.html (site visité le 19 octobre 2021).
PHARMACTUEL, Vol. 55, No. 4, 2022