Anne-Sophie Martin, Pharm.D., M.Sc.1,2, Sylvie Plante, B.Pharm., M.Sc.1,2, Dominique Fréchette, B.Pharm., M.Sc.1,2, Sébastien Fortin, B.Sc., M.Sc., Ph.D.3,4
Reçu le 7 avril 2022: Accepté après révision par les pairs le 29 juillet 2022
Résumé
Objectifs : Le premier objectif est de décrire les médicaments utilisés pour induire et maintenir une sédation palliative chez des patients hospitalisés au Centre hospitalier universitaire de Québec–Université Laval et à la Maison Michel-Sarrazin. Le deuxième objectif est de détailler les doses sédatives employées selon les doses reçues avant la sédation et certaines caractéristiques des patients.
Méthode : Il s’agit d’une étude descriptive longitudinale et rétrospective menée chez 154 patients ayant reçu une sédation palliative entre le 10 décembre 2015 et le 30 septembre 2017.
Résultats : En moyenne, la durée de la sédation palliative était de 38,5 ± 35,6 heures. Les sédatifs les plus utilisés étaient le midazolam (79,2 %) et la méthotriméprazine (76,6 %). Les doses moyennes (mg/24 heures) au décès étaient supérieures aux doses initiales, tant pour les benzodiazépines (87,0 vs 44,8 en équivalent de midazolam) que pour la méthotriméprazine (134,1 vs 98,5). L’augmentation était statistiquement significative dès les 24 premières heures, où plus de 50 % des patients ont eu besoin minimalement d’un changement de dose. Le sous-groupe présédation en équivalent de midazolam inférieur à 7,5 mg/24 heures a subi la hausse la plus marquée. L’utilisation de doses présédation égales ou supérieures à 30 mg/24 heures en équivalent de midazolam entraînait significativement des doses de benzodiazépines supérieures au moment du décès. Les patients de moins de 75 ans avaient besoin de doses plus élevées tandis que ceux atteints d’un cancer recevaient plus de sédatifs.
Conclusion : Une optimisation des doses sédatives initiales semble indiquée, mais il faut envisager l’influence de certains facteurs (âge, dose sédative présédation). Un outil guidant la prescription, qui comprend une échelle d’évaluation de l’efficacité, s’avère essentiel.
Mots-clés : Benzodiazépines, méthotriméprazine, midazolam, sédation palliative continue
Abstract
Objective : The primary objective is to describe the drugs used to induce and maintain palliative sedation in patients hospitalized at the Centre hospitalier universitaire de Québec–Université Laval and at the Maison Michel-Sarrazin. The secondary objective is to detail the sedative doses used according to the doses received before sedation and certain patient characteristics.
Method : This was a longitudinal, retrospective, descriptive study of 154 patients who received palliative sedation between December 10, 2015 and September 30, 2017.
Results : On average, the duration of palliative sedation was 38.5 ± 35.6 hours. The most commonly used sedatives were midazolam (79.2%) and methotrimeprazine (76.6%). The mean doses (mg/24 hours) at the time of death were higher than the initial doses for both benzodiazepines (87.0 vs. 44.8 in midazolam equivalent) and methotrimeprazine (134.1 vs. 98.5). The increase was statistically significant as early as the first 24 hours, when more than 50% of the patients required at least one dose change. The subgroup with presedation in midazolam equivalent less than 7.5 mg/24 hours had the largest increase. The use of presedation doses greater than or equal to 30 mg/24 hours in midazolam equivalent resulted in significantly higher benzodiazepine doses at the time of death. Patients under 75 years of age required higher doses, while those with cancer received more sedatives.
Conclusion : Optimizing initial sedative doses appears to be indicated, but the influence of certain factors (age, presedation sedative dose) should be considered. A prescribing guidance tool that includes an efficacy rating scale is essential.
Keywords : Benzodiazepines, continuous palliative sedation, methotrimeprazine, midazolam
La sédation palliative, une pratique mentionnée pour la première fois dans la littérature dans les années 1990, est encadrée par une loi au Québec depuis décembre 20151–3. Elle est définie comme l’administration de médicaments ou de substances dans un contexte de soins palliatifs à une personne en fin de vie dans le but de soulager ses souffrances en la rendant inconsciente, de façon continue, jusqu’à son décès2. Le caractère réfractaire d’un symptôme en fin de vie est déterminé par une équipe multidisciplinaire, de concert avec le patient et/ou ses proches, et est décrit comme l’échec à soulager ce symptôme malgré les multiples essais thérapeutiques considérés comme réalistes (tolérables et dans un délai approprié)1,3–14. En dernier recours, l’abaissement du niveau de conscience devient la seule modalité envisageable pour soulager le patient4,5,8–11,15,16. Les indications souvent mentionnées dans la littérature sont l’agitation terminale, la dyspnée, la douleur et l’anxiété3,7,8,10–14,16–19.
Cette pratique est de plus en plus fréquente au Québec depuis vingt ans, mais sa prévalence semble difficilement mesurable4,18. Selon la littérature internationale, le recours à la sédation palliative chez les patients en fin de vie est très variable (de 1 % à 52 %, 72 % et de 2 % à 10 %), car sa définition change grandement7,11,12,19,20. En 2008, une unité de soins palliatifs d’Ottawa a signalé un taux d’utilisation de 20,4 % (comprenant les sédations légères)19. Pour des considérations éthiques et méthodologiques, les seules études sur la sédation palliative accessibles et publiées dans la littérature consultée sont de nature descriptive, majoritairement rétrospective et principalement menées auprès de patients atteints d’un cancer8,16. Les recommandations émanant de ces études reposent sur des preuves de niveau IV ou V et il ne semble donc pas y avoir de consensus international sur cette pratique1,8. Au Québec, le guide d’exercice du Collège des médecins du Québec intitulé La sédation palliative en fin de vie, publié en 2016 et en cours de révision, encadre cette pratique4. Un formulaire de déclaration de la sédation continue est disponible au CHU de Québec–Université Laval, comme le prévoit la loi.
Selon la littérature, l’agent sédatif employé est sélectionné empiriquement puisque la supériorité d’un médicament par rapport à un autre n’a pas été établie1,3,8,11,21. Il est également suggéré de se fier aux symptômes réfractaires à soulager pour choisir la classe de médicaments la plus appropriée et de privilégier des agents à durée d’action allant d’intermédiaire à longue en cas d’administration intermittente1,3,8,21. En outre, il est conseillé d’utiliser un agent possédant plusieurs propriétés pharmacologiques lorsque le patient présente de multiples symptômes afin de restreindre le nombre de médicaments administrés4. Il est recommandé de diminuer le niveau de conscience pour soulager les symptômes réfractaires1,8,10,11,14,17,21. Ainsi, il faut augmenter la dose d’un sédatif de façon sécuritaire selon son efficacité (dose minimale efficace) à soulager les symptômes réfractaires du patient et à maintenir la sédation à un niveau déterminé, tout en limitant le recours à doses excessives pouvant occasionner des effets indésirables1,4,6–8,10–14,21. Il faut, bien entendu, tenir compte du caractère urgent de certaines situations où l’atteinte rapide du confort du patient nécessite des ajustements plus intenses. Les agents privilégiés par les cliniciens pour la sédation palliative sont les benzodiazépines (midazolam et lorazépam) et la méthotriméprazine1,5,10,11,14,21,22. En avril 2022, l’Institut national d’excellence en santé et en services sociaux (INESSS) a publié un protocole médical national afin de soutenir les cliniciens lors de l’administration de la sédation palliative continue chez l’adulte en fin de vie21.
Au moment de l’étude, la sédation palliative n’était pas guidée ni encadrée par des protocoles uniformes au CHU de Québec–Université Laval et à la Maison Michel-Sarrazin. Par conséquent, les types de sédatifs et les doses employés pouvaient varier selon les prescripteurs et les milieux. Plusieurs ajustements apportés aux médicaments utilisés sont parfois nécessaires à l’obtention d’un degré optimal de sédation palliative assurant le confort du patient. Il faut savoir qu’une sédation palliative sous-optimale compromet le soulagement du patient, une expérience pénible qui alimente aussi la détresse des proches et de l’équipe traitante (perception d’échec)4,8,10. Pour toutes ces raisons, il est important de décrire l’état de la situation afin de déterminer si des changements dans la pratique actuelle sont nécessaires pour atteindre rapidement un niveau de sédation satisfaisant. De plus, il existe peu de données sur les facteurs susceptibles d’influencer le choix des agents sédatifs et des doses afin d’aider le prescripteur. Dans ce contexte, l’identification de ces facteurs est essentielle pour l’obtention d’une sédation palliative optimale individualisée.
Cette étude a donc pour objectif principal de décrire les médicaments utilisés pour induire et maintenir une sédation palliative chez des patients hospitalisés au CHU de Québec–Université Laval et à la Maison Michel-Sarrazin entre décembre 2015 et septembre 2017. De façon secondaire, cette étude vise à décrire la diversité d’agents et de doses employés pour la sédation palliative selon diverses caractéristiques des patients (diagnostic de la maladie terminale, âge et exposition à des sédatifs en présédation).
Une étude descriptive, rétrospective et multicentrique de population longitudinale a été menée auprès de patients ayant reçu une sédation palliative au CHU de Québec–Université Laval et à la Maison Michel-Sarrazin entre le 10 décembre 2015 et le 30 septembre 2017. Pour faire partie de l’étude, les patients devaient respecter les critères d’inclusion suivants : 1) avoir 18 ans ou plus au moment de la sédation; et 2) avoir un formulaire signé de consentement à la sédation palliative continue. Le comité d’éthique du CHU de Québec–Université Laval n’a émis aucune objection quant à la tenue de ce projet rétrospectif. Les directions des services professionnels du CHU de Québec–Université Laval et de la Maison Michel-Sarrazin ont permis l’accès aux dossiers. Les services des archives des centres participants ont effectué l’échantillonnage par recensement des formulaires de consentement aux dossiers des patients durant la période désignée. Après une première sélection des sujets, ceux dont la sédation palliative a été administrée autrement que par voie sous-cutanée ou intraveineuse ont été exclus de l’étude.
La chercheuse principale a effectué une collecte de données rétrospective de quatre semaines de juin à juillet 2018 à partir des dossiers patients électroniques contenus dans les archives (DPE–Logiciel Cristal-Net) du CHU de Québec–Université Laval et des dossiers patients archivés en format papier de la Maison Michel-Sarrazin. Pour y arriver, un outil de collecte de données a été élaboré. Celui-ci a été adapté dans le logiciel Microsoft Excel pour faciliter l’analyse statistique des données.
Les variables de l’étude ont été séparées en quatre classes distinctes énumérées ci-dessous. Pour faciliter la lecture, celles mesurées après le premier 24 heures et après le deuxième 24 heures de la sédation palliative sont notées respectivement comme étant au jour 1 et au jour 2.
L’âge, le poids, le sexe, la présence d’une atteinte pulmonaire, le diagnostic de maladie terminale (cancer, insuffisance cardiaque, maladie pulmonaire obstructive chronique ou autre) et les symptômes ayant mené à la sédation palliative mentionnés sur le formulaire provincial de consentement à la sédation palliative continue (délirium hyperactif avec agitation psychomotrice incontrôlable, détresse respiratoire majeure et récidivante, dyspnée progressive et incontrôlable, convulsions réfractaires, douleur intraitable et intolérable, sécrétions bronchiques très abondantes et réfractaires, détresse hémorragique, nausées et vomissements incoercibles, détresse psychologique ou existentielle réfractaire qui compromet gravement l’atteinte du confort et/ou autre état réfractaire) ont été recueillis.
Le consentement et le milieu hospitalier ont été collectés.
Le nom du médicament ainsi que la dose (mg/24 h) au début de la sédation palliative ont été colligés.
Parmi celles-ci, on retrouve les variables suivantes : médicament utilisé (lorazépam, midazolam, méthotriméprazine, phénobarbital et/ou propofol); voie et mode d’administration; dose (initiale, jour 1, au décès); nombre de sédatifs (à l’instauration, au décès); nombre de changements de dose de benzodiazépine et/ou de méthotriméprazine (jour 1, jour 2); narcotique concomitant et sa dose (à l’instauration, au décès); présence de scopolamine et sa dose (à l’instauration, au décès); durée totale de la sédation palliative.
Dans l’étude, le début de la sédation palliative a été considéré comme officiel lors de l’obtention d’un consentement signé. La dose initiale pour chacun des agents correspondait à la dose totale (mg/24 h) prévue que le patient aurait reçu au cours de la première journée de sédation palliative en tenant compte du fait que la posologie (débit de perfusion ou dose intermittente régulière) serait demeurée la même pendant cette période. De plus, le cas échéant, les doses des bolus prévus la première journée ont été ajoutées à celle-ci. La dose au jour 1, pour chacun des agents, correspondait à la dose totale (mg/24 h) réellement reçue par le patient pendant la première journée de sédation palliative. Elle a été calculée par l’addition des doses reçues chaque heure au cours des 24 premières heures. Ainsi, pour chaque médicament, les débits de perfusion continue, les doses régulières et les entre-doses données ont été considérés. Pour les patients dont la durée de sédation palliative était inférieure à 24 h, les doses de sédatifs en mg/h (selon la durée réelle) ont été extrapolées pour obtenir une dose en mg/24 h. Enfin, la dose au moment du décès pour chacun des agents correspondait à la dose totale (mg/24 h) que le patient aurait reçu au cours de la prochaine période de 24 h en considérant que les débits de perfusion et les doses régulières seraient demeurés les mêmes qu’au moment du décès. Un facteur d’équivalence de 1 mg de lorazépam pour 2,5 mg de midazolam a été utilisé pour regrouper les doses de benzodiazépines en un seul groupe d’équivalent de midazolam, selon un ratio de 1:1 (voie orale : voie sous-cutanée ou intraveineuse)3. Le degré d’efficacité de la sédation palliative n’a pas été noté, car aucune échelle standardisée n’était employée à ces fins dans les milieux à l’étude.
Des statistiques descriptives et comparatives ont été compilées pour représenter les différentes caractéristiques de l’échantillon. Ainsi, les variables qualitatives ont été exprimées en proportion tandis que les variables quantitatives (continues ou discrètes) ont plutôt été décrites sous forme de mesures de tendance centrale (moyenne, médiane) et de dispersion (écart type, écart interquartile). Les analyses statistiques ont été exécutées à l’aide du logiciel SPSS 25.0. Le test t de Student a servi à comparer les moyennes, et le test du Chi carré, à comparer les proportions. Le test d’analyse de la variance (ANOVA) a également été utilisé. Enfin, les modèles multivariés de régression linéaire généralisée ont été ajustés pour estimer les effets des différentes caractéristiques sur les variables continues. Le seuil de significativité statistique a été fixé à une valeur p inférieure ou égale à 0,05.
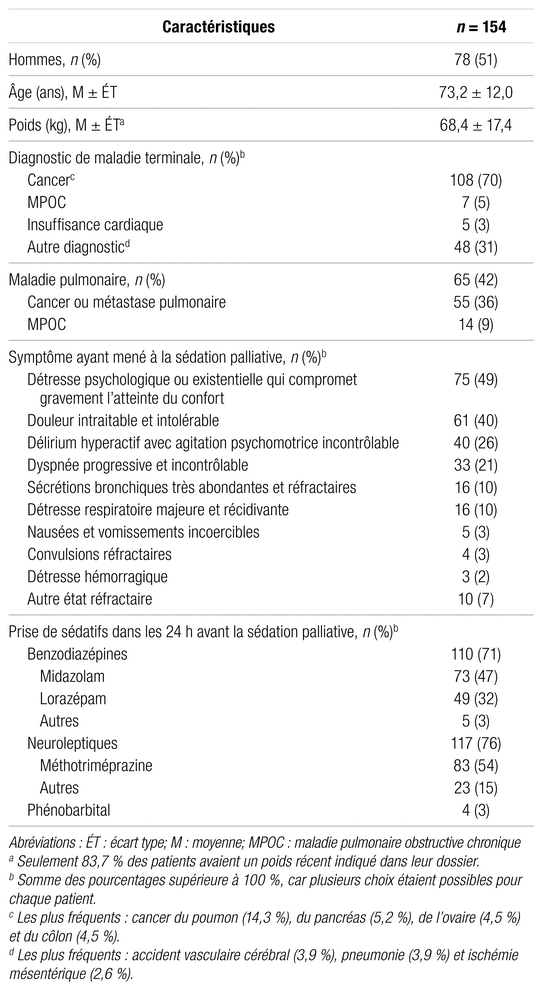
Sur les 182 patients recensés, neuf ne satisfaisaient pas aux critères d’inclusion et 19 avaient des données incomplètes (doses et agents utilisés). Le tableau I présente les principales caractéristiques des 154 patients inclus dans l’étude ainsi que leur exposition à des sédatifs en présédation. Le cancer était le diagnostic de maladie terminale le plus fréquent. La sédation palliative a été commencée en présence d’un (42,7 %) ou de deux (42,0 %) symptômes réfractaires dans la majorité des cas. Les symptômes les plus fréquents, indiqués par le médecin sur la feuille de déclaration de la sédation palliative et ayant mené à son instauration, étaient : une détresse psychologique ou existentielle réfractaire, une douleur intraitable et intolérable, un délirium hyperactif avec agitation psychomotrice incontrôlable et une dyspnée progressive et incontrôlable. Il est à noter que 71,4 % des patients prenaient déjà une benzodiazépine au moment de débuter la sédation palliative. Les molécules les plus courantes étaient le midazolam (47,4 % des patients) à une dose moyenne de 23,5 mg/24 h et le lorazépam (31,8 % des patients) à une dose moyenne de 2,3 mg/24 h. En ce qui concerne les neuroleptiques, 76,0 % des patients en recevaient de façon régulière. La méthotriméprazine était donnée à 53,9 % des patients, à raison de 38,0 mg/24 h en moyenne.
Tableau I Caractéristiques des patients

Au total, 47 médecins ont été les prescripteurs des 154 sédations palliatives dans l’ensemble des installations du CHU de Québec–Université Laval (84 %) et à la Maison Michel-Sarrazin (16 %). Le tableau II détaille les caractéristiques principales de la sédation palliative, dont la durée moyenne était de 38,5 ± 35,6 h. Au moment du décès, le midazolam et la méthotriméprazine étaient les sédatifs les plus employés.
Tableau II Caractéristiques de la sédation palliative
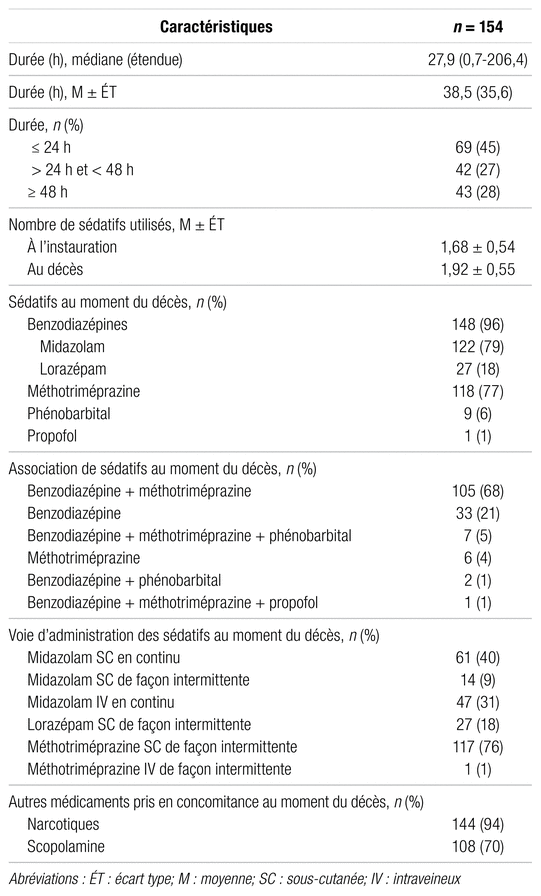
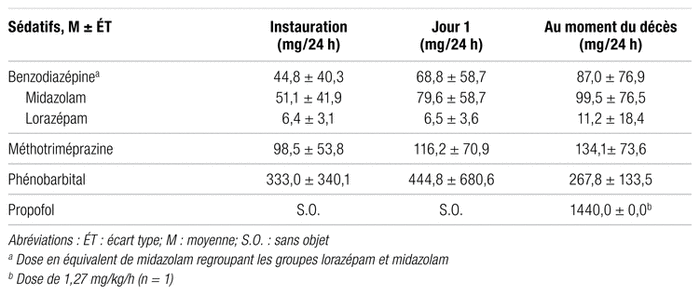
Le tableau III présente les doses moyennes des sédatifs utilisés. Les doses de lorazépam ont été converties en équivalent de midazolam et regroupées avec les doses de midazolam afin de former un seul groupe de sédatif, soit celui des benzodiazépines. Au décès, les doses moyennes de benzodiazépines et de méthotriméprazine étaient respectivement de 87,0 ± 76,0 mg/24 h et de 134,1 ± 73,6 mg/24 h. Un bolus de midazolam a été injecté au début de la sédation palliative chez 39 patients (37,5 %). Au jour 1, la majorité des patients ont eu besoin d’au moins une modification de la dose de benzodiazépine (56,9 %) ou de méthotriméprazine (51,6 %). Le nombre moyen de changements de dose de sédatifs était de 1,56 ± 1,45. Dans le cas des benzodiazépines, les doses initialement prévues semblaient adéquates chez 12,6 % des patients, tandis que 80,1 % des patients ont eu besoin d’une hausse de la dose dès le jour 1. Pour la méthotriméprazine, 17,2 % des patients semblaient avoir reçu une dose initiale satisfaisante contre 68,0 % des patients qui ont eu une augmentation au jour 1. Après le jour 1, le nombre moyen de changements de dose de sédatifs a diminué à 0,80 ± 1,09.
Tableau III Doses des sédatifs lors de la sédation palliative
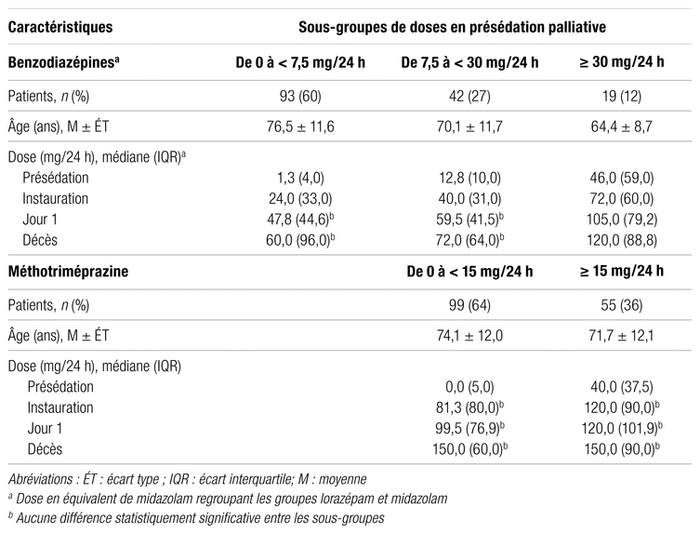
Les doses de sédatifs utilisées durant la sédation palliative ont été comparées en fonction de sous-groupes préétablis selon la prise d’agents sédatifs en présédation. Le tableau IV présente ces résultats, ainsi que l’évolution dans le temps des doses de sédatifs selon ces mêmes sous-groupes. La valeur de p a été calculée entre les doses de sédatifs de chaque sous-groupe pour certains moments précis de la sédation palliative. Pour les benzodiazépines, aucune différence statistiquement significative n’a été identifiée dans les doses des deux sous-groupes pour lesquels la dose présédation était inférieure à 30 mg/24 h, et ce, autant au jour 1 (valeur de p = 0,1073) qu’au décès (valeur de p = 1,0000). Cependant, une différence statistiquement significative a été notée lorsque les doses de ces deux mêmes sous-groupes ont été comparées à celles du sous-groupe égal ou supérieur à 30 mg/24 h, et ce, du début de la sédation palliative jusqu’au décès. Quant à la méthotriméprazine, aucune différence statistiquement significative dans les doses utilisées n’a été révélée, que ce soit à l’instauration (valeur de p = 0,2282), au jour 1 (valeur de p = 0,4753) ou au décès (valeur de p = 0,2565), en ce qui a trait aux sous-groupes de dose de sédatifs en présédation.
Tableau IV Description des doses de sédatifs utilisées lors de la sédation palliative selon leur dose en présédation palliative
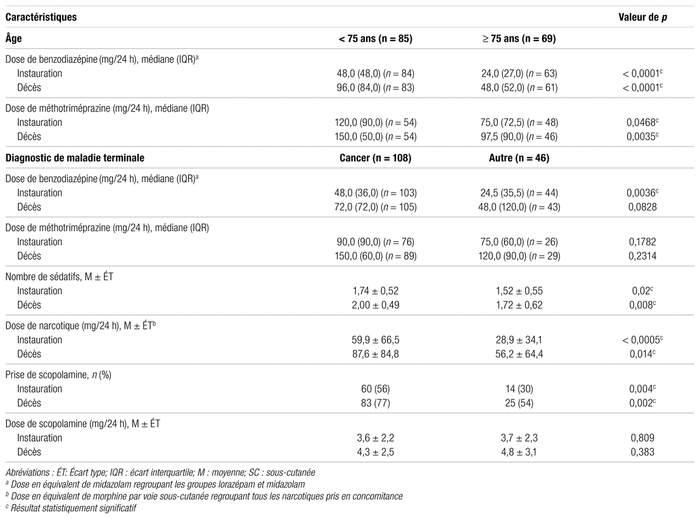
L’influence de certaines caractéristiques des patients (par ex. : âge et diagnostic de maladie terminale, comme le cancer) sur les doses de certains médicaments reçus lors de la sédation palliative est détaillée dans le tableau V. De façon statistiquement significative, les doses initiales de benzodiazépines et de méthotriméprazine et celles au décès étaient plus élevées chez les patients plus jeunes (moins de 75 ans). De plus, en présence de cancer, le nombre de sédatifs était significativement augmenté, autant à l’instauration de la sédation palliative qu’au décès.
Tableau V Comparaison des doses de médicaments utilisés (sédatifs et autres) selon l’âge des patients et le diagnostic de maladie terminale
Cette étude avait pour objectif de décrire les médicaments servant à induire et à maintenir une sédation palliative au CHU de Québec–Université Laval et à la Maison Michel-Sarrazin. Elle tentait aussi d’établir certaines caractéristiques des patients pouvant influencer le choix ou la dose de sédatif. Durant la période à l’étude, les principaux symptômes réfractaires ayant mené à la sédation palliative étaient semblables à ceux répertoriés dans la littérature, soit la douleur, le délirium (avec agitation psychomotrice), la dyspnée et la détresse psychologique3,7,8,12,13,16–19,21,23. La durée de la sédation palliative était courte, mais correspondait tout de même à celle de la littérature, soit d’un à six jours4,8,16,19,24–27. Une des hypothèses formulées pour expliquer cette courte durée est que la détérioration de l’état clinique de certains patients était plus avancée au moment de la signature du formulaire de consentement indiquant le début officiel de la sédation palliative. En effet, les doses moyennes d’agents sédatifs en présédation peuvent être considérées comme élevées (23,5 mg/24 h de midazolam et 38,0 mg/24 h de méthotriméprazine) au point où elles peuvent s’apparenter aux doses utilisées en sédation palliative chez certains patients et donc constituer la manifestation d’une détérioration avancée de l’état clinique.
Le choix des principaux agents sédatifs employés dans l’étude était comparable aux recommandations, soit une benzodiazépine en association ou non avec la méthotriméprazine1–3,4,21,22. Étant donné que 74,7 % des patients recevaient une association de sédatifs au moment du décès, la monothérapie semblait insuffisante pour atteindre une sédation palliative continue que les prescripteurs jugeaient acceptable. L’agent sédatif et la dose étant laissés à la discrétion du médecin, il est impossible de tirer des conclusions sur la raison expliquant les associations utilisées puisque plusieurs variables (dose maximale atteinte, état du patient, etc.) influençant le choix n’ont pu être analysées. De plus, l’absence de données comparatives dans la littérature sur la fréquence et la nature des associations d’agents sédatifs ne permet pas d’élucider le choix des prescripteurs. Les différentes recommandations sur la prescription de la sédation palliative privilégient habituellement l’administration de sédatifs par voie sous-cutanée pour favoriser le confort du patient3,4,28. Certains guides de pratique n’émettent toutefois pas d’opinion sur la voie d’administration à favoriser10,11,14. La voie intraveineuse a été employée chez environ le tiers des patients, en grande majorité pour le midazolam. Ce choix pourrait s’expliquer par la préférence de certains prescripteurs, la facilité d’accès à la voie intraveineuse ou l’inefficacité de la voie sous-cutanée. Cependant, les notes au dossier étaient insuffisantes pour en établir les raisons exactes.
Des recommandations sont aussi émises quant aux doses de sédatifs nécessaires durant la sédation palliative. Il est à noter qu’une comparaison directe avec les lignes directrices doit être nuancée, car les doses recommandées sont souvent en contexte de monothérapie alors que dans l’étude actuelle, 74,6 % des patients recevaient une association d’agents sédatifs. Dans l’étude, la dose moyenne initiale de midazolam était au moins le double de celle suggérée (4,8 à 24,0 mg/24 h) alors que dans le cas de la méthotriméprazine, elle était minimalement de 1,3 à 4,0 fois supérieure à celle recensée dans la littérature (12,5 à 75,0 mg/24 h)3,4,6,8,10–12,14. Comme il a été mentionné auparavant, ces résultats pourraient être attribuables en partie à l’hypothèse d’une détérioration plus avancée de l’état clinique des patients de l’étude au moment où la sédation palliative était commencée par rapport à la littérature, ce qui peut constituer une limite à l’interprétation des doses initiales. Il est probable que d’autres facteurs non collectés dans cette étude rétrospective puissent également influencer cette donnée. Les doses de ces sédatifs au jour 1 et au décès étaient aussi plus élevées que les doses moyennes jugées efficaces dans la littérature (de 10 à 70 mg/24 h pour le midazolam et de 30 à 100 mg/24 h pour la méthotriméprazine), mais dans une moindre mesure3,4,6,8,12,19,22,25,27,29. Certaines recommandations proposent des intervalles posologiques comportant des doses maximales plus élevées, mais dans un contexte de monothérapie10,11,14.
Ces constatations semblent indiquer la nécessité de réviser les guides de pratique sur les doses initiales émanant de la littérature. En effet, à priori, les doses initiales recommandées pourraient être insuffisantes et engendrer davantage de hausses des doses de sédatifs. Il faut toutefois noter que sans collecte de données directes de l’efficacité, ces conclusions demeurent des hypothèses. De plus, bien que les doses initiales de sédatifs de l’étude aient été en moyenne supérieures à celles suggérées dans la littérature scientifique, elles ont majoritairement dû être augmentées dès le jour 1 pour atteindre, voire surpasser, les doses moyennes efficaces recommandées au moment du décès. Même si l’objectif de l’étude n’était pas d’évaluer l’efficacité directe de la sédation palliative à l’aide d’une échelle objective, il est possible d’émettre l’hypothèse que la dose d’un sédatif était augmentée quand les symptômes réfractaires du patient n’étaient pas adéquatement soulagés. Suivant cette hypothèse, on peut se demander s’il est éthiquement acceptable de soumettre le patient à des changements de doses dès le début de la sédation palliative, sachant qu’un délai dans l’atteinte d’un degré de sédation satisfaisant pourrait augmenter son inconfort et celui de son entourage. Ce délai pourrait aussi être plus grand si le personnel infirmier doit contacter le prescripteur chaque fois qu’une augmentation de dose est requise. Conséquemment, en considérant la courte durée moyenne de la sédation palliative dans l’étude, il est possible de se demander si les doses initiales de sédatifs devraient plutôt tendre vers celles atteintes 24 heures après son début. D’ailleurs, dans le protocole médical récemment publié (avril 2022), les doses initiales proposées par l’INESSS sont de 2 à 5 mg/h pour le midazolam et de 75 à 150 mg/24 h pour la méthotriméprazine. Ces données corroboreraient le fait que des doses plus élevées s’avèrent nécessaires dans un contexte où la monothérapie est rare et que le choix des agents en bithérapie doit s’effectuer selon le ou les symptômes réfractaires et le traitement médicamenteux concomitant21. Enfin, l’analyse des doses de phénobarbital et de propofol a été impossible en raison du faible nombre de patients en recevant durant l’étude, leur utilisation étant probablement réservée aux cas réfractaires aux autres modalités de traitement.
Selon les résultats de l’étude, les doses initiales de benzodiazépines et de méthotriméprazine semblaient varier en fonction des doses sédatives reçues en présédation palliative. En effet, il a pu sembler logique pour les prescripteurs de commencer par des doses plus faibles de sédatifs chez les patients n’en ayant jamais pris et par des doses plus élevées chez ceux qui avaient reçu des doses substantielles en présédation. Selon les données recueillies, le recours à des doses supérieures dès le début de la sédation palliative serait nécessaire uniquement chez les grands consommateurs de benzodiazépines (≥ 30 mg d’équivalent de midazolam/24 h). En effet, 24 heures après le début de la sédation palliative, un débit avoisinant 4 mg/h d’équivalent de midazolam a été observé chez ces derniers comparativement à approximativement 2 mg/h chez les plus petits consommateurs (< 30 mg d’équivalent de midazolam/24 h), une différence qui perdurerait jusqu’au décès. De plus, les résultats de l’étude semblent indiquer que les deux sous-groupes de patients ayant des doses inférieures à 30 mg/24 h d’équivalent de midazolam en présédation devraient être considérés comme un seul groupe pour estimer les besoins en benzodiazépines. En effet, une augmentation plus marquée des doses dès le premier jour de la sédation palliative dans le sous-groupe consommant le moins de benzodiazépines en présédation (< 7,5 mg/24 h d’équivalent de midazolam) fait en sorte que les besoins en sédatifs de ces derniers rejoignent ceux du groupe intermédiaire (de 7,5 à < 30 mg/24 h d’équivalent de midazolam) au jour 1 et au décès. Par conséquent, une dose initiale supérieure dans ce sous-groupe semblerait souhaitable pour atteindre plus rapidement le degré de sédation désiré.
À la lumière de ces résultats, il pourrait être suggéré de commencer la sédation palliative des patients consommant moins de 30 mg/24 h d’équivalent de midazolam (12 mg/24 h de lorazépam) à la même dose de benzodiazépines. Cette tendance a aussi été observée dans une étude française où une exposition antérieure au midazolam engendrait le recours à une dose plus élevée de midazolam de l’instauration de la sédation palliative jusqu’au décès26.
Quant à la méthotriméprazine, le prescripteur semblait moins influencé par les doses reçues en présédation lorsqu’il évaluait la dose initiale nécessaire, étant donné l’absence de différence significative entre les doses reçues dans les deux sous-groupes dès le début de la sédation palliative. Le fait que les patients recevaient la même dose de méthotriméprazine au moment du décès, peu importe la dose reçue en présédation ou au début de la sédation, demeure sans explication évidente. L’analyse d’un sous-groupe exposé à des doses très élevées de méthotriméprazine en présédation n’a pu avoir lieu en raison de la petite taille de l’échantillon. De plus, l’influence de l’exposition à d’autres antipsychotiques dans les 24 heures précédant la sédation palliative n’a pas pu être considérée étant donné l’absence de dose équivalente établie dans ce contexte, ce qui constitue une limite de l’étude. L’évolution clinique du patient est aussi possiblement un facteur d’influence non négligeable, mais non mesurable, des modifications des doses utilisées lors de la sédation palliative. D’ailleurs, l’impossibilité d’analyser son effet sur les médicaments sédatifs nécessaires fait également partie des limites de l’étude.
Par ailleurs, les résultats de l’étude ont permis de déterminer certaines caractéristiques qui méritent une attention particulière lors de la prescription de la sédation palliative afin de mieux en jauger les répercussions sur les doses de sédatifs nécessaires. En effet, les patients de moins de 75 ans consommaient significativement plus de benzodiazépines et de méthotriméprazine dès le début de la sédation palliative, et ce, jusqu’au décès. Par conséquent, une dose initiale plus élevée serait sans doute préférable chez les plus jeunes patients afin d’atteindre plus rapidement un degré adéquat de sédation. En outre, la littérature actuelle ne comporte pas de recommandations différentes quant au choix de sédatif et de dose à privilégier selon le diagnostic de la maladie terminale, notamment selon la présence ou l’absence de cancer. D’ailleurs, le diagnostic de cancer ne semble pas avoir influencé les doses de sédatifs au moment du décès du patient. Cependant, le nombre de sédatifs employés était significativement plus élevé chez ces patients, tant à l’instauration qu’au décès. Une des hypothèses pouvant expliquer cette tendance est que le cancer s’accompagne souvent de différents types de symptômes réfractaires nécessitant l’association d’agents aux propriétés complémentaires3. De plus, comparativement aux autres patients, ceux atteints de cancer avaient besoin significativement de doses plus élevées d’opioïdes et d’un recours accru à la scopolamine. Ces deux médicaments peuvent aussi occasionner de la sédation et donc contribuer indirectement à la sédation palliative. Quoique leur utilisation plus importante chez les patients atteints de cancer n’ait pas été analysée dans l’étude, elle pourrait expliquer l’absence de différence significative dans les doses de sédatifs au décès par rapport à ceux qui n’avaient pas le cancer. Une des limites de l’étude est d’ailleurs qu’aucune analyse de l’effet sur les doses de sédatifs de certains médicaments pris de façon concomitante n’a été effectuée. Il faut noter que le protocole médical national de l’INESSS inclut la scopolamine dans les choix d’agents pharmacologiques en sédation palliative, contrairement aux autres recommandations, mais il n’est pas suggéré de l’utiliser en monothérapie21.
Le peu d’études existantes sur la sédation palliative et l’analyse de facteurs pouvant influencer sa prescription (par ex. : exposition à des sédatifs en présédation, cancer et âge du patient) renforcent l’aspect novateur de cette étude. Ses résultats peuvent facilement être extrapolés à plusieurs patients, car ils reflètent une pratique diversifiée, que ce soit en raison du nombre élevé de prescripteurs de différents milieux, de la grande quantité de dossiers évalués et de la représentation adéquate de différents diagnostics de maladie terminale (70 % de cancer et 30 % d’une autre maladie). En outre, l’utilisation d’analyses multivariées dans le but d’évaluer l’effet de certains facteurs d’influence (âge, cancer, etc.) sur la sédation palliative, une fois les principales variables confondantes éliminées, constitue l’un des points forts de l’étude.
Comme toute étude, la présente comporte certaines limites, outre celles susmentionnées. D’abord, son aspect rétrospectif fait en sorte qu’il manquait des données pour certains patients. Cependant, puisque cela ne représentait pas une grande proportion des patients, l’effet sur les résultats était probablement mineur. De plus, l’étude comptait des prescripteurs ayant des expériences variables en sédation palliative, ce qui a pu influencer le choix des sédatifs et des doses. Étant donné qu’il était impossible de déterminer avec certitude le début officiel de la sédation palliative, cette donnée a été établie à la signature du formulaire de consentement, ce qui a pu se répercuter sur les doses utilisées et la durée réelle de la sédation. Les doses de benzodiazépines antérieures aux 24 heures avant l’instauration de la sédation palliative n’ont pas été notées. Il est donc impossible de déterminer l’influence de certains facteurs (par ex. : durée d’exposition à ces doses) sur la réponse du patient à la sédation. De plus, même si ce n’était pas l’objectif initial, l’absence d’une échelle uniforme objective pour mesurer l’efficacité de la sédation palliative de son instauration jusqu’au décès demeure une lacune très importante, l’efficacité de la sédation étant interprétée indirectement de façon subjective dans l’étude. Il est donc impossible de supposer que les degrés de sédation et d’éveil avant le début de la sédation palliative et au moment du décès étaient similaires ou non pour chacun des patients. Par conséquent, la comparaison entre les patients et avec les données de la littérature devient difficile. Quoiqu’il n’existe pas d’échelle validée spécifique pour l’évaluation de l’efficacité de la sédation palliative, l’échelle d’agitation-sédation de Richmond (RASS) ou une version modifiée pour les soins palliatifs (RASS-PAL) peut être utilisée9–11,14,21,30. De plus, étant donné le recours possible à la sédation palliative parfois en cas de douleur réfractaire, ce symptôme pourrait aussi être évalué à l’aide d’un outil approprié comme la Nociception Coma Scale (NCS) ou l’échelle comportementale d’évaluation de la douleur9,21. Ainsi, il faut interpréter les recommandations faisant suite aux résultats de l’étude en considérant cette limite. Bien entendu, une étude sur l’efficacité de la sédation palliative à l’aide d’une échelle de sédation reconnue, comme les deux mentionnées plus tôt, permettrait de confirmer les résultats de l’étude actuelle9,30. Aussi, étant donné les durées variables des sédations palliatives, le recours à l’extrapolation des données sur 24 heures aux fins d’analyses statistiques a pu surestimer ou sous-estimer le résultat obtenu. Cependant, à priori, cette extrapolation était la meilleure façon de comparer les patients. Par ailleurs, l’équivalence reconnue des doses de midazolam et de lorazépam n’est pas uniforme dans la littérature. L’effet sur les résultats est probablement négligeable puisqu’il touche uniquement une faible proportion des patients (17,5 %), soit ceux qui recevaient du lorazépam. Enfin, la petite taille de l’échantillon de patients a rendu impossible certaines analyses de sous-groupes, car le nombre de sujets aurait été insuffisant pour dégager un résultat significatif avec la puissance nécessaire.
Pour chaque patient chez qui une sédation palliative est commencée, il faut tenir compte des médicaments sédatifs reçus antérieurement, de son âge et du fait que les doses recommandées dans la littérature sont probablement sous-optimales. Il apparaît aussi nécessaire de commencer d’emblée par au moins deux agents sédatifs puisque la majorité des sédations au moment du décès en comportent deux ou plus. À la lumière des résultats de l’étude, les doses initiales de midazolam (50 mg/24 h) et de méthotriméprazine (100 mg/24 h) semblent plus indiquées, particulièrement chez le patient de moins de 75 ans. Étant donné les limitations imposées par le devis rétrospectif de cette étude, une évaluation de l’efficacité directe de la sédation palliative (à l’aide d’une échelle de sédation) serait indiquée afin de valider les données précédentes. D'ailleurs, en 2021, cette étude a permis de contribuer à la création d'un formulaire d’ordonnance préimprimé au CHU de Québec–Université Laval, qui comprend une échelle d’évaluation du degré de sédation et des doses optimisées de sédatifs. Il serait donc intéressant, dans un deuxième temps, de réévaluer la pratique de la sédation palliative dans ce milieu après sa mise en œuvre puisque l’échelle d’évaluation du degré de sédation permettrait désormais d’obtenir des données cliniques sur son efficacité.
Les auteurs remercient M. David Simonyan, biostatisticien, pour son soutien lors des analyses statistiques des résultats de l’étude. Cette personne a donné son autorisation écrite. La MMS est également remerciée pour l'accès aux dossiers.
Les auteurs n’ont déclaré aucun financement lié au présent article. S. Fortin est titulaire d’une bourse de carrière Chercheur-boursier Junior 1 du Fonds de recherche du Québec–Santé.
Tous les auteurs ont soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts lié à cet article.
1. Dean MM, Cellarius V, Henry B, Oneschuk D. Framework for continuous palliative sedation therapy in Canada. J Palliat Med 2012;15:870–9.

2. Gouvernement du Québec. Loi concernant les soins de fin de vie (chapitre S-32.0001). (Mise à jour 2020) [en ligne] https://www.legisquebec.gouv.qc.ca/fr/document/lc/S-32.0001 (site visité le 23 septembre 2020).
3. Association des pharmaciens des établissements de santé du Québec. Guide pratique des soins palliatifs : gestion de la douleur et autres symptômes. 5e éd. Québec : APES; 2017. 562 pages.
4. Société québécoise des médecins de soins palliatifs. La sédation palliative en fin de vie. Montréal : Collège des médecins du Québec; 2016. 61 pages.
5. Blondeau D, Dumont S, Roy L, Martineau I. Attitudes of Quebec doctors toward sedation at the end of life: an exploratory study. Palliat Support Care 2009;7:331–7.

6. Cherny NI, Radbruch L. European Association for Palliative Care (EAPC) recommended framework for the use of sedation in palliative care. Palliat Med 2009;23:581–93.

7. Kirk TW, Mahon MM. National Hospice and Palliative Care Organization (NHPCO) position statement and commentary on the use of palliative sedation in imminently dying terminally ill patients. J Pain Symptom Manage 2010;39:914–23.

8. de Graeff A, Dean M. Palliative sedation therapy in the last weeks of life: a literature review and recommendations for standards. J Palliat Med 2007;10:67–85.

9. Patel C, Kleinig P, Bakker M, Tait P. Palliative sedation: a safety net for the relief of refractory and intolerable symptoms at the end of life. Aust J Gen Pract 2019;48:838–45.

10. BC Centre for Palliative Care. B.C. Inter-professional palliative symptom management guidelines: refractory symptoms & palliative sedation. New Westminster : BC Centre for Palliative Care; 2019. 22 pages.
11. Waterloo Wellington Interdisciplinary HPC Education Committee PST Task Force. Waterloo Wellington palliative sedation therapy protocol. Waterloo Wellington Integrated Hospice Palliative Care; 2019. 44 pages.
12. Morita T. Differences in physician-reported practice in palliative sedation therapy. Support Care Cancer 2004;12:584–92.

13. Cherny NI. ESMO clinical practice guidelines for the management of refractory symptoms at the end of life and the use of palliative sedation. Ann Oncol 2014;25:143–52.

14. McMaster University. Continuous palliative sedation therapy (CPST) guidelines. Division of Palliative Care, Dept. of Family Medicine, McMaster University; 2020. 23 pages.
15. Deschepper R, Laureys S, Hachimi-Idrissi S, Poelaert J, Distelmans W, Bilsen J. Palliative sedation: why we should be more concerned about the risks that patients experience an uncomfortable death. Pain 2013;154:1505–8.

16. Beller EM, van Driel ML, McGregor L, Truong S, Mitchell G. Palliative pharmacological sedation for terminally ill adults. Cochrane Database Syst Rev 2015;1:CD010206.

17. Voeuk A, Oneschuk D. Continuous palliative sedation therapy. Palliative Care Files. Canadian Family Physician 2014;60:813–5.
18. Abarshi E, Rietjens J, Robijn L, Caraceni A, Payne S, Deliens L et al. International variations in clinical practice guidelines for palliative sedation: a systematic review. BMJ Support Palliat Care 2017;7:223–9.
19. McKinnon M, Azevedo C, Bush SH, Lawlor P, Pereira J. Practice and documentation of palliative sedation: a quality improvement initiative. Curr Oncol 2014;21:100–3.


20. Voeuk A, Nekolaichuk C, Fainsinger R, Huot A. Continuous palliative sedation for existential distress? A survey of Canadian palliative care physicians’ views. J Palliat Care 2017;32:26–33.

21. Institut national d’excellence en santé et en services sociaux. Protocole médical national : Administration de la sédation palliative continue (SPC) chez l’adulte en fin de vie. INESSS : Direction de l’évaluation et de la pertinence des modes d’intervention en santé avec la collaboration d’un comité consultatif formé de cliniciens et d’experts québécois; 2022. 12 pages.
22. Prommer E. Midazolam: an essential palliative care drug. Palliat Care Soc Pract 2020;14:1–12.
23. Parra Palacio S, Giraldo Hoyos CE, Arias Rodriguez C, Mejia Arrieta D, Vargas Gomez JJ, Krikorian A. Palliative sedation in advanced cancer patients hospitalized in a specialized palliative care unit. Support Care Cancer 2018; 26:3173–80.

24. Pype P, Teuwen I, Mertens F, Sercu M, De Sutter A. Suboptimal palliative sedation in primary care: an exploration. Acta Clin Belg 2018;73:21–8. 25.

25. Won YW, Chun HS, Seo M, Kim RB, Kim JH, Kang JH. Clinical patterns of continuous and intermittent palliative sedation in patients with terminal cancer: a descriptive, observational study. J Pain Symptom Manage 2019;58:65–71.

26. Gamblin V, Berry V, Tresch-Bruneel E, Reich M, Da Silva A, Villet S et al. Midazolam sedation in palliative medicine: retrospective study in a French center for cancer control. BMC Palliat Care 2020;19:1–10.

27. Arantzamendi M, Belar A, Payne S, Rijpstra M, Preston N, Menten J et al. Clinical aspects of palliative sedation in prospective studies: a systematic review. J Pain Symptom Manage 2021;61:831–44.

28. Alves M, Abril R, Neto IG. Symptomatic control in end-of-life patients. Acta Med Port 2017; 30:61–8.

29. Covarrubias-Gomez A, Lopez Collada-Estrada M. Propofol-based palliative sedation to treat antipsychotic-resistant agitated delirium. J Pain Palliat Care Pharmacother 2017:1–5.
30. Bush SH, Grassau PA, Yarmo MN, Zhang T, Zinkie SJ, Pereira JL. The Richmond Agitation-Sedation Scale modified for palliative care inpatients (RASS-PAL): a pilot study exploring validity and feasibility in clinical practice. BMC Palliat Care 2014;13:1–9.

PHARMACTUEL, Vol. 56, No. 1, 2023