Sam Boudi1, Hélène Roy2, B.Pharm., M.Sc., Jean-Marc Forest2, B.Pharm., DPH, M.Sc., Grégoire Leclair3, B.Pharm., Ph.D.
1Candidat au Pharm.D. au moment de la rédaction, stage STOP, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
2Pharmacien, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec) Canada;
3Professeur titulaire, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada
Reçu le 24 juillet 2022; Accepté après révision par les pairs le 15 février 2023
Résumé
Objectif: Évaluer la compatibilité physique de l’amoxicilline-acide clavulanique en injection avec 98 autres médicaments dans le cadre d’une administration en Y.
Méthode: Des échantillons de dix millilitres du médicament de référence ont été combinés, dans un ratio de 1:1, à 98 autres médicaments en injection non dilués à la température ambiante. Pour chaque médicament, une réplique a été faite afin d’évaluer la compatibilité physique immédiatement après le mélange et quatre heures plus tard. L’évaluation de la compatibilité s’est d’abord faite visuellement. Dans le cas où cette première évaluation se montrait concluante (c’est-à-dire en l’absence de précipité, de bulles de gaz ou de changement de couleur, de turbidité ou de viscosité), les échantillons ont été soumis à un test de dénombrement des particules par obstruction de lumière. La norme USP <788>1.B a été choisie pour définir le nombre acceptable de particules. Pour être considérés comme compatibles, les mélanges devaient réussir les deux examens au temps zéro et quatre heures plus tard.
Résultats: Au total, 80 des 98 médicaments en injection testés avec l’association amoxicilline-acide clavulanique se sont révélés compatibles à l’examen visuel et au test de dénombrement des particules.
Conclusion: En tout, dix-huit médicaments se sont révélés incompatibles avec l’amoxicilline-acide clavulanique et ne devront pas y être associés lors d’une administration en Y. Seule la compatibilité physique a été évaluée dans cette étude.
Mots clés: Amoxicilline-acide clavulanique, compatibilité, administration en Y
Abstract
Objective: To evaluate the physical compatibility of injectable amoxicillin/clavulanic acid with 98 other drugs during Y-site administration
Method: Ten-milliliter samples of the reference drug were combined in a 1:1 ratio with 98 other undiluted injectable drugs at room temperature. For each drug, a duplicate was made to assess physical compatibility immediately after mixing and four hours later. Compatibility was initially assessed visually. If this initial assessment was conclusive (e.g., no precipitate, gas bubbles or change in colour, turbidity or viscosity), the samples were subjected to a light obscuration particle count test. Standard USP <788>1.B was chosen to define an acceptable number of particles. To be considered compatible, the mixtures had to pass both tests at time zero and four hours later.
Result: A total of 80 of the 98 injectable drugs tested with the amoxicillin-clavulanic acid combination were found to be compatible on visual examination and on the particle count test.
Conclusion: A total of 18 drugs were found to be incompatible with amoxicillin/clavulanic acid and should not be used with this combination during Y-site administration. Only physical compatibility was assessed in this study.
Keywords: Amoxicillin/clavulanic acid, compatibility, Y-site administration
L’amoxicilline par voie orale, présente sur le marché depuis les années 1970, est la pénicilline la plus utilisée en Europe, seule ou en association avec l’acide clavulanique1. Dérivée de l’ampicilline, de laquelle elle ne diffère que par l’ajout d’un groupe hydroxyle sur le noyau benzénique, l’amoxicilline inactive une protéine nommée « protéine fixatrice de pénicilline » (PFP) 1A, essentielle à la synthèse de la paroi bactérienne, et possède une activité bactéricide variable selon les microorganismes1,2. L’ajout d’acide clavulanique (substance naturellement produite par les bactéries de l’espèce Streptomyces clavuligerus ) à l’amoxicilline élargit le spectre d’activité de cette dernière en permettant une couverture de certaines bactéries productrices de bêta-lactamines, comme Moraxella catarrhalis, Hæmophilus influenzæ ou Staphylococcus aureus sensible à la méticilline1,3. Par ailleurs, l’acide clavulanique possède également une petite activité antibiotique intrinsèque2.
L’association amoxicilline-acide clavulanique en injection contient 2000 mg d’amoxicilline et 200 mg d’acide clavulanique (10:1) qui est reconstitués avec 20 mL d’eau stérile pour une concentration finale de 100 mg/mL d’amoxicilline et de 10 mg/mL d’acide clavulanique. À noter qu’il existe aussi un ratio de 5 pour 1 au Canada. Toutefois, il n’est pas employé au Centre Hospitalier Universitaire (CHU) Sainte-Justine, car l’équipe préfère la préparation contenant le moins d’acide clavulanique pour pouvoir donner de plus hautes doses d’amoxicilline, tout en limitant les effets indésirables de l’acide clavulanique.
Cette association est utilisée au CHU Sainte-Justine pour traiter, entre autres, des infections de la peau et des tissus mous, des infections oto-rhino-laryngologiques, certaines pneumonies ainsi que des infections urinaires, selon les résultats de l’antibiogramme. La voie intraveineuse pour administrer un antibiotique est parfois préférée pour de nombreuses raisons, le plus fréquemment pour obtenir de plus grandes concentrations sanguines, mais également en présence d’une intolérance aux formes orales, d’une malabsorption ou encore d’une diminution de l’irrigation gastro-intestinale faisant suite à une phase critique et réduisant l’absorption du médicament4. À noter que le CHU Sainte-Justine ne disposait que d’ampicilline par voie intraveineuse avant l’ajout de l’amoxicilline-acide clavulanique par voie intraveineuse en 2020. C’est l’ajout de cette nouvelle option qui nécessite de nouvelles données de compatibilité.
Dans la littérature médicale, les données sur la compatibilité de l’amoxicilline-acide clavulanique avec d’autres médicaments pour une injection en Y sont peu nombreuses5–13. C’est dans ce contexte que sont mentionnés ici les résultats d’une étude portant sur la compatibilité de l’amoxicilline-acide clavulanique avec 98 autres médicaments en injection, soit les principaux médicaments injectables susceptibles d’être associés à l’amoxicilline-acide clavulanique. Ces résultats ont été obtenus par un examen visuel et un dénombrement des particules. Ces deux tests relèvent exclusivement de l’évaluation de l’incompatibilité physique. Outre cette dernière, il existe deux autres types d’incompatibilité5,6,14–18, soit l’incompatibilité chimique (qui peut altérer les médicaments ou engendrer une substance possiblement nocive pour le patient) et l’incompatibilité pharmacologique (qui peut entraîner des effets antagonistes, synergiques, voire toxiques). Comme ces deux derniers types d’incompatibilité n’ont pas été évalués, il n’est pas possible de garantir l’efficacité et l’innocuité cliniques des mélanges de médicaments. Les résultats obtenus permettent toutefois de recommander l’administration de 80 des 98 médicaments sans risque de formation d’un précipité lors de l’administration en Y.
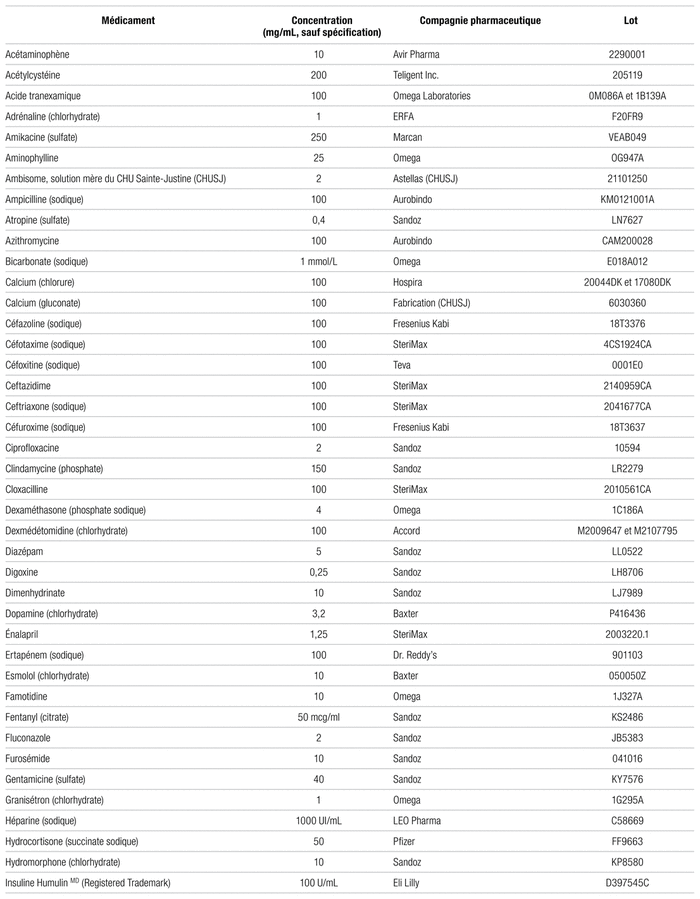
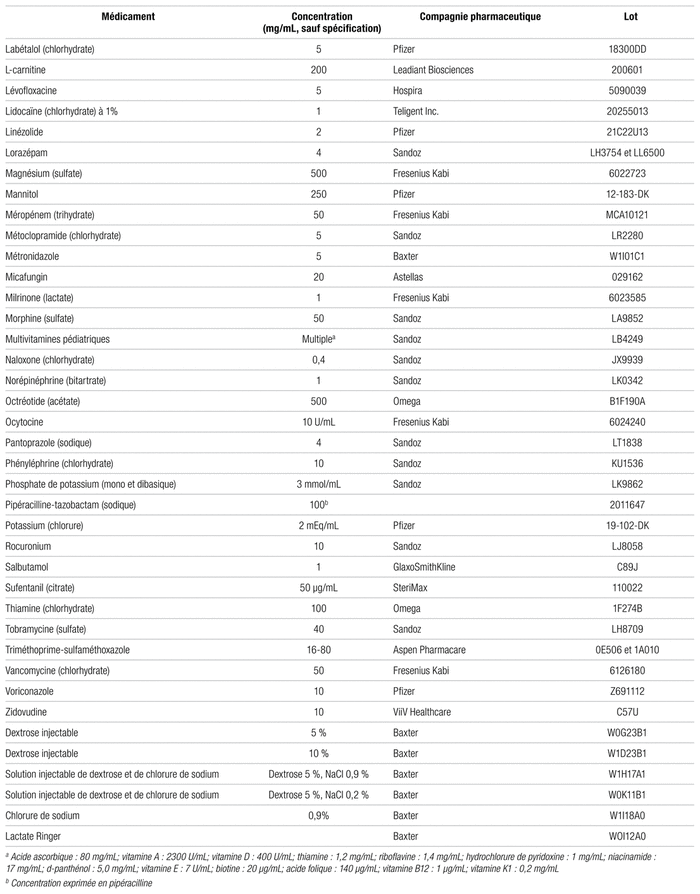
L’association amoxicilline-acide clavulanique (Sandoz, lot KR6021) utilisée pour mener à bien l’étude était préparée à partir d’un flacon contenant 2000 mg d’amoxicilline et 200 mg d’acide clavulanique. Conformément à la pratique du CHU Sainte-Justine, le médicament était reconstitué avec 20 mL d’eau stérile pour injection (Pfizer, lot 42059DK), aboutissant à une concentration de 100 mg/mL d’amoxicilline et de 10 mg/mL d’acide clavulanique. Parmi les 98 autres médicaments (tableaux I et II), ceux qui devaient être reconstitués l’ont aussi été en suivant les recommandations appliquées au CHU Sainte-Justine, soit surtout avec de l’eau stérile et parfois de la solution saline (chlorure de sodium 0,9 %, NS, Pfizer, lot GJ0975), suivant les recommandations de la monographie. Le principe voulant qu’un médicament n’étant pas incompatible à une concentration élevée ne le sera généralement pas non plus à une concentration plus faible incite à avoir recours aux concentrations maximales de chaque médicament5. En plus de la concentration, nous avons consigné le nom du fabricant et le numéro de lot de chaque médicament dans les tableaux I et II. En ce qui a trait au matériel ayant servi à faire les mélanges, des aiguilles stériles de calibre 20G × 1 (Becton Dickinson, lot 1179698) étaient disposées sur des seringues de polypropylène de 30 mL (Becton Dickinson, lot 2278468), sauf quand le médicament se présentait sous forme d’ampoules, auquel cas une aiguille stérile de calibre 20G × 1–1/2 dotée d’un filtre de 5 μm (Becton Dickinson, Blunt fill needle, lot 1144585) permettait d’éviter que la présence d’infimes débris de verre ne fausse les résultats.
Les mélanges de médicaments étaient préparés sous une hotte de laboratoire, comme suit : 10 mL d’amoxicilline-acide clavulanique étaient prélevés, puis 10 mL de chacun des 98 médicaments étaient ajoutés pour produire 20 ml d’une solution qui était mélangée manuellement, c’est-à-dire par inversion. Chaque couple de médicaments était préparé à température ambiante et sous éclairage normal (lumière fluorescente) à deux reprises, pour permettre une évaluation à t = 0, puis à t = 4 heures, en raison de l’impossibilité de réutiliser un échantillon une fois soumis au compteur de particules19. Une première évaluation visuelle à l’œil nu contre un fond blanc, puis noir avait pour but de détecter la présence de précipité, de bulles de gaz ou de changement de couleur, de turbidité ou de viscosité (ces phénomènes indiquaient une incompatibilité physique et mettaient fin à l’expérience). Dans le cas où aucun indice visuel n’évoquait une incompatibilité, deux évaluations visuelles similaires étaient effectuées à t = 1 heure et t = 4 heures. Le délai de 4 heures a été choisi afin de reproduire expérimentalement le temps de contact des médicaments dans le cathéter lors d’une administration de médicaments en Y et à faible débit6. Puisque le temps de contact ne dépasse habituellement pas trois heures6, le choix du délai de quatre heures assurait un résultat sécuritaire.
En plus de l’évaluation visuelle, un test de dénombrement des particules par obstruction de lumière a été effectué à l’aide du compteur de particules LS-20 (Lighthouse Worlwide Solutions, Medford, OR, USA)19. En l’absence de signes d’incompatibilité physique (qui pourraient endommager l’appareil), l’un des deux échantillons était soumis au compteur de particules au temps t = 0 heure et le second au temps t = 4 heures. L’appareil était calibré pour répondre à la norme USP <788>20. Son fonctionnement repose sur la mesure de la variation de l’intensité lumineuse d’un laser traversant l’échantillon. Une courbe de calibration intégrée au logiciel de l’appareil convertit la mesure en un décompte de particules. L’échantillon de 20 mL fourni dans chaque seringue était utilisé de la façon suivante : les 4 premiers mL servaient à rincer l’appareil, les 15 mL suivants permettaient une analyse en trois temps à raison de 5 mL pour chaque analyse. Il restait donc 1 mL qui protégeait la dernière analyse d’une altération du résultat par l’entrée de petites bulles d’air.
Seule la compatibilité physique a été évaluée dans cette étude. Par conséquent, cette dernière ne permet pas de statuer sur la compatibilité pharmacologique ou chimique des médicaments concernés. En ce qui concerne la compatibilité physique, elle a été, d’une part, évaluée visuellement par l’observation de la présence ou de l’absence de précipité, de bulles de gaz ou de changement de couleur, de turbidité ou de viscosité. Tout changement constaté était considéré comme un signe d’incompatibilité21–38. D’autre part, un test par numération des particules était effectué sur chaque échantillon jugé compatible visuellement. Ce test permettait d’estimer avec précision la quantité des différentes particules. Le seuil de compatibilité reposait sur la norme USP <788> 1.B s’appliquant aux solutions d’un volume inférieur à 100 mL. Selon cette norme, un échantillon dépassant 6000 particules de plus de 10 μm et 600 particules de plus de 25 μm par contenant de 20 mL échouait au test. Il fallait donc que le nombre de particules de plus de 10 μm par mL soit inférieur ou égal à 300 et que le nombre de particules de plus de 25 μm par mL soit inférieur ou égal à 3020.
Tableau I Médicaments compatibles avec l’amoxicilline-acide clavulanique en vue d’une administration en Y et selon la norme USP <788>1.B


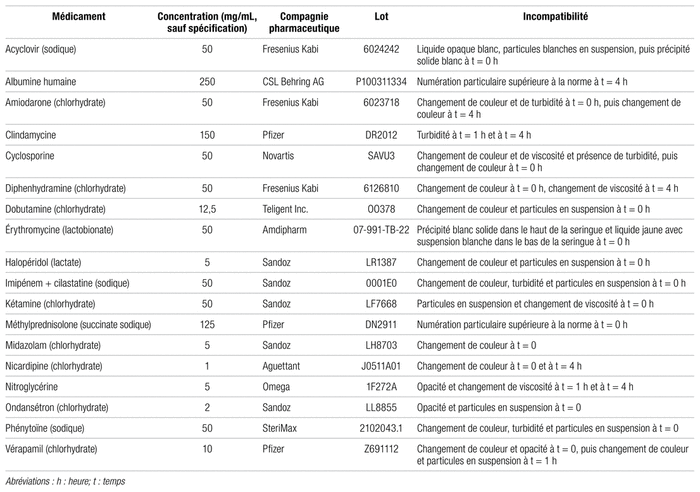
Tableau II Médicaments incompatibles avec l’amoxicilline-acide clavulanique et ne permettant pas une administration en Y
L’association amoxicilline-acide clavulanique s’est révélée compatible avec 80 des 98 médicaments (tableau I). Ces mélanges ont réussi les deux tests de compatibilité physique aux temps t = 0 et t = 4 h. Immédiatement après avoir été préparés, les mélanges jugés compatibles présentaient un nombre de particules de plus de 10 μm entre 2,0 et 212,5 par mL et un nombre de particules de plus de 25 μm entre 0,1 et 28,9 par mL. Après 4 heures, le nombre de particules de plus de 10 μm se situait entre 1,3 et 218,3 par mL et celui des particules de plus de 25 μm, entre 0,1 à 28,3 par mL.
Toutefois, 18 des 98 médicaments testés se sont révélés incompatibles (tableau II). Seize d’entre eux ont échoués le test visuel étant donné que des modifications étaient observables à l’œil nu. Les détails sont colligés dans le tableau II. Comme prévu, ces échantillons n’ont pas été soumis au compteur de particules. Des 82 médicaments ayant réussi la première étape, seulement 2 n’ont pas réussi le test du compteur de particules : l’albumine humaine et la méthylprednisolone. L’albumine a répondu à la norme au temps t = 0 heure (23,2 particules de 10 μm et plus et 13,5 particules de 25 μm et plus), mais a échoué au temps t = 4 h (70,3 particules de 10 μm et plus et 41,9 particules de 25 μm et plus). La méthylprednisolone avait une numération particulaire de 190,9 particules de 10 μm et plus et 66,3 particules de 25 μm et plus au temps t = 0 heure, ainsi que 26,9 particules de 10 μm et plus et 7,5 particules de 25 μm et plus au temps t = 4 heures.
Bien que l’administration de médicaments injectables en Y ne soit pas rare en milieu hospitalier, il existe très peu de données sur certaines combinaisons médicamenteuses5–7, notamment celle de l’amoxicilline-acide clavulanique, en dépit de son importante fréquence d’usage. Il est intéressant de rappeler que seule la compatibilité physique a été évaluée dans la présente étude. Les quelques données trouvées dans la littérature font aussi état de compatibilité (ou d’incompatibilité) physique. En ce qui concerne le Trissel’s Tables of Physical Compatibility, paru en 1996, il ne contient aucune donnée de compatibilité sur l’amoxicilline-acide clavulanique6. Cette absence de données s’explique possiblement par la non-actualisation desdites tables, dont la dernière version date du XXe siècle. La 20e édition du Handbook on injectable drugs, publiée en 2018, constitue également une source intéressante dans le contexte de cette étude5. Plus régulièrement mis à jour, ce livre contient quatre données de compatibilité : incompatibilité du chlorhydrate d’amiodarone, 2,5 mg/mL, en raison d’une turbidité apparue à t = 0 heure (concordant avec les résultats de la présente étude); incompatibilité du chlorhydrate de midazolam, 5 mg/mL, à la suite de la formation d’un précipité blanc à t = 0 heure (également signalée dans cette étude); compatibilité du lorazépam, 0,33 mg/mL (aussi citée dans cette étude) et compatibilité de la clarithromycine, 4 mg/mL (ce médicament n’a pas fait l’objet d’un test de compatibilité dans la présente étude). Les données visuelles au temps zéro étaient identiques à celles au temps = 1 heure. Quant à la base de données Micromedex®, elle mentionne que le tramadol, la vancomycine, la rifampicine, le propofol, le pantoprazole, l’ofloxacine, le lorazépam, la clarithromycine, le bumétanide et l’atosiban sont compatibles avec l’amoxicilline-acide clavulanique7. Parmi les médicaments cités, la vancomycine, le pantoprazole et le lorazépam ont été testés dans le cadre de la présente étude et se sont également révélés compatibles. Cette même base de données indique que l’amiodarone et la témocilline sont incompatibles tandis que la compatibilité du midazolam est variable. La présente étude mentionne, quant à elle, une incompatibilité de l’amiodarone et du midazolam et n’a pas utilisé de témocilline.
Il y a donc une concordance entre les résultats de la présente étude et les données de la littérature médicale. Néanmoins, il convient de relativiser cette concordance étant donné les données limitées disponibles. De plus, pour bien évaluer cette littérature, il faut tenir compte de plusieurs critères essentiels, comme la description complète du matériel et de son mode d’utilisation, la méthode employée et sa validation, les indications claires sur les temps de contact et les mesures faites, les tests montrant la reproductibilité de la méthode, les tests statistiques adéquats utilisés selon le cas, particulièrement lors de l’étude des concentrations en fonction du temps et, enfin, les conclusions appropriées, appuyées tant par l’expérimentation que par une discussion conforme de la littérature référencée. Chacun de ces éléments apporte sa part essentielle à l’ensemble de l’étude31.
Le type de manipulations de mélanges en seringue employé dans cette étude est semblable à celui de nombreuses autres études de compatibilité18,21–30. C’est un modèle de choix dans lequel deux solutions administrées ensemble par injection en Y entrent en contact dans un ratio de 1:16,32,33. En vertu du principe selon lequel un médicament n’étant pas incompatible à une concentration élevée ne le sera généralement pas à une concentration plus faible5, la concentration maximale de chaque médicament a été utilisée, hormis pour les antibiotiques dont la concentration visée est définie de façon rigoureuse au CHU Sainte-Justine. Toutes les préparations ont été testées immédiatement (t = 0 heure) et quatre heures après le mélange (t = 4 heures), ce qui constitue une méthode de choix lors des tests de compatibilité de médicaments injectables en Y, comme le prouvent de nombreuses études précédentes18,21–30.
Les critères visuels ayant mené à une conclusion d’incompatibilité physique étaient presque toujours un changement de couleur vers le blanc, une turbidité ou une opacification de l’échantillon. Certains cas étaient plus particuliers, comme l’association imipénem-cilastatine qui est passée au vert, puis au bleu. Quant à l’échantillon contenant de la diphenhydramine, il a montré divers signes d’incompatibilité : un changement de couleur vers le blanc et une turbidité à t = 0 heure, maintenue à t = 1 heure, puis l’apparition d’une huile non miscible sur le dessus de l’échantillon à t = 4 heures. Dans le cas de la clindamycine, deux échantillons provenant de fabricants différents ont été testés par suite de problèmes d’approvisionnement. Il est intéressant de noter que le produit de Pfizer, contenant de l’alcool benzylique, a été déclaré incompatible, contrairement à celui de Sandoz qui n’en contenait pas. Ici encore, les excipients sont soupçonnés d’être à l’origine de l’incompatibilité, et non la molécule active elle-même. Il est essentiel de garder en tête toute l’importance de la préparation d’une molécule en ce qui a trait à ses compatibilités33. Des facteurs comme le pH, la concentration, le ou les véhicules peuvent aussi être en cause et même expliquer pourquoi une même molécule est à la fois compatible et incompatible avec une autre quand on change par exemple de fournisseur et de préparation. Cette particularité est présente dans tous les pays et encore plus dans le temps puisque la formulation d’une préparation peut ainsi évoluer35–37. La littérature1–18,21–38 montre que le pharmacien est le mieux placé pour régler ce type de problème d’administration et qu’il doit participer à la recherche d’une solution, dans l’intérêt des patients.
Comme dans d’autres études18,29,30, le compteur de particules s’est révélé d’une grande utilité, car il a permis de statuer sur l’incompatibilité physique de deux médicaments (albumine humaine et méthylprednisolone) qui semblaient pourtant parfaitement compatibles à l’œil nu. Par ailleurs, il est intéressant de comparer cette étude à celle portant sur le citrate de caféine. Cette dernière comparait également la compatibilité physique de 99 médicaments avec le citrate de caféine et avait conclu que 19 médicaments n’étaient pas compatibles29. Une autre similitude entre ces deux études est que la plupart des incompatibilités ont été constatées à l’examen visuel (16 médicaments sur 18 dans cette étude et 19 sur 19 dans l’étude sur le citrate de caféine). Une autre étude, portant cette fois sur la compatibilité du soluté Plasmalyte-A avec d’autres produits injectables pour une administration en Y, a établi que 87 des 99 médicaments testés étaient compatibles30. Toutefois, la majorité des incompatibilités avaient été révélées par le compteur de particules (7 médicaments sur 12). Ces différents cas de figure confortent le principe qu’un examen de compatibilité physique en deux étapes est nécessaire et que l’examen visuel ne suffit donc pas.
Parmi les 98 médicaments testés, et en tenant compte des fournisseurs mentionnés, il est conclu que l’amoxicilline-acide clavulanique était incompatible avec l’acyclovir, l’albumine humaine, l’amiodarone, la clindamycine (Pfizer), la cyclosporine, la diphenhydramine, la dobutamine, l’érythromycine, l’halopéridol, l’association imipénem-cilastatine, la kétamine, la méthylprednisolone, le midazolam, la nicardipine, la nitroglycérine, l’ondansétron, la phénytoïne et le vérapamil. Les 80 autres médicaments se sont révélés compatibles physiquement avec l’amoxicilline-acide clavulanique. Il convient toutefois de rappeler que la compatibilité physique n’est pas une condition nécessaire et suffisante pour juger de l’efficacité et de l’innocuité cliniques d’un mélange de médicaments injectables. Néanmoins, ces résultats permettront de faciliter l’administration d’une myriade de médicaments et amélioreront le confort des patients.
Les auteurs tiennent à remercier Mme Mihaela Friciu, agente de recherche, Plateforme de biopharmacie, Faculté de pharmacie, Université de Montréal, Montréal, pour son aide tout au long de la préparation des tests. Cette personne a donné son autorisation écrite.
Les auteurs n’ont déclaré aucun financement lié au présent article. La totalité des médicaments étudiés provenait du département de pharmacie du CHU Sainte-Justine.
Tous les auteurs ont soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts lié au présent article.
1. Huttner A, Bielicki J, Clements MN, Frimodt-Møller N, Muller AE, Paccaud JP, Mouton JW. Oral amoxicillin and amoxicillin–clavulanic acid: properties, indications and usage. Clinical Microbiol Infect 2020;26:871–9.

2. Reading C, Cole M. Clavulanic acid: a beta-lactamase-inhibiting beta-lactam from streptomyces clavuligerus. Antimicrob Agents Chemother 1977;11:852–7.

3. Sutherland R. β-Lactamase inhibitors and reversal of antibiotic resistance. Trends Pharmacol Sci 1991;12:227–32.

4. Werth BJ. Revue générale des médicaments antibactériens–Maladies infectieuses–Édition professionnelle du Manuel MSD (4 mai 2020) [en ligne]. https://www.merckmanuals.com/fr-ca/professional/maladies-infectieuses/bactéries-et-médicaments-antibactériens/revue-générale-des-médicaments-antibactériens (site visité le 24 avril 2022).
5. American Society of Health-System Pharmacist. Handbook on injectable drugs. 20e ed. Bethesda: American Society of Health-System Pharmacist; 2015. 1254 pages.
6. Trissel LA. Trissel’s tables of physical compatibility. 1re éd. Lake Forest : Multimatrix;1996. 590 pages.
7. Micromedex Healthcare Series. Compatibilité de l’amoxicilline/clavulanate potasssium (2017). Thomson Micromedex, 1974–2009. [en ligne] http://www.thomsonhc.com (site visité le 24 avril 2022).
8. King Guide Publications. King guide to parenteral admixtures (2022). [en ligne] http://kingguide.com/index.html (site visité le 24 avril 2022).
9. Janknegt R, Stratermans T, Cilissen J, Lohman JJ, Hooymans PM. Ofloxacin intravenous. compatibility with other antibacterial agents. Pharm Weekbl Sci 1991;13:207–9.

10. Jangknegt R, Schrouff GG, Lohman JJ, Hermens WJ. Compatibility studies with pefloxacin. Ziekenhuisfarmacie 1989;5:75–8.
11. Janknegt R, Schrouff GG, Hooymans PM, Hermens WJ, Lohman JJ. Quinolones and penicillins incompatibility. DICP 1989;23:91–2.

12. Serrurier C, Chenot ED, Vigneron J, May I, Demoré B. Assessment of injectable drugs’ administration in two intensive care units and determination of potential physico-chemical incompatibilities. Eur J Hosp Pharm Sci 2006; 12:96–9.
13. Hecq JD, Kramer I, Vigneron J. European databases on stability and compatibility of injectable medicinal products in Europe. Pharmaceutical Technolnology in Hospital Pharmacy 2019;113–7.
14. Trissel LA. Drug stability and compatibility issues in drug delivery. Handbook on injectable drugs 11th edition 2001, ASHP.
15. Newton DW. Drug incompatibility chemistry. Am J Health Syst Pharm 2009;66:348–57.

16. Allen LV Jr. Intravenous admixture preparation considerations, Part 2: Incompatibilities and factors involved. Int J Pharm Compd 2020;24: 44–50.
17. Allen LV Jr. Intravenous admixture preparation considerations, Part 7: Stability issues. Int J Pharm Compd 2020;24:473–8.
18. Macoviciuc M, Nguyen C, Forest JM, Leclair, G. Compatibilité physique de l’acétaminophène injectable avec 102 autres médicaments lors d’une administration en Y. Pharmactuel 2022; 55:247–255.
19. Manuel d’instruction de l’appareil LS-20 Liquid Particle Counter (Lighthouse Worldwide Solutions, Medford, OR). 54 pages.
20. USP <788> Particulate matter in injections. In: United States Pharmacopeia. USP 36. Rockville, MD; United States Pharmacopeia; 2012. p.350–3.
21. Ferreira E, Forest JM, Hildgen P. Compatibilité du dimenhydrinate injectable pour l’administration en Y. Pharmactuel 2004;37:17–20.
22. Péré H, Chassé V, Forest JM, Hildgen P. Compatibilité du pantoprazole injectable lors d’administration en Y. Pharmactuel 2004;37: 193–6.
23. Pelletier É, Forest JM, Hildgen P. Compatibilité de la kétamine injectable lors de l’administration en dérivé avec d’autres médicaments usuels. Pharmactuel 2006;39:71–5.
24. Pelletier É, Forest JM, Hildgen P. Compatibilité des mélanges de morphine et de kétamine ou d’hydromorphone et de kétamine injectables lors de leur administration en dérivé avec d’autres médicaments usuels. Pharmactuel 2007;40(suppl. 2):23–7.
25. Tollec S, Touzin K, Pelletier É, Forest JM. Évaluation visuelle de la compatibilité physique de la naloxone avec d’autres médicaments intraveineux usuels. Pharmactuel 2013;46: 16–22.
26. Legris ME, Valiquette ME, Lavoie A, Forest JM, Leclair G. Compatibilité physique par évaluation visuelle du salbutamol injectable lors de son administration en Y. Pharmactuel 2011; 44:14–8.
27. Forest JM, Hildgen P. Compatibilité de l’acétylcystéine injectable lors d’administration en Y avec d’autres médicaments usuels. Pharmactuel 2014;47:161–6.
28. Legris ME, Lavoie A, Forest JM, Hildgen P. Compatibilité par évaluation visuelle du thiopental injectable lors de son administration en Y avec des médicaments usuels. Pharmactuel 2014;47:167–72.
29. Audet MA, Forest É, Friciu M, Forest JM, Leclair G. Compatibilité du citrate de caféine injectable avec plusieurs autres médicaments. Pharmactuel 2017;50:27–33.
30. Audet MA, Thompson-Desormeaux F, Forest JM, Leclair G. Compatibilité du soluté Plasmalyte-AMD avec plusieurs autres médicaments pour une administration en Y. Pharmactuel 2021;54:28–34.
31. Hecq JD, Bihin B, Jamart J, Galanti L. Criteria for judging the quality of a publication on physicochemical stability of ready to use injectable drugs. Pharm Techno Hosp Pharm 2017;2: 79–84.
32. Allen LV, Stiles ML. Compatibility of various admixtures with secondary additives at Y-injection sites of intravenous administration sets. Part 2. Am J Hosp Pharm 1981;38:380–1.
33. Allen LV, Levison RS, Phisustsinthop D. Compatibility of various admixtures with secondary additives at Y-site injection sites of intravenous administration sets. Am J Hosp Pharm 1977; 34:939–43.
34. Hasegawa R. Caring about stability and compatibility. Am J Hosp Pharm 1994;51:1533–4.
35. Trissel LA. Everything in a compatibility study is important. Am J Health Syst Pharm 1996; 53:2990.

36. Kohut J, Trissel LA, Leissing NC. Don’t ignore details of drug compatibility reports. Am J Health Syst Pharm 1996;53:2339.

37. Nema S, Brendel RJ. Excipients and their role in approved injectable products: current usage and future directions. PDA J Pharm Sci Technol 2011;65:287–332.

38. Guignard B, Gschwind L, Fonzo-Christe C. Les incompatibilités médicamenteuses en 2015 : encore une mission du pharmacien d’établissement de santé ? Pharmactuel 2015; 48:132–4.
PHARMACTUEL, Vol. 56, No. 3, 2023