Marie-Élaine Métras1,2, Pharm.D., M.Sc., Carine Nyalendo3,4, Ph.D., Clotilde Low-Kam5, Ph.D., Émilie Vallières6,7, M.D., Ph.D., Patrice Hildgen8, B.Pharm., Ph.D., Victoria Forest9, B.Sc., Jean-Marc Forest1, B.Pharm., DPH, M.Sc.
1Pharmacien, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec) Canada
2Professeure adjointe de clinique, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada
3Biochimiste clinique, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec) Canada
4Professeure adjointe de clinique, Département de biochimie et médecine moléculaire, Faculté de médecine, Université de Montréal, Montréal (Québec) Canada
5Biochimiste clinique, Centre intégré universitaire de santé et de services sociaux du Nord-de-l’Île-de-Montréal, Hôpital Jean-Talon, Montréal (Québec) Canada
6Microbiologiste, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec) Canada
7Professeure adjointe de clinique, Département de microbiologie, infectiologie et immunologie, Faculté de médecine, Université de Montréal, Montréal (Québec) Canada
8Professeur retraité, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada
9Bio-informaticienne, Faculté des arts et des sciences, Université de Montréal, Montréal (Québec) Canada
Reçu le 24 juillet 2022; Accepté après révision par les pairs le 30 décembre 2022
Résumé
Objectifs: Afin de répondre aux normes de pratique moderne, comme ceux d’Agrément Canada et de divers autres organismes réglementaires, il faut procéder au retrait des électrolytes concentrés des unités de soins et des diverses cliniques. Devant le manque évident de disponibilités de certains solutés stériles commerciaux, les principaux solutés injectables requis sont fabriqués en lots et leur stabilité est vérifiée conformément à la norme OPQ 2014.01 et aux autres normes applicables. Un des objectifs de la présente étude était de vérifier s’il est possible d’augmenter la date limite d’utilisation de ces solutés grâce à des tests de stérilité et de teneur.
Méthode: Plus d’une vingtaine de préparations d’usage courant au Centre hospitalier universitaire Sainte-Justine ont été étudiées pour leur stabilité à long terme. Quatre catégories principales de solutés ont été préparées en lot, soit des solutés dextrosés à des concentrations non commerciales, des solutés phosphorés, des solutés avec des suppléments divers tels que le magnésium et enfin des solutés de lactate commerciaux additionnés de potassium. Le laboratoire de biochimie a reçu un aliquot de chaque sac chaque semaine et analysé la teneur des divers ingrédients. Un test de stérilité a également été effectué en fin d’étude, soit trois mois après la production.
Résultats: Aucune variation de concentration de plus de 5 % n’a été constatée, peu importe l’élément de soluté analysé. Les solutés sont stables tant biochimiquement que microbiologiquement pendant trois mois à partir de la date de préparation en milieu stérile, lorsqu’ils sont exécutés dans le secteur fabrication du Département de pharmacie.
Conclusion: Moyennant un contrôle tant biochimique que microbiologique de chacun des lots, il est possible de produire divers solutés non commerciaux dont la stabilité à température ambiante est de trois mois et respecte les normes en vigueur, principalement celles de l’Ordre des pharmaciens du Québec. Ce processus simplifie les soins aux patients et est plus sûr, car il évite la manipulation d’électrolytes concentrés aux unités de soins.
Mots-clés: Électrolytes concentrés, soluté, stabilité, stérilité
Abstract
Objectives: To meet the standards of practice, such as those of Accreditation Canada and various other regulatory bodies, for concentrated electrolytes that should be removed from care units and different clinics. Because of the lack of availability of certain commercial sterile solutions, a number of injectable solutions frequently prescribed are prepared in batches and tested for stability in accordance with standard OPQ 2014.01 and other applicable standards. One of the objectives of this study was to determine if the expiry date of these solutions can be extended through sterility and concentration testing.
Method: More than 20 preparations in common use at the Centre hospitalier universitaire Sainte-Justine were tested for their long-term stability. Four main categories of solutions were prepared in batches: dextrose solutions at noncommercial concentrations, phosphorus solutions, solutions with various supplements, such as magnesium, and, lastly, commercial lactate solutions with added potassium. The biochemistry laboratory received an aliquot from each bag every week and determined the concentration of the various ingredients. In addition, a sterility test was performed at the end of the study, that is, three months after preparation.
Result: No variation in concentration greater than 5% was found for any solution ingredient tested. The solutions are stable, both biochemically and microbiologically, for 3 months from the date of preparation in sterile conditions when made in the preparation section of the Pharmacy Department.
Conclusion: By doing both biochemical and microbiological testing on each batch, it is possible to prepare various noncommercial solutions that are stable at room temperature for three months. They comply with the current standards of the Ordre des pharmaciens du Québec. This process helps streamline patient care and it is safer for the patient, since it eliminates the handling of concentrated electrolytes in the care units.
Keywords: Concentrated electrolytes, solution, stability, sterility
Depuis 2001, différents bulletins sur l’innocuité publiés par l’Institut pour la sécurité des médicaments aux patients du Canada (ISMP Canada) signalent les dangers associés à l’utilisation de solutions intraveineuses d’électrolytes concentrés, notamment le chlorure de potassium et le phosphate de potassium1. D’autres organismes qui veillent à la qualité des soins et à la sécurité des patients, ainsi que des organismes d’agrément en santé, comme Agrément Canada, ont émis des recommandations pour réduire le risque de conséquences potentiellement mortelles en cas d’administration par inadvertance de ces solutions concentrées. Par exemple, parmi les pratiques organisationnelles requises, Agrément Canada demande que « la disponibilité des électrolytes concentrés soit évaluée et limitée afin de s’assurer que les doses pouvant causer des incidents liés à la sécurité des usagers ne sont pas entreposées sur les unités de soins »2. Le tout doit se faire dans un contexte normatif. De nombreux organismes réglementaires internationaux, tels que l’International Medication Safety Network (IMSN), l’United States Pharmacopeia (USP) ou la pharmacopée européenne, abondent dans le même sens. Les normes canadiennes et québécoises s’en inspirent largement1–5. Cependant, l’administration d’électrolytes par voie intraveineuse est nécessaire dans certaines situations cliniques. Pour le potassium, plusieurs solutés commerciaux à différentes concentrations de chlorure de potassium sont disponibles, de même que des mini-sacs permettant d’administrer des doses intermittentes ponctuelles. La majorité du temps, ces produits permettent de répondre aux besoins de supplémentation.
Pour le phosphore et le magnésium, la situation devient plus difficile. En pédiatrie, plusieurs situations peuvent nécessiter une supplémentation en phosphore par voie intraveineuse. Il est possible de penser notamment aux patients en chimiothérapie ou prenant des immunodépresseurs, pour qui la supplémentation par voie orale n’est parfois pas possible, ou encore aux patients en acidocétose diabétique grave. En obstétrique-gynécologie, des solutés avec magnésium sont parfois nécessaires pour des indications spécifiques, notamment pour la prévention et le traitement des convulsions en cas de prééclampsie et d’éclampsie. Ainsi, lorsque l’état clinique du patient exige une supplémentation par voie intraveineuse, le clinicien fait face à l’absence de solutés commerciaux qui contiennent l’électrolyte requis, à savoir le phosphore ou le magnésium. Cette situation peut donc entraîner la manipulation d’électrolytes concentrés sous forme de phosphate de potassium, de phosphate de sodium ou de sulfate de magnésium.
Pour éviter ces manipulations aux unités de soins, une façon de contourner le problème est de fabriquer ces solutés directement dans le secteur fabrication du département de pharmacie dans un contexte protocolaire fixe, rigoureux et surveillé. Un comité a été créé afin de standardiser les préparations et les concentrations pour essayer de répondre aux besoins de tous. Les solutés contenant du phosphore ont été standardisés en premier, suivis de ceux de magnésium. Cependant, pour tous ces solutés maison, il existait peu ou pas de données de stabilité dans la littérature, d’où la nécessité d’en établir2–10.
Une fois la méthode mise au point pour ces solutés, des demandes pour produire des solutés pour d’autres indications cliniques ont fait surface, notamment pour des solutés dextrosés à des concentrations plus élevées que ce qui est recensé dans la littérature, ainsi que pour adapter des solutés de lactate Ringer contenant du dextrose et/ou du chlorure de potassium qui n’étaient pas non plus commercialisés.
Le but du présent projet est donc de confirmer la faisabilité de la préparation de divers solutés d’électrolytes (p. ex. : phosphate de potassium monobasique et dibasique, phosphate sodique et sulfate de magnésium), de différents solutés de dextrose concentré, de lactate Ringer, etc., ainsi que d’établir leur stabilité à moyen ou à long terme, tant sur le plan biochimique que microbiologique.
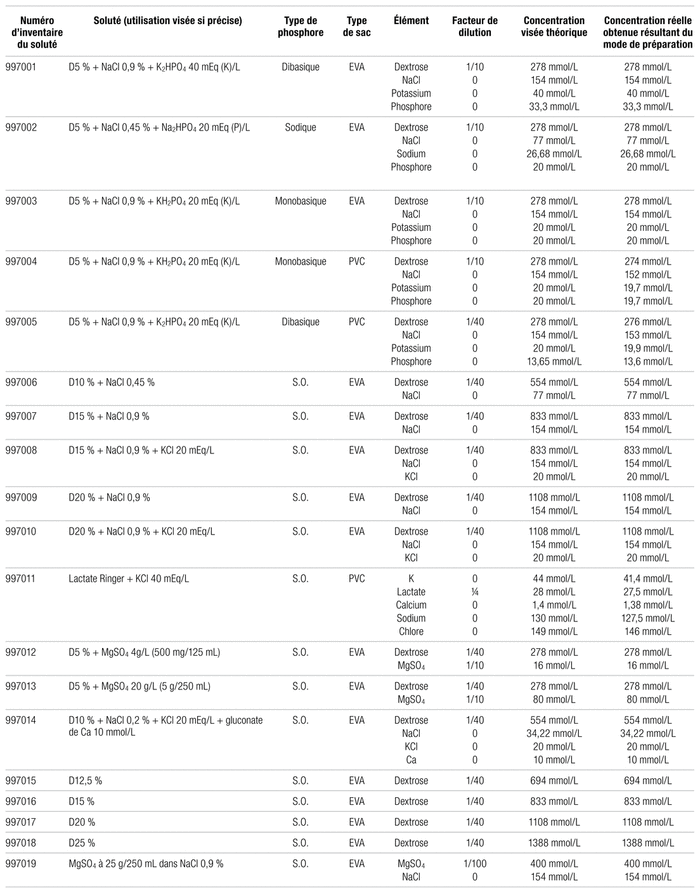
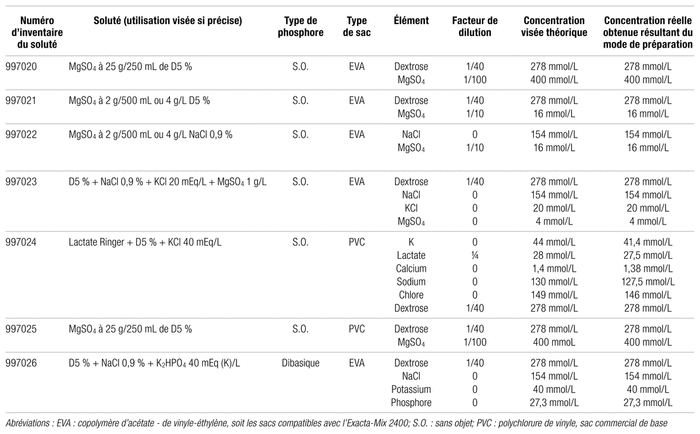
La préparation des solutés respecte les normes habituelles sur la stérilité des produits, comme la norme 2014.01 de l’Ordre des pharmaciens du Québec (OPQ) sur les produits stériles non dangereux6. Les 26 types différents de solutés testés sont indiqués dans le tableau I. À des fins administratives internes du Département de pharmacie, leurs numéros d’inventaire commencent toujours par 9970 et se terminent par 01 à 26. Ils ont été réalisés au secteur de fabrication du département de pharmacie du Centre hospitalier universitaire (CHU) Sainte-Justine, un hôpital mère-enfant provincial de 450 lits. Les solutés phosphorés (nos 1 à 5) ont tous été effectués dans une première série. Les trois premiers ont été exécutés directement à l’aide d’une pompe Exacta-Mix 2400 (Baxter) en sac de type copolymère d’acétate de vinyle-éthylène (EVA). Deux solutés ont également été faits en sacs de polychlorure de vinyle (PVC) standard commerciaux par l’injection manuelle du volume de phosphore dans un sac contenant déjà un mélange de dextrose à 5 % et de NaCl à 0,9 % d’un litre (Baxter, lot W7k29A1). Le phosphate utilisé était un des suivants :
Par la suite, diverses concentrations non commerciales de dextrose, avec ou sans électrolytes, ont été confectionnées (les numéros 6 à 10 et 12 à 23 dans le tableau I) toujours en utilisant la pompe Exacta-Mix et les sacs d’EVA. Les solutés numéros 6 à 10 sont destinés surtout aux soins intensifs, ceux portant les numéros 12 et 13 ainsi que 23 et 26 principalement à l’oncologie, ceux ayant les numéros 14 à 18 à la néonatologie et les numéros 19 à 22 et 25 majoritairement à l’obstétrique. Quant aux sacs avec un numéro d’inventaire se terminant par 11 et 24, ils ont été réalisés par l’ajout manuel de chlorure de potassium dans des sacs commerciaux de lactate Ringer avec ou sans dextrose à 5 %, entre autres pour les cas d’acidocétose diabétique ou pour des utilisations aux soins intensifs. Rien n’empêche l’emploi d’un soluté dans un secteur différent de celui qui en a initialement fait la demande. L’utilisation d’un sac commercial au départ explique que la concentration réelle indiquée dans le tableau I soit plus faible que celle de départ, dans certains cas, puisqu’un élément de départ du sac se trouve dilué par le ou les ajouts.
À noter que le système de pompe Exacta-Mix 2400 de Baxter est employé lorsque c’est possible au lieu de faire les ajouts manuellement, car ce système fonctionne par code-barres, ce qui réduit le risque d’erreurs de manipulation humaine. Le système injecte dans un sac vide chacun des éléments selon le volume requis.
Tableau I Composition détaillée des sacs étudiés


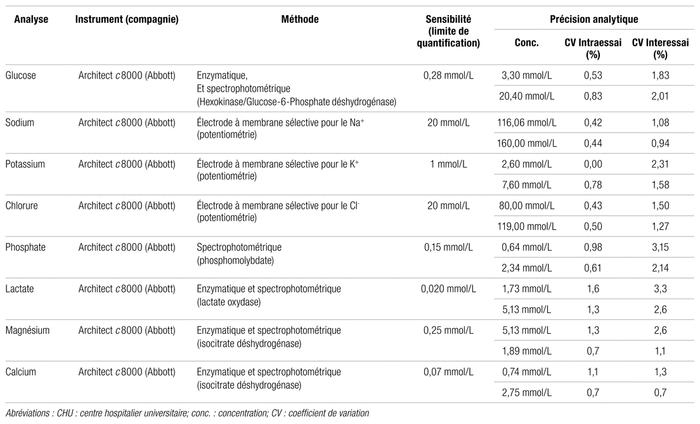
Une fois préparés, les sacs ont été conservés à la température ambiante, soit entre 20 et 22 °C, sous un éclairage normal artificiel de tubes fluorescents. Un échantillon de 20 mL a été prélevé stérilement une fois par semaine, dilué le cas échéant au Département de pharmacie selon les facteurs de dilution apparaissant dans le tableau I, puis envoyé au laboratoire de biochimie du centre hospitalier pour analyse avec le système Architect c8000 d’Abbott. Ce système répond aux différents paramètres apparaissant dans le tableau II. Il est aussi utilisé pour l’analyse des échantillons des patients, mais a été légèrement adapté afin d’accepter les concentrations plus élevées. C’est pour cette raison qu’un facteur de dilution doit être appliqué pour certains tests. La figure 1 montre un exemple de formulaire d’analyse biochimique modifié pour répondre à ces exigences.
L’étude s’échelonne sur une période d’un peu plus de trois mois pour chaque type de sacs afin d’obtenir une valeur de stabilité physico-chimique pour cette période. À la fin de la période d’échantillonnage, tous les volumes restants dans les sacs ainsi ponctionnés ont été vérifiés microbiologiquement à l’aide du dispositif QT Junior de 0,2 micron QI-TJ3100 de QI-Medical et le bouillon de culture correspondant, en fiole de 20 ml TSBG. L’incubation se faisait en deux temps, soit à la température ambiante pour la première semaine et à 37 °C pour la seconde. Les lectures de turbidité des bouillons ont été effectuées aux temps 0, 3, 4, 7, 8, 10 et finalement après 15 jours par le laboratoire de microbiologie du CHU Sainte-Justine. Il était attendu que les bouillons exempts de contamination demeurent clairs. Toutes ces procédures respectent la norme USP <71> sur la tenue de tests de stérilité, conformément aux normes de l’OPQ11. Le taux d’évaporation d’un sac de 100 mL de chlorure de sodium en EVA et d’un autre en PVC a également été estimé sur trois mois en les pesant hebdomadairement pour en connaître le poids. Une perte de 1 gramme signifiait la perte d’un millilitre d’eau par évaporation au travers de la membrane. Une balance de type Sartorius avec une sensibilité minimale de 1 mg, calibrée et entretenue selon les politiques et procédures internes au secteur fabrication du département de pharmacie, a été utilisée12.
L’analyse statistique des résultats comporte le calcul du pourcentage et du coefficient de variation pour les triplicatas à chaque temps de prélèvement, pour chaque ingrédient par rapport à sa valeur nominale. Une régression linéaire complète ion par ion ou élément par élément a également été effectuée pendant les trois mois de l’étude. Conformément aux normes en vigueur pour les préparations magistrales, le pourcentage de variation maximale était fixé à un maximum de 10 % tout au long de l’étude.
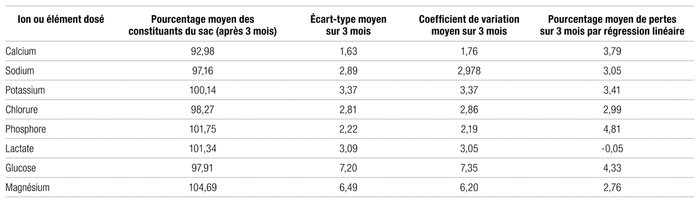
Le tableau III résume à lui seul l’ensemble des résultats de l’étude. Il donne les pourcentages moyens des divers constituants des sacs pour la durée de l’étude, leur écart-type moyen, ainsi que leur coefficient de variation calculé par régression linéaire. Il s’agit ici de la combinaison de chaque ion ou élément pour l’ensemble des 26 solutés produits afin de simplifier la présentation et de ne pas procéder sac par sac, bien qu’une telle analyse ait été réalisée dans un premier temps. Les concentrations de chaque constituant sont demeurées supérieures à 92 % tout au long de la période d’analyse et les coefficients de variation, sous les 8 %. Enfin, une variation de moins de 5 % a été observée pour l’ensemble des ions pendant les trois mois d’analyse. La figure 2 présente les moyennes des différentes concentrations d’ions pour les cinq premiers solutés sous forme d’histogramme, ce qui permet d’en apprécier la distribution. Le graphique de la figure 3 montre la variation des divers ions en fonction du temps pour le soluté numéro trois spécifiquement, toujours à titre d’exemple.
Tableau II Paramètres du système analytique du service de biochimie du CHU Sainte-Justine
Tous les tests microbiologiques effectués en fin d’étude se sont révélés négatifs (aucune preuve de contamination microbienne n’a été découverte). Malgré une ponction hebdomadaire de 20 mL, une absence de croissance bactérienne a été constatée. Puisqu’un petit lot de sacs était à l’étude et qu’ils étaient tous régulièrement ponctionnés, leur test de stérilité effectué une fois en fin d’étude seulement respecte les méthodes de l’USP <71>11. En production régulière, 10 % de chacun des lots font l’objet d’un test microbiologique, toujours pour répondre aux normes USP. Pour ce qui est de la teneur de chaque sac, puisque les normes sont muettes sur le nombre d’échantillonnages à faire et même sur la nécessité de les faire, nous avons vérifié un seul sac par lot en mode de production, pour fins de sécurité.
Finalement, le taux d’évaporation des sacs d’EVA a été estimé à 8,3 % par rapport à 5,2 % pour le PVC, après régression linéaire des résultats obtenus à la suite des diverses pesées au cours des trois mois de l’étude. L’évaporation de l’eau à travers une membrane d’EVA serait donc du même ordre, voire supérieure à celle à travers un sac de PVC.
Il appert que tous les solutés étudiés possèdent une stabilité physicochimique d’au moins trois mois à la température ambiante, ce qui est peu surprenant puisqu’il s’agit d’ions en solution ou de grosses molécules stables comme le glucose. Pour chacun des ions potassium, sodium, chlore et phosphore, les concentrations se sont en général maintenues dans un écart de moins de 5 % de la valeur attendue. À noter que pour le dextrose, ainsi que pour les ions lactate, magnésium et calcium, le département de pharmacie devait procéder à une dilution d’une demie, d’un dixième, d’un quarantième ou d’un centième de l’échantillon avant son envoi au laboratoire afin que ce dernier puisse l’analyser directement, sans autre manipulation. Ces manipulations supplémentaires pourraient expliquer une variation plus importante des résultats, qui n’est pas présente pour tous les autres ions dont les concentrations en échantillon permettaient l’analyse directe par le laboratoire de biochimie. Il y a donc un facteur d’erreur potentiel plus important pour ces différents éléments.
|
| ||
|
Figure 1 Formulaire d’analyse adapté pour l’étude de stabilité
| ||
Le taux d’évaporation normal d’un sac peut influencer la concentration de son contenu et paradoxalement le plus souvent à la hausse, ce qui est l’inverse de la logique de dégradation habituelle. Une même quantité globale d’un ion se trouve dans un volume qui diminue lentement avec le temps, ce qui occasionne une augmentation de la concentration totale. C’est ce phénomène qui semble observable sur le graphique de la figure 3. C’est pourquoi une compagnie pharmaceutique comme Baxter indique une date limite d’utilisation hors de son suremballage de 15 jours pour un sac de 50 mL et moins et de 30 jours pour un sac de 100 mL et plus, si la date d’expiration du produit est supérieure à six mois. Si la date d’expiration est inférieure ou égale à six mois, la date limite d’utilisation passe à sept jours pour un sac de 50 mL et moins et à 20 jours pour un sac de 100 mL et plus en moyenne13. Un tel phénomène doit être pris en compte, comme l’ont fait Perks et coll. dans leur étude en effectuant une étude de stabilité du phosphate de sodium en sacs de PVC standard dans laquelle un facteur de correction a été appliqué pour tenir compte du phénomène14. Par contre, la majorité des sacs de l’étude sont en EVA, soit le type de plastique des sacs spécialement conçus pour s’adapter à la pompe, et non en PVC. Malgré diverses recherches, notamment auprès de la compagnie, aucune donnée ne semble disponible sur l’évaporation spécifique à ce matériel, bien qu’elle semble également présente. C’est pourquoi quelques tests simples ont été effectués en pesant hebdomadairement des sacs de chlorure de sodium à 0,9 % en PVC standard d’une part et en EVA d’autre part, pendant trois mois, afin d’en évaluer le taux d’évaporation. Le taux d’évaporation des sacs en EVA est de 8,3 %, donnée non disponible dans la littérature, contre 5,2 % pour les sacs en PVC. Cette dernière valeur est comparable à la valeur de 5 % obtenue par Perks et coll.14. Cette évaporation pourrait expliquer la positivité de toutes les valeurs récoltées, à l’exception des ions lactate qui sont légèrement négatifs. La manipulation des échantillons pour effectuer les dilutions pourrait être mise en cause.
Tableau 3 Résumé des résultats des analyses statistiques des 26 solutés combinés
|
| ||
|
Figure 2 Moyennes des différentes concentrations des ions en solution, en mmol par litre pour les solutés nos 1 à 5 | ||
|
| ||
|
Figure 3. Variation des concentrations des divers ions, en mmol par litre en fonction du temps pour le soluté no 3 spécifiquement, à titre d’exemple | ||
Pour la préparation des sacs, certaines particularités s’appliquaient. Par exemple, le sac dont le numéro d’inventaire se terminait par 01 (Dextrose 5 % + NaCl 0,9 % + PO4 40 mEq (K)/L) demandait un ajout manuel de 9,1 mL de K2HPO4, car cet ingrédient ne figurait pas dans le montage de la pompe au démarrage de l’étude. Pour le sac numéro 2 (Dextrose 5 % + NaCl 0,45 % + Na2HP04 20 mEq (P)/L), le même problème d’absence de l’ingrédient sur la pompe au moment du lancement de l’étude s’appliquait au phosphate de sodium dibasique pour lequel 6,67 mL de Na2HPO4 ont été ajoutés manuellement. Le sac numéro 4 (Dextrose 5 % + NaCl 0,9 %) était un sac commercial, sauf pour le PO4 monobasique à 20 mEq (K)/L, dans lequel il a fallu ajouter 16,3 mL de KH2PO4 manuellement également. À noter que tout ajout manuel s’est fait visuellement à la seringue et par photo selon le processus standard d’ajouts aux solutés. Un sac commercial d’un litre de Baxter contient un surplus moyen d’environ 50 mL dont il faut tenir compte dans les calculs d’ajouts et de concentration. C’est également le cas pour le sac numéro 5 (Dextrose 5 % + NaCl 0,9 % + PO4 dibasique 20 mEq (K)/L) fabriqué à partir de sacs commerciaux de Dextrose 5 % + NaCl 0,9 % dans lequel est ajouté 4,8 mL de K2HPO4 en tenant compte du surplus de 50 mL du sac commercial. L’emploi de sacs commerciaux permettait à la fois de connaître la stabilité d’un soluté dans un autre matériau que l’EVA utilisé avec la pompe, mais permettait aussi d’avoir une autre solution de fabrication en cas de rupture d’approvisionnement des sacs d’EVA ou en présence d’une incapacité d’utiliser la pompe de fabrication pour une raison quelconque (p. ex. : rupture d’approvisionnement d’un ingrédient). L’emploi de sacs commerciaux de lactate Ringer pour les préparations nos 11 et 24 a permis d’éviter de brancher des sacs de lactate Ringer directement sur la pompe comme ingrédient de base pour ce mélange. D’ailleurs, l’obtention d’un sac de lactate Ringer avec dextrose 5 % ne serait pas possible techniquement puisque la pompe diluerait le lactate Ringer de façon importante pour y joindre le dextrose en quantité suffisante. Aucune source pure de lactate Ringer concentré injectable branchable sur la pompe ne semble malheureusement exister sur le marché.
La conservation à la température ambiante a été choisie pour différents facteurs, notamment parce qu’il est plus facile de conserver un produit à la température ambiante qu’au réfrigérateur et que les espaces de réfrigération sont plus rares ou moins accessibles dans bien des cas. De plus, les produits commerciaux équivalents sont habituellement conservés à température ambiante. Enfin, il faut noter qu’un produit réfrigéré doit être ramené à la température ambiante avant son administration au patient. Certaines infirmières notent aussi qu’une solution dextrosée froide aura davantage tendance à déclencher les alarmes d’occlusion d’une pompe, possiblement en raison d’une augmentation de sa viscosité à froid.
De telles stabilités prolongées permettent de préparer un lot de solutés, de les placer en quarantaine, de tester les sacs biochimiquement et microbiologiquement, puis de les libérer pour utilisation. Avec 90 jours de stabilité à température ambiante, les pertes sont réduites au minimum et l’efficacité de production est augmentée. Les solutés peuvent alors être placés aux communs des unités de soins concernées, dans les divers cabinets pertinents, directement à l’urgence ou simplement être conservés au Département de pharmacie pour usage futur. Leur gestion en est simplifiée et leur innocuité est accrue, mais surtout, leur disponibilité sécuritaire pour les patients en est grandement améliorée.
Enfin, afin de rendre le système pleinement efficient, il faut idéalement que chaque soluté existe en double version possible dans le système de production. La première version possède une stabilité de 90 jours à température ambiante, avec un contrôle microbiologique et de teneur, ainsi qu’une mise en quarantaine en attendant la confirmation de l’absence de contamination microbienne. La seconde version, pour usage immédiat, possède une stabilité de 9 jours au réfrigérateur sans contrôle microbiologique ni de teneur et répond donc à la norme OPQ 2014.01, pour une production de risque moyen6. Cette seconde entrée peut être utilisée en cas de rupture d’approvisionnement en sac contrôlé, mais aussi de façon systématique une fois un traitement amorcé, alors que les sacs contrôlés seraient réservés pour amorcer les traitements hors des heures d’ouverture de la pharmacie et en cas d’urgence. Ils peuvent aussi être utilisés de routine si l’institution n’est pas en mesure d’effectuer l’encadrement requis par les tests microbiologiques.
Par acquit de conscience, comme déjà mentionné, un test de teneur est effectué sur les différents constituants pour chacun des lots produits, en plus des tests microbiologiques. Un tel test n’est pas exigé par les normes, mais accroît la sécurité des patients, en raison notamment du dosage des électrolytes particulièrement dangereux, comme le potassium. Ils ont été mis au point pour les tests de stabilité, mais peuvent fort bien faire partie des tests courants par la suite. Puisqu’ils ne sont pas inscrits dans les normes, un seul sac par lot est arbitrairement échantillonné.
Cette étude a permis d’établir une stabilité physico-chimique de 90 jours à la température ambiante pour divers solutés, préparés en lot de glucose concentré, d’électrolytes ou de lactate Ringer, tant qu’un contrôle physicochimique et microbiologique est effectué. La présence et l’accessibilité de ces différents solutés sur les unités de soins contribuent à diminuer grandement la manipulation des électrolytes concentrés et réduisent ainsi les risques associés. Il faut cependant mettre en place un système afin de réévaluer de façon sporadique les solutés préparés en lot, pour s’assurer qu’ils répondent toujours aux besoins des patients selon les équipes cliniques et pour s’ajuster au besoin.
Les auteurs n’ont déclaré aucun financement pour le présent article. Le département de pharmacie a absorbé les coûts de production et de manutention des solutés et les laboratoires se sont chargés de ceux des analyses tant microbiologiques que de teneurs.
Les auteurs ont soumis le formulaire de l’ICMJE sur la divulgation des conflits d’intérêts potentiels. Marie-Élaine Metras est rédactrice associée de Pharmactuel. Les autres auteurs n’ont déclaré aucun conflit d’intérêts lié au présent article.
Les auteurs tiennent à remercier Monsieur Maxime Thibault, pharmacien, pour son aide dans l’élaboration des grilles d’analyse et dans l’analyse préliminaire des données proprement dites. Ils souhaitent également adresser des remerciements tout spéciaux aux équipes des assistants techniques du secteur fabrication du département de pharmacie, des techniciens du laboratoire de biochimie et des techniciens du laboratoire de microbiologie d’Optilab Montréal du CHU Sainte-Justine, sans lesquels cette étude de stabilité n’aurait pu avoir lieu. La personne nommée a donné son autorisation écrite.
1. Institut pour la sécurité des médicaments aux patients du Canada. Tragédies évitables : Deux décès pédiatriques par suite de l’administration intraveineuse d’électrolytes concentrés. [en ligne] : https://ismpcanada.ca/wp-content/uploads/2022/02/BISMPC2019n1-electrolytesConcentres.pdf (site visité le 1er février 2022).
2. Agrément Canada – programme QMentum. Norme - Gestion des médicaments : Pour les visites qui commencent après le 1er janvier 2018. Date générée : 1er février 2018 Ver. 12. 77 pages. [en ligne]. https://healthstandards.org/fr/norme/gestion-des-medicaments-2/ (site visité le 1er février 2022).
3. International Medication Safety Network (IMSN). [en ligne]. https://www.intmedsafe.net (site visité le 1er février 2022).
4. United States Pharmacopeial Convention (USP). General Chapter. In: USP–NF. Rockville, MD 2022. [en ligne]. https://www.uspnf.com/purchase-usp-nf (site visité le 1er février 2022).
5. European Pharmacopoeia. 11th Edition 2022. [en ligne] https://pheur.edqm.eu/home (site visité le 1er février 2022).
6. Ordre des pharmaciens du Québec. Norme 2014.01–Préparations de produits stériles non dangereux en pharmacie. OPQ;2014. 108 pages. [en ligne] https://www.opq.org/wp-content/uploads/2017/11/Norme_2014_01_Ste%CC%81rile_non-_dangereux-_Fe%CC%81v2023_Final.pdf (site visité le 1er février 2022).
7. Trissel LA, Leissing NC. Trissel’s tables of physical compatibility. 1st edition. Lake Forest, IL: MultiMatrix;1996. 590 pages.
8. American Society of Health-System Pharmacists. Handbook on injectable drugs. 20e éd. Bethesda (MD): American Society of Health-System Pharmacists; 2018. 1465 pages.
9. Micromedex Healthcare Series. Thomson Micromedex. [en ligne] http://www.micromedexsolutions.com (site visité le 6 août 2018).
10. Catania PN, rédacteur. King guide to parenteral admixtures. Napa, CA King Guide Publications; 1999. [en ligne] http://www.kingguide.com (site visité le 1er février 2022).
11. United States Pharmacopeial Convention (USP). Chapter <71> Sterility tests. In: USP–NF. Rockville, MD 2022 [en ligne]. https://www.uspnf.com/purchase-usp-nf (site visité le 1er février 2022).
12. Politique et procédure FNS2.1A1. Préparations magistrales non stériles Catégories 1-2-3. Annexe 1–Guide du matériel requis pour les préparations magistrales non stériles au secteur fabrication. Document interne, secteur fabrication, département de pharmacie, CHU Sainte-Justine. Juin 2017.
13. Communication personnelle. Lettre de la compagnie Baxter du 3 mai 2018 de Mme Mona Ghobros.
14. Perks W, Iazzetta J, Chan PC, Brouzas A, Law S, Walker S. Extended stability of sodium phosphate solutions in polyvinyl chloride bags. Can J Hosp Pharm 2017;70:7–12.

PHARMACTUEL, Vol. 56, No. 2, 2023