Marie-Ève Newberry1*, Winnie Tran1*, Sissy Jade Lee Yam Seng1*, Mounia Louerguioui1*, Jessica Doiron2, Pharm.D., M.Sc., Jean-François Tessier2, B.Pharm., M.Sc., Venessa Doyon-Kemp3, Pharm.D., M.Sc.
1Candidate au Pharm.D. au moment de la rédaction, Université de Montréal, Montréal (Québec) Canada
2Pharmacien(ne), Centre intégré universitaire de santé et de services sociaux de l’Est-de-l’Île-de-Montréal, Hôpital Maisonneuve-Rosemont, Montréal (Québec) Canada
3Pharmacienne, Centre intégré universitaire de santé et de services sociaux du Centre-Sud-de-l’Île-de-Montréal, Centre d’hébergement Émilie-Gamelin, Montréal (Québec) Canada
Reçu le 15 août 2022; Accepté après révision le 20 décembre 2022
Résumé
Objectif: Explorer les impacts de diverses interventions d’antibiogouvernance effectuées par les pharmaciens en milieu ambulatoire, soit dans des cliniques médicales, des pharmacie communautaire, aux urgences et au congé de l’hôpital, puis évaluer leur faisabilité au sein du système de santé québécois.
Description de la problématique: Les programmes d’antibiogouvernance constituent un élément de pratique organisationnelle exigé par Agrément Canada dans les établissements de santé. Ils sont par contre moins nombreux en contexte de soins ambulatoires. Pourtant, la majorité des antibiotiques sont servis en externe et sont fréquemment pris même quand ils ne sont pas nécessaires ou de façon inappropriée, contribuant ainsi à l’augmentation du risque d’antibiorésistance.
Résolution de la problématique: Les pharmaciens ont un rôle primordial à jouer dans l’antibiogouvernance, notamment en s’assurant que le bon antibiotique est donné au bon patient à la bonne dose, à la bonne fréquence et pour la bonne durée de traitement. Plusieurs interventions d’antibiogouvernance en milieu ambulatoire dont l’efficacité a été établie peuvent être instaurées au Québec, telles que l’utilisation d’algorithmes de traitement adaptés aux résistances locales, la révision des cultures par le pharmacien, la rétroaction aux cliniciens sur leurs habitudes de prescription d’antibiotiques et l’éducation des patients. Combiner plus d’une intervention et former une équipe interdisciplinaire vouée à la tâche semble améliorer l’efficacité des activités d’antibiogouvernance.
Conclusion: Vu sa position clé dans le circuit des antibiotiques et son expertise en matière de médicaments, le pharmacien est un acteur incontournable dans la mise en place de mesures d’antibiogouvernance en contexte de soins ambulatoires pour prévenir l’antibiorésistance et les effets indésirables associés au mésusage des antibiotiques.
Mots clés: Antibiogouvernance, milieu ambulatoire, pharmaciens, pharmacies communautaires, résistance aux antibiotiques, urgences
Abstract
Objective: To explore the impact of various antibiotic stewardship interventions performed by pharmacists in ambulatory settings, such as medical clinics, retail pharmacies, emergency departments and at hospital discharge, and to assess their feasibility within Quebec’s healthcare system.
Problem description: Antibiotic stewardship programs are a component of organizational practice required by Accreditation Canada in healthcare facilities. However, they are less common in ambulatory care settings. Yet, most antibiotics are dispensed in the outpatient setting. Frequently, these antibiotics are not necessary or inappropriately prescribed, and they contribute to the increased risk of antibiotic resistance.
Problem resolution: Pharmacists have a key role to play in antibiotic stewardship, including ensuring that the right antibiotic is given to the right patient at the right dose, at the right frequency and for the right duration of treatment. There are a number of ambulatory setting antibiotic stewardship interventions with proven effectiveness that can be implemented in Quebec. A few examples are the use of treatment algorithms adjusted to local resistances, clinical pharmacist reviewing the culture results, feedback to clinicians on their antibiotic prescribing habits, and patient education. Combining interventions and having an interdisciplinary team dedicated to this task appears to improve the effectiveness of antibiotic stewardship activities.
Conclusion: Pharmacists are key players in the implementation of antibiotic stewardship measures in ambulatory care settings for preventing antibiotic resistance and the adverse effects associated with antibiotic misuse. They play an important role in the antibiotic circuit considering their expertise in this area.
Keywords: Ambulatory setting, antibiotic resistance, antibiotic stewardship, community pharmacies, emergency departments, pharmacists
Quand on parle d’enjeux de santé mondiale, les changements climatiques et les zones de crise prolongée où sévissent insécurité et iniquité nous viennent indubitablement à l’esprit. Peu de gens songeront à la résistance aux antimicrobiens, qui figure nonobstant parmi les dix plus importantes menaces à la santé établies par l’Organisation mondiale de la Santé1. En effet, on estime que les infections résistantes aux antibiotiques pourraient causer 10 millions de morts par année dans le monde d’ici 2050, soit plus que le nombre de cancers enregistrés aujourd’hui2.
L’utilisation des antibiotiques n’est pas sans risques. En 2018, un Canadien hospitalisé sur 180 a contracté une infection causée par un micro-organisme résistant aux antibiotiques. Ces infections ont ainsi entraîné 14 000 morts3. De 2015 à 2019, au Canada, le taux de bactériémies à Staphylococcus aureus résistant à la méthicilline (SARM) d’origine communautaire a augmenté de 125 %; un patient atteint sur cinq est décédé dans les 30 jours suivant le diagnostic4. La proportion d’infections à Neisseria gonorrhoeæ multirésistante s’est également accrue de 44 %4. Les antibiotiques engendrent une altération du microbiote intestinal qui peut tripler le risque d’infections à Clostridioides difficile (ICD) acquise en communauté5. De plus, un patient hospitalisé sur cinq recevant un antibiotique pendant au moins 24 heures subira un effet indésirable, le risque grimpant de 3 % tous les 10 jours de traitement additionnels6.
Le facteur de risque modifiable le plus important pour le développement d’une résistance est la prescription inappropriée d’antibiotiques7. Selon une étude rétrospective canadienne incluant presque 39 millions d’ordonnances d’antibiotiques rédigées en externe entre 2000 et 2018, 50 % d’entre elles n’étaient pas nécessaires8. De plus, selon le Centers for Disease Control and Prevention (CDC), la moitié des prescriptions d’antibiotiques seraient inappropriées selon les lignes directrices locales quant à la dose, à la durée ou au choix de traitement9.
Plusieurs études ont révélé que des durées de traitement plus courtes sont aussi efficaces et plus sécuritaires que les durées conventionnelles, par exemple des traitements de 3 à 5 jours au lieu de 7 à 10 jours pour pneumonie acquise en communauté (PAC) et de 5 à 7 jours de préférence à 10 à 14 jours pour une pyélonéphrite10. Un essai à répartition aléatoire contrôlé, regroupant 380 enfants atteints de PAC non sévère, mené dans des cliniques médicales ou aux urgences aux États-Unis a constaté que les patients recevant un traitement antibiotique de cinq jours plutôt que dix avaient 69 % plus de chances d’avoir une issue clinique plus désirable sur le plan de l’efficacité et de l’innocuité (intervalle de confiance à 95 % [IC 95 %] : 63–75)11. Chez 171 de ces enfants, le nombre médian de gènes d’antibiorésistance par cellule était significativement inférieur pour un traitement de cinq jours comparativement à dix jours11.
Dans une étude australienne, un patient sur huit se présentant aux urgences obtenait une ordonnance d’antibiotique ; celle-ci était inappropriée dans 32,7 % des cas, souvent en raison d’un régime à trop large spectre12. Au congé d’hôpital, une étude américaine a détecté 457 problèmes sur 803 prescriptions de départ : 35,9 % concernaient la durée de traitement, 35,2 %, le médicament choisi et 20,1 %, la dose9. Dans une étude effectuée dans un centre de soins primaires américain, seulement 18 % des ordonnances d’antibiotiques étaient adéquates dans des proportions de 43,4 %, de 71,1 % et de 88,1 % pour l’agent prescrit, la durée et la dose, respectivement13. Un des facteurs de risque dans le choix d’un agent sous-optimal était la présence d’allergies aux antibiotiques au dossier13. Par exemple, la mention d’une allergie aux pénicillines au dossier d’un patient est associée à l’usage d’antibiotiques à spectre plus large ainsi qu’à un risque plus élevé d’effets indésirables, d’ICD, de résistance, d’issues cliniques plus défavorables et à une hausse des coûts en santé14. Selon une revue de littérature, d’autres facteurs contribuent à la prescription inadéquate d’antibiotiques, comme l’équilibre entre les risques et bénéfices de l’antibiothérapie qui peut être mal compris par le prescripteur et les attentes des patients qui veulent recevoir un antibiotique lors d’une consultation. Selon une étude, les médecins prescrivaient des antibiotiques dans 48 % des consultations pour une infection des voies respiratoires en pédiatrie lorsqu’ils percevaient une attente de la part des parents, comparativement à 10 % lorsqu’ils n’en percevaient pas (valeur de p < 0,001)15.
Depuis 1990, 78 % des compagnies pharmaceutiques majeures ont délaissé le développement de nouveaux antibiotiques, un secteur peu rentable étant donné que ces derniers ne sont administrés en traitement aigu que si les options de première ligne échouent16. Malgré les initiatives de l’Infectious Diseases Society of America (IDSA) pour faciliter le développement et la commercialisation de nouveaux antimicrobiens, les nouvelles molécules reprennent souvent les mécanismes d’action de médicaments existants et demeurent donc vulnérables aux mêmes barrières de résistance16. Les nouveaux antimicrobiens à venir risquent, par conséquent, d’être insuffisants à eux seuls pour nous sortir de cette situation.
Néanmoins, certaines statistiques sont plus encourageantes. Entre 2015 et 2019, la consommation canadienne d’antibiotiques est passée de 17,3 à 16,3 doses définies journalières (DDD) pour 1000 habitants-jour, une DDD étant la dose quotidienne usuelle d’un antibiotique pour son indication principale chez un adulte4. Entre 2014 et 2018, le taux de prescription d’antibiotiques au Canada a décru, passant de 42,2 à 35,5 % pour les otites et de 24,1 à 19,5 % pour les infections urinaires, tandis que les ICD ont diminué de 15 % de 2015 à 20183. Cette baisse pourrait s’expliquer par l’instauration de plusieurs initiatives d’antibiogouvernance, dont les guides d’usage optimal des antibiotiques de l’Institut national d’excellence en santé et en services sociaux (INESSS) ou les guides d’antibiothérapie des différents centres hospitaliers.
Les programmes d’antibiogouvernance constituent une pratique organisationnelle exigée par Agrément Canada dans les établissements de santé. L’antibiogouvernance en contexte de soins hospitaliers est détaillée dans plusieurs guides cliniques, dont ceux du CDC, du Regroupement de pharmaciens experts en infectiologie (RPEI) de l’Association des pharmaciens des établissements de santé du Québec ainsi que de l’IDSA et de la Society for Healthcare Epidemiology of America7,17,18. Cependant, les programmes d’antibiogouvernance sont moins nombreux en contexte ambulatoire. Pourtant, en 2019, 92,7 % des DDD d’antimicrobiens au Canada ont été délivrées en pharmacie d’officine et 63,8 % des ordonnances ont été émises par des médecins de famille et omnipraticiens3.
Le rapport The Core Elements of Outpatient Antibiotic Stewardship du CDC établit quatre principes primordiaux pour le développement de programmes d’antibiogouvernance en milieu ambulatoire : l’engagement, l’implantation de politiques et de procédures, la production de rapports de surveillance ainsi que l’éducation et l’expertise7. Il revient maintenant à déterminer comment le pharmacien, en se basant sur ces principes, peut participer à la mise en place d’interventions d’antibiogouvernance en milieux de soins ambulatoires.
De prime abord, le pharmacien a un rôle primordial à jouer dans les cliniques médicales, plus particulièrement dans les groupes de médecine de famille (GMF), en raison de sa proximité avec le prescripteur et de l’accès aux données cliniques des patients. Une étude de cohorte prospective aux États-Unis a évalué l’effet de la révision des cultures par le pharmacien au sein des services d’urgence, des centres de soins primaires et des cliniques externes. Après avoir révisé la prescription d’antibiotiques en fonction des résultats des cultures pour diverses indications, dont les infections urinaires et infections de la peau et des tissus mous, le pharmacien recommandait au prescripteur de modifier la durée, la dose ou l’agent si nécessaire. Sur 965 révisions, 194 ont nécessité l’intervention du pharmacien (20,1 %). Une diminution du taux d’échec au traitement (5,4 % vs 28,3 %, valeur de p < 0,0001) et de réadmission à 30 jours (0,7 % vs 10,9 %, valeur de p = 0,0005) a été observée lorsque les interventions des pharmaciens étaient approuvées, sans aucun effet sur la mortalité au bout de 30 jours (valeur de p = 0,38)19.
L’enseignement aux médecins et la rétroaction différée sur leurs prescriptions sont deux autres interventions réalisables. Une étude multicentrique a évalué l’effet de la création d’une équipe de gestion des antimicrobiens comprenant notamment des médecins, pharmaciens et infirmiers, sur la prescription de fluoroquinolones pour les infections urinaires dans des centres de soins primaires. Les interventions de l’équipe, dont l’éducation, la rétroaction aux prescripteurs et la comparaison entre pairs, ont entraîné une réduction des prescriptions de fluoroquinolones de 23,8 à 6,8 % (valeur de p < 0,001)20. Ensuite, une méta-analyse s’est penchée sur l’effet des interventions du pharmacien en antibiogouvernance dans les milieux de soins de première ligne, y compris l’organisation de réunions entre cliniciens, la création d’ateliers éducatifs et de matériel pédagogique ainsi que l’instauration d’un processus d’audit et de rétroaction sur les prescriptions21. En six mois, ces interventions ont diminué le nombre d’antibiotiques prescrits (rapport de cotes [RC] : 0,86; IC 95 % : 0,78–0,95) et amélioré la proportion d’ordonnances respectant les lignes directrices locales (RC : 1,96; IC 95 % : 1,56–2,45)21.
Sur la même lancée, une étude pilote à répartition aléatoire a montré une augmentation des prescriptions d’antibiotiques conformes aux recommandations locales lorsqu’un pharmacien expliquait individuellement aux prescripteurs les lignes directrices actuelles, leur distribuait des tableaux des traitements recommandés et les encourageait à résister devant l’insistance des patients pour recevoir un antibiotique22. Par ailleurs, une étude canadienne prospective menée en clinique médicale a noté que la création d’une ordonnance non pharmacologique à remettre aux patients pour les infections virales des voies respiratoires pouvait faciliter la discussion sur l’usage approprié des antibiotiques. Cette ordonnance contenait des renseignements sur les mesures non pharmacologiques et l’utilisation adéquate des antibiotiques. Elle faisait également en sorte que les patients ne quittaient pas la consultation les mains vides, un détail important étant donné que leur satisfaction ne reposerait pas tant sur l’obtention d’une ordonnance d’antibiotique que sur une communication efficace combinant des informations verbales et écrites sur la gestion de l’infection. Les médecins ont d’ailleurs trouvé que cet outil les aidait à dissuader les patients de prendre un antibiotique dont ils n’avaient pas besoin23.
En pharmacie communautaire, plusieurs activités peuvent aussi optimiser l’usage des antibiotiques, notamment la prescription d’antibiotiques par le pharmacien pour des infections mineures, ce qui peut réduire le recours à d’autres soins de santé et, par conséquent, les coûts du système de santé24. Le projet de loi 31 permet désormais au pharmacien de prescrire une antibiothérapie pour les infections urinaires et les pharyngites en présence d’un strep test positif suite à une ordonnance d’un prescripteur autorisé25. Selon une étude contrôlée sans répartition aléatoire menée dans 39 pharmacies d’officine au Nouveau-Brunswick, le taux de conformité des ordonnances d’antibiotiques pour les infections urinaires rédigées par les pharmaciens était de 95,1 % vs 35,1 % pour les médecins (valeur de p < 0,001)26. Par rapport aux pharmaciens, les médecins prescrivaient des durées de traitement plus longues, notamment pour la nitrofurantoïne (médiane de 6,7 vs 5,1 jours, valeur de p < 0,001) et le sulfaméthoxazole-triméthoprime (4,8 vs 2,9 jours, valeur de p < 0,001), et davantage de fluoroquinolones (10,6 % vs 1,1 %)26. Dans cette même étude, les pharmaciens ont optimisé jusqu’à 45,9 % des traitements non conformes prescrits par les médecins pour une infection urinaire en réduisant la durée du traitement ou en changeant l’agent26. Il est à noter que les modifications des pharmaciens n’ont pas entraîné de diminution significative du taux d’échec au traitement.
Le pharmacien peut améliorer la conformité des prescriptions d’antibiotiques pour la pharyngite, une infection associée à un taux substantiel d’ordonnances inutiles considérant son origine virale la majorité du temps24. Selon une étude prospective canadienne, pour les patients se présentant en pharmacie pour des symptômes s’apparentant à ceux d’une pharyngite, le taux de prescription d’un antibiotique par le pharmacien était de 26,4 %27. Des données d’une étude observationnelle rétrospective canadienne montrent plutôt un taux de prescription de 70 % lorsque les médecins traitent un patient pour les mêmes symptômes28. Par ailleurs, selon une revue systématique, les patients ayant consulté un pharmacien pour la prescription d’un antibiotique pour une infection mineure rapportaient une satisfaction élevée pour les services, l’accessibilité et la rapidité à obtenir une consultation24.
Le pharmacien d’officine occupe une position idéale pour l’enseignement aux patients. Une revue de littérature montre que bien que l’éducation auprès des patients sur l’usage approprié des antibiotiques soit l’intervention la plus fréquente, les données d’efficacité sur cette méthode divergent selon l’indication, l’antibiotique et le secteur de pratique29. Dans une étude à répartition aléatoire québécoise, les médecins qui ont suivi une formation sur la prise de décision partagée avec un patient consultant pour une infection autorésolutive des voies respiratoires ont diminué l’utilisation des antibiotiques en clinique médicale de 25 % risque relatif ajusté : 0,48 ; (IC 95 % : 0,34–0,68)30. La prise de décision partagée, centrée sur les préférences du patient et sur une discussion portant sur les risques et bénéfices de l’antibiothérapie, peut être davantage intégrée dans les consultations avec le pharmacien.
D’autres interventions, telles que la prévention des infections et la promotion de la vaccination, peuvent également être instaurées31. Les taux de vaccination au Québec sont sous-optimaux dans certaines populations. En 2018, seulement 51 % des personnes de 65 ans et plus au Québec rapportaient avoir été vaccinées contre le pneumocoque32. Le pharmacien peut contribuer à l’effort de vaccination en ciblant les patients ayant des calendriers de vaccination incomplets, en leur faisant de l’éducation et en les vaccinant afin de réduire le fardeau des infections à pneumocoque et des prescriptions d’antibiotiques en découlant.
Enfin, le pharmacien d’officine est bien placé pour questionner les patients sur leurs réactions allergiques aux antibiotiques afin de documenter le tout au dossier14. Cette étape demeure cruciale pour assurer la continuité des soins et guider la prescription d’antibiotiques lorsque le profil pharmacologique est transmis à d’autres intervenants. Le pharmacien peut également éduquer les patients sur leurs allergies et les diriger vers une clinique d’allergie s’il le juge pertinent14.
Le rôle du pharmacien ne s’arrête pas au contexte de soins de première ligne. Le pharmacien aux urgences travaille au sein d’une équipe multidisciplinaire, ce qui le place à un endroit privilégié pour améliorer l’usage des antibiotiques.
Une méta-analyse mentionne une diminution, quoique non significative, des retours à l’urgence avec la présence d’un pharmacien dans l’équipe et la mise en place d’un programme d'antibiogouvernance aux urgences (RC : 0,65; IC 95 % : 0,39–1,10)33. Elle associe en outre les activités d’antibiogouvernance des pharmaciens aux urgences à un taux de conformité des prescriptions d’antibiotiques 3,47 fois plus élevé (IC 95 % : 2,39–5,03)33. En effet, la proportion d’ordonnances adéquates augmentait de 3,13 fois avec la validation par le pharmacien de l’agent choisi (IC 95 % : 2,27–4,32) et de 5,23 fois (IC 95 % : 2,68–10,23) avec l’élaboration d’un algorithme de traitement adapté aux résistances locales couplée à des initiatives d’éducation des cliniciens. Une revue exploratoire a, quant à elle, observé une réduction significative des retours à l’urgence dans les 30 jours à la suite des activités d’antibiogouvernance du pharmacien (RC : 0,547; IC 95 % : 0,312–0,960)34.
Enfin, la révision de la validité des allergies aux pénicillines documentées aux dossiers des patients a accru la conformité des prescriptions d’antibiotiques de 45 % à 58 % (valeur de p = 0,018), sans influencer la fréquence des réactions allergiques35.
Selon l’étude de Vaughn et coll., les pharmaciens ont aussi un rôle à jouer dans l’usage optimal des antibiotiques au moment du congé de l’hôpital, considérant que 93,2 % des jours de traitement excédant la durée minimale efficace seraient prescrits à ce moment36. Un essai clinique multicentrique sans répartition aléatoire a obtenu une proportion d’ordonnances optimales 5,63 fois plus élevée quand les pharmaciens vérifiaient les prescriptions avant le congé des patients en utilisant des algorithmes de traitement (IC 95 % : 3,69–8,60), en plus d’une réduction des effets indésirables (RC : 0,40; IC 95 % : 0,18–0,88)37. Une étude de cohorte rétrospective a montré, quant à elle, que la présence d’un pharmacien pour réviser les prescriptions de départ faisait passer le taux d’ordonnances inappropriées de 46 % à 17 % (valeur de p < 0,00001), notamment en écourtant les durées de traitement38. Une étude évaluant une intervention similaire chez des patients atteints de pneumonie a constaté une diminution de la durée moyenne de l’antibiothérapie au moment du congé de 5,2 à 4,2 jours39. Bien que les durées de traitement étaient fréquemment corrigées à la baisse, aucune différence significative n’est ressortie dans ces trois études quant au taux de réadmission après 30 jours.
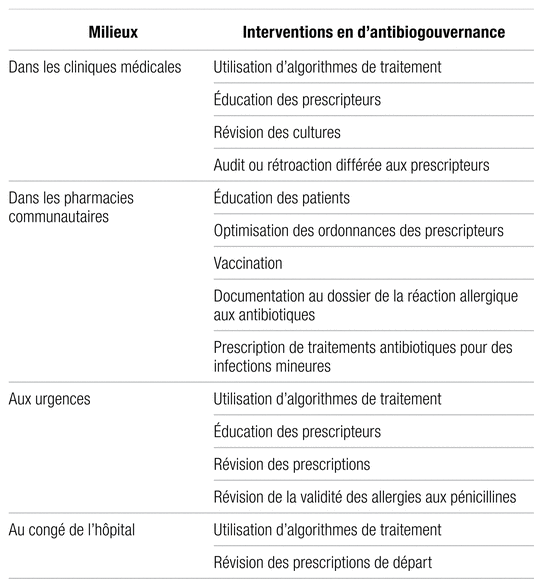
Tableau I Interventions en antibiogouvernance pouvant être effectuées par des pharmaciens en milieu ambulatoire

Au Québec, les GMF sont des lieux propices aux programmes d’antibiogouvernance. La proximité du pharmacien avec le prescripteur favorise une relation de confiance permettant une collaboration interprofessionnelle et augmentant l’influence du pharmacien sur la pratique professionnelle de ses pairs. Par exemple, le pharmacien peut organiser des audits, suggérer subséquemment des formations et des algorithmes de traitement abordant entre autres la notion des durées de traitement d’antibiotique plus courtes, puis mesurer l’effet de cette intervention sur les habitudes de prescription des médecins, tout en offrant de la rétroaction à ces derniers.
L’insistance des patients pour recevoir un traitement peut mener à une ordonnance non indiquée d’antibiotiques15. Pour remédier à cette situation, les pharmaciens peuvent fournir aux médecins des modèles de prescription non pharmacologique pour les infections virales, qui proposent des soins de support pour atténuer les symptômes et expliquent le cours autorésolutif de la maladie et les risques liés aux antibiotiques24. Cette intervention peut d’ailleurs également être implantée en pharmacie d’officine. Enfin, les pharmaciens peuvent intégrer la révision des cultures dans leurs suivis et aviser les médecins lorsqu’un changement thérapeutique est requis.
Dans la mise en œuvre d’un programme d’antibiogouvernance, un responsable doit être nommé. Ce dernier fixera un objectif spécifique, mesurable et réaliste à atteindre dans un délai établi7. Il faut ainsi affecter un ou plusieurs pharmaciens à ces tâches étant donné qu’un pharmacien en GMF y travaille en moyenne 16,3 heures par semaine, ce qui peut constituer une barrière à la mise en œuvre du programme d’antibiogouvernance40.
Le pharmacien d’officine reste un des professionnels de la santé les plus accessibles et a, par conséquent, un rôle fondamental dans l’éducation des patients, que ce soit sur la vaccination, la prévention des infections, l’antibiorésistance ou les allergies aux antibiotiques24. Il peut ainsi promouvoir un meilleur usage des antibiotiques et gérer les attentes des patients lorsque la prise d’antibiotiques n’est pas nécessaire. Qui plus est, il peut contribuer à la vaccination des patients, entre autres contre le pneumocoque, et réduire les prescriptions d’antibiotiques en découlant. L’éducation aux patients, quoique pertinente pour la sensibilisation, a toutefois une efficacité variable selon l’indication et l’antibiotique29.
Comme dernier filet de sécurité avant la remise du médicament au patient, le pharmacien a également l’importante responsabilité de valider les ordonnances d’antibiotiques et de les optimiser au besoin, notamment à l’aide des résultats des cultures s’ils sont disponibles. L’élargissement des activités cliniques du pharmacien, comprenant la prescription d’antibiotiques pour certaines conditions mineures et l’ajustement d’ordonnances pour assurer l’efficacité ou l’innocuité du traitement, permet d’augmenter le nombre de prescriptions d’antibiotiques appropriées et la satisfaction des patients grâce à l’accessibilité des consultations24.
Au Québec, il existe toutefois une vaste hétérogénéité entre les pharmacies d’officine. Dans un contexte de pénurie de pharmaciens, d’un haut taux de roulement de personnel et d’une surcharge de travail liée à plusieurs nouvelles activités, la mise en place d’un programme d’antibiogouvernance peut sembler ardue. Une piste de solution serait la création d’un groupe d’experts chapeautant plusieurs pharmacies d’officine du même secteur. Cette intervention peut être développée et mise en œuvre localement par les comités régionaux sur les services pharmaceutiques (CRSP) et les tables locales et territoriales de pharmaciens. Autrement, parmi les barrières inhérentes au milieu, figurent le manque d’accès aux données pertinentes pour juger si un traitement est approprié ainsi que la difficulté à contacter le prescripteur s’il y a lieu.
Des algorithmes de traitement adaptés aux profils de résistance locaux seraient également utiles aux urgences pour uniformiser les prescriptions d’antibiotiques et augmenter leur conformité aux lignes directrices41. La révision des ordonnances d’antibiotiques par le pharmacien constitue aussi une solution efficace dont l’applicabilité est raisonnable33. Néanmoins, un enjeu majeur reste la charge de travail supplémentaire pour les pharmaciens. Comme solution possible, il y a la formation d’une équipe interdisciplinaire qui se répartirait les diverses responsabilités d’antibiogouvernance. L’intérêt d’une collaboration interprofessionnelle repose également sur la possibilité d’un enseignement aux prescripteurs, intervention qui s’est avérée efficace dans le contexte d’un programme d’antibiogouvernance33. Par ailleurs, les urgences représentent un milieu opportun pour réévaluer la validité d’une allergie aux pénicillines35.
En ce qui concerne l’antibiogouvernance au moment du congé de l’hôpital, la révision des prescriptions de départ par le pharmacien de l’unité de soins est possible et est même déjà appliquée dans certains milieux. Les pharmaciens ont accès aux dossiers médicaux des patients, ce qui leur donne des informations pertinentes sur l’infection afin de déterminer les traitements possibles. Selon une revue de littérature, le changement parfois nécessaire de la forme, de la voie d’administration ou du médicament pour le retour à domicile favorise les ordonnances d’antibiotiques inadéquates36. Grâce à son expertise sur les médicaments, le pharmacien peut s’assurer que l’antibiotique prescrit au congé est approprié pour le patient. Toutefois, ce ne sont généralement pas tous les secteurs cliniques d’un hôpital qui sont dotés d’un pharmacien. Dans ce cas, il est possible d’attribuer à un pharmacien assigné à l’antibiogouvernance la vérification des ordonnances de départ provenant des secteurs sans pharmacien. La conception d’algorithmes de traitement basés sur les profils de résistance locaux pour les infections communes, comme les infections urinaires ou les pneumonies, constitue également une intervention pertinente37. Bien entendu, cette tâche nécessite des ressources et du temps, mais serait rentable à long terme dans le cadre d’un programme d’antibiogouvernance, tel que conclu par les études susmentionnées37–39.
Certaines tendances se dégagent dans la littérature. Les programmes d’antibiogouvernance les plus efficaces sont généralement ceux qui exploitent plus d’une approche, par exemple en combinant des audits et rétroactions à l’élaboration de formations et d’outils pédagogiques21. De surcroît, la création d’une équipe interdisciplinaire semble améliorer l’efficacité des interventions20.
Les données présentées dans cet article comportent certaines limites. Tout d’abord, les lignes directrices ne sont pas toujours mises à jour en fonction des données probantes récentes. Ainsi, qualifier un antibiotique d’inapproprié en se fiant uniquement aux recommandations locales peut s’avérer inadéquat.
Ensuite, la majorité des études mentionnées ont été menées aux États-Unis, où le paysage de soins ambulatoires diffère de celui du Québec. Par exemple, parmi les 9714 pharmaciens recensés au Québec en 2019, 270 travaillaient dans un GMF (2,8 %), tandis que 5 % des pharmaciens américains exerçaient en milieu ambulatoire en 2020, à l’exclusion des pharmacies d’officine40–42. Par conséquent, certaines interventions instaurées dans des milieux où le pharmacien est plus présent aux États-Unis qu’au Québec peuvent être moins réalistes dans le contexte de soins québécois. Par ailleurs, contrairement au Québec, les États-Unis reconnaissent des spécialisations en maladies infectieuses pour les pharmaciens, ce qui peut faciliter l’intégration de ces derniers dans les programmes d’antibiogouvernance. Les interventions relevées dans le présent article ont tout de même été abordées en tenant compte de la réalité et des enjeux des soins pharmaceutiques propres au Québec.
Mener des essais contrôlés avec répartition aléatoire est peu réaliste en contexte de soins ambulatoires vu la nature de ces milieux. Ainsi, la plupart des études dans ces milieux sont des études contrôlées sans répartition aléatoire ou des études avec comparaison pré- et post-intervention qui comportent un risque de biais et fournissent des données de plus faible qualité. Par ailleurs, en raison de la grande hétérogénéité des devis et des issues mesurées, aucune méta-analyse sur les interventions en pharmacie communautaire n’a été repérée. La méthodologie des études sélectionnées a toutefois été revue pour exclure celles comprenant des risques de biais majeurs ou des issues moins pertinentes pour le sujet de l’article.
Une utilisation sous-optimale des antibiotiques a plusieurs conséquences néfastes, dont l’augmentation de l’antibiorésistance, du risque d’effets indésirables et de la survenue d'ICD. Il devient alors primordial et urgent d’être proactif dans l’instauration de programmes d’antibiogouvernance pour conserver l’efficacité des antibiotiques et ainsi réduire les risques pour la santé mondiale, d’autant plus qu’il est impossible de compter uniquement sur le développement de nouveaux antibiotiques. Les pharmaciens en antibiogouvernance ont un réel impact sur le problème, notamment par leur capacité à diminuer les prescriptions d’antibiotiques inappropriées et inutiles. Plus spécifiquement, le pharmacien en milieu ambulatoire s’est montré essentiel pour limiter la progression et les répercussions de l’antibiorésistance, tant dans les cliniques médicales et les pharmacies d'officine qu'aux urgences et au congé de l'hôpital
Les auteurs n’ont déclaré aucun financement lié au présent article.
Tous les auteurs ont soumis le formulaire de l’ICMJE pour la divulgation des conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts lié au présent article.
1. Organisation mondiale de la Santé. Dix ennemis que l’OMS devra affronter cette année. [en ligne] https://www.who.int/fr/news-room/spotlight/ten-threats-to-global-health-in-2019 (site visité le 18 décembre 2022).
2. O’Neill J. Review on antimicrobial resistance. Antimicrobial resistance: Tackling a crisis for the health and wealth of nations (2014). [en ligne] https://amr-review.org/sites/default/files/AMR%20Review%20Paper%20-%20Tackling%20a%20crisis%20for%20the%20health%20and%20wealth%20of%20nations_1.pdf (site visité le 18 décembre 2022).
3. Shurgold J, Volling C, Béïque L, Carson C, Avery B, Rank C et al. Agence de la santé publique du Canada. Système canadien de surveillance de la résistance aux antimicrobiens (29 juin 2020). [en ligne] https://www.canada.ca/content/dam/hc-sc/documents/services/drugs-health-products/canadian-antimicrobial-resistance-surveillance-system-2020-report/CARSS-2020-report-2020-fr.pdf (site visité le 20 mai 2022).
4. Niragira O, Shurgold J, Pelude L, Carson C, Brooks J, Mounchili A et al. Agence de la santé publique du Canada. Rapport du Système canadien de surveillance de la résistance aux antimicrobiens (4 avril 2021). [en ligne] https://www.canada.ca/content/dam/phac-aspc/documents/services/publications/drugs-health-products/canadian-antimicrobial-resistance-surveillance-system-report-2021/rapport-2021-systeme-canadien-surveillance-resistance-antimicrobiens.pdf (site visité le 20 mai 2022).
5. Brown KA, Khanafer N, Daneman N, Fisman DN. Meta-analysis of antibiotics and the risk of community-associated Clostridium difficile infection. Antimicrob Agents Chemother 2013;57:2326–32.


6. Tamma PD, Avdic E, Li DX, Dzintars K, Cosgrove SE. Association of adverse events with antibiotic use in hospitalized patients. JAMA Intern Med 2017;177:1308–15.


7. Sanchez GV, Fleming-Dutra KE, Roberts RM, Hicks LA. Core elements of outpatient antibiotic stewardship. MMWR Recomm Rep 2016;65:1–12.

8. Saatchi A, Reid JN, Povitz M, Shariff SZ, Silverman M, Morris AM et al. Appropriateness of outpatient antibiotic use in seniors across two Canadian provinces. Antibiotics (Basel) 2021;10:1484.


9. Parsels KA, Kufel WD, Burgess J, Seabury RW, Mahapatra R, Miller CD et al. Hospital discharge: an opportune time for antimicrobial stewardship. Ann Pharmacother 2021;56: 869–77.

10. Wald-Dickler N, Spellberg B. Short-course antibiotic therapy-replacing constantine units with “shorter is better”. Clin Infect Dis 2019;69:1476–9.


11. Williams DJ, Creech CB, Walter EB, Martin JM, Gerber JS, Newland JG et al. Short- vs standard-course outpatient antibiotic therapy for community-acquired pneumonia in children: the SCOUT-CAP randomized clinical trial. JAMA Pediatr 2022;176:253–61.


12. Denny KJ, Gartside JG, Alcorn K, Cross JW, Maloney S, Keijzers G. Appropriateness of antibiotic prescribing in the emergency department. J Antimicrob Chemother 2019;74:515–20.


13. Kiel A, Catalano A, Clark CM, Wattengel BA, Mason J, Sellick J et al. Antibiotic prescribing in the emergency department versus primary care: implications for stewardship. J Am Pharm Assoc 2020;60:789–95.e2.

14. Kufel WD, Justo JA, Bookstaver PB, Avery LM. Penicillin allergy assessment and skin testing in the outpatient setting. Pharmacy (Basel) 2019; 7:136.


15. Marcelin JR, Chung P, Van Schooneveld TC. Antimicrobial stewardship in the outpatient setting: a review and proposed framework. Infect Control Hosp Epidemiol 2020;41:833–40.

16. CDC. Antibiotic resistance threats in the United States 2019. [en ligne] https://www.cdc.gov/drugresistance/pdf/threats-report/2019-ar-threats-report-508.pdf (site visité le 20 mai 2022).
17. Association des pharmaciens des établissements de santé du Québec (A.P.E.S.). Rôle du pharmacien d’établissement en infectiologie–Recommandations. Guide de pratique élaboré par le Regroupement de pharmaciens experts en infectiologie. [en ligne] https://www.apesquebec.org/sites/default/files/publications/ouvrages_specialises/20210323_RPEI_GDP_vf.pdf (site visité le 18 décembre 2022).
18. Barlam TF, Cosgrove SE, Abbo LM, MacDougall C, Schuetz AN, Septimus EJ et al. Implementing an antibiotic stewardship program: Guidelines by the Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America. Clin Infect Dis 2016;10:51–77.

19. Wattengel BA, Sellick JA, Mergenhagen KA. Outpatient antimicrobial stewardship: Optimizing patient care via pharmacist led microbiology review. Am J Infect Control 2020;48:189–193.

20. Cubillos AL, Patch ME, Chandler EL, Lynch LW, Gieselman MR, Saunders MB et al. Antimicrobial stewardship intervention bundle decreases outpatient fluoroquinolone prescribing for urinary tract infections. Infect Control Hosp Epidemiol 2022:1–3.
21. Saha SK, Hawes L, Mazza D. Effectiveness of interventions involving pharmacists on antibiotic prescribing by general practitioners: a systematic review and meta-analysis. J Antimicrob Chemother 2019;74:1173–81.

22. Ilett KF, Johnson S, Greenhill G, Mullen L, Brockis J, Golledge C et al. Modification of general practitioner prescribing of antibiotics by use of a therapeutics adviser (academic detailer). Br J Clin Pharmacol 2000;49:168–73.


23. Lee C, Jafari M, Brownbridge R, Phillips C, Vanstone JR. The viral prescription pad–A mixed methods study to determine the need for and utility of an educational tool for antimicrobial stewardship in primary health care. BMC Fam Pract 2020;21:42.

24. Wu JH, Khalid F, Langford BJ, et al. Community pharmacist prescribing of antimicrobials: A systematic review from an antimicrobial stewardship perspective. Can Pharm J 2021; 154:179–92.

25. Ordre des pharmaciens du Québec. Guide d’exercice : les activités professionnelles du pharmacien. [en ligne] https://www.opq.org/wp-content/uploads/2020/12/Guide_exercice_nouv_act_16dec2020.pdf (site visité le 18 décembre 2022).
26. Beahm NP, Smyth DJ, Tsuyuki RT. Antimicrobial utilization and stewardship in patients with uncomplicated urinary tract infections managed by pharmacists in the community: A sub-study of the RxOUTMAP trial. J Assoc Med Microbiol Infect Dis Can 2021;6:205–12.

27. Papastergiou J, Trieu CR, Saltmarche D, Diamantouros A. Community pharmacist-directed point-of-care group A Streptococcus testing: Evaluation of a Canadian program. J Am Pharm Assoc 2018;58:450–6.

28. Schwartz KL, Langford BJ, Daneman N, Chen B, Brown K, McIsaac W et al. Unnecessary antibiotic prescribing in a Canadian primary care setting: a descriptive analysis using routinely collected electronic medical record data. CMAJ 2020;E360–E369.

29. Lambert M, Smit CCH, De Vos S, Benko R, Llor C, Paget WJ et al. A systematic literature review and meta-analysis of community pharmacist-led interventions to optimise the use of antibiotics. Br J Clin Pharmacol 2022;88:2617–41.


30. Légaré F, Labrecque M, Cauchon M, Castel J, Turcotte S, Grimshaw J. Training family physicians in shared decision-making to reduce the overuse of antibiotics in acute respiratory infections: a cluster randomized trial. CMAJ 2012; 184:E726–34.


31. Ashiru-Oredope D, Doble A, Thornley T, Saei A, Gold N, Sallis A et al. Improving management of respiratory tract infections in community pharmacies and promoting antimicrobial stewardship: a cluster randomised control trial with a self-report behavioural questionnaire and process evaluation. Pharmacy (Basel) 2020;8:44.


32. Deceuninck G, Lefebvre B, De Wals P, Brousseau N. Institut national de santé publique du Québec. Programme de surveillance du pneumocoque : rapport 2018 (22 septembre 2020). [en ligne] https://www.inspq.qc.ca/sites/default/files/publications/2684_programme_surveillance_pneumocoque_2018.pdf (site visité le 20 mai 2022).
33. Kooda K, Canterbury E, Bellolio F. Impact of pharmacist-led antimicrobial stewardship on appropriate antibiotic prescribing in the emergency department: a systematic review and meta-analysis. Ann of Emerg Med 2022;79: 374–87.

34. Jorgensen SCJ, Yeung SL, Zurayk M, Terry J, Dunn M, Nieberg P et al. Leveraging antimicrobial stewardship in the emergency department to improve the quality of urinary tract infection management and outcomes. Open Forum Infect Dis 2018;6:ofy101.

35. Campbell S, Hauler G, Immler EL, Seiti S, Dandache P, Srinivas P. Pharmacist-led penicillin allergy assessment in the emergency department reduced empiric fluoroquinolone use. Clin Infect Dis 2020;71:e506–8.
36. Vaughn VM, Flanders SA, Snyder A, Conlon A, Rogers MAM, Malani AN et al. Excess antibiotic treatment duration and adverse events in patients hospitalized with pneumonia: a multihospital cohort study. Ann Intern Med 2019;171:153–63.

37. Mercuro NJ, Medler CJ, Kenney RM, MacDonald NC, Neuhauser MM, Hicks LA et al. Pharmacist-driven transitions of care practice model for prescribing oral antimicrobials at hospital discharge. JAMA network Open 2022;5:e2211331.


38. Spigelmyer A, Howard C, Rybakov I, Burwell S, Slain D. 96. Impact of hospital-based pharmacist discharge prescription review on the appropriateness of antibiotic therapy. Open Forum Infect Dis 2021;8(suppl.1):163.


39. Caplinger C, Crane K, Wilkin M, Bohan J, Remington R, Madaras-Kelly K. Evaluation of a protocol to optimize duration of pneumonia therapy at hospital discharge. Am J Health Syst Pharm 2016;73:2043–54.

40. Réseau québécois des pharmaciens GMF. Organisation du travail des pharmaciens GMF (janvier 2020). [en ligne]. https://drive.google.com/file/d/13z4Pd-ESd7U4XJ-F9LWBH2s6YGh__N-p/view (site visité le 28 mai 2022).
41. Stoll K, Feltz E, Ebert S. Pharmacist-driven implementation of outpatient antibiotic prescribing algorithms improves guideline adherence in the emergency department. J Pharm Pract 2021;34:875–81.

42. Bureau of Labor Statistics. U.S. Department of Labor. Occupational Outlook Handbook, Pharmacists (18 avril 2022). [En ligne] https://www.bls.gov/ooh/healthcare/pharmacists.htm#tab-3 (site visité le 7 juin 2022).
PHARMACTUEL, Vol. 56, No. 2, 2023