Audrey Vachon1,2, B.Pharm., M.Sc., Sylvie Pilote3, M.Sc., Benoît Drolet4,5, B.Pharm., Ph.D., Chantale Simard1,4,5, B.Pharm., M.Sc., Ph.D.
1Pharmacienne, Institut universitaire de cardiologie et de pneumologie de Québec–Université Laval, Québec (Québec) Canada
2Professeure de clinique, Faculté de pharmacie, Université Laval, Québec (Québec) Canada
3Professionnelle de recherche, Centre de recherche de l’Institut universitaire de cardiologie et de pneumologie de Québec–Université Laval, Québec (Québec) Canada
4Professeur titulaire, Faculté de pharmacie, Université Laval, Québec (Québec) Canada
5Chercheur, Institut universitaire de cardiologie et de pneumologie de Québec–Université Laval, Québec (Québec) Canada
Reçu le 29 septembre 2022; Accepté après révision par les pairs le 13 février 2023
Résumé
Objectif: Comparer la stabilité de la pénicilline G sodique reconstituée avec de l’eau stérile ou avec une solution tamponnée avec du citrate de sodium.
Méthode: Des fioles de pénicilline ont été reconstituées avec de l’eau stérile ou avec du citrate de sodium à 1,7 %, conditionnées en seringue ou en sac de polychlorure de vinyle (PVC) contenant du NaCl 0,9 %, puis conservées au réfrigérateur et à température ambiante. La chromatographie liquide à haute performance a été utilisée pour mesurer la concentration de pénicilline résiduelle en fonction du temps.
Résultats: Par rapport à une reconstitution avec de l’eau stérile, l’ajout du tampon citrate permet aux préparations en seringue ou en sac de PVC de conserver plus de 90 % de leur concentration initiale de pénicilline jusqu’à neuf jours, plutôt que cinq, lorsque la réfrigération est maintenue. Lorsque les sacs de PVC sont placés 24 heures à température ambiante après un entreposage de 48 heures à 6 °C, la concentration résiduelle diminue à 80 % pour la pénicilline reconstituée avec l’eau. Toutefois, lorsque le citrate de sodium est employé, même après neuf jours d’entreposage à 6°C, puis 24 heures à température ambiante, la concentration résiduelle demeure supérieure à 90 %.
Conclusion: L’utilisation du citrate de sodium pour reconstituer la pénicilline G sodique permet d’en prolonger substantiellement la stabilité, que la pénicilline soit conditionnée en seringue ou en sac, entreposée au réfrigérateur ou à température ambiante.
Mots clés: Pénicilline G sodique, préparation de médicament, stabilité médicamenteuse
Abstract
Objective: To compare the stability of penicillin G sodium reconstituted with sterile water or a sodium citrate-buffered solution.
Method: Vials of penicillin were reconstituted with sterile water or 1.7% sodium citrate, packaged in syringes or polyvinyl chloride (PVC) bags containing 0.9% NaCl, and stored in the refrigerator and at room temperature. High-performance liquid chromatography was used to measure the concentration of residual penicillin as a function of time.
Results: Compared to reconstitution with sterile water, adding citrate buffer enables syringe and PVC bag preparations to retain more than 90% of their initial penicillin concentration for up to 9 days instead of 5 when refrigeration is maintained. When PVC bags are left at room temperature for 24 hours after 48 hours of storage at 6°C, the residual concentration decreases to 80% for penicillin reconstituted with water. However, when sodium citrate is used, even after 9 days of storage at 6°C followed by 24 hours at room temperature, the residual concentration remains above 90%.
Conclusion: The use of sodium citrate to reconstitute penicillin G sodium substantially prolongs its stability, whether the penicillin is packaged in a syringe or bag or stored in the refrigerator or at room temperature.
Keywords: Drug preparation, drug stability, penicillin G sodium
La pénicilline, un antibiotique à spectre étroit, est indiquée dans la prise en charge de plusieurs infections, dont certaines nécessitant des traitements prolongés1. Une fois reconstitué, cet anti-infectieux tend à se dégrader rapidement, sa stabilité physicochimique dépendant grandement de la température de conservation et du pH de la solution2,3. À 25 °C, la stabilité maximale de la pénicilline G sodique injectable est obtenue lorsque le pH du diluant servant à sa reconstitution est ajusté à 6,8, quoique la dégradation est relativement stable pour des valeurs de pH entre 6,5 et 7,54. La pénicilline G sodique injectable reconstituée avec de l’eau stérile et diluée dans le chlorure de sodium (NaCl) 0,9 % à raison de 12 mg/mL et de 48 mg/mL possède un pH initial entre 5,4 et 5,8, ce qui explique en grande partie son instabilité physicochimique4.
Pendant plusieurs années, une des préparations génériques de pénicilline G sodique injectable en vente au Canada, produite par la compagnie Teva Canada, était tamponnée avec du citrate de sodium et de l’acide citrique, préajoutés à même la fiole. Selon la monographie, chaque million d’unités (MU) de pénicilline contenait environ 28 mg de tampon citrate (composé surtout de citrate de sodium et d’un maximum de 0,92 mg d’acide citrique)5. Cet ajout avait pour effet de contrôler le pH afin de prolonger de façon substantielle la stabilité de l’antibiotique conservé au réfrigérateur ou à température ambiante après reconstitution5,6. Ce produit n’est plus offert sur le marché, et les données de stabilité de la pénicilline non tamponnée sont décevantes4. De plus, les articles traitant de la stabilité de la pénicilline G sodique injectable ne précisent pas tous clairement si le produit étudié était commercialement tamponné (pour ajuster le pH). Un doute persiste donc à savoir si l’antibiotique est assez stable à température ambiante pour être administré en continu dans le cadre d’une antibiothérapie par voie intraveineuse à domicile2,7.
Dans les années 1990, après l’arrêt de la commercialisation de la pénicilline prétamponnée au Royaume-Uni, Alwood et Brown ont étudié l’effet de l’ajout d’un tampon citrate contenant 44,6 g/L de citrate de sodium et 0,4 g/L d’acide citrique sur la stabilité de l’antibiotique (définie comme étant la rétention d’au moins 90 % de la concentration initiale)3,4. Leurs recherches ont permis de déterminer que la stabilité de la pénicilline (12 mg/mL) conservée à 5 °C était de 28 jours lorsqu’elle était reconstituée avec le tampon citrate (pH entre 6,5 et 7,5), puis diluée dans un mini-sac de 50 mL de NaCl 0,9 %. Le témoin, quant à lui, reconstitué avec de l’eau stérile conformément aux recommandations du fabricant, présentait une stabilité de seulement 48 heures dans les mêmes conditions4.
En 2014, en Australie, Mc Dougall et coll. ont évalué la stabilité de l’antibiotique reconstitué avec du citrate de sodium à 4 % et dilué dans du NaCl 0,9 % pour une concentration finale de 50 000 unités/mL et de 100 000 unités/mL. Ces préparations étaient conditionnées dans un dispositif élastomérique permettant une perfusion continue. Elles étaient ensuite entreposées au réfrigérateur pendant sept jours, puis à 31 °C ou à 37 °C pendant 24 heures8. Ils ont noté que la concentration de l’antibiotique n’avait aucun effet sur la stabilité au jour huit. Ils ont observé que la pénicilline tamponnée conservait toujours une moyenne de 102 % de la concentration initiale après sept jours au réfrigérateur et que si ces échantillons étaient par la suite maintenus 24 heures additionnelles à des températures de 31 °C ou 37 °C, cette moyenne diminuait à 98 % et 93 % respectivement. Le témoin reconstitué avec de l’eau stérile ne contenait plus que 84 % de la concentration initiale après sept jours au réfrigérateur et que 1 % de la concentration initiale (dégradation quasi totale) après avoir passé 24 heures supplémentaires à 37 °C8.
Le citrate de sodium injectable à 4 % est en vente au Canada et sert surtout à l’anticoagulation régionale des systèmes de circulation extracorporelle (tels que l’aphérèse, l’hémofiltration et l’hémodialyse) ou encore au verrouillage des cathéters veineux en remplacement de l’héparine9,10. En principe, il n’est pas destiné à une utilisation intraveineuse directe 9,11. Il exerce son effet anticoagulant en chélatant le calcium, un élément essentiel à la coagulation10. D’un point de vue physiologique, le citrate est métabolisé par le cycle de Krebs, principalement dans le foie, mais aussi dans les muscles et les reins. Chaque molécule de citrate métabolisée produit trois molécules de bicarbonate10. Les complications redoutées en cas de surdose sont surtout l’hypocalcémie et l’alcalose métabolique. Toutefois, ces effets indésirables ne se manifestent que lorsque les clairances du foie et du circuit extracorporel sont inférieures à la vitesse de perfusion10,12. Après plusieurs traitements extracorporels, la charge de citrate retournant dans la circulation systémique du patient est d’environ 0,3 à 0,5 mmol/kg/h10. Par ailleurs, selon des études sur les animaux, on estime que la vitesse maximale de perfusion respectant la clairance hépatique du produit chez l’humain est de 1,2 mmol/kg/h8, soit 1440 mmol sur une période de 24 heures pour un patient de 50 kg. Dans l’étude de McDougall et coll., la quantité totale de citrate de sodium administrée avec la dose maximale quotidienne de 24 MU de pénicilline (14,4 g de pénicilline) était de 5,6 mmol, soit bien en deçà des capacités métaboliques d’un patient. Ce résultat se veut donc rassurant du point de vue de l’innocuité8.
À l’Institut universitaire de cardiologie et de pneumologie de Institut universitaire de cardiologie et de pneumologie de Québec–Université Laval (IUCPQ-UL), la pénicilline G sodique est reconstituée avec de l’eau stérile, puis diluée dans du NaCl 0,9 % jusqu’à un volume final de 50 mL pour les doses de 1 à 4 MU (concentrations finales des seringues de 20 000 à 80 000 unités/mL). La stabilité physicochimique est estimée à 48 heures, selon une extrapolation des données obtenues en sac de PVC pour les concentrations de 20 000 à 80 000 unités/mL7. Pour les patients quittant l’hôpital et devant poursuivre leur traitement à domicile, un sac contenant toutes les doses de pénicilline G sodique requises pour 24 heures est installé sur une pompe à perfusion ambulatoire. Ce sac (PVC) est préparé en reconstituant les fioles avec de l’eau stérile et en diluant ensuite la dose quotidienne avec du dextrose 5 % jusqu’à une concentration fixe en pénicilline G sodique de 37 037 unités/mL. Cette modalité est contraignante, mais permet d’attribuer une date limite d’utilisation de neuf jours lorsque l’antibiotique est conservé au réfrigérateur, selon l’étude de Rayani et coll.13. Dans cette publication canadienne de 1985, les auteurs montrent que la pénicilline G sodique injectable de la compagnie Ayerst reconstituée avec de l’eau stérile pour injection, puis diluée avec du dextrose 5 % pour une concentration finale de 37 037 unités/mL, est toujours stable après 39 jours de congélation à −20 °C, suivis de 31 jours au réfrigérateur à 5 °C13. Or, il n’est pas possible de confirmer hors de tout doute que la compagnie Ayerst ajoutait commercialement un tampon à sa préparation de pénicilline G sodique injectable en 1985. On ne peut ainsi présumer que la préparation utilisée en perfusion continue, demeurant à température ambiante durant 24 heures, est stable d’un point de vue physicochimique durant toute la durée d’administration.
C’est donc sur la monographie 2014 de la pénicilline G sodique injectable tamponnée de Teva Canada, qui n’est plus commercialisée, ainsi que sur les publications de Allwood et Brown et de McDougall et coll. que la présente étude s’appuie3,4,5,8. Cette dernière a pour but de comparer la stabilité de la pénicilline G sodique reconstituée avec de l’eau stérile ou avec un tampon de citrate de sodium, lorsqu’elle est conditionnée en seringue aux concentrations de 40 000 et 120 000 unités/mL ou en sac de PVC (NaCl 0,9 %) aux concentrations de 32 000 et de 64 000 unités/mL. Toutes ces préparations sont conservées au réfrigérateur, puis à température ambiante pendant 24 heures additionnelles afin de simuler les conditions que subit une préparation utilisée en perfusion continue. Les concentrations de pénicilline G sodique injectable étudiées ont été sélectionnées afin de permettre l’administration de doses unitaires de 1 à 5 MU de pénicilline en seringues, ainsi que la perfusion d’une dose quotidienne de 8 à 24 MU en soluté de NaCl 0,9 % à l’aide d’une pompe ambulatoire. La concentration en citrate de sodium du diluant a été élaborée de façon à reproduire ce qui était autrefois vendu par Teva. À l’époque, une fiole de pénicilline G sodique injectable de 10 MU de Teva contenait 280 mg de citrate de sodium (soit 28 mg par MU) pour un volume total de 20 mL après reconstitution avec 16,2 mL de diluant5. Pour obtenir le même résultat, nous avons fabriqué un diluant de citrate de sodium à 1,7 % pour permettre l’ajout de 280 mg de citrate de sodium à la fiole de pénicilline de 10 MU, tout en respectant le volume de diluant de 16,2 mL (concentration finale du tampon = 17,3 mg/mL ou 1,7 %).
Les fioles commerciales de 10 MU de pénicilline G sodique injectable (Fresenius Kabi Canada, Toronto ON, lot 306180) ont été reconstituées de façon aseptique avec de l’eau stérile (Baxter Corporation, Mississauga ON, lot W0L08A0) ou avec du citrate de sodium à 1,7 % fabriqué à partir d’eau stérile (Baxter Corporation, Mississauga ON, lot W0L08A0) et de seringues de citrate de sodium à 4 % (MedXL, Pointe-Claire QC, lot 14381). Après une dilution ultérieure de la pénicilline G sodique injectable avec du NaCl 0,9 % (Baxter Corporation, lot W0J23MO et W1C28A0), les solutions ont été conditionnées en seringues de polypropylène de 50 mL (Becton, Dickinson and Company, Franklin Lakes NJ) ou en sacs de PVC contenant 250 mL de NaCl 0,9 % (Baxter Corporation, lot W0L04C0).
Les seringues commerciales de citrate de sodium à 4 % de MedXL contiennent 4 g de citrate de sodium pour 100 mL. En prélevant 7 mL de ces seringues, on obtient 280 mg de citrate de sodium. En ajoutant ensuite 9,2 mL d’eau, on obtient 280 mg de citrate de sodium pour un volume total de 16,2 mL, c’est-à-dire une reproduction fidèle de la concentration en citrate de la monographie 2014 de Teva, soit 280 mg de citrate/16,2 mL, ou 1,7 g/100 mL, et donc, 1,7 % de citrate de sodium5.
Les fioles de 10 MU de pénicilline G sodique injectable ont été reconstituées selon les recommandations du fabricant avec 16,2 mL d’eau stérile ou avec le même volume de citrate de sodium à 1,7 % pour une concentration de 500 000 unités/mL. Des doses de 2 MU et de 6 MU diluées avec du NaCl 0,9 % pour un volume total de 50 mL (concentration de 40 000 unités/mL et de 120 000 unités/mL respectivement) ont été préparées aseptiquement en triplicata pour chaque diluant. Des aliquotes de chacune des 12 seringues ont été prélevées et analysées aux temps préspécifiés suivants : immédiatement après la préparation (T0), après 24 heures d’entreposage à température ambiante (T0 + 24 h) et après réfrigération durant 48, 120, 216, 336 et 720 heures à 6 °C.
Les fioles de 10 MU de pénicilline G sodique injectable ont été reconstituées tel que mentionné précédemment. Les sacs de 8 MU ont été préparés en triplicata de façon aseptique pour chaque diluant étudié en retirant 16 mL d’un sac de 250 mL de NaCl 0,9 % avant d’y injecter 16 mL de pénicilline G sodique injectable à 500 000 unités/mL (concentration finale : 32 000 unités/mL). Les sacs de 16 MU ont aussi été préparés en trois exemplaires pour chaque diluant en retirant 32 mL d’un sac de 250 mL de NaCl 0,9 % avant d’y injecter 32 mL de pénicilline G sodique injectable (concentration finale : 64 000 unités/mL). Des analyses ont été planifiées sur des aliquotes prélevées des 12 sacs de PVC aux temps prédéterminés suivants : immédiatement après la préparation (T0), après 24 heures d’entreposage à température ambiante (T0 + 24 h) et après réfrigération durant 48, 120, 216, 336 et 720 heures à 6 °C. Pour simuler l’utilisation de ces sacs dans un contexte d’antibiothérapie par voie intraveineuse à domicile, des analyses supplémentaires ont été prévues pour des échantillons prélevés après 48 et 216 heures de réfrigération et maintenus à température ambiante durant 24 heures additionnelles.
La mesure de la concentration en pénicilline G sodique de chaque série d’analyse aux intervalles préspécifiés s’est poursuivie tant et aussi longtemps qu’au moins 90 % de la concentration initiale était mesurée et que, par conséquent, le produit était encore considéré comme chimiquement stable selon la United States Pharmacopeia (USP)14.
Selon une méthode de Moine et coll. légèrement modifiée, la concentration de pénicilline G sodique a été déterminée par chromatographie liquide à haute performance (HPLC) avec le système Prominence de Shimadzu (Columbia MD) (composé d’un échantillonneur automatique SIL-20AC maintenu à 6 °C, d’une pompe LC-20AD et d’un détecteur UV-visible SPD-20A)15. La séparation chromatographique de la pénicilline G sodique a été effectuée en isocratique, à 30 °C et à raison de 1 mL/min, à l’aide d’une colonne Ultrasphere ODS 5μ, 250 X 4,6 mm (Canadian Life Technologies, Burlington ON) et d’une précolonne μ-Bondapack C18 (Waters, Mississauga ON). La phase mobile était constituée d’un tampon phosphate de 10 mM à pH 8,0 et d’acétonitrile (dans une proportion 80:20) auquel 0,1 % de triéthylamine a été ajouté. La détection a eu lieu à 240 nm (le pic de pénicilline G sodique éluant à 6,3 min).
Un échantillon de chaque préparation de pénicilline G sodique, en triplicata, a été prélevé, le pH a été mesuré, et l’échantillon a été dilué par un facteur de 1:100 (pour les concentrations de 32 000, 40 000 et 64 000 unités/mL) et de 1:200 (pour la concentration de 120 000 unités/mL) immédiatement avant l’analyse chromatographique, pour chacun des temps susmentionnés. Un échantillon supplémentaire a aussi été prélevé et maintenu à température ambiante pendant 24 heures additionnelles au temps 0, pour les conditionnements en seringue (eau ou citrate), et aux temps 0, 48 et 216 heures pour les conditionnements en sac (eau ou citrate) avant d’être dilué pour analyse. Cinquante microlitres ont été injectés dans l’appareil. Les aires sous la courbe du pic de pénicilline G sodique mesurées pour chacune des préparations aux différents temps ont été comparées à leur temps 0 respectif afin de déterminer les pourcentages encore présents.
Une courbe standard (0–40 μg) de pénicilline G sodique (Toronto Research Chemicals (TRC), North York ON) a été préparée pour évaluer la linéarité de la méthode dans l’intervalle de concentrations attendues pour les dosages à venir. Un coefficient de détermination R2 de 0,998 a été calculé pour la zone quantifiable. La correspondance entre la quantité injectée et le nombre d’unités a ensuite été calculée par une courbe faite avec des dilutions subséquentes d’une fiole commerciale de 10 MU de pénicilline G sodique injectable préparée selon les recommandations du fabricant.
Les analyses statistiques ont été effectuées à l’aide d’un modèle linéaire mixte avec le logiciel SAS version 9,4 (SAS Institute, Cary, NC). Toutes les données présentées sont des moyennes des triplicatas ou de pourcentages ± écarts-types. Une valeur de p < 0,05 était considérée comme significative.
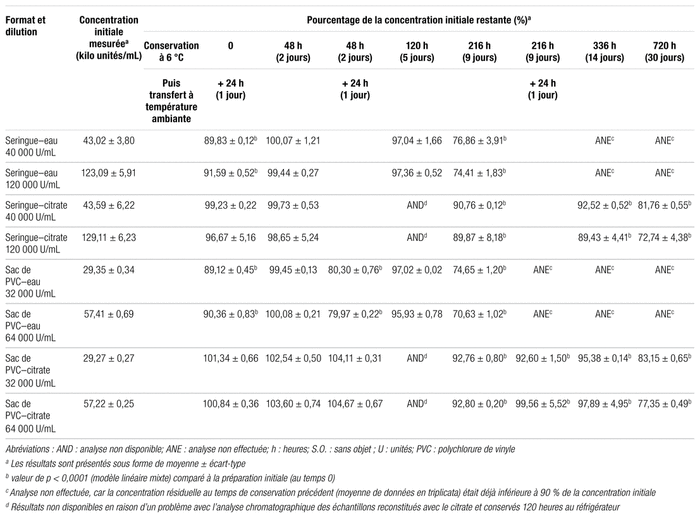
Comme on peut le voir dans le tableau I, peu importe la concentration et le type de conditionnement, la pénicilline G sodique injectable reconstituée avec de l’eau stérile conserve plus de 90 % de sa concentration initiale jusqu’à 5 jours au réfrigérateur. Et lorsqu’elle est diluée avec du citrate à 1,7 %, environ 90 % de la concentration initiale est encore présente après 9 jours au réfrigérateur. En ce qui concerne plus particulièrement la seringue de pénicilline G reconstituée avec le citrate et concentrée à 120 000 unités/mL, la concentration résiduelle de 89,87 % trouvée au jour 9 a été considérée comme cliniquement acceptable, puisque cette valeur n’est que très légèrement inférieure au seuil de 90 % établi par l’USP.
Comme nous nous y attendions, le transfert de l’antibiotique du réfrigérateur à la température ambiante a eu un effet négatif significatif sur la stabilité du produit lorsqu’il est reconstitué avec de l’eau stérile comme le recommande le fabricant. Le sac de PVC de pénicilline G sodique injectable fraîchement préparé puis installé immédiatement sur la pompe à perfusion ambulatoire lors du début de l’antibiothérapie intraveineuse à domicile présente encore 90 % de la concentration initiale après 24 heures à température ambiante, peu importe la concentration du produit. Toutefois, bien que le sac de pénicilline G sodique injectable reconstituée avec de l’eau conserve encore plus de 99 % de la concentration initiale après 48 heures d’entreposage au réfrigérateur, cette valeur diminue autour de 80 % après 24 heures supplémentaires à la température ambiante, ce qui est nettement sous le seuil de 90 %. La reconstitution de la pénicilline G sodique injectable avec le citrate de sodium à 1,7 % élimine ce problème, car les pourcentages de la concentration initiale présents après 9 jours de conservation au réfrigérateur, puis 24 heures à température ambiante sont de 92,60 % et de 99,56 % pour les concentrations de 32 000 et de 64 000 unités/mL, respectivement.
Tableau I Concentration de pénicilline G sodique injectable présente en solution, selon divers conditionnements et conditions/temps d’entreposage

Le pH du citrate de sodium à 1,7 % servant à reconstituer la pénicilline G sodique injectable est de 6,96, une valeur considérée optimale pour favoriser la stabilité physicochimique de l’antibiotique4. La figure 1 illustre l’évolution du pH en fonction du temps d’entreposage à 6 °C pour les préparations de pénicilline G sodique injectable reconstituées avec de l’eau et du citrate. Lorsque le citrate est utilisé, le pH initial de la solution est plus élevé et se rapproche davantage de la valeur de 6,8, ce qui favorise la stabilité de la molécule de pénicilline G sodique4. De plus, le pH diminue plus rapidement en fonction du temps d’entreposage au réfrigérateur lorsque la préparation n’est pas tamponnée.
L’utilisation du citrate de sodium à 1,7 % pour reconstituer la pénicilline G sodique injectable confère un avantage certain pour la stabilité du produit. Comme nous avons pu l’observer, le pH de la solution antibiotique diminue à mesure que se dégrade la pénicilline G sodique. Cette diminution est beaucoup plus lente lorsque la pénicilline G sodique injectable est reconstituée avec le citrate, ce qui se traduit par une meilleure stabilité de l’antibiotique.
Concrètement, le fait de reconstituer la pénicilline G sodique injectable avec le citrate de sodium à 1,7 % permet la préparation aseptique de plusieurs doses, en lots, pour couvrir jusqu’à neuf jours de traitement pour les usagers hospitalisés pour qui il est possible de conserver le produit réfrigéré jusqu’à l’administration. Les doses d’antibiotique reconstituées avec de l’eau stérile étaient quant à elles stables durant 5 jours au réfrigérateur, ce qui semble concorder avec les données de Mc Dougall et coll.8.
|
| ||
|
Figure 1 Évolution du pH de la solution de pénicilline G sodique injectable en fonction du temps d’entreposage à 6 °C
| ||
Le tampon de citrate de sodium à 1,7 % s’avère un avantage indéniable pour la clientèle ambulatoire. À la lumière des résultats obtenus, la reconstitution de la pénicilline G sodique avec de l’eau stérile et la dilution subséquente avec le NaCl 0,9 % (tel que recommandé par le fabricant) pour des doses d’antibiotiques destinées à être administrées par une pompe ambulatoire, permet une utilisation sûre du produit pendant au plus 24 heures à température ambiante. Il aurait été intéressant de mesurer la concentration résiduelle lorsque la pénicilline reconstituée avec de l’eau et conditionnée en sac est conservée 24 heures au réfrigérateur, puis 24 heures à température ambiante pour valider si cette courte stabilité pourrait être légèrement allongée. Quoi qu’il en soit, il aurait fallu préparer aseptiquement deux sacs (PVC) d’antibiotique tous les deux jours, le premier devant être installé sur la pompe le jour même et le second servant à la perfusion du lendemain. Ultimement, cet horaire de préparation n’aurait pas été plus compatible avec les services ambulatoires en place pour les usagers qui habitent en région plus éloignée ou qui n’ont pas de pharmacie habilitée à préparer des produits injectables stériles à proximité, ce qui représente un fardeau clinique non négligeable. Heureusement, l’utilisation du citrate de sodium pourrait offrir maintenant une avenue thérapeutique sûre pour la clientèle ambulatoire sous perfusion continue de pénicilline G sodique. Les résultats obtenus semblent indiquer qu’il serait possible de préparer plusieurs sacs à la fois, puisque la stabilité du produit est de neuf jours au réfrigérateur, puis de 24 heures à température ambiante.
Lorsque les échantillons testés par chromatographie liquide à haute performance (HPLC) présentaient des concentrations résiduelles de pénicilline G sodique nettement en deçà du seuil minimal de 90 % de la concentration initiale, comme l’exige l’USP, nous avons considéré qu’il n’était plus nécessaire de poursuivre l’analyse pour les temps ultérieurs. En effet, il semble raisonnable de postuler que les concentrations résiduelles ultérieures auraient été encore plus faibles et forcément, encore plus loin du seuil minimal de 90 % de la concentration initiale. Ainsi, une telle préparation de pénicilline G sodique injectable ne pourrait, de toute façon, être utilisée chez un patient. Cette dégradation plus importante a été observée pour toutes les préparations de pénicilline G sodique diluées avec de l’eau stérile (en seringue ou en sac de PVC), après 9 jours de conservation à 6 °C. Puisque toutes les données présentées sont des moyennes en triple exemplaire, la possibilité d’une erreur de mesures est considérablement diminuée. De plus, les préparations reconstituées avec l’eau stérile (en seringue et en sac de PVC) comportent des patrons similaires de dégradation en fonction du temps, renforçant ainsi la validité des mesures. De tels modèles de dégradation, lorsque la pénicilline est reconstituée avec de l’eau stérile, ont d’ailleurs été observés aussi dans les études de Allwood et Brown4 et de McDougall et coll.8. Enfin, les analyses ont été effectuées en deux volets (deux préparations par période), ce qui écarte davantage la possibilité d’une erreur de mesure sur un temps spécifique.
Les chromatogrammes obtenus pour les échantillons reconstitués avec le citrate et conservés 120 heures au réfrigérateur présentaient tous des aires sous la courbe plus élevées que celles du T0 (voir le tableau I). Ce problème résulte d’une contamination de la précolonne du système HPLC et a été corrigé complètement par le remplacement de la pièce en question. Malheureusement, ce problème technique n’a été détecté qu’au moment de la compilation des données, soit une fois l’analyse des échantillons de cette série terminée. Or, dans cette étude linéaire de stabilité en fonction du temps, les analyses étaient effectuées sur des aliquotes prélevées à partir des sacs de PVC ou des seringues à des temps prédéterminés. Il s’avérait donc difficile de récupérer les données des préparations conservées 120 heures. Ces données manquantes n’affectent toutefois aucunement la conclusion de l’étude puisque 90 % de la concentration initiale est encore présente après 9 jours de conservation au réfrigérateur lorsque la pénicilline est reconstituée avec le citrate de sodium à 1,7 %.
En somme, cette étude propose une solution avantageuse, soit le citrate de sodium à 1,7 %, pour reconstituer la fiole de pénicilline G sodique injectable, comparativement à l’eau stérile. Lorsque l’antibiotique est dilué dans du NaCl 0,9 %, préparé en seringue à une concentration de 40 000 ou de 120 000 unités/mL et conservé au réfrigérateur, le citrate de sodium confère neuf jours de stabilité. Lorsque la pénicilline G sodique injectable est destinée à l’antibiothérapie par voie intraveineuse à domicile, qu’elle est préparée en sac de PVC contenant du NaCl 0,9 % aux concentrations de 32 000 ou 64 000 unités/mL et conservée au réfrigérateur avant d’être installée sur une pompe ambulatoire à perfusion continue, le citrate de sodium procure une stabilité de 10 jours (9 jours + 24 h). Une des auteurs a d’ailleurs fait une demande à la RAMQ à l’automne 2022 pour inscrire le citrate de sodium à 4 % sur la liste des ingrédients des préparations magistrales afin que son utilisation soit remboursée en milieu ambulatoire.
Ce projet a été entièrement financé par le Fonds Pharmacie de la Fondation IUCPQ-UL.
Tous les auteurs ont soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts lié au présent article.
Les auteurs souhaitent remercier mesdames Marie-Pierre Bergeron et Mélina Paré-Lacroix, assistantes techniques en pharmacie, pour leur collaboration au projet. Une autorisation écrite a été obtenue des personnes nommées.
1. Sanford Guide [application mobile]. Dallas (TX) : Antimicrobial therapy. 2021. endocarditis, streptococcal; (révisé le 19 mai 2021 ; consulté le 14 juin 2021).
2. Trissel LA. Handbook on injectable drugs. 18e éd. Bethesda: American Society of Health-System Pharmacists Publications; 2015. 1266 pages.
3. Allwood MC, Brown PW. The stability of benzylpenicillin injections. Pharm J 1991;247:R12.
4. Allwood MC, Brown PW. The effect of buffering on the stability of reconstituted benzylpenicillin injection. Int J Pharm Pract 1992;1:242–4.

5. Teva Canada. Monographie de produit : Pénicilline G sodique pour injection (25 février 2014). [en ligne] https://www.tevacanada.com/globalassets/canada-scs/product-monographs/penicillin-g-sodium-for-injection-1-million-iu-5-million-iu-and-10-million-iu-pm-feb25_2014-wis-eng.pdf (site visité le 16 novembre 2021).
6. Hossain MA, Friciu M, Aubin S, Leclair G. Stability of penicillin G sodium diluted with 0,9% sodium chloride injection of 5% dextrose injection and stored in polyvinyl chloride bag containers and elastomeric pump containers. Am J Health-Syst Pharm 2014;71:669–73.

7. Bing CD, Nowobilski-Vasilios A. Extended stability for parenteral drugs. 6e éd. Bethesda: American Society of Health-System Pharmacists Publications; 2017. 340 pages.
8. McDougall DAJ, McWhinney BC. Stability of buffered benzylpenicillin solutions for outpatient parenteral antimicrobial therapy. J Pharm Pract Res 2014;44:26–8.

9. Gouvernement du Canada. Base de données sur les produits pharmaceutiques (10 mars 2022). [en ligne] http://produits-sante.canada.ca/dpd-bdpp/index-fra.jsp (site visité le 21 juin 2022).
10. Monchi M. Citrate pathophysiology and metabolism. Transfus Apher Sci 2017;56:28–30.

11. MedXL. Directives d’utilisation : CitraFlow 4 %. [en ligne] https://www.medxl.com/cms_files/product_pdfs/CitraFlow4_IFU.pdf (site visité le 29 décembre 2022).
12. Kramer L, Bauer E, Joukhadar C, Strobl W, Gendo A, Madl C et al. Citrate pharmacokinetics and metabolism in cirrhotic and noncirrhotic critically ill patients. Crit Care Med 2003; 31:2450–5.

13. Rayani S, Jamali F. The stability of penicillin G sodium in 5 % dextrose in water minibags after freezing. Can J Hosp Pharm 1985;38 :162–4.
14. Allen LV Jr. Basics of compounding: potency and stability testing. Int J Pharm Compd 2013; 17:220–4.
15. Moine P, Mueller SW, Schoen JA, Rothchild KB, Fish DN. Pharmacokinetic and pharmacodynamic evaluation of a weight-based dosing regimen of cefoxitin for perioperative surgical prophylaxis in obese and morbidly obese patients. Antimicrob Agents Chemother 2016; 60:5885–93.


PHARMACTUEL, Vol. 56, No. 2, 2023