Recherche
Recensement des ressources et des activités des pharmacies de recherche en établissement de santé au Québec
Gloria El Darsa1, B.Sc., Rachel Choquette2, B.Sc., Catherine Côté-Sergerie2, B.Sc., Jean-François Bussières3,4, B.Pharm., M.Sc., MBA, FCSHP, FOPQ, Denis Lebel5, B.Pharm., M.Sc., FCSHP, Cynthia Tanguay6, B.Sc., M.Sc.
1Assistante de recherche, Unité de recherche en pratique pharmaceutique, Département de pharmacie, Centre hospitalier universitaire Sainte- Justine, Montréal (Québec) Canada;
2Spécialiste en activités cliniques, Unité de recherche en pratique pharmaceutique, Département de pharmacie, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec) Canada;
3Pharmacien, Unité de recherche en pratique pharmaceutique, Département de pharmacie, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec) Canada;
4Professeur titulaire de clinique, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
5Pharmacien, chef, Département de pharmacie et Unité de recherche en pratique pharmaceutique, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec) Canada;
6Spécialiste en activités cliniques et coordonnatrice, Unité de recherche en pratique pharmaceutique, Département de pharmacie, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec) Canada
Reçu le 5 mai 2023; Accepté après révision par les pairs le 29 septembre 2023
Résumé
Objectif: Dresser un portrait des ressources et des activités des pharmacies de recherche au Québec.
Méthode: Un questionnaire a été créé pour évaluer les types de recherches menées dans les départements de pharmacie ainsi que les ressources et les activités des services pharmaceutiques de soutien à la recherche. Il a été envoyé aux départements de pharmacie des établissements de santé du Québec par l’entremise de la communauté de pratique du soutien pharmaceutique à la recherche clinique et par courriel aux chefs des départements de pharmacie. Des statistiques descriptives ont été effectuées.
Résultats: Le taux de participation était de 83 % (25/30 établissements). Vingt (80 %) établissements offraient un service pharmaceutique de soutien à la recherche. Une médiane [min–max] de 1,8 [0–11,3] équivalent temps plein était consacrée au service pharmaceutique de soutien à la recherche, dont 0,4 [0–4] pharmacien. Plusieurs titres d’emploi distincts étaient formés dans les services pharmaceutiques de soutien à la recherche, soit au moins un pharmacien (100 %, 25/25), un assistant technique (58 %, 14/24), un agent de planification, de programmation et de recherche, un spécialiste en activités cliniques ou un assistant de recherche (n = 8) ou autre (n = 3). Les services pharmaceutiques de soutien à la recherche avaient une médiane [min–max] de 29 [1–187] protocoles ouverts et effectuaient 425 [0–2582] dispensations de produits de recherche annuellement. Les centres hospitaliers universitaires et les instituts avaient une charge de travail plus élevée, soit 80 [23–187] protocoles et 1000 [252–2582] dispensations.
Conclusion: Les établissements de santé du Québec sont nombreux à offrir un service pharmaceutique de soutien à la recherche. Les charges de travail et les ressources consacrées à la recherche varient. La gestion de la recherche nécessite également des ressources. En outre, le financement de ces activités constitue un enjeu pour les départements de pharmacie du Québec.
Mots-clés: Pharmacie hospitalière, recherche clinique, ressources humaines, service de soutien pharmaceutique à la recherche
Abstract
Objective: To describe the resources and activities of Quebec’s investigational drug services.
Method: A questionnaire was created to identify the types of research conducted in pharmacy departments as well as the resources and activities of investigational drug services. The survey was sent to pharmacy departments in Quebec’s health-care centres via the community of practice on pharmaceutical support for clinical research and by e-mail to chief pharmacists. Descriptive statistics were performed.
Results: The participation rate was 83% (25/30 centres). Twenty (80%) centres provided an investigational drug service. A median [min–max] of 1.8 [0–11.3] full-time equivalents were devoted to this service, including 0.4 [0–4] pharmacists. Several different job titles were trained to provide pharmaceutical research support services, including at least one pharmacist (100%, 25/25), one technical assistant (58%, 14/24), one planning, programming, and research officer, one clinical activities specialist or research assistant (n = 8) or other (n = 3). Investigational drug services were involved in a median [min–max] of 29 [1–187] ongoing trials and dispensed 425 [0–2582] orders for investigational products annually. Institutes and teaching hospitals had a higher workload, with involvement in 80 [23–187] ongoing trials and 1 000 [252–2582] investigational products dispensed.
Conclusion: Many of Quebec’s health-care centres offer pharmaceutical services which support research. The workload and resources devoted to research vary. The management of research activities also requires resources. In addition, funding for these activities is an issue for pharmacy departments in Quebec.
Keywords: Clinical research, hospital pharmacy, human resources, investigational drug services
Introduction
Les départements de pharmacie des établissements de santé québécois ont la responsabilité d’encadrer la gestion des produits de recherche en vertu du cadre de référence ministériel pour la recherche avec des participants humains1. La recherche doit, entre autres, être conforme au Titre 5 de la partie C du Règlement sur les aliments et drogues et aux bonnes pratiques cliniques (BPC)2,3. Les départements de pharmacie doivent s’assurer d’avoir les ressources humaines et les infrastructures nécessaires pour gérer les essais cliniques. Comme le précise le cadre ministériel, les « dépenses de la recherche liées à la pharmacie sont intégrées à la structure des coûts du projet, avant son approbation »1. Les sources de financement des études varient. Par exemple, dans un sondage de 2016 auprès des départements de pharmacie du Québec, Marceau et coll. ont indiqué que les activités de recherche étaient financées en partie par l’industrie pharmaceutique dans moins de la moitié des cas (46,2 %), que les établissements de santé absorbaient ces dépenses (46,2 %) ou qu’elles étaient financées par divers fonds de recherche (38,5 %)4. Bien qu’il y ait peu de publications pour appuyer ces chiffres, il est clair que le financement existant est insuffisant pour soutenir les services offerts par la pharmacie dans le cadre des projets de recherche. Ce constat a notamment été fait pour les études menées par des investigateurs-promoteurs5. Les départements de pharmacie sont des départements cliniques qui ne font pas partie des centres de recherche, ce qui contribue aux difficultés de financement de leurs activités en soutien à la recherche clinique.
Les tâches de gestion d’un essai clinique prises en charge par les départements de pharmacie sont variées et comprennent notamment la mise en œuvre des études, la gestion de la traçabilité et des dispensations de produits de recherche et de leur retour ainsi que les suivis récurrents auprès des promoteurs et des équipes de recherche6–8. L’investigateur principal doit déléguer cette responsabilité officiellement à un pharmacien. L’exécution de ces tâches spécifiques aux essais cliniques nécessite une formation rigoureuse qui représente en moyenne près de trois heures de lecture par personne par étude9. En 2016, 13 des 22 (59 %) établissements de santé québécois comptaient sur un service pharmaceutique de soutien à la recherche (SPSR) pour la conduite des essais cliniques4.
Compte tenu de la variabilité du financement disponible et des tâches à effectuer, les établissements ont besoin de comparer leurs ressources et leurs pratiques. Depuis 2018, une communauté de pratique, qui regroupe les pharmacies de recherche des établissements de santé du Québec, facilite le partage et les échanges sur les meilleures pratiques et les différents enjeux dans la gestion des essais cliniques. Les communautés de pratique sont des regroupements de personnes partageant un domaine d’activités, qui permettent entre autres « le rapprochement entre l’apprentissage […] et l’action »10.
L’objectif de cette étude descriptive transversale était de dresser un portrait des ressources et des activités des SPSR des départements de pharmacie du Québec. L’objectif secondaire était de décrire les autres activités de recherche menées par les départements de pharmacie.
Méthode
Création du questionnaire
Un questionnaire a été créé sur la plateforme Research Electronic Data Capture (REDCap) hébergée au Centre de recherche du Centre hospitalier universitaire (CHU) Sainte-Justine11. Il a été prétesté par l’équipe du présent projet (composée de pharmaciens et de spécialistes en activités cliniques [SAC] de l’équipe responsable du SPSR). Le questionnaire a été présenté le 2 février 2023 à une réunion de la communauté de pratique du soutien pharmaceutique à la recherche clinique, afin de s’assurer que les participants le trouvent clair et que les données recueillies permettent un balisage et une comparaison des ressources et des pratiques. Les participants ont pu poser des questions et offrir des suggestions pour bonifier le questionnaire.
Le questionnaire définitif comportait 37 questions fermées et 27 questions ouvertes. Les premières sect ions s’adressaient à tous les établissements de santé: contact et caractéristiques générales (n = 10 questions) et recherche dans les départements de pharmacie (n = 12). Les sections subséquentes s’adressaient seulement aux établissements offrant un SPSR: ressources humaines (n = 3), ressources matérielles (n = 10), charge de travail et tâches (n = 5) et pratiques (n = 24). Dans la section sur les ressources humaines, les titres d’emploi considérés étaient les pharmaciens, les assistants techniques en pharmacie (ATP) et, selon la définition du Comité patronal de négociation du secteur de la santé et des services sociaux, les agents de planification, de programme et de recherche (APPR), les SAC et les assistants de recherche (AR)12–14.
Distribution du questionnaire
Le questionnaire a été transmis aux 73 membres de la communauté de pratique le 7 février 2023 par Microsoft Teams ainsi que par courriel. Il a également été envoyé par courriel à 30 chefs de département de pharmacie le 21 février 2023 afin de solliciter les établissements de santé ne faisant pas partie de la communauté de pratique ou n’ayant pas de SPSR. Chaque établissement pouvait nommer la personne-ressource responsable de répondre au questionnaire pour l’établissement. Le taux de réponse a été calculé en fonction du nombre d’établissements distincts contactés. L’équipe de ce projet était disponible pour répondre à toute question sur le questionnaire. Des rappels ont été effectués. Le questionnaire a été fermé le 13 mars 2023. Les répondants ont consenti à partager les données de leur établissement et ont été avisés que les données agrégées seraient utilisées aux fins de publication. Conformément à l’énoncé de politique des trois conseils, ce projet d’évaluation des SPSR n’exige pas d’évaluation par un Comité d’éthique de la recherche (CER)15.
Un établissement de santé comporte une ou plusieurs installations. Une installation est un lieu physique où sont offerts des soins de santé et des services sociaux à la population du Québec16. Étant donné que les pratiques peuvent varier d’une installation à l’autre, les répondants avaient l’option de répondre au questionnaire pour chaque installation ou de combiner plusieurs installations sur un même questionnaire. Les répondants avaient également l’option de répondre à un questionnaire distinct pour leur SPSR d’oncologie.
Analyse des données
Tous les établissements ont été invités à répondre à la section du questionnaire sur les activités de recherche dans les départements de pharmacie. Pour cette section, la base du dénominateur correspond à un établissement de santé. Seuls les répondants offrant un SPSR ont répondu aux sections subséquentes. Pour ces sections, la base du dénominateur correspond à un questionnaire étant donné que certains établissements ont fourni deux questionnaires et ont répondu séparément pour l’oncologie.
L’équipe de ce projet a contacté certains répondants pour clarifier des réponses, au besoin. Les données ont été exportées vers Microsoft Excel et stratifiées par type d’établissement selon la définition en vigueur au ministère de la Santé et des Services sociaux (MSSS): CHU, institut, centre intégré universitaire de santé et de services sociaux (CIUSSS) et centre intégré de santé et de services sociaux (CISSS)16. Pour la présentation des résultats, les données provenant des instituts ont été regroupées avec celles des CHU. Des statistiques descriptives ont été effectuées.
Résultats
Taux de réponse
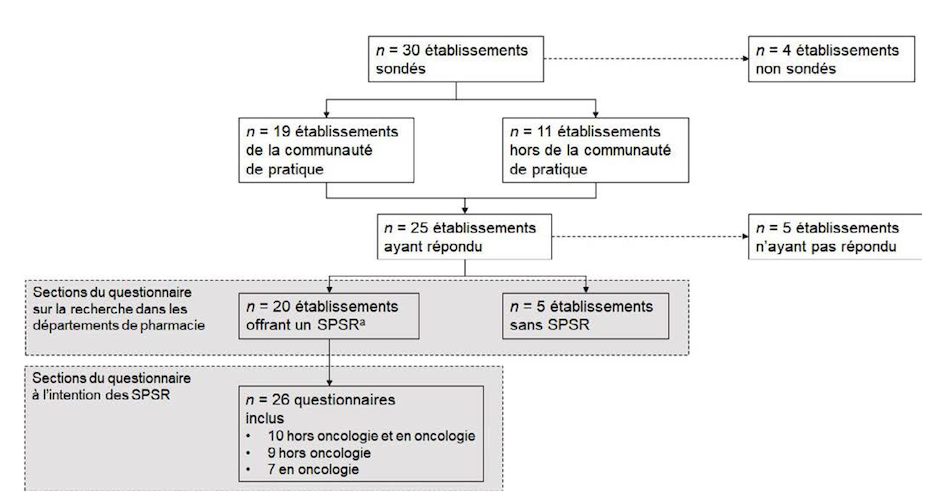
Le questionnaire a été envoyé à 30 établissements de santé, dont 19 ayant au moins un membre participant à la communauté de pratique (Figure 1). Le taux de participation global était de 83 % (25/30 établissements) et de 95 % (18/19) pour les établissements participant à la communauté de pratique. Ces 25 établissements représentaient un total de 37 installations.
Activités de recherche des départements de pharmacie
La majorité des établissements sondés offraient un SPSR (80 %, 20/25 établissements). Parmi les autres activités de recherche, certains offraient du soutien à la recherche pour les études sur des animaux (29 %, 7/24) ou du soutien à la recherche fondamentale (29 %, 7/24), ce qui consistait principalement à faire certaines commandes de médicaments ou à préparer des médicaments cytotoxiques. En tout, 86 % (19/22) des établissements ont indiqué faire de la recherche évaluative, ce qui exclut la gestion des essais cliniques, mais inclut, par exemple, l’encadrement de projets de maîtrise ou les revues d’utilisation de médicaments. Six établissements avaient une unité structurée de recherche évaluative.
Plusieurs ont mentionné qu’au moins un pharmacien de l’équipe agissait comme cochercheur de projet de recherche (38 %, 9/24). La majorité des établissements ont précisé que des pharmaciens de leur département participaient au CER (71 %, 17/24).
Peu d’établissements ont indiqué jouer un rôle dans l’encadrement de l’accès aux données provenant des systèmes informatiques de la pharmacie (40 %, 10/25); trois ont dit que c’était leur SPSR qui s’en chargeait. Six ont mentionné s’occuper de l’extraction des données, et sept ont précisé qu’ils vérifiaient les autorisations avant le partage. Seulement un établissement a dit demander une compensation financière pour l’encadrement de l’accès aux données.
Établissements offrant un SPSR
Parmi les 20 établissements offrant un SPSR qui ont répondu aux sections subséquentes du sondage, six ont utilisé deux questionnaires distincts pour décrire leurs pratiques. Ainsi, un total de 26 questionnaires a été analysé, soit 10 questionnaires jumelant des activités hors oncologie et oncologie, neuf excluant l’oncologie et sept exclusivement en oncologie. Dix questionnaires provenaient de CHU, neuf de CIUSSS et sept de CISSS.
| |
| |
|
Figure 1 Organigramme des participants
Abréviation: SPSR: service pharmaceutique de soutien à la recherche
a En tout, 25 établissements ont répondu à la section sur les caractéristiques générales; le dénominateur de cette section est calculé par établissement |
Ressources humaines dans les SPSR
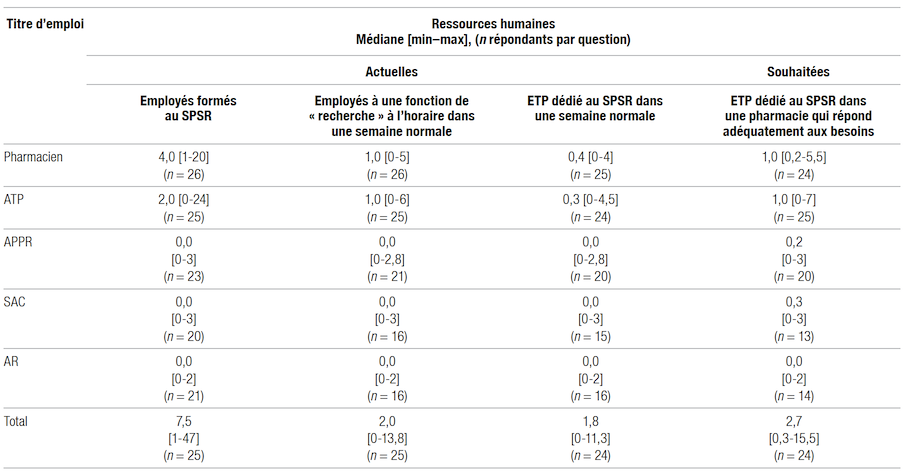
Tous les répondants ont indiqué avoir au moins un pharmacien formé au SPSR (100 %, 25/25 questionnaires). Les autres titres d’emplois formés au SPSR étaient variables, soit au moins un ATP (58 %, 14/24), au moins un APPR (32 %, 7/22), au moins un SAC (15 %, 3/20), au moins un AR (19 %, 4/21) et au moins un autre titre d’emploi (n = 3). Ainsi, en combinant ces trois titres d’emplois, huit répondants ont indiqué avoir au moins un APPR, un SAC ou un AR formé à son SPSR.
Les répondants avaient une médiane de sept personnes formées au SPSR, dont deux à une fonction de recherche intégrée à l’horaire dans une semaine normale (Tableau I). Une médiane de 1,8 [0–11,3] équivalent temps plein (ETP) était affectée au SPSR, mais les répondants ont indiqué qu’une médiane de 2,7 [0,3–15,5] ETP était nécessaire dans une pharmacie de recherche pour répondre adéquatement aux besoins. Stratifié par type d’établissement, le nombre total actuel d’ETP pour le SPSR était de 2,1 [0,8–11,3], le nombre total d’ETP souhaité était de 2,9 [1–15,5] pour les CHU et les instituts, le nombre total actuel et souhaité était de 0,8 [0–4,2] et de 2,9 [1,2–6] ETP pour les CIUSSS et de 1,6 [0–4] et 2,4 [0,3–6] pour les CISSS.
Seulement 30 % (8/26) des répondants ont indiqué avoir un plan pour intégrer des techniciens en pharmacie (TP) dans la pharmacie de recherche et prévoyaient notamment des tâches additionnelles pour ces derniers par rapport aux ATP.
Ressources matérielles dans les SPSR
Il y avait une médiane [min–max] de 1 [0–13] local distinct réservé pour la recherche, soit 10 [1–300] m2 au total (incluant les bureaux et l’entreposage). Dans une pharmacie de recherche permettant de répondre adéquatement aux besoins, les répondants souhaitaient une médiane de 30 [5–450] m2. La majorité des locaux appartenaient au département de pharmacie (84 %, 21/25), les autres appartenant au centre de recherche (16 %, 4/25). Dans la majorité des cas (92 %, 23/25), l’accès aux locaux était restreint aux membres du département de pharmacie. Dans les autres cas, seuls les membres de la pharmacie de recherche (4 %, 1/25) ou ceux de la pharmacie de recherche et quelques infirmières de recherche (4 %, 1/25) y avaient accès.
Les répondants disposaient de peu d’équipement dédié à la recherche. Ils possédaient notamment une médiane de 2 [0–14] réfrigérateurs et de 1 [0–2,5] congélateur à −20 °C réservés à la recherche. Treize répondants ont indiqué vouloir plus de réfrigérateurs dédiés pour la recherche uniquement, 10 voulaient davantage de hottes et neuf, plus de congélateurs à −20 °C. Les répondants ont indiqué surveiller les températures manuellement (65 %, 17/26) et électroniquement de façon automatisée (85 %, 22/26). Huit systèmes différents étaient employés pour la surveillance électronique et les rapports étaient produits automatiquement par ce système dans 45 % des cas (10/22).
Charge de travail dans les SPSR
Les heures d’ouverture des SPSR étaient similaires, la majorité offrant un service les jours ouvrables de 8 heures à 16 heures (60 %, 15/25). Seulement 8 % (2/26) des répondants ont indiqué être en mesure d’offrir une garde en tout temps. D’autres options ont été mentionnées, soit une garde pour certaines études spécifiques avec des frais additionnels (64 %, 16/25) et des trousses prêtes à l’emploi mises à la disposition des équipes de recherche, le cas échéant (56 %, 14/25).
Les répondants ont mentionné une médiane de 25 [0–309] essais cliniques actifs, ce qui représentait 425 [0–2582] dispensations de produits de recherche par année (tableau II). La charge de travail pour les activités de SPSR était plus élevée dans les CHU et les instituts.
Tableau I Ressources humaines actuelles et souhaitées
Tâches des SPSR
Les tâches dans les SPSR ont été réparties en trois catégories: évaluation et mise en place, gestion de l’étude et des médicaments et finalement la préparation, dispensation et validation (Figure 2). La répartition des tâches variait selon les établissements. Les pharmaciens dédiés à la recherche pouvaient faire la majorité des tâches, mais étaient peu nombreux à effectuer les tâches de préparation. Les ATP dédiés à la recherche s’occupaient surtout des tâches de gestion des réceptions, dispensations, des registres et des préparations. Plusieurs ont indiqué que des pharmaciens et ATP non dédiés à la recherche effectuaient plusieurs tâches de SPSR, surtout des tâches de validation dans le cas des pharmaciens et de préparation dans le cas des ATP. Dans les établissements qui avaient des APPR, des SAC ou des AR, ces derniers participaient à la majorité des tâches d’évaluation, de mise en place et de gestion d’étude. Plusieurs répondants ont également mentionné que les infirmières coordonnatrices de recherche participaient à plusieurs tâches de soutien.
Pratiques dans les SPSR
Évaluation
Une médiane [min–max] de 14 [2–84] jours était demandée pour évaluer un nouveau projet. Sept répondants (27 %) n’avaient pas de délai préétabli. Dans le cadre de cette évaluation, 89 % (23/26) ont précisé consulter le manuel de pharmacie pour déterminer les précautions applicables aux travailleurs, 85 % (22/26), la section sur les risques et précautions de la brochure de l’investigateur, 73 % (19/26), la liste de médicaments dangereux du National Institute for Occupational Safety and Health, 38 % (10/26), celle de l’établissement, et 50 % (13/26) la fiche de données de sécurité. En outre, 15 % (4/26) établissaient une analyse de risque par écrit.
Délégation et formation
Les tâches spécifiques au protocole qui étaient déléguées au personnel de la pharmacie de recherche étaient consignées dans le registre de délégation du promoteur (69 %, 18/26), dans le registre de délégation spécifique à la pharmacie (12 %, 3/26), dans le registre de délégation qui fait également office de registre de formation (12 %, 3/26) ou dans le registre de délégation du département réglementaire (8 %, 2/26). Les personnes dont les tâches étaient consignées dans ce registre de délégation variaient: seuls les pharmaciens ou les deux pharmaciens responsables de l’étude (38 %, 8/21), toutes les personnes de la pharmacie de recherche (24 %, 5/21) ou toute autre combinaison (38 %, 8/21). Parmi les répondants qui avaient des ATP dédiés à la recherche, 75 % (12/16) consignaient leurs tâches dans le registre de délégation. Aucun des répondants qui avaient des ATP non dédiés à la recherche ne consignait leurs tâches dans un registre de délégation (0 %, 0/21).
La formation sur les documents spécifiques à une étude (comme les protocoles et les manuels de pharmacie) était consignée dans un registre de formation spécifique à la pharmacie (69 %, 18/26), dans celui du promoteur (54 %, 14/26) ou dans celui du département réglementaire (4 %, 1/26).
Tableau II Charge de travail selon le type d’établissement et le type d’activité

| |

| |
|
Figure 2 Distribution des tâches selon le titre d’emploi
Légende: Les tâches sont distribuées en trois catégories (par ordre d’apparition). A. Évaluation et mise en place (noir): (1) Évaluation de faisabilité d’une nouvelle étude; (2) Création d’un budget pour la pharmacie; (3) Émission de l’approbation d’une nouvelle étude; (4) Création des FOPR; (5) Approbation des FOPR; (6) Création des documents d’étude; (7) Encadrement des visites d’initiation; (8) Encadrement des visites de sélection, de surveillance (« monitoring ») et de fermeture; (9) Création ou révision des modes opératoires normalisés. B. Gestion de l’étude et des médicaments (barres diagonales): (10) Confirmation de réception; (11) Commandes manuelles de médicament de recherche; (12) Saisie de l’ordonnance dans le système informatique; (13) Remplir les registres de traçabilité et étiquetage; (14) Communication avec l’équipe de recherche, les associés de recherche cliniques; (15) Décompte des retours; (16) Destruction; (17) Archivage; (18) Facturation. C. Préparation, dispensation et validation (gris): (19) Dispensation simple; (20) Préparation non-stérile; (21) Préparation stérile; (22) Validation du service; (23) Validation de l’ordonnance; (24) Remise du produit de recherche
Plusieurs choix de réponses pouvaient être cochés pour une même tâche
Abréviations: APPR: agent de planification et de programmation de recherche; AR: assistant de recherche; ATP: assistant technique en pharmacie; FOPR: feuilles d’ordonnances prérédigées; SAC: spécialiste en activités cliniques |
Un seul répondant a indiqué que tous les pharmaciens du département devaient suivre la formation sur les BPC et sur le Titre 5 du Règlement sur les aliments et drogues. Parmi les répondants qui avaient des ATP dédiés à la recherche, 94 % (15/16) avaient une politique pour les former sur les BPC et 88 % (14/16), sur le Titre 5. Aucun des répondants qui avaient des ATP non dédiés à la recherche ne leur offrait des formations sur les BPC ou sur le Titre 5 (0 %, 0/21).
Procédures
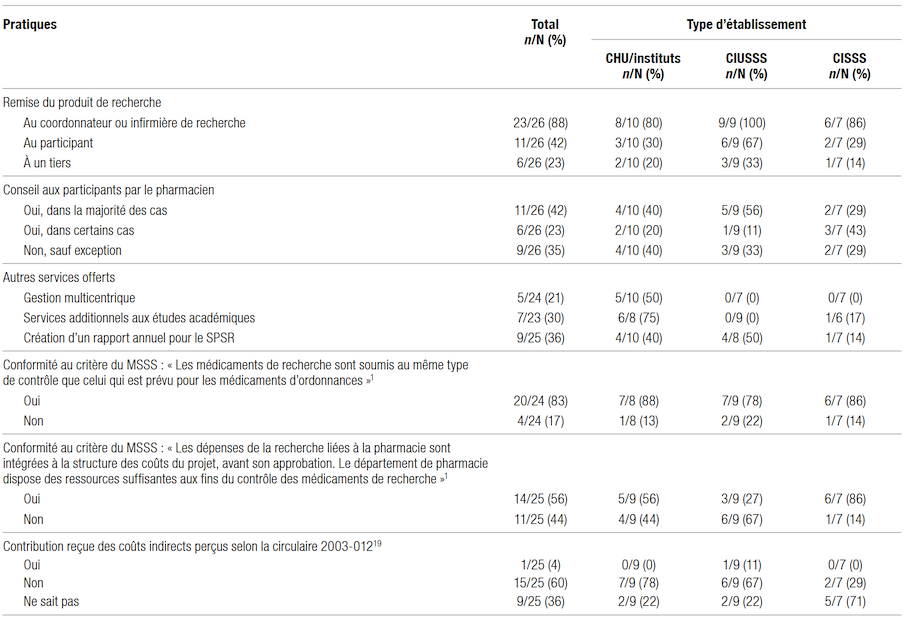
La majorité des répondants ont mentionné utiliser des modes opératoires normalisés (MON) spécifiques à la pharmacie de recherche (62 %, 16/26), les politiques et procédures du département de pharmacie (50 %, 13/26) ou les MON du N2 Canada (19 %, 5/26)18. Tous les répondants des CHU et des instituts avaient des MON spécifiques au SPSR (100 %, 10/10). Peu ont dit recevoir un soutien de leur centre de recherche pour les MON, soit pour leur rédaction (19 %, 5/26) ou leur approbation (42 %, 11/26). La plupart des répondants ont indiqué remettre le produit de recherche au coordonnateur de l’étude et être en mesure d’offrir un conseil aux participants dans la majorité des cas (Tableau III). Moins de la moitié des répondants offraient un service de gestion multicentrique des études, des services additionnels aux études académiques ou la création d’un rapport annuel. Toutefois, ces activités étaient plus fréquentes dans les CHU et les instituts.
Financement
Moins de la moitié des répondants recevaient un soutien de leur centre de recherche pour la création et le suivi des factures (44 %, 11/25). Les frais indirects de 30 % applicables selon la circulaire ministériel le 2003–012 étaient généralement ajoutés par le centre de recherche (62 %, 13/21), mais deux répondants (10 %, 2/21) ont indiqué les ajouter directement sur le budget de la pharmacie transmis à l’équipe de recherche et six répondants ne savaient pas19. Toutefois, la majorité des répondants ne recevaient pas de contribution des coûts indirects (Tableau III).
Discussion
Types de recherche dans les départements de pharmacie
Les résultats indiquent que 20 des 25 (80 %) établissements de santé du Québec offraient un SPSR, une augmentation par rapport aux données de 2016 où 13 sur 22 (59 %) départements de pharmacie le faisaient4. Les départements de pharmacie étaient toutefois moins nombreux à offrir du soutien à la recherche sur les animaux ou à la recherche fondamentale. Selon le rapport 2020–2021 sur les pharmacies hospitalières canadiennes, 60 des 144 (42 %) répondants avaient un programme de recherche clinique, dont 18 au Québec, ce qui concorde avec les résultats de notre questionnaire20.
La majorité des établissements avaient au moins un pharmacien membre du CER. Peu ont indiqué avoir au moins un pharmacien agissant comme cochercheur (38 %). Selon un sondage mené auprès des pharmaciens hospitaliers de Colombie-Britannique, 87 % des répondants avaient un intérêt à mener de la recherche21. Cependant, le manque de temps constituait l’obstacle principal à la recherche pour 92 % d’entre eux21.
Une augmentation du nombre d’établissements faisant de la recherche évaluative a aussi été observée, soit 19 sur 22 (86 %) par rapport à 13 sur 22 (59 %) pour les départements de pharmacie qui ont dit faire ce type de recherche en 20164. La recherche en pratique pharmaceutique est une discipline qui connaît une croissance importante et qui inclut à la fois des données cliniques, économiques, humaines ainsi que des données sur la mise en œuvre des pratiques22. Une revue systématique conclut que les pharmaciens sont généralement convaincus de l’utilité de la recherche en pratique pharmaceutique, mais qu’ils mentionnent des barrières, comme le manque de temps, de ressources et de soutien23. Les pharmaciens peuvent également participer à d’autres types de recherche qui n’ont pas été couverts dans notre questionnaire.
Peu d’établissements ont indiqué participer aux demandes d’accès aux données provenant des systèmes de la pharmacie. Le maintien, l’extraction et le partage des données peuvent représenter une charge de travail considérable et nécessitent une vérification de la demande et des autorisations. Malgré tout, seulement un établissement a indiqué réclamer une compensation financière pour cet encadrement. L’adoption du projet de loi 3 (Loi sur les renseignements de santé et de services sociaux et modifiant diverses dispositions législatives) et l’entrée en vigueur du projet de loi 64 (Loi modernisant des dispositions législatives en matière de protection des renseignements personnels, aussi nommée loi 25) risquent de toucher les pratiques de partage des données des départements de pharmacie en raison de la modification des exigences réglementaires24,25.
Tableau III Pratiques de remise des produits de recherche, autres services offerts et critères du MSSS
Les établissements de santé du Québec ont tout à gagner à offrir une infrastructure de soutien à la recherche clinique et à la recherche évaluative. Nos résultats devraient alimenter les réflexions entourant l’organisation, la dotation et l’encadrement de la recherche au sein des départements de pharmacie. La présence d’un chef adjoint pharmaceutique affecté à l’enseignement et à la recherche pourrait assurer un développement cohérent de la recherche, notamment parce qu’une personne serait ainsi responsable de mettre en place une structure de recherche et de définir des objectifs et des priorités.
Ressources humaines et tâches
En tout, une médiane de 7,5 employés étaient formés au SPSR, tandis que 2,0 employés étaient assignés à une fonction « recherche » à l’horaire d’une semaine normale. De façon globale, les répondants souhaitaient deux fois plus d’ETP dédiés à la recherche, particulièrement plus de pharmaciens et d’ATP. Les ressources actuelles étaient plus élevées dans les CHU et les instituts, suivi des CIUSSS et des CISSS, ce qui concorde avec les charges de travail de leur SPSR respectif. Un sondage mené aux États-Unis en 2013 a montré un nombre beaucoup plus élevé de ressources consacrées à la recherche, soit une moyenne de 2,39 ± 1,67 ETP pharmaciens et de 2,34 ± 1,67 ETP ATP, comparativement à 0,4 et à 0,3 dans le présent projet, respectivement26. Les établissements américains sondés avaient un plus grand nombre d’études actives, soit entre 51 et 400 pour la majorité des répondants26.
Lorsqu’un répondant indiquait la présence d’au moins un pharmacien formé au SPSR, ce dernier participait généralement à la majorité des tâches, à l’exception de la préparation qui était d’habitude effectuée par des ATP. Plusieurs tâches pouvaient être accomplies par des pharmaciens non dédiés à la recherche. Selon l’article C.05.010(b) du Règlement sur les aliments et drogues, le médicament doit être employé conformément au protocole2. Hamrah et coll. ont révélé que le risque d’avoir des déviations au protocole par rapport aux médicaments de recherche était significativement réduit lorsqu’un pharmacien de recherche faisait la supervision et que le SPSR était utilisé27. En effet, les pharmaciens dédiés à la recherche remplissent plusieurs rôles pour assurer l’utilisation conforme et sûre des médicaments, notamment grâce au développement de MON, d’instructions de dispensation et d’ordonnances prérédigées26. Toutefois, Brown et coll. soulignent aussi que plusieurs mécanismes de sécurité existant pour les médicaments commerciaux ne sont pas adaptés aux produits de recherche, comme l’utilisation de la mise en majuscule et la standardisation de l’information28.
Les ATP dédiés à la recherche se voyaient confier plus de tâches que ceux qui ne l’étaient pas. Leur participation se limitait généralement à la saisie des ordonnances et à la préparation. Peu de répondants avaient déjà formulé un plan d’intégration des TP. Dans la foulée de la création du programme collégial de techniques de pharmacie en octobre 2021, l’Association des pharmaciens des établissements de santé du Québec a identifié plusieurs tâches de recherche qu’ils pourraient accomplir, comme la préparation et la diffusion des procédures de travail technique spécifique au protocole de recherche, la préparation des visites d’audit et la participation à ces visites, ainsi que la rédaction des résumés d’étude clinique29.
Peu d’établissements employaient au moins un APPR, un SAC ou un AR dans leur SPSR, ce qui explique leur participation à diverses tâches, mais à une fréquence plus faible. Ces titres d’emploi se retrouvaient principalement dans les CHU et les instituts. Lorsqu’un répondant mentionnait la présence d’au moins un APPR, SAC ou AR, cet employé avait des tâches diversifiées conformément à ses qualifications. Dans le sondage mené aux États-Unis, la répartition des tâches de SPSR était plutôt traditionnelle, soit dans un ratio pharmacien: ATP de 1:126. L’émergence d’un nouveau modèle a été constatée par certains répondants du fait que plusieurs tâches étaient effectuées par les ATP sans supervision directe du pharmacien ou par d’autres types d’employés26.
Étant donné la diversité des ressources humaines et du travail, la délégation des tâches et la formation variaient également grandement d’un établissement à l’autre. Bien qu’essentielle, la gestion de cette documentation prend un temps considérable et la charge de travail associée n’est pas négligeable9.
Ressources matérielles
Les établissements désirent avoir plus de ressources matérielles. La superficie médiane du local consacré à la recherche était de 10 m2. Les répondants ont indiqué qu’ils aimeraient disposer d’un local au moins deux fois plus grand. Avec la complexification de la documentation associée à la recherche clinique, l’espace accordé à son maintien augmente. De plus, il est souhaitable d’entreposer les produits de recherche dans des équipements réservés à la recherche pour limiter les risques d’erreur, mais l’espace est parfois insuffisant pour y parvenir.
Charge de travail
La charge de travail pour les activités de recherche était plus élevée dans les établissements à vocation universitaire. Ce point avait également été souligné en 20164. Les établissements offrant une structure de SPSR devaient gérer une médiane de 25 essais cliniques actifs représentant 500 dispensations de produits de recherche annuellement. La médiane était deux fois plus élevée dans les CHU et les instituts avec 78 essais cliniques actifs et 1000 dispensations. La complexité de la gestion des études peut varier en fonction de divers facteurs, comme la gestion de l’insu, la participation de la pharmacie, la répartition aléatoire et l’assignation des traitements ainsi que la complexité de la préparation30.
Évaluation des études
Peu d’établissements avaient évalué un essai clinique provenant du Service d’évaluation ACCÉLÉRÉE, ce qui s’explique par le fait qu’il s’agit d’un nouveau projet pilote offert au Québec ayant pour l’objectif de faciliter et d’accélérer la mise en place des essais cliniques17. Ce service pilote prévoit notamment une étape de vérification de la conformité des dossiers avant leur soumission au CER. Les CHU étaient plus nombreux à avoir évalué ce type d’essais cliniques. L’évaluation de la faisabilité d’une étude et des ressources requises présente un défi particulier pour les pharmacies de recherche. En effet, c’est une étape indispensable à l’approbation de l’étude qui doit souvent être effectuée avec des documents incomplets et dans de courts délais. La majorité des répondants ont indiqué avoir besoin de deux semaines pour mener cette évaluation.
L’identification des médicaments dont la manipulation nécessite des précautions constitue également un enjeu, car les données sur les dangers potentiels des produits de recherche sont rarement disponibles et que les promoteurs ne les connaissent pas très bien31,32.
Autres pratiques des SPSR
Les établissements à vocation universitaire étaient plus nombreux à offrir des services additionnels, comme la gestion multicentrique ou le soutien aux études académiques. Les études académiques ou celles ayant un investigateur-promoteur nécessitent souvent une collaboration accrue avec la pharmacie pour leur planification et leur mise en œuvre. Par exemple, un groupe de travail suisse a constaté une différence substantielle entre les coûts d’achat de produits de recherche réels et les coûts anticipés dans plusieurs études académiques et a établi que la collaboration avec la pharmacie constituait un facteur clé du succès de la gestion des études5.
De même, la création et la mise à jour de MON spécifiques à la pharmacie de recherche représentent des démarches chronophages, mais essentielles pour réduire les risques de déviations au protocole28. Les établissements dont la charge de travail liée à la recherche est accrue peuvent probablement justifier plus facilement le temps nécessaire à leur mise en œuvre. En ce sens, un groupe français a montré que le score global pour la mise en œuvre d’une démarche de qualité était corrélé avec le nombre d’essais cliniques actifs, ce qui appuie le fait que les établissements ont plus tendance à mettre une structure de recherche en place lorsque leur charge de travail augmente33.
Néanmoins, la majorité des répondants considéraient qu’ils respectaient le critère du ministère exigeant un niveau de contrôle identique pour les médicaments de recherche et d’ordonnance1.
Financement de la recherche
Bien que les entreprises privées soient tenues d’assumer les coûts de la recherche menée dans les établissements de santé québécois, seulement environ la moitié des répondants considéraient que les dépenses étaient « intégrées à la structure de coûts du projet » et que la pharmacie possédait les « ressources suffisantes aux fins du contrôle des médicaments de recherche »1. En vertu de la circulaire ministérielle 2003–012, une contribution supplémentaire de 30 % est perçue sur tous les coûts directs de manière à couvrir les coûts indirects (18 % pour les coûts d’infrastructure et 12 % pour les services administratifs comme le CER19,20). Cette circulaire a été mise à jour en avril 2023 et la contribution aux frais indirects a été maintenue34. Nous avons constaté que les départements de pharmacie connaissaient relativement mal les frais indirects que nécessite la recherche. Une clarification du financement de la recherche dans les pharmacies des établissements de santé est donc souhaitable. L’attribution d’une partie de cette contribution perçue aux départements de pharmacie aiderait à combler le déficit.
Forces et limites de cette étude descriptive
L’excellent taux de participation obtenu représente bien les établissements de santé de la province. La participation de la communauté de pratique a contribué à ce taux de réponse et a permis d’offrir un questionnaire répondant aux besoins des établissements participants. Les réponses n’ont pas été pondérées selon la taille des établissements. Certains ont répondu sur deux questionnaires distincts lorsque les pratiques des installations variaient ou pour la structure de SPSR en oncologie. Les données pour les calculs des ressources humaines et des charges de travail existantes dans les établissements étaient variables. L’équipe du présent projet a fourni des définitions standardisées pour faciliter la comparaison des données. Une harmonisation des définitions et des indicateurs serait bénéfique pour les comparaisons futures. Le nombre de réponses obtenu était plus faible pour certaines questions; les établissements ayant moins de ressources consacrées à la recherche ont probablement été moins nombreux à répondre au questionnaire.
Conclusion
Les départements de pharmacie des établissements de santé québécois sont de plus en plus nombreux à faire de la recherche évaluative et à offrir un SPSR pour la gestion des essais cliniques. Divers modèles de répartition des tâches de SPSR contenant une variété de titres d’emplois ont été observés. Davantage de tâches pourraient être confiées à des APPR, des SAC, des AR ainsi que des futurs TP. Les CHU et les instituts avaient une charge de travail plus élevée et comptaient sur plus de ressources humaines affectées au SPSR. Toutefois, les répondants ont mentionné qu’il faudrait plus de ressources humaines et matérielles pour continuer à offrir un service de qualité respectant les exigences canadiennes et internationales. La croissance des infrastructures de SPSR est nécessaire pour appuyer la réalisation d’essais cliniques au Québec. Une clarification du financement accordé aux départements de pharmacie, notamment en ce qui a trait aux frais indirects de la recherche, est requise pour soutenir cette croissance. Ces résultats devraient alimenter les réflexions entourant l’organisation et la dotation des ressources humaines affectées à la recherche au sein des départements de pharmacie.
Financement
Les auteurs n’ont déclaré aucun financement lié au présent article.
Conflits d’intérêts
Tous les auteurs ont soumis le formulaire de l’ICMJE sur la divulgation de conflits d’intérêts potentiels. Jean-François Bussières est membre du comité de rédaction de Pharmactuel. Les autres auteurs n’ont déclaré aucun conflit d’intérêts lié au présent article.
Remerciements
Remerciements aux membres de la communauté de pratique sur le soutien pharmaceutique à la recherche clinique pour leur participation à ce projet.
Références
1. Ministère de la Santé et Services sociaux. Cadre de référence ministériel pour la recherche avec des participants humains. [en ligne] https://publications.msss.gouv.qc.ca/msss/fichiers/2019/19-727-05W.pdf (site visité le 12 avril 2023).
2. Règlement sur les aliments et les drogues, C.R.C., ch.870 (15 février 2023). [en ligne] https://laws-lois.justice.gc.ca/fra/reglements/C.R.C.,_ch._870/page-85.html#h-56644 (site visité le 2 mai 2023).
3. International Council for Harmonisation of Technical Requirements For Pharmaceuticals For Human Use (ICH). Integrated addendum to ICH E6 (R1): guideline for good clinical practice E6(R2) (9 novembre 2016). [en ligne] https://database.ich.org/sites/default/files/E6_R2_Addendum.pdf (site visité le 12 avril 2023).
4. Marceau N, Lamoureux CL, Cabot JF, To V, Adam JP. État de la recherche en pharmacie d’établissement de santé au Québec. Pharmactuel 2017;50:219–26.
5. Taji Heravi A, Henn A, Deuster S, McLennan S, Gloy V, Mitter VR et al. Investigational medicinal products, related costs and hospital pharmacy services for investigator-initiated trials: A mixed-methods study. PloS One 2022; 17:e0264427.

6. Société canadienne des pharmaciens d’hôpitaux (SCPH). Essais cliniques: lignes directrices pour les pharmacies des établissements de santé (2013). [en ligne] https://www.cshp.ca/docs/pdfs/Essais%20cliniques_LD%20pour%20les%20pharmacies%20(2013).pdf (site visité le 2 mai 2023).
7. Kay SC, Luke DG, Tamer HR. ASHP guidelines for the management of investigational drug products. Am J Hosp Pharm 2018;75:561–73.
8. Méthot J, Brisson D, Gaudet D. On-site management of investigational products and drug delivery systems in conformity with good clinical practices (GCPs). Clinical Trials 2012;9:265–71.

9. Martel-Côté N, Choquette R, Côté-Sergerie C, Lebel D, Bussières JF, Tanguay C. Training workload in the investigational drug service of a university hospital center. AM J Hosp Pharm 2023;80:495–502.
10. Institut national de santé publique du Québec. La communauté de pratique un outil pertinent: résumé des connaissances adaptées au contexte de la santé publique (novembre 2017). [en ligne] https://www.inspq.qc.ca/sites/default/files/publications/2351_communaute_pratique_outil_pertinent_resume_connaissance.pdf (site visité le 11 juillet 2023).
11. Harris PA, Taylor R, Thielke R, Payne J, Gonzalez N, Conde JG. Research Electronic Data Capture (REDCap)–A metadata-driven methodology and workflow process for providing translational research informatics support. J Biomed Inform 2009;42:377–81.

12. Comité patronal de négociation du secteur de la santé et des services sociaux. 1565–Agent de planification, de programmation et de recherche. [en ligne] https://cpnsss.gouv.qc.ca/titres-demploi-et-salaires/nomenclatureet-mecanisme-de-modification/fichedemploi/1565-22-0 (site visité le 12 avril 2023).
13. Comité patronal de négociation du secteur de la santé et des services sociaux. 1407–Spécialiste en activité clinique. [en ligne] https://cpnsss.gouv.qc.ca/titres-demploi-et-salaires/nomenclature-et-mecanisme-de-modification/fiche-demploi/1407-22-0 (site visité le 12 avril 2023).
14. Comité patronal de négociation du secteur de la santé et des services sociaux. 5187 – Assistant de recherche. [en ligne] https://cpnsss.gouv.qc.ca/titres-demploi-et-salaires/nomenclature-et-mecanisme-de-modification/fiche-demploi/5187-9-0 (site visité le 12 avril 2023).
15. Groupe en éthique de la recherche. Énoncé de politique des trois conseils: éthique de la recherche avec des êtres humains – EPTC 2 (2022). [en ligne] https://ethics.gc.ca/fra/policy-politique_tcps2-eptc2_2022.html (site visité le 11 juillet 2023).
16. Ministère de la Santé et Services sociaux. Glossaire: définition de termes relatifs au réseau de la santé et des services sociaux. [en ligne] https://publications.msss.gouv.qc.ca/msss/fichiers/2017/17-127-03W.pdf (site visité le 30 mars 2023).
17. CATALIS reche rche clinique Québec. Recherche clinique Québec ACCÉLÉRÉE. [en ligne] https://www.catalisquebec.com/fr/service-devaluation-acceleree/ (site visité le 20 avril 2023).
18. N2 Canada’s Alliance for Excellence in Clinical Research. Resources. [en ligne] https://n2canada.ca/resources/ (site visité le 3 mai 2023).
19. Ministère de la Santé et Services sociaux. Contribution de l’entreprise privée dans le cadre d’activités de recherche découlant d’un contrat de recherche ou d’une subvention (Circulaire 2003-012). [en ligne] https://g26.pub.msss.rtss.qc.ca/Formulaires/Circulaire/ConsCirculaire.aspx?enc=qTErJxG6g/I= (site visité le 3 mai 2023).
20. Société canadienne des pharmaciens d’hôpitaux. Sondage sur les pharmacies hospitalières canadiennes de 2020/21. [en ligne] https://www.cshp.ca/docs/pdfs/SPHC-2020-21-Qs-FR.pdf (site visité le 3 mai 2023).
21. Lee R, Dahri K, Lau TTY, Shalansky S. Perceptions of hospital pharmacists concerning clinical research: a survey study. Can J Hosp Pharm 2018;71:105–10.
22. Fernandez-Llimos F, Desselle S, Stewart D, Garcia-Cardenas V, Babar ZUD, Bond C et al. Improving the quality of publications in and advancing the paradigms of clinical and social pharmacy practice research: the Granada statements. Int J Pharm Pract 2023;31:119–25.
23. Awaisu A, Alsalimy N. Pharmacists’ involvement in and attitudes toward pharmacy practice research: A systematic review of the literature. Res Social Adm Pharm 2015;11:725–48.

24. Assemblée nationale. Projet de loi n° 64, Loi modernisant des dispositions législatives en matière de protection des renseignements personnels. [en ligne] https://www.assnat.qc.ca/fr/travaux-parlementaires/projets-loi/projet-loi-64-42-1.html?appelant=MC (site visité le 3 mai 2023).
25. Assemblée nationale. Projet de loi n° 3, Loi sur les renseignements de santé et de services sociaux et modifiant diverses dispositions législatives. [en ligne] https://assnat.qc.ca/fr/travaux-parlementaires/projets-loi/projetloi-3-43-1.html (site visité le 3 mai 2023).
26. Siden R, Tamer HR, Skyles AJ, Dolan CS, Propes DJ, Redic K. Survey to assess the role of pharmacy technicians and nonpharmacist staff in the operation of research pharmacies. Am J Health Syst Pharm 2014;71:1877–89.

27. Hamrah SD, Gallagher S, Ortega-Villa AM, Wheatley LM, Touré O. Impact of extramural DAIT/NIAID pharmacy programs, research pharmacist scientist oversight on study performance, and lessons learned. Contemp Clin Trials 2023;124:106938.

28. Brown JN, Britnell SR, Stivers AP, Cruz JL. Medication safety in clinical trials: role of the pharmacist in optimizing practice, collaboration, and education to reduce errors. Yale J Biol Med 2017;90:125–33.
29. Association des pharmaciens des établissements de santé du Québec. Intégration des techniciens en pharmacie. [en ligne] https://www.apesquebec.org/sites/default/files/integration-tp/profil-re/ (site visité le 20 avril 2023).
30. Calvin-Lamas M, Pita-Fernandez S, Pertega- Diaz S, Rabunal-Alvarez MT, Martín-Herranz I. A complexity scale for clinical trials from the perspective of a pharmacy service. Eur J Hosp Pharm 2018;25:251–6.

31. Jaskowiak JM, Chu B. Investigational medications and healthcare professional safety: A call for clinical trial sponsors to improve investigational product shipment labelling. Am J Health Syst Pharm 2023;80:960–1.

32. Jaskowiak JM. Classifying investigational medications for USP <800>: Strategies and considerations. Am J Health Syst Pharm 2022;79:932–3.

33. Delavoipière E, Bouglé C, Saint-Lorant G, Divanon F, Alix A. Management de la qualité du circuit des produits de santé expérimentaux dans les pharmacies hospitalières: enquête nationale et développement d’outils standardisés. Ann Pharm Fr 2022;80:758–68.

34. Ministère de la Santé et Services sociaux. Contribution de l’entreprise privée dans le cadre d’activités de recherche découlant d’un contrat de recherche ou d’une subvention (Circulaire 2023-015). [en ligne] https://g26.pub.msss.rtss.qc.ca/Formulaires/Circulaire/ConsCirculaire.aspx?enc=inQwpsCi19w= (site visité le 3 mai 2023).
Pour toute correspondance: Cynthia Tanguay, Centre hospitalier universitaire Sainte-Justine, 3175, chemin de la Côte Sainte-Catherine, Montréal (Québec) H3T 1C5, CANADA, Téléphone: 514-345-4603; Courriel: cynthia.tanguay.hsj@ssss.gouv.qc.ca
(Return to Top)
PHARMACTUEL, Vol. 57, No. 1, 2024