Catherine Bédard1-4, Pharm.D., Justine Drouin1-3,5, Pharm.D., Audrey Vachon3,6,7, B.Pharm., M.Sc., Isabelle Toupin3,6, B.Pharm., M.Sc., Julie Méthot3,6,8,9, B.Pharm., M.Sc., Ph.D., FOPQ
1Candidate à la maîtrise en pharmacothérapie avancée au moment de la rédaction, Faculté de pharmacie, Université Laval, Québec (Québec) Canada;
2Pharmacienne résidente au moment de la rédaction, Institut universitaire de cardiologie et de pneumologie de Québec–Université Laval, Québec (Québec) Canada;
3Chargée d’enseignement clinique, Faculté de pharmacie, Université Laval, Québec (Québec) Canada;
4Pharmacienne, Centre intégré de santé et de services sociaux de Lanaudière, Hôpital Pierre-Le Gardeur, Terrebonne (Québec) Canada;
5Pharmacienne, Centre intégré universitaire de santé et de services sociaux de la Capitale-Nationale, Québec (Québec) Canada;
6Pharmacienne, Institut universitaire de cardiologie et de pneumologie de Québec–Université Laval, Québec (Québec) Canada;
7Professeure de clinique, Faculté de pharmacie, Université Laval, Québec (Québec) Canada;
8Professeure titulaire et doyenne, Faculté de pharmacie, Université Laval, Québec (Québec) Canada;
9Chercheuse associée, Centre de recherche, Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval, Québec (Québec) Canada
Reçu le 22 octobre 2023; Accepté après révision par les pairs le 21 mai 2024
Résumé
Objectif: Décrire l’utilisation des inhibiteurs du cotransporteur sodium-glucose de type 2 (iSGLT2) chez les patients ayant une fraction d’éjection abaissée, suivis à la clinique d’insuffisance cardiaque de l’Institut universitaire de cardiologie et de pneumologie de Québec–Université Laval.
Méthode: Étude descriptive rétrospective menée auprès des patients ayant commencé un iSGLT2 entre septembre 2019 et février 2022. Les données ont été collectées à l’aide d’un dossier patient électronique et de Vision C+MD.
Résultats: Cent cinquante-six dossiers ont été analysés. L’hypotension (n = 42) était l’effet indésirable le plus signalé, deux patients ayant cessé leur traitement pour cette raison. Lorsqu’on exclut les hypotensions ayant une autre cause possible, six (4 %) seraient liés à l’ajout d’un iSGLT2. Dix-huit (12 %) arrêts de traitement ont été répertoriés, dont sept (39 %) pour une mycose génitale. Treize (10 %) cas d’insuffisance rénale aiguë sont survenus au cours de 134 épisodes de soin. Chez les 86 patients diabétiques, quatre (5 %) cas d’hypoglycémie ont été signalés. Le furosémide est l’agent le plus fréquemment ajusté au moment de l’ajout d’un iSGLT2. Dans les trois mois suivants, les autres agents clés du traitement ont en moyenne été ajustés à la hausse. L’ajout d’un iSGLT2 requiert en moyenne 1,3 suivi par l’équipe de la clinique.
Conclusion: La prescription d’un iSGLT2 est globalement bien tolérée dans cette population et ne semble pas limiter l’optimisation des autres traitements anti-remodelage. Des conseils d’hygiène sont essentiels au maintien du traitement.
Mots clés: effets indésirables, inhibiteurs du cotransporteur sodium-glucose de type 2, insuffisance cardiaque
Abstract
Objective: To describe the use of sodium-glucose cotransporter-2 (SGLT-2) inhibitors in patients with heart failure with reduced ejection fraction followed at the Institut universitaire de cardiologie et de pneumologie de Québec-Université Laval (IUCPQ-UL, Quebec Heart and Lung Institute).
Method: Descriptive, retrospective study of patients who started an SGLT-2 inhibitor between September 2019 and February 2022. Data were gathered using electronic patient records and Vision C+.
Result: In total, 156 records were analyzed. Hypotension (n = 42) was the most reported adverse effect, leading to discontinuation of treatment in two patients. When hypotension due to another possible cause was excluded, six (4%) were related to the addition of an SGLT-2 inhibitor. There were 18 (12%) treatment discontinuations recorded, including seven (39%) for genital mycosis. There were 13 (10%) cases of acute kidney injury that occurred during 134 care periods. Among the 86 diabetic patients, four (5%) cases of hypoglycemia were reported. Furosemide was the agent most frequently adjusted when an SGLT-2 inhibitor was added. During the following three months, the doses of other key agents in the treatment were, on average, titrated upwards. The addition of an SGLT-2 inhibitor requires an average of 1.3 follow-ups by the clinic’s team.
Conclusion: SGLT-2 inhibitors are generally well tolerated in this population and do not appear to limit the optimization of other anti-remodeling treatments. Counselling on hygiene is essential for maintenance of treatment.
Keywords: Adverse effects, heart failure, sodium-glucose cotransporter-2 inhibitors
L’insuffisance cardiaque est une cardiopathie associée à une morbimortalité importante. Au Canada, en 2021, on comptait 750 000 personnes atteintes, plus de 100 000 nouveaux cas et 6 300 décès1. L’insuffisance cardiaque constitue une des principales raisons d’hospitalisations au pays. En 2019, elle a causé plus de 71 000 hospitalisations1. D’ici 2030, les coûts associés aux soins devraient atteindre plus de 2,8 milliards de dollars par an au Canada1.
Les lignes directrices de la Société canadienne de cardiologie et de la Société canadienne d’insuffisance cardiaque préconisent des traitements qui réduisent la mortalité cardiovasculaire et les hospitalisations pour cause d’insuffisance cardiaque2. Les traitements pharmacologiques de l’insuffisance cardiaque avec fraction d’éjection du ventricule gauche (FEVG) abaissée ayant un effet significatif sur la mortalité sont les inhibiteurs de l’enzyme de conversion de l’angiotensine (IECA), les antagonistes des récepteurs de l’angiotensine II (ARA), les inhibiteurs des récepteurs de l’angiotensine et de la néprilysine (ARNI), les bêtabloquants (BB), les antagonistes des récepteurs minéralocorticoïdes (ARM) et, plus récemment, les inhibiteurs du cotransporteur sodium-glucose de type 2 (iSGLT2)2,3.
Les trois iSGLT2 présentement commercialisés au Canada ont d’abord été étudiés dans le traitement du diabète4–6. Les études EMPA-REG OUTCOME, CANVAS et DECLARE-TIMI 58 ont révélé que la prise d’empagliflozine, de canagliflozine et dapagliflozine, respectivement, était associée à une réduction des hospitalisations pour insuffisance cardiaque7–9. Puis, deux grandes études comparant un iSGLT2 au placebo, en ajout aux traitements standard de l’insuffisance cardiaque, ont été publiées en 2019 et en 2020 respectivement : DAPAHF (dapagliflozine) et EMPEROR-Reduced (empagliflozine)10,11. Les résultats ont montré une diminution significative d’une combinaison des hospitalisations pour insuffisance cardiaque et de la mortalité cardiovasculaire, indépendamment de la présence ou non de diabète10,11. De son côté, la canagliflozine n’a pas fait l’objet d’études spécifiquement en contexte d’insuffisance cardiaque.
Concernant l’innocuité, cette classe thérapeutique semble sûre puisqu’il y a peu de différences statistiquement significatives entre le groupe traitement et le groupe témoin quant aux effets indésirables dans les essais cliniques réalisés en contexte d’insuffisance cardiaque. Seule l’étude EMPEROR-Reduced a soulevé une différence significative sur le plan des infections génitales non compliquées11. Par contre, certaines études sur le diabète mentionnent une hausse statistiquement significative d’infections génitales, d’acidocétose diabétique, d’amputation, de fracture et d’hypovolémie dans les groupes sous iSGLT27–9. Un suivi clinique et biochimique adéquat est donc recommandé afin de valider l’innocuité du traitement, tel que la surveillance de l’état volémique du patient, la survenue d’hypotension, d’hypoglycémie, d’une infection urinaire ou génitale et l’augmentation de la créatinine12.
Au Québec comme ailleurs, plusieurs centres hospitaliers se sont dotés d’une clinique d’insuffisance cardiaque (CLIC). Bien que cela puisse varier d’un établissement à l’autre, le mandat d’une telle clinique est de veiller à l’optimisation des traitements pharmacologiques et non pharmacologiques de l’insuffisance cardiaque, de permettre un accès rapide et facilité aux soins en période de décompensation et de faire de l’enseignement aux patients sur la maladie, sa prise en charge et son caractère souvent chronique afin qu’ils puissent prendre part activement à leurs traitements. Cette clinique de consultation externe est généralement multidisciplinaire et composée de cardiologues ou d’internistes, d’infirmiers, de pharmaciens et de nutritionnistes.
Depuis la publication des études DAPA-HF, EMPEROR-Reduced et des lignes directrices canadiennes parues en avril 2021, l’utilisation d’une quadruple thérapie comprenant un IECA, un ARA ou un ARNI, en plus d’un BB, d’un ARM et d’un iSGLT2 est préconisée2. Malgré tout, selon les données internes de la CLIC de l’Institut universitaire de cardiologie et de pneumologie de Québec de l’Université Laval (IUCPQ-UL), seulement 17 % des patients avec FEVG abaissée prenaient un iSGLT2 en mai 2021. Cette constatation peut s’expliquer par le manque d’expérience des cliniciens avec cette classe de médicaments et la crainte des effets indésirables. En outre, l’innocuité chez les patients souffrant d’insuffisance cardiaque n’est pas totalement connue, et les ajustements des autres traitements n’ont pas été décrits12. Par ailleurs, la dapagliflozine n’a été ajoutée à la liste des médicaments d’exception de la Régie de l’assurance maladie du Québec (RAMQ) avec un code pour cette indication que le 15 décembre 202113. Pour les deux autres iSGLT2, les patients non diabétiques assurés par le régime public d’assurance médicaments doivent passer par la mesure du patient d’exception de la RAMQ pour obtenir un remboursement, ce qui peut complexifier la prescription et l’accès13.
L’objectif principal de cette étude est de décrire l’usage des iSGLT2 et la tolérance au médicament des patients souffrant d’insuffisance cardiaque avec FEVG abaissée suivis à la CLIC de l’IUCPQ-UL. Deux objectifs secondaires ont également été étudiés : décrire les ajustements apportés aux médicaments cardiovasculaires et aux hypoglycémiants à l’instauration de l’iSGLT2 et dans les trois premiers mois d’utilisation et décrire les suivis engendrés par chaque nouvelle ordonnance à la clinique d’insuffisance cardiaque.
Une étude descriptive de population longitudinale avec une collecte de données rétrospective allant de septembre 2019 à mai 2022 a été menée. La période de traitement étudiée était de trois mois à partir de l’instauration de l’iSGLT2 ou jusqu’à la cessation de l’agent, s’il y avait lieu. L’accès aux dossiers médicaux a été obtenu du Directeur des services professionnels. Le comité d’éthique de l’IUCPQ-UL a approuvé le projet.
La population étudiée se composait de patients souffrant d’insuffisance cardiaque à FEVG abaissée suivis à la CLIC qui ont commencé la prise d’un iSGLT2 entre le 19 septembre 2019 et le 25 février 2022, soit après la parution de l’étude DAPA-HF. Les patients ayant commencé le traitement avant d'être inscrits à la clinique et ceux sans valeurs de laboratoire ou sans notes de suivi des symptômes dans les trois mois suivant le début de l'iSGLT2 ont été exclus. Les patients dont la dernière valeur de créatinine sérique ou de pression artérielle systolique (PAS) datait de plus de 28 jours au moment de l’instauration ont été exclus des analyses sur la fonction rénale et la pression artérielle, respectivement.
Les deux pharmaciennes résidentes ont effectué la collecte de données rétrospective entre le 9 mai et le 10 juin 2022 dans le cadre de leur maîtrise en pharmacothérapie avancée à l’aide du dossier médical électronique de l’application Vision C+MD (Société québécoise d’insuffisance cardiaque, Montréal, Québec, Canada) et du dossier patient électronique par l’entremise de Cristal-NetMD (Centre de services du DCI Cristal-Net, Québec, Québec, Canada). Elles ont ensuite compilé les données dans un outil qu’elles ont développé, qui a fait l’objet d’un prétest chez dix sujets.
Le lieu de prescription de l’iSGLT2 a été noté : 1) clinique d’insuffisance cardiaque, 2) cliniques de consultation externe, par un autre professionnel ou au congé de l’hôpital, 3) en cours d’hospitalisation. Puisqu’un portrait plus complet de la prise en charge effectué par l’équipe de la clinique d’insuffisance cardiaque était désiré, tous les éléments de suivi pertinents inscrits au dossier des patients ayant commencé l’iSGLT2 à la clinique dans les trois premiers mois ont été recueillis (analyse de laboratoire, suivi téléphonique, visite en personne). Les symptômes d’hypotension (décrits comme des étourdissements, des vertiges ou de la fatigue), d’hypovolémie (objectivée par de la soif), d’hypervolémie (objectivée par de la dyspnée), d’hypoglycémie et d’hyperglycémie soulevés par l’équipe de la CLIC dans les notes versées au dossier lors des rendez-vous ont été collectés. Certains facteurs préalablement déterminés pouvant potentiellement contribuer aux symptômes décrits précédemment ont aussi été colligés : augmentation de la dose d’autres médicaments hypotenseurs (pouvant expliquer l’hypotension), augmentation de la dose de furosémide (pouvant avoir un effet sur l’hypovolémie), diminution de la dose de furosémide (pouvant entraîner une hypervolémie), majoration de tout autre traitement pour le diabète (pouvant mener à l’hypoglycémie) et réduction des traitements hypoglycémiants (pouvant occasionner une hyperglycémie).
La variation de la créatinine sérique et du débit de filtration glomérulaire estimé (DFGe) a été calculée exclusivement pour les patients ayant reçu leur ordonnance à la CLIC à l’aide de la valeur de laboratoire associée à la plus grande variation de la fonction rénale. Il en est de même pour l’analyse de la variation de la pression artérielle systolique. Pour les autres sous-groupes, seule la première valeur de créatinine sérique analysée suivant l’ajout de l’iSGLT2 a été recueillie, ainsi qu’un portrait plus sommaire de l’innocuité et des médicaments au profil. Finalement, la survenue d’insuffisance rénale aiguë (IRA) a été évaluée pour l’ensemble des patients des trois sous-groupes lorsqu’une valeur de créatinine sérique de base prélevée dans les 28 jours précédant le début de l’iSGLT2 était présente. L’IRA est définie de plusieurs façons dans la littérature. Dans notre étude, elle correspond à une hausse de 30 % ou plus de la créatinine sérique. Nous avons choisi d’établir notre valeur critique à 30 %, car en pratique, c’est l’augmentation généralement tolérée suite à l’ajout d’un IECA et c’est aussi une valeur mitoyenne des différentes définitions acceptées par les Kidney Disease: Improving Global Outcomes14,15.
Des analyses descriptives ont été effectuées avec les logiciels IBM SPSSMD Statistics version 28.0, SASMD (IBM, New-York, New-York, É.-U.) et ExcelMD (Microsoft, Seattle, Washington, É.-U.). Les variables quantitatives ont été exprimées sous forme de moyennes, d’écarts-types et d’étendues, et les variables qualitatives en proportions. Le test exact de Fisher a servi à l’analyse des variables qualitatives afin de comparer la survenue d’effets indésirables et les arrêts de traitement entre les patients diabétiques et non diabétiques. Ce test a également été utilisé pour les analyses exploratoires comparant l’ajustement ou non des doses de furosémide à l’instauration de l’iSGLT2 et la survenue subséquente d’effets indésirables volémiques. Le test t de Student a été employé pour les analyses exploratoires sur la comparaison de l’hémoglobine glyquée (HbA1c) moyenne des patients diabétiques et la survenue ou non de mycoses génitales, ainsi que sur la dose moyenne de base de furosémide et la survenue ou non d’effets indésirables volémiques. Le seuil de signification statistique a été fixé à 5 % (p < 0,05). Enfin, les analyses portant sur les ajustements apportés aux médicaments cardiovasculaires et aux hypoglycémiants à l’instauration de l’iSGLT2 et dans les trois mois ainsi que l’évolution des doses cibles des médicaments clés contre l’insuffisance cardiaque ont été stratifiées selon le lieu de prescription de l’iSGLT2. L’équipe a bénéficié de l’expertise du biostatisticien du Centre de recherche de l’IUCPQ–UL pour les analyses statistiques.
Parmi les 383 dossiers de patients suivis à la CLIC qui ont été consultés, 150 respectaient les critères d’inclusion et d’exclusion. Six patients ont été inclus à deux reprises, pour un total de 156 épisodes.
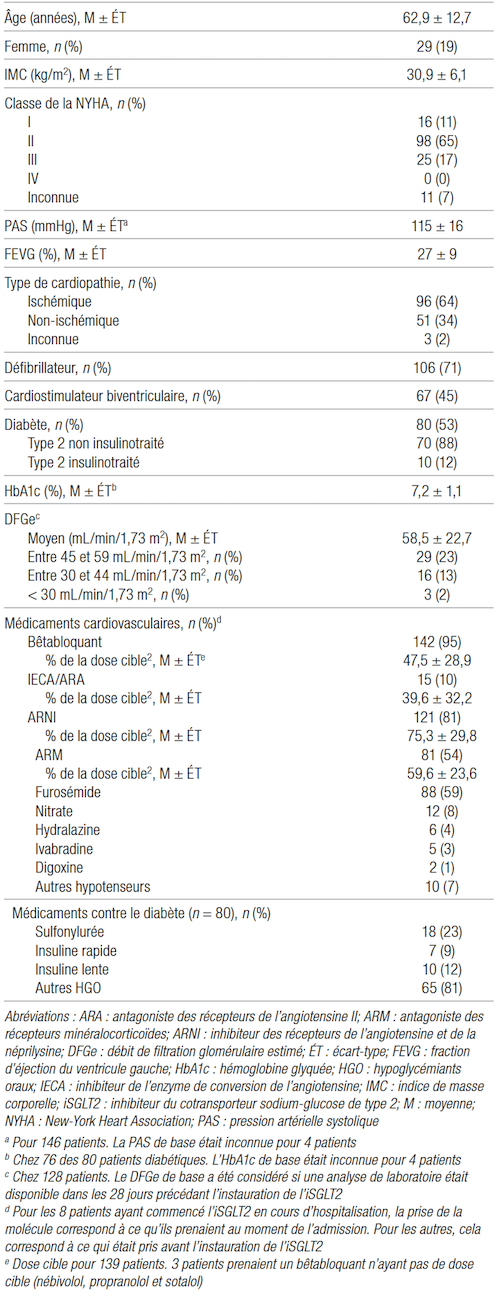
Le tableau I présente les caractéristiques de base des 150 patients inclus. Pour les six patients ayant été traités deux fois chacun, les caractéristiques de base incluses étaient celles du premier traitement. La majorité des patients (81 %) étaient des hommes dont l’âge moyen était de 62,9 ans. Près des deux tiers avaient une classe fonctionnelle II de la New York Heart Association et aucun n’avait une classe IV. Plus de la moitié des patients étaient atteints d’un diabète de type 2 et 88 % d’entre eux n’étaient pas insulinotraités. Il n’y avait aucun patient diabétique de type 1. Pour les 128 ayant eu une analyse de la créatinine sérique, le DFGe moyen était de 58,5 mL/min/1,73 m2.
Le détail du traitement médicamenteux de base des patients est également présenté dans le tableau I. Presque tous (95 %) prenaient un BB dont la dose quotidienne moyenne correspondait à 47,5 % de la dose cible recommandée en cas d’insuffisance cardiaque2. Plus de 90 % des sujets étaient traités avec un IECA, un ARA ou un ARNI. Chez les 121 patients prenant un ARNI, la dose quotidienne moyenne correspondait à 75,3 % de la dose cible pour l’insuffisance cardiaque2. Seulement 54 % des patients prenaient un ARM, alors que 59 % avaient du furosémide à leur profil.
La CLIC représente le lieu de prescription principal avec 104 nouvel les ordonnances (67 %). Un total de 43 (27 %) ordonnances ont été commencées dans une clinique de consultation externe, par un autre professionnel ou au congé de l’hôpital. Enfin, neuf iSGLT2 (6 %) ont été commencés durant l’hospitalisation. Dans la majorité des cas (94 %), l’iSGLT2 était commencé à la dose recommandée par les lignes directrices2. La dapagliflozine était l’agent le plus prescrit (68 %), suivi de l’empagliflozine (29 %) puis de la canagliflozine (3 %).
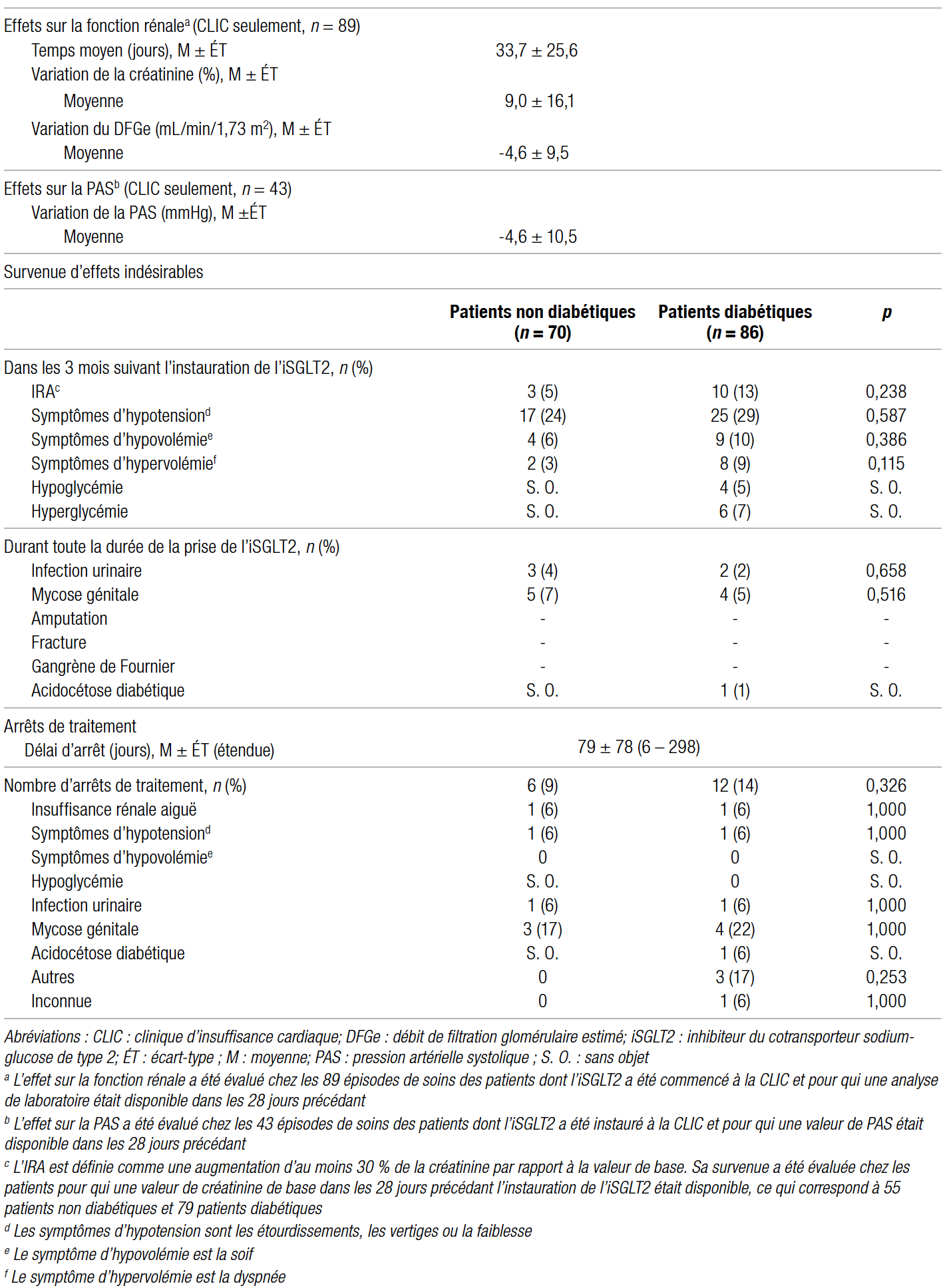
Le tableau II présente les données d’innocuité ayant été recueillies après l’instauration de l’iSGLT2.
Le pourcentage moyen de la plus grande variation de la créatinine dans les trois mois suivant le début de l’iSGLT2 dans les 89 épisodes de soins des patients traités à la CLIC (temps moyen de 33,7 jours) est de 9,0 %, ce qui se traduit par une variation moyenne du DFGe de −4,6 mL/min/1,73 m2. Pour l’ensemble des cas où une analyse de laboratoire de base avait eu lieu dans les 28 jours précédant l’instauration de l’iSGLT2 (134), 13 (10 %) cas d’IRA ont été décelés, dont 10 chez des patients diabétiques. Deux (1 %) patients ont ultimement cessé l’iSGLT2 pour cette raison.
Tableau I Caractéristiques de base des patients avant l’instauration de l’iSGLT2 (n = 150)

La variation maximale moyenne de la pression artérielle systolique analysée dans les 43 épisodes de soins des patients traités à la CLIC était de −4,6 mmHg. Dans l’ensemble de la population à l’étude, l’effet indésirable le plus fréquent était la survenue de symptômes d’hypotension (étourdissements, vertiges ou faiblesse) chez 42 sujets (27 %). Deux (1 %) ont cessé la prise de l’iSGLT2 pour cette raison.
La survenue de certains effets indésirables a été répertoriée pendant toute la durée de la prise de l’iSGLT2, soit 294 jours par épisode en moyenne. Neuf (6 %) mycoses génitales et cinq (3 %) infections urinaires ont été diagnostiquées, mais aucune amputation, fracture ni gangrène de Fournier n’ont été documentées.
Des symptômes d’hypovolémie (soif) ont été établis chez 13 patients (8 %) après l’ajout de l’iSGLT2. Pour huit (62 %) d’entre eux, aucun autre facteur pouvant expliquer l’hypovolémie n’a été mis en relief. Pour les autres, l’ajustement du furosémide à la hausse (n = 2), une gastro-entérite (n = 1), l’hypovolémie préalable (n = 1) et l’ajout de l’iSGLT2 en contexte d’hospitalisation pour décompensation aiguë de l’insuffisance cardiaque (n = 1) ont pu contribuer aux symptômes.
Chez les 86 patients diabétiques de l’étude, quatre (5 %) hypoglycémies ont été dénombrées. Elles pouvaient s’expliquer par d’autres facteurs, comme l’ajout d’une sulfonylurée, un jeûne, la reprise simultanée de tous les médicaments contre le diabète après une interruption et des symptômes d’hypoglycémie (tremblements et faiblesse) malgré une glycémie normale à 5,3 mmol/L.
L’iSGLT2 a été cessé chez 18 patients (12 %) dans un délai moyen de 79 jours (entre 6 et 298 jours). La raison principale était une mycose génitale pour sept d’entre eux (39 %). Deux patients l’ont cessé à cause d’une IRA, deux en raison de symptômes d’hypotension et trois pour d’autres raisons : fréquence urinaire accrue, arrêt durant une hospitalisation et erreur médicamenteuse.
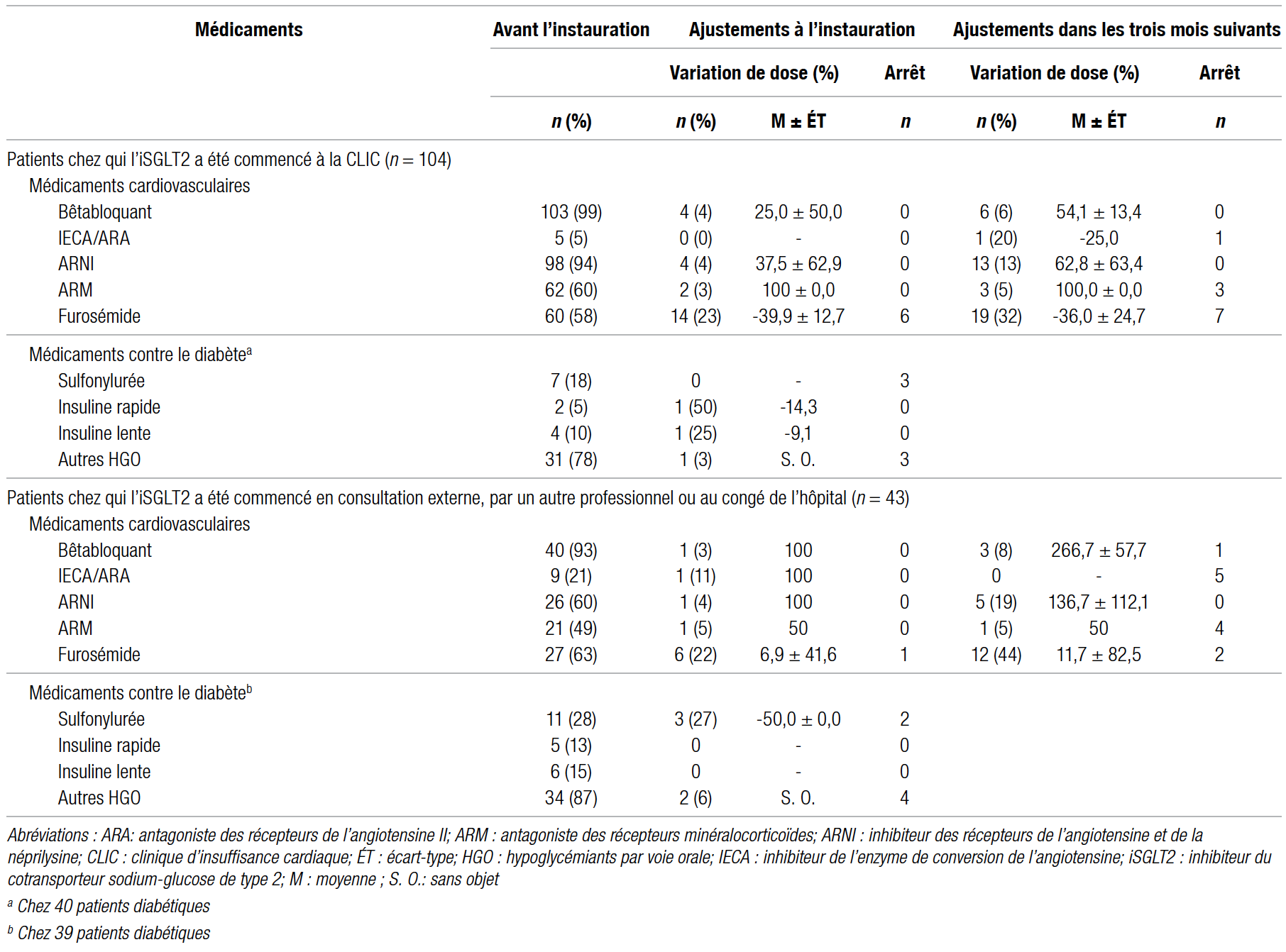
La première section du tableau III présente les ajustements du traitement des patients dont l’iSGLT2 a été commencé à la CLIC. La majorité des ajustements faits au moment de l’instauration était une variation de la dose de furosémide, pour 14 des 60 traitements avec ce médicament, avec une variation moyenne de la dose de −39,9 % et un arrêt complet à six occasions. Trois mois après l’ajout de l’iSGLT2, la variation moyenne de la dose d’ARNI a été de +62,8 % (n = 13), celle de la dose de BB de +54,1 % (n = 6) et celle de l’ARM de +100 % (n = 3).
Chez les 40 patients atteints de diabète de type 2, quelques ajustements des hypoglycémiants ont été effectués à l’instauration de l’iSGLT2, soit l’arrêt d’un hypoglycémiant par voie orale chez six personnes et la diminution des doses d’insuline d’un patient. L’arrêt de la sulfonylurée et du méglitinide ainsi que la réduction des doses d’insuline ont potentiellement mené à des hyperglycémies chez trois de ces patients.
Tableau II Tolérance à l’iSGLT2 et arrêt de traitement
Dans la seconde section du tableau III, l’ajustement le plus fréquent à l’instauration de l’iSGLT2 est encore une fois une variation de la dose de furosémide. À trois mois, bien que la variation moyenne de la dose du furosémide était positive (donc à la hausse), un plus grand nombre de patients ont eu une diminution de dose (n = 7) qu’une hausse (n = 5). Trois mois après l’ajout de l’iSGLT2, la dose d’ARNI a été augmentée en moyenne de 136,7 % (n = 5), celle du BB de 266,7 % (n = 3) et celle de l’ARM de 50 % (n = 1). Par ailleurs, neuf patients ont commencé à prendre un ARNI au moment de l’ajout de l’iSGLT2 ou dans les trois mois suivants.
Cinq des 39 personnes diabétiques dont l’iSGLT2 n’a pas été commencé à la CLIC ont cessé au moins un agent hypoglycémiant. Ces arrêts pourraient être responsables d’une des trois hyperglycémies survenues dans ce sous-groupe. À l’instauration de l’iSGLT2, une baisse de 50 % de la dose de sulfonylurée a eu lieu chez trois patients et une augmentation des autres hypoglycémiants par voie orale a également été relevée pour deux patients.
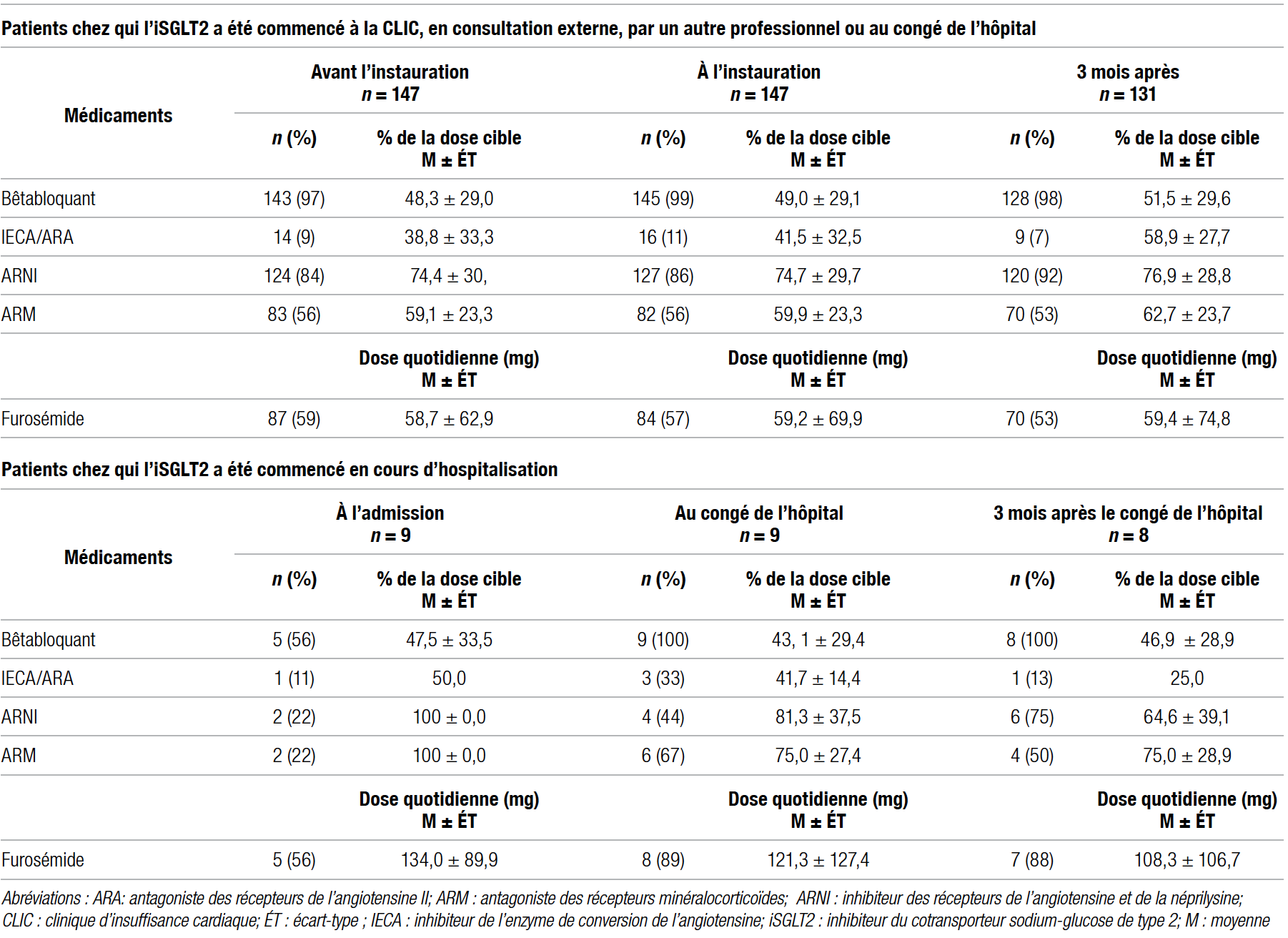
Le tableau IV dresse le portrait pharmacothérapeutique de la population à l’étude. Il présente le pourcentage d’atteinte des doses cibles des traitements anti-remodelage à trois moments différents : avant le début de l’iSGLT2, au moment de l’instauration et trois mois après. Pour l’ensemble des traitements anti-remodelage, les doses étaient plus élevées autant au début qu’après trois mois. Il est à noter que le nombre de patients prenant chaque agent au bout de trois mois était parfois moindre, puisque la collecte de données s’arrêtait si le patient était hospitalisé ou avait cessé l’iSGLT2 durant cette période.
Pour les neuf cas où l’iSGLT2 a été commencé en cours d’hospitalisation, on observe une baisse du pourcentage d’atteinte des doses cibles des médicaments clés au départ de l’hôpital et après trois mois. Par contre, le nombre de patients prenant chaque agent était plus élevé au congé de l’hôpital et au bout de trois mois qu’à leur arrivée à l’hôpital.
Tableau III Ajustement du traitement médicamenteux des patients au moment de l’instauration de l’iSGLT2 et dans les trois mois suivants
Le tableau V présente les suivis et les interventions menés chez les patients ayant commencé l’iSGLT2 à la CLIC. Au moins un suivi a eu lieu dans les trois premiers mois pour la totalité des 104 patients traités et le premier survenait en moyenne à 19,6 jours. Un seul patient a nécessité quatre suivis sur 46 jours afin de stabiliser son état après l’ajout de l’iSGLT2. Au total, ce sont 138 suivis qui ont été effectués, la majorité (57 %) par téléphone. L’ajout d’un iSGLT2 a entraîné en moyenne 1,3 suivi par cas et 123 analyses de laboratoire, dont 119 ont été prescrites par l’équipe de la CLIC. En ce qui a trait aux ajustements du traitement de l’insuffisance cardiaque et du diabète (variation de dose, ajout, arrêt), l’équipe de la CLIC a procédé à 21 ajustements en tout en cours de suivi.
Des analyses supplémentaires ont été menées af in de comparer la tolérance à l’iSGLT2 entre les patients diabétiques et non diabétiques étant donné le peu de recul sur ce traitement chez ces derniers. Comme le montre le tableau II, aucune différence statistiquement significative n’a été décelée quant à la tolérance ou aux arrêts de traitement entre les deux groupes, autant pour la survenue d’IRA (p = 0,238), les arrêts de traitement en raison d’IRA (p = 1,000), la survenue de symptômes d’hypotension (p = 0,587) et les arrêts de traitement en raison de symptômes d’hypotension (p = 1,000). En ce qui a trait à la survenue d’une mycose génitale, l’HbA1c des trois patients diabétiques ayant présenté cet effet indésirable était supérieure au reste de la population diabétique (8,1 ± 1,0 % vs 7,1 ± 1,1 %, p = 0,147), mais de façon non statistiquement significative. Enfin, on observe six arrêts de traitement chez les patients non diabétiques contre 12 chez les patients diabétiques. Malgré une tendance défavorable pour ces derniers, cette différence n’est pas statistiquement significative (p = 0,326). Par contre, il s’agit d’analyses complémentaires qui demeurent exploratoires.
Des analyses exploratoires ont également été effectuées afin d’évaluer l’influence des doses quotidiennes de base de furosémide ainsi que les répercussions des ajustements du furosémide au moment de l’instauration de l’iSGLT2 sur la survenue de symptômes volémiques. Les patients chez qui l’iSGLT2 a été commencé en cours d’hospitalisation ont été exclus de ces analyses.
Tableau IV Évolution des doses moyennes de la pharmacothérapie de l’insuffisance cardiaque en pourcentage d’atteinte des doses cibles pour les médicaments clés2
Pour les 87 patients qui prenaient du furosémide avant l’instauration de l’iSGLT2, la dose quotidienne moyenne de base du diurétique était plus élevée chez les patients ayant présenté subséquemment des symptômes d’hypovolémie (83 ± 35 mg vs 56 ± 65 mg, p = 0,624) et d’hypervolémie (103 ± 135 mg vs 55 ± 52 mg, p = 0,385), mais de manière non statistiquement significative. La dose quotidienne médiane du diurétique était aussi plus élevée chez les patients ayant éprouvé des symptômes d’hypovolémie (80 mg contre 40 mg), mais était identique chez ceux ayant eu des symptômes d’hypervolémie (40 mg dans les deux groupes).
Lors d’une analyse des 60 cas où l’iSGLT2 a été commencé à la CLIC, la dose moyenne de furosémide était plus élevée chez les sujets qui ont connu des symptômes d’hypovolémie (88 ± 33 mg vs 41 ± 35 mg, p = 0,005), et ce, de manière statistiquement significative, ce qui n’était pas le cas pour l’hypervolémie (67 ± 46 mg vs 43 ± 37 mg, p = 0,292).
Aucune association significative n’a été décelée entre les ajustements de dose de furosémide faits à l’instauration de l’iSGLT2 et la survenue de symptômes volémiques. Toutefois, en l’absence d’ajustement de la dose de furosémide (n = 63), il s’est produit sept (11 %) hypovolémies contre une seule (4 %) chez les 24 patients ayant eu une diminution ou un arrêt du furosémide (p = 0,436). Par ailleurs, une hypervolémie a été notée chez trois (13 %) d’entre eux. Pour les 20 épisodes où le furosémide a été ajusté sans engendrer d’effets indésirables volémiques établis, 13 réductions de la dose quotidienne de 38 % en moyenne ont eu lieu (dose quotidienne moyenne de base 49 ± 26 mg) en plus de sept arrêts (dose quotidienne moyenne de base 24 ± 11 mg).
Cette étude a permis de décrire l’utilisation des iSGLT2 chez les patients atteints d’insuffisance cardiaque à FEVG abaissée suivis à la CLIC de l’IUCPQ–UL. Elle portait sur la tolérance au médicament, les arrêts de traitement, les ajustements des agents pharmacologiques pertinents et les suivis faits par l’équipe de la CLIC. Au total, 150 patients ont été inclus dans l’étude, dont six à deux reprises. De manière générale, les caractéristiques de base des patients étaient semblables à celles des patients des études DAPA-HF et EMPEROR-Reduced. Cependant, plus de patients avaient une cardiopathie ischémique (64 % vs 55,5 % et 52,8 %) ou un diabète (53 % vs 41,8 % et 49,8 %)10,11. L’HbA1c moyenne des patients diabétiques n’était pas disponible dans les études DAPA-HF et EMPEROR-Reduced10,11. Néanmoins, le diabète des patients de la présente étude était mieux contrôlé avec une HbA1c moyenne de 7,2 % en comparaison des études sur les iSGLT2 réalisées chez les patients atteints de diabète (CANVAS 8,2 % ; CREDENCE 8,3 % ; DAPA-CKD 7,4 % et DECLARE-TIMI 58 8,3 %)8,9,16,17. Le DFGe moyen des patients inclus dans l’étude était de 58,5 mL/min/1,73 m2, ce qui est légèrement inférieur aux patients des études DAPA-HF (66,0 mL/min/1,73m2) et EMPEROR-Reduced (61,8 mL/min/1,73m2)10,11.
Les iSGLT2 ont été relativement bien tolérés par les patients souffrant d’insuffisance cardiaque avec FEVG abaissée suivis à la CLIC.
Tableau V Suivis et interventions de l’équipe de la CLIC auprès des 104 patients chez qui l’iSGLT2 a été commencé à la CLIC
Au total, 13 (10 %) IRA sont survenues. Toutefois, étant donné le caractère rétrospectif de l’étude, ce chiffre peut être biaisé : le moment des analyses sanguines était variable entre les patients, et seuls ceux ayant une analyse de la créatinine sérique dans les 28 jours précédant l’instauration de l’iSGLT2 ont été inclus. Bien que ce délai ait été déterminé pour limiter les biais d’information, la valeur réelle de la créatinine sérique de base pourrait être différente de celle utilisée pour les analyses. Cependant, seuls deux patients ont cessé l’iSGLT2 pour cause d’IRA, laissant possiblement présager que l’effet de ce dernier sur la fonction rénale tend à se stabiliser dans le temps, sans nécessairement mener à l’arrêt du traitement.
L’hypotension était l’effet indésirable le plus fréquent chez 27 % des patients à l’étude comparativement à 9,4 % dans EMPEROR-Reduced (8,7 % dans le groupe témoin)11. Ce résultat s’explique possiblement par le fait que 81 % des patients prenaient un ARNI (comparativement à 10,5 % dans l’étude DAPA-HF et à 18,3 % dans l’étude EMPERORReduced) et que cet agent a un potentiel hypotenseur supérieur à l’IECA, comme l’a montré l’étude PARADIGM-HF10,11,18. Par ailleurs, en excluant les cas pouvant être causés par d’autres facteurs, des symptômes d’hypotension sont survenus à seulement six (4 %) reprises. Ainsi, les symptômes d’hypotension directement attribuables à l’ajout de l’iSGLT2 pourraient possiblement être moins fréquents qu’on le croit. Cela reste une hypothèse et mériterait d’être davantage approfondi dans une étude future. Au bout du compte, l’hypotension a mené à seulement deux arrêts de traitement.
En tout, 6 % des patients de l’étude ont souffert d’une mycose génitale contre seulement 1,7 % de ceux du groupe prenant un iSGLT2 dans EMPEROR-Reduced11. La première étude ayant soulevé cet effet indésirable a été publiée en 2015 et a révélé une survenue de 6,4 % de mycose génitale : une meilleure prise en charge des patients durant les études subséquentes pourrait en avoir sous-estimé la prévalence7. Il est possible que les patients inclus dans notre étude n’y aient pas été suffisamment sensibilisés.
L’hypovolémie (objectivée par de la soif) et l’hypervolémie (par de la dyspnée) ont été constatées chez 23 (15 %) sujets, mais n’ont jamais mené à un arrêt de traitement. Des facteurs comme la non-adhésion des patients au traitement ayant un effet sur la volémie ou à la restriction liquidienne peuvent avoir surestimé la présence d’hypervolémie, mais ils n’ont pas été étudiés.
Lorsque la dose de furosémide était diminuée ou que le diurétique était cessé à l’instauration de l’iSGLT2, seulement 4 % des patients présentaient une hypovolémie contre 11 % en l’absence d’ajustement (p = 0,436). Bien qu’il ne soit pas statistiquement significatif, il semble aussi y avoir un lien entre la survenue de symptômes volémiques et de plus fortes doses de base de furosémide. En effet, les doses étaient plus élevées (supérieures à environ 80 mg par jour) chez les patients ayant présenté des symptômes d’hypovolémie et d’hypervolémie. Bien que ces analyses soient exploratoires, il serait peut-être plus prudent d’attendre que la volémie du patient soit stable avant de commencer un iSGLT2 et d’être plus vigilant chez les patients nécessitant de plus fortes doses de diurétique.
La survenue d’arrêt de traitement de 12 % dans notre cohorte est supérieure à celle des groupes traités avec un iSGLT2 des études DAPA-HF (4,7 %) et EMPEROR-Reduced (8,5 %)10,11. Dans notre étude, la cause principale d’arrêt de traitement était la mycose génitale dans 39 % des cas. Une sensibilisation accrue des professionnels à cet effet indésirable ainsi que la conscientisation des patients aux bienfaits cardiovasculaires de l’agent pourraient certainement augmenter l’adhésion au traitement.
Étant donné le potentiel hypotenseur et diurétique connu des iSGLT2, on aurait pu s’attendre à une diminution des doses des autres traitements de l’insuffisance cardiaque7–11. Cependant, la variation moyenne de la dose des agents ayant engendré des bienfaits sur l’insuffisance cardiaque est majoritairement positive. Il semble donc possible de poursuivre l’ajustement des traitements anti-remodelage malgré l’ajout d’un iSGLT2. Même lorsque ce dernier était commencé pendant une hospitalisation, de nouveaux patients ont pu commencer un BB, un ARNI ou un ARM dans les trois mois suivant leur sortie de l’hôpital.
En tout, nous avons constaté quatre hypoglycémies et six hyperglycémies. Les quatre hypoglycémies pouvaient s’expliquer par d’autres facteurs. À l’inverse, une diminution préventive des hypoglycémiants par voie orale et des insulines à l’instauration de l’iSGLT2 a possiblement entraîné quatre des six hyperglycémies. Il semble donc important de suivre de près la glycémie des patients à l’ajout de l’iSGLT2 et de ne pas ajuster les médicaments pour le diabète trop agressivement. À la CLIC, seuls trois patients ont été dirigés à la clinique du diabète pour un suivi conjoint à l’instauration de l’iSGLT2. Une plus grande collaboration avec cette équipe pourrait être bénéfique.
Les résultats semblent indiquer que le suivi actuel est adéquat. En effet, tous les patients ont eu minimalement un suivi. L’ajout d’un iSGLT2 a causé en moyenne 1,3 suivi par ordonnance, ce qui est acceptable avec les ressources actuelles de la CLIC.
Le délai de remboursement de l’iSGLT2 par la RAMQ a sans contredit contribué à la petite taille de l’échantillon et aux données manquantes. En effet, le statut d’exception a certainement été un frein à l’ajout du traitement chez les patients non diabétiques, car il pouvait s’écouler plusieurs semaines avant l’acception de la demande de paiement. Une extension de la collecte de données pour couvrir une plus vaste période suivant l’arrivée du code de remboursement pour la dapagliflozine aurait permis d’obtenir un plus grand échantillon et possiblement d’améliorer la puissance de l’étude à détecter de légères différences sur le plan de l’innocuité entre les patients diabétiques et ceux qui ne le sont pas. Comme la puissance de la présente étude était limitée, cette comparaison de l’innocuité entre les deux groupes demeure exploratoire.
Étant donné le caractère rétrospectif de l’étude, certaines données manquaient, et d’autres pourraient ne pas refléter la valeur réelle. Ces éléments pourraient, par ailleurs, avoir entraîné des biais d’information. En effet, une analyse de laboratoire ou une valeur de pression artérielle systolique dans les 28 jours précédant l’instauration de l’iSGLT2 n’était pas toujours présente, ce qui a limité l’analyse de la fonction rénale et de la pression artériel le à une port ion de l’échantillon. Les délais entre la valeur de base de la créatinine ou de la pression et l’ajout de l’iSGLT2 pouvaient être plus ou moins grands (jusqu’à 28 jours), ce qui constituait une limite à l’interprétation des résultats liés à ces informations. Pour les patients qui ont commencé l’iSGLT2 ailleurs qu’à la CLIC, seule la première analyse de laboratoire a été collectée, ce qui peut avoir eu un effet sur le nombre réel d’IRA. Il est possible que certains effets indésirables aient été sous-documentés de façon involontaire par les différents intervenants, ce qui a entraîné une surestimation de l’innocuité de l’iSGLT2. De même, des facteurs contributoires aux effets indésirables autres que l’ajout d’un iSGLT2 pourraient ne pas avoir été répertoriés et ces effets pourraient avoir été attribués à tort à l’iSGLT2. Le fait que certains intervenants étaient au courant du projet depuis juin 2021 peut également avoir influencé l’information recueillie, une consignation plus complète des effets indésirables pouvant avoir eu lieu à partir de ce moment. Aussi, le poids aurait été une variable plus précise pour le suivi de la volémie, mais il n’était pas possible de le collecter adéquatement de manière rétrospective.
L’iSGLT2 a été introduit dans des milieux et contextes différents. Cette hétérogénéité fait en sorte que l’ajustement des médicaments cardiovasculaires et hypoglycémiants était très variable. Ainsi, la validation de l’état volémique au moment de l’instauration de l’iSGLT2 aurait été une donnée pertinente à collecter. Chez les patients diabétiques, l’ajustement des hypoglycémiants dépend de leurs glycémies de base. Cette variabilité et le peu de sujets inclus dans l’étude rendent difficile la généralisation des résultats. L’étude souligne cependant l’importance d’individualiser le traitement selon le contexte clinique.
L’étude a été menée chez une population québécoise fortement traitée par un ARNI, souffrant d’insuffisance cardiaque avec FEVG abaissée et suivie dans une clinique spécialisée d’insuffisance cardiaque. Elle comportait peu de critères d’exclusion. La majorité des patients étaient traités avec l’ensemble de la pharmacothérapie indiquée dans les dernières lignes directrices pour cette maladie. Les résultats peuvent donc s’appliquer dans toutes les cliniques d’insuffisance cardiaque du Québec, même aux patients suivis en première ligne. Cependant, malgré l’ajout des iSGLT2 dans les dernières lignes directrices canadiennes, notre étude ne porte somme toute que sur un petit échantillon de seulement 156 cas2. La couverture des iSGLT2 par le statut d’exception a certainement été un frein à la prescription de cette classe de médicaments. Puisque la dapagliflozine est désormais remboursée depuis décembre 2021 avec un code d’exception par le régime général d’assurance-médicaments, une plus grande proportion de patients suivis à la CLIC prennent maintenant cette molécule13.
En conclusion, les iSGLT2 sont relativement bien tolérés chez les patients atteints d’insuffisance cardiaque avec FEVG abaissée qui sont suivis à la CLIC de l’IUCPQ–UL et qui prennent aussi un ARNI dans plus de 80 % des cas. Bien que l’hypotension soit l’effet indésirable le plus fréquent, l’ajout d’un iSGLT2 ne semble pas avoir subséquemment limité la titration ou l’ajout des autres médicaments clés dans la prise en charge de l’insuffisance cardiaque. En plus de l’iSGLT2, d’autres facteurs peuvent avoir contribué à l’hypotension. On compte aussi 10 % (n = 13) d’IRA, mais seulement deux patients ont ultimement cessé le traitement pour cette raison. Quelques hypoglycémies ont été constatées chez les patients diabétiques, mais elles pouvaient toutes s’expliquer par des facteurs de confusion. Pour finir, 12 % des 156 cas étudiés ont dû cesser leur traitement, surtout en raison d’une mycose génitale. Des conseils d’hygiène sont donc essentiels à la bonne tolérance et au maintien du traitement. Le furosémide est l’agent le plus fréquemment ajusté lors de l’ajout d’un iSGLT2, avec une diminution moyenne de la dose de 25,9 % et 10 arrêts alors que dans les trois mois suivants, les autres agents clés du traitement ont en moyenne été augmentés. Chaque ordonnance d’iSGLT2 a occasionné en moyenne 1,3 suivi par l’équipe de la CLIC.
Les auteurs n’ont déclaré aucun financement lié au présent article.
Toutes les auteures ont soumis le formulaire de l’ICMJE sur la divulgation des conflits d’intérêts potentiels. Julie Méthot est rédactrice associée du comité de rédaction de Pharmactuel. Les autres auteures n’ont déclaré aucun conflit d’intérêts lié au présent article.
Les auteures adressent un remerciement spécial aux pharmaciens de la CLIC de l’IUCPQ-UL et à monsieur Serge Simard pour son soutien dans les analyses statistiques. Cette personne a donné son autorisation écrite.
1. Heart and Stroke Foundation of Canada. Falling short: How Canada is failing people with heart failure – and how we can change that (2022). [en ligne] https://www.heartandstroke.ca/-/media/pdf-files/canada/2022-heart-month/hs-heart-failure-report-2022-final.pdf?rev=245159ea1726419aaa6f71ae9e7692f3 (site visité le 9 février 2024).
2. McDonald M, Virani S, Chan M, Ducharme A, Ezekowitz JA, Giannetti N et al. CCS/CHFS Heart failure guidelines update: defining a new pharmacologic standard of care for heart failure with reduced ejection fraction. Can J Cardiol 2021;37:531–46.

3. Ezekowitz JA, O’Meara E, McDonald MA, Abrams H, Chan M, Ducharme A et al. 2017 Comprehensive update of the Canadian Cardiovascular Society guidelines for the management of heart failure. Can J Cardiol 2017;33:1342–33.

4. Janssen Inc. Monographie de produit avec renseignements destinés aux patients: Invokana (11 mars 2024). [en ligne] https://www.janssen.com/canada/sites/www_janssen_com_canada/files/prod_files/live/invokana_cpmf.pdf (site visité le 30 mai 2024).
5. AstraZeneca Canada. Monographie de produit avec renseignements destinés aux patients: Forxiga (10 octobre 2023). [en ligne] https://www.astrazeneca.ca/content/dam/az-ca/frenchassets/Ourmedicines/forxiga-product-monograph-fr.pdf (site visité le 30 mai 2024).
6. Boehringer Ingelheim (Canada). Monographie de produit avec renseignements destinés aux patients: Jardiance (9 mars 2023). [en ligne] https://www.pdf.hres.ca/dpd_pm/00070148.PDF (site visité le 8 février 2024).
7. Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015;373:2117–28.

8. Neal B, Perkovic V, Mahaffey KW, de Zeeuw D, Fulcher G, Erondu N et al. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med 2017;377:644–57.

9. Wiviott SD, Raz I, Bonaca MP, Mosenzon O, Kato ET, Cahn A et al. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2019;380:347–57.

10. McMurray JJV, Solomon SD, Inzucchi SE, Kober L, Kosiborod MN, Martinez FA et al. Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med 2019; 381:1995–2008.

11. Packer M, Anker SD, Butler J, Filippatos G, Pocock SJ, Carson P et al. Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med 2020;383:1413–24.

12. Leclerc V. Dapagliflozine pour les patients atteints d’insuffisance cardiaque à fraction d’éjection réduite : étude DAPA-HF. Pharmactuel 2020;53:167–72.
13. Régie de l’assurance maladie du Québec. Liste des médicaments : mise à jour le 28 septembre 2022. [en ligne] https://www.ramq.gouv.qc.ca/sites/default/files/documents/liste-med-2022-09-28-fr.pdf (site visité le 18 octobre 2022).
14. Bakris GL, Weir MR. Angiotensin-converting enzyme inhibitor–associated elevations in serum creatinine: is this a cause for concern? Arch Intern Med 2000;160:685–93.

15. Kidney Disease: Improving Global Outcomes (KDIGO) acute kidney injury work group. KDIGO clinical practice guideline for acute kidney injury. Kidney Int Suppl 2012;2:1–138.
16. Perkovic V, Jardine MJ, Neal B, Bompoint S, Heerspink HJL, Charytan DM et al. Canagliflozin and renal outcomes in type 2 diabetes and nephropathy. N Engl J Med 2019;380:2295–306.

17. Heerspink HJL, Stefánsson BV, Correa-Rotter R, Chertow GM, Greene T, Hou FF et al. Dapagliflozin in patients with chronic kidney disease. N Engl J Med 2020;383:1436–46.

18. McMurray JJV, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR et al. Angiotensinneprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014;371:993–1004.

Pour toute correspondance : Audrey Vachon, Institut universitaire de cardiologie et de pneumologie de Québec–Université Laval, 2725, chemin Sainte-Foy, Québec (Québec) G1V 4G5, CANADA; Téléphone : 418-656-8711, poste 2925 ; Courriel : audrey.vachon@ssss.gouv.qc.ca
PHARMACTUEL, Vol. 57, No. 3, 2024