Lettre au rédacteur
Outil d’encadrement de médicaments utilisés hors indication, novateurs et émergents en établissement de santé
Cynthia Tanguay1,2, B.Sc., M.Sc., Catherine Côté-Sergerie2, B.Sc., Geneviève Cardinal3, ll.m., Jean-François Bussières4,5, B.Pharm., M.Sc., MBA, FSCHP, FOPQ, Denis Lebel6, B.Pharm., M.Sc., FCSHP
1Coordonnatrice, Unité de recherche en pratique pharmaceutique, Département de pharmacie, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec) Canada;
2Spécialiste en activités cliniques, Unité de recherche en pratique pharmaceutique, Département de pharmacie, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec) Canada;
3 Chef du Bureau de l’éthique de la recherche et présidente du Comité d’éthique de la recherche, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec) Canada;
4Pharmacien, Unité de recherche en pratique pharmaceutique, Département de pharmacie, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec) Canada;
5Professeur titulaire de clinique, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
6Pharmacien, chef, Département de pharmacie et Unité de recherche en pratique pharmaceutique, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec) Canada
Reçu le 28 novembre 2023; Accepté après révision le 5 janvier 2024
Le chef du département de pharmacie est responsable « d’élaborer, pour son département, […] des règles d’utilisation des médicaments qui tiennent compte de la nécessité de rendre des services adéquats aux usagers, de l’organisation et des ressources dont dispose l’établissement »1.
Dans de nombreuses situations, la prise de décision entourant l’utilisation d’un médicament est complexe, notamment en raison de l’intention du traitement, de l’incertitude quant au statut du médicament, des particularités d’accès ou d’autres considérations ayant trait au clinicien, au patient ou à l’établissement. Il est de la responsabilité du prescripteur de justifier l’utilisation du médicament auprès du chef pharmacien qui valide la demande et l’encadrement proposé. Notre objectif était d’illustrer cette complexité et de faciliter l’encadrement du recours aux médicaments avec des considérations particulières, ce qui inclut les traitements émergents, novateurs ou utilisés pour une indication non reconnue.
Un outil a été développé et testé avec plusieurs exemples de médicaments ayant des considérations particulières d’utilisation. De plus, un comité ad hoc a été créé pour recenser les situations types et les problématiques entourant l’utilisation sécuritaire des médicaments et l’accès en temps opportun. Le comité multidisciplinaire, composé de représentants du Département de pharmacie, du Comité d’éthique de la recherche, du centre de recherche, du Comité d’éthique clinique, du bureau des affaires juridiques, du bureau du partenariat patients-familles-soignants, de chercheurs et de médecins, s’est réuni à deux reprises en 2021. Les problématiques soulevées ont été intégrées à l’outil.
L’outil s’adresse aux cliniciens et aux autorités compétentes participant à la décision de recourir ou non à un médicament pour un patient donné. Cinq questions doivent être posées. Quelle est l’intention du traitement? Quel est le degré d’incertitude lié au traitement? Quel est le statut du médicament? Quelles sont les modalités d’accès? Quels sont les autres facteurs spécifiques à considérer?
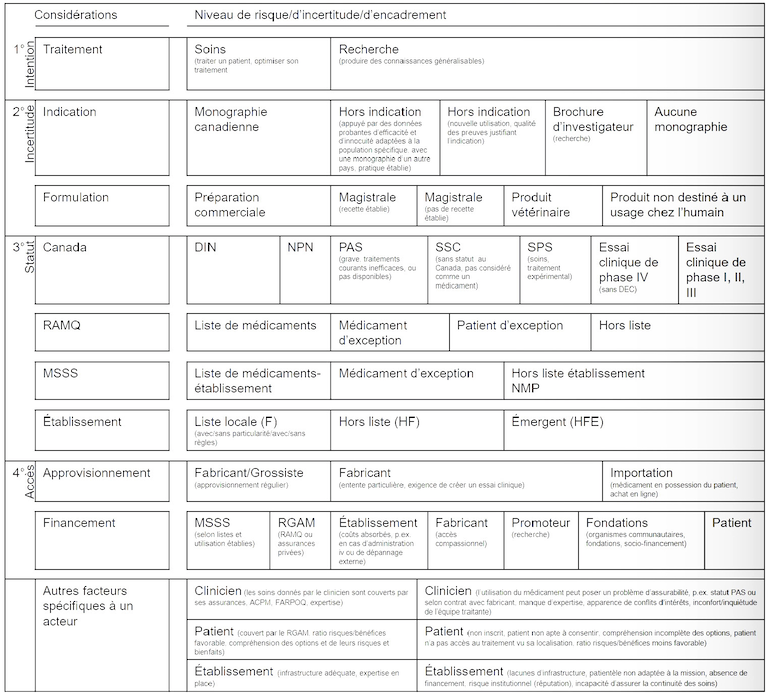
Neuf considérations sont prises en compte dans l’outil (figure 1). Pour chacune, il existe un gradient de risque, d’incertitude et d’encadrement. Pour une situation donnée, plus la considération tend vers la droite sur la figure, plus l’encadrement devrait être serré. Par exemple, un encadrement « minimal » est réaliste lorsqu’on veut traiter un patient à l’aide d’un médicament faisant l’objet d’une monographie canadienne, offert dans une forme commerciale, inscrit sur la liste des médicaments du régime général d’assurance médicaments, en vente chez un grossiste et financé par le ministère de la Santé et des Services sociaux. En revanche, l’encadrement devrait être plus serré lorsqu’on veut soigner un patient à l’aide d’un médicament dont l’indication n’est pas reconnue dans la monographie canadienne (hors indication), pour une nouvelle utilisation sans preuve de qualité, en ayant recours à une préparation magistrale sans recette établie et pour un médicament non inscrit sur les listes nationales ou locales. Chaque considération est indépendante, et chaque ligne de l’outil doit être lue séparément.
L’outil permet d’illustrer le degré de complexité, d’incertitude et de risque. Il fournit des pistes sur l’encadrement requis en précisant la nature des problèmes. L’encadrement peut se faire à trois niveaux : auprès du patient, des instances ou du clinicien. Le demandeur peut obtenir un consentement verbal ou écrit du patient pour les soins ou pour sa participation à la recherche ou à la publication scientifique. Le demandeur peut solliciter un avis ou obtenir une autorisation de la part d’instances locales, gouvernementales et externes, par exemple, du chef du département de pharmacie, du comité de convenance chargé de l’évaluation de ces demandes ou encore du Comité d’éthique de la recherche. Il peut aussi devoir remplir une demande d’accès, signer une entente aux fins de remboursement par la Régie de l’assurance maladie du Québec, un tiers privé ou un fabricant ou encore demander l’autorisation de Santé Canada pour importer le produit. Le demandeur peut devoir justifier l’utilisation du médicament en en démontrant l’efficacité et l’innocuité et en précisant les suivis à faire dans le parcours de soins du patient. Si plusieurs de ces mesures d’encadrement sont déterminées par le cadre juridique en vigueur, certaines peuvent être laissées à la discrétion de l’établissement. L’outil permet de guider l’établissement dans les zones grises pour déterminer le degré d’encadrement souhaitable.
| |
| |
|
Figure 1. Outil d’encadrement de l’utilisation de médicaments en situations particulière
Abréviations : ACPM : Agence canadienne de protection médicale; DIN : drug identification number (numéro d’identification du médicament); F : formulaire (inscrit à la liste locale de l’établissement); FARPOPQ : Fonds d’assurance responsabilité de l’Ordre des pharmaciens du Québec; HF : hors formulaire (non inscrit à la liste locale de l’établissement); HFE : hors formulaire pour médicament émergent (non inscrit à la liste locale de l’établissement et considéré comme un médicament émergent); MSSS : ministère de la Santé et des Services sociaux; NMP : nécessité médicale particulière; NPN : numéro de produit naturel; PAS : Programme d’accès spécial; RAMQ : Régie de l’assurance maladie du Québec; RGAM : régime général d’assurance médicaments; SPS : single patient study (essai clinique sur un seul participant selon les exigences de Santé Canada); SSC : sans statut au Canada |
En outillant les prescripteurs à considérer tous les risques d’un traitement, nous espérons établir un dialogue entre le demandeur et l’approbateur de la demande afin d’obtenir une bonne justification et de faciliter l’encadrement des risques. Le partage de cet outil permet d’échanger sur les meilleures pratiques entourant la décision de recourir ou non à un médicament ayant des considérations particulières afin d’en assurer une utilisation pertinente, sécuritaire, cohérente et équitable partout au Québec.
Remerciements
Les auteurs remercient les membres du comité ad hoc et les personnes qui ont participé aux versions de l’outil.
Références
1. Loi sur les services de santé et les services sociaux, chapitre S-4.2, article 190. [en ligne] https://www.legisquebec.gouv.qc.ca/fr/document/lc/s-4.2 (site visité le 8 novembre 2023).
Pour toute correspondance : Denis Lebel, Centre hospitalier universitaire Sainte-Justine, 3175, chemin de la Côte Sainte-Catherine, Montréal (Québec) H3T 1C5, CANADA; Téléphone : 514-345-4603; Courriel : denis.lebel.hsj@ssss.gouv.qc.ca
(Return to Top)
PHARMACTUEL, Vol. 57, No. 1, 2024
