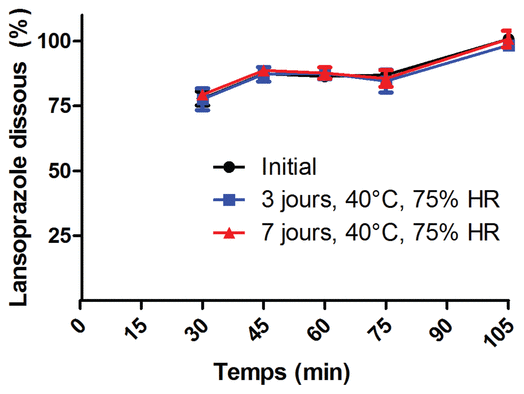
Figure 1 Pourcentage de lansoprazole dissous en fonction des conditions d’entreposage
Abréviations : HR : humidité relative; min : minutes
Alexandre Melkoumov1, B.Pharm., M.Sc., Grégoire Leclair2, B.Pharm., Ph.D.
Reçu le 27 octobre 2014: Accepté après révision par les pairs le 11 novembre 2014
La population pédiatrique est sujette au reflux gastroœsophagien, aux ulcères peptiques et à d’autres pathologies liées à l’acidité gastrique, et les cas les plus graves nécessitent une intervention pharmacologique1,2. Un des choix de traitement est l’administration d’un inhibiteur de la pompe à protons (IPP). Cependant, la majorité des IPP sont disponibles au Québec sous forme de comprimés solides. L’administration de ces comprimés à une population pédiatrique constitue donc un problème. Plusieurs préparations liquides d’IPP ont été proposées, mais aucune d’elles n’est réellement acceptable en raison de problèmes de stabilité et d’efficacité3,4. Entre autres, la solution de lansoprazole dans du bicarbonate de sodium n’est pas conforme aux exigences USP pour les formulations entériques. De plus, une formulation de lansoprazole dans l’Orablend (Laboratoires Paddock, MN, É.-U.) ne présente pas de stabilité à long terme acceptable4. Conséquemment, l’hôpital pédiatrique CHU Sainte-Justine a décidé de ne plus recommander les formulations liquides d’IPP, mais plutôt de proposer l’utilisation de comprimés de lansoprazole orodispersibles (PrevacidMD FasTab, Abbott Canada, Montréal, QC, Canada). Ces comprimés sont coupés en deux ou en quatre selon la dose désirée, puis dissous dans de l’eau et immédiatement administrés au patient. À défaut de connaître leur stabilité, les soignants jettent simplement les portions inutilisées. Étant donné le coût de ce médicament, il est intéressant de savoir si la moitié inutilisée, sortie de son emballage, est suffisamment stable pour être utilisée le lendemain.
Nous avons donc réalisé une étude de stabilité sur des moitiés de comprimés de lansoprazole sortis de leur emballage. Les comprimés de lansoprazole orodispersibles (PrevacidMD FasTab 30 mg, Abbott Canada, lot 06038NB) ont d’abord été coupés en deux portions égales à l’aide d’un coupe-pilules. Nous avons évalué la variabilité entre les demi-comprimés en mesurant le coefficient de variation de leur masse (n = 12). Ces demi-comprimés ont ensuite été entreposés dans un contenant ouvert et conservés à l’abri de la lumière, à 40 °C et à 75 % d’humidité relative pendant trois ou sept jours (n = 6 pour chaque condition d’entreposage). Par la suite, des tests de dissolution ont permis d’évaluer la réaction des moitiés de comprimés soumis aux conditions de stabilité. Brièvement, les tests ont nécessité l’utilisation d’un appareil à dissolution, tel que le décrit la pharmacopée américaine pour les formulations à enrobage entérique (37 °C, 75 rpm, appareil II)5. Comme nous l’avons mentionné dans une étude antérieure4, nous avons d’abord exposé les demi-comprimés à de l’acide chlorhydrique (490 ml; 0,1 N; 60 min). Après le prélèvement d’un échantillon (25 ml), du tampon phosphate (475 ml, pH 6,8) a été ajouté au milieu de dissolution. Nous avons prélevé des échantillons (3 ml) à des moments prédéterminés (30, 45, 60 et 75 minutes après les 60 minutes initiales d’exposition à l’acide chlorhydrique) avant d’ajouter, après 75 minutes, de l’hydroxyde de sodium (100 ml, 1 N) au milieu de dissolution afin de dissoudre toute la quantité résiduelle de lansoprazole. Enfin, un dernier échantillon a été prélevé 30 minutes plus tard. Tous les échantillons ont été analysés selon une méthode éprouvée de chromatographie liquide à haute performance (CLHP)4. Six moitiés de comprimés ont été évaluées à chaque moment prédéterminé, et chaque injection CLHP a été effectuée en triplicata.
Le coefficient de variation de la masse des demi-comprimés était de 9,1 % (n = 12). Normalement, le coefficient de variation de la masse des formes unitaires pharmaceutiques devrait être inférieur à 6 %. Ce coefficient plus élevé provient de la difficulté à couper de façon précise les comprimés orodispersibles de lansoprazole. Toutefois, le lansoprazole n’est pas un médicament à dose critique. Ainsi, l’imprécision de la coupe de ces comprimés ne devrait pas être considérée comme un frein au traitement. Les résultats que nous avons obtenus ne montrent aucun changement de profil de dissolution entre les comprimés qui sortent de l’emballage et ceux vieux de trois et sept jours (figure 1). Ces résultats témoignent de la stabilité de cette forme pharmaceutique de lansoprazole dans les conditions évaluées.
|
|
||
|
Figure 1 Pourcentage de lansoprazole dissous en fonction des conditions d’entreposage |
||
En conclusion, il est possible de conserver les fractions de comprimés de lansoprazole orodispersibles pendant au moins une semaine à l’abri de la lumière et dans des conditions n’excédant pas 40 °C et 75 % d’humidité relative. De plus, les comprimés de lansoprazole sont difficiles à couper de façon précise, et il faut bien veiller à obtenir des demi-doses de masse correcte.
Les comprimés de lansoprazole orodispersibles ont été généreusement fournis par le département de pharmacie du CHU de Sainte-Justine.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
1. Vandenplas Y, Rudolph CD, Di Lorenzo C, Hassall E, Liptak G, Mazur L et coll. Pediatric gastroesophageal reflux clinical practice guidelines: joint recommendations of the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition (NASPGHAN) and the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition (ESPGHAN). J Pediatr Gastroenterol Nutr 2009;49:498–547.
2. Chelimsky G, Czinn S. Peptic ulcer disease in children. Pediatr Rev 2001;22:349–55.
3. Blanc A, Melkoumov A. Reflux gastro-oesophagien : comment administrer le lansoprazole en pédiatrie? Québec Pharmacie 2012;59:7–8.
4. Melkoumov A, Soukrati A, Elkin I, Forest JM, Hildgen P, Leclair G. Quality evaluation of extemporaneous delayed-release liquid formulations of lansoprazole. Am J Health Syst Pharm 2011;68:2069–74.
5. Lansoprazole delayed-release capsules monograph. United States Pharmacopeia 37 – National Formulary 32. Rockville, MD: The United States Pharmacopeia Convention 2014. p. 3499–500.
PHARMACTUEL, Vol. 48, No. 1, 2015