Charlotte Ballandras1, Suzanne Atkinson2, B.Pharm., M.Sc., DESS, Aurélie Guérin3, Denis Lebel4, B.Pharm., M.Sc., FCSHP, Jean-François Bussières5,6, B.Pharm., M.Sc., MBA, FCSHP
Reçu le 05 mai 2014: Accepté après révision par les pairs le 30 décembre 2014
Résumé
Objectif : Revoir les modalités de gestion de la qualité et des risques au sein du département de pharmacie d’un centre hospitalier universitaire québécois.
Description de la problématique : L’exercice de la pharmacie a considérablement évolué au cours des dernières décennies, particulièrement à cause des changements législatifs et normatifs et de la prise en charge toujours plus complète du circuit du médicament. Actuellement, nous sommes confrontés à un défi de taille : assurer la gestion de la qualité et des risques, tout en offrant des services et des soins pharmaceutiques de façon continue.
Discussion : Nous avons effectué une revue de la littérature scientifique, rencontré les gestionnaires de la qualité et des risques d’autres unités fonctionnelles, et passé en revue les titres d’emplois et les formations relatives à ce domaine. Nous avons pu mettre en évidence cinq principes directeurs et établir un calendrier d’audits. Notre démarche souligne la nécessité d’établir un programme cohérent, réaliste et continu de gestion de la qualité et des risques.
Conclusion : Cet article met en lumière la pertinence de créer un titre d’emploi spécifique au sein des départements de pharmacie de centres hospitaliers universitaires et d’établir un programme structuré d’évaluation.
Mots clés : Centre hospitalier universitaire, gestion de la qualité et des risques, organisation, pharmacie d’établissement
Abstract
Objective : To review the risk and quality management mechanisms in the pharmacy department of a Quebec university hospital.
Description of problem : The practice of pharmacy has changed considerably in the past few decades, mainly because of legislative and normative changes and increasingly comprehensive medication circuit management. Presently, we are faced with a major challenge: managing risk and quality while at the same time providing pharmaceutical care and services on a continuous basis.
Discussion : The following steps were undertaken: a literature review, a meeting with risk and quality managers from other functional units, and a scan of job titles and training pertaining to this area. We identified five guiding principles and established an audit schedule. This work brought to light the need to create a consistent, realistic and ongoing risk and quality management program.
Conclusion : This article underscores the need to create a dedicated job title, particularly in university hospital pharmacy departments, and to put a structured evaluation program in place.
Keywords : Institutional pharmacy, organization, risk and quality management, university health centre
L’exercice de la pharmacie a considérablement évolué au cours des dernières décennies, notamment en raison des changements législatifs et normatifs et de la prise en charge de plus en plus complète du circuit du médicament1. En 2014, les départements de pharmacie font face à un défi de taille : assurer la gestion de la qualité et des risques, tout en offrant des services et des soins pharmaceutiques de façon continue. Est-il encore réaliste de relever ce défi sans ressources spécifiques? Est-il encore possible, sans programme structuré, d’offrir la meilleure qualité possible tout en réduisant les risques au maximum? L’objectif de cet article vise à revoir les modalités de gestion de la qualité et des risques au sein d’un département de pharmacie d’un centre hospitalier universitaire québécois.
Le Centre hospitalier universitaire Sainte-Justine (CHU Sainte-Justine) est un établissement de santé de 500 lits, à vocation mère-enfant. Le circuit du médicament est placé sous la responsabilité du chef de département de pharmacie. La distribution unitaire centralisée représente annuellement plus de 1,4 million de transactions, plus de 0,6 million de préparations et près de 60 000 demandes d’information. À l’heure actuelle, la gestion de la qualité et des risques est répartie entre un adjoint au chef de département pour les soins, l’enseignement et la recherche, et un adjoint au chef de département pour les services pharmaceutiques.
Le premier adjoint joue le rôle de gestionnaire des risques pour le département de pharmacie et siège au comité central de gestion des risques de l’établissement. Il tient un tableau de bord et suit des indicateurs de qualité. Le deuxième adjoint s’assure que le circuit des médicaments est respecté, autant dans la pharmacie que dans tout l’établissement, notamment en ce qui concerne la gestion des substances contrôlées, des médicaments de niveau d’alerte élevé et de la tenue physique des lieux. Il collabore avec des pharmaciens chefs d’équipe de trois secteurs, entre autres pour la formation et la certification des assistants techniques en pharmacie et pour le respect des normes au sein du département.
Ce sont principalement les étudiants et les assistants de recherche de l’Unité de recherche en pratique pharmaceutique qui se chargent de l’évaluation de la qualité et des risques. Puisque plusieurs personnes se partagent la gestion de la qualité et des risques, il devient difficile de rassembler de l’information, d’assurer le suivi et de mettre en place des mesures correctrices en vue d’obtenir des résultats.
De plus, au cours des dernières années, les départements de pharmacie du Québec se sont vus confrontés à de nombreux audits externes (p. ex. : Santé Canada, différents groupes de recherche internationaux, Ordre des pharmaciens du Québec [OPQ], Agrément Canada, Direction de la cancérologie du Québec).
À ces audits externes il faut ajouter plusieurs auto-évaluations volontaires associées à la publication de lignes directrices et d’articles de documentation primaire. La gestion de ces nombreuses vérifications est complexe, notamment pour les raisons suivantes : nombre important de recommandations à évaluer et à mettre en place, difficulté à gérer des recommandations similaires ou contradictoires, complexité à classer les recommandations par ordre de priorité, perte de la vue d’ensemble de tous les écarts à corriger et impression de perte de contrôle parce que l’exercice semble interminable. En outre, la survenue périodique de ces audits externes ne contribue pas forcément à établir une culture continue de la qualité, mais plutôt à exercer une pression ciblée et artificielle sur l’ensemble des employés afin de satisfaire un organisme dans un temps donné. En somme, l’ensemble du cadre normatif est complexe, les écarts nombreux et le suivi difficile à réaliser dans le contexte actuel.
Dans un premier temps, nous avons établi six étapes de révision des modalités de gestion de la qualité et des risques au sein de notre établissement : 1) revue documentaire; 2) rencontre avec les gestionnaires d’autres unités; 3) recherche des titres d’emploi applicables à la gestion de la qualité et des risques dans le réseau de la santé du Québec; 4) détermination de la formation requise pour un gestionnaire de la qualité et des risques; 5) élaboration des principes directeurs d’un programme de gestion de la qualité et des risques; 6) création d’un échéancier d’audits. La revue documentaire nous a permis de mettre en évidence quelques ouvrages en gestion de la qualité et des risques2–7.
Dans un deuxième temps, nous avons recensé et comparé les éléments du cadre législatif et normatif en matière de gestion de la qualité et des risques au sein des unités d’imagerie médicale, de laboratoire et de pharmacie. Cet examen a mis en évidence un cadre normatif tout aussi exigeant pour les trois secteurs, avec l’obligation d’appliquer plusieurs dizaines de lois, de règlements et de normes. Si certaines normes n’ont pas de portée juridique au Québec (p. ex. le chapitre 800 de la United States Pharmacopeia8), elles ont une influence sur les pratiques. Autrement dit, le clinicien ajuste son arsenal thérapeutique quand une étude convaincante est publiée, peu importe le lieu de réalisation de l’étude. De même, un gestionnaire clinicien devrait réfléchir aux changements à apporter à l’organisation de son service lorsqu’une norme propose de nouvelles façons de faire.
Afin de valider et de comprendre ce cadre normatif, nous avons rencontré les gestionnaires administratifs des secteurs d’imagerie médicale et de laboratoire afin de déterminer les modalités de gestion de la qualité et des risques. Dans le département d’imagerie médicale du CHU Sainte-Justine, la gestion de la qualité et des risques ne relève pas d’un gestionnaire particulier, mais est placée sous la responsabilité du chef de service, qui assume aussi de très nombreuses autres tâches. Par contre, même si ce dernier est soumis à plusieurs contraintes légales et normatives, le volume d’activité du département d’imagerie médicale n’est pas nécessairement comparable à celui de notre département.
Aux laboratoires, la gestion de la qualité et des risques est par contre sous la gouverne d’une personne affectée à cette tâche, à savoir un cadre-conseil en assurance qualité et biosécurité. Ce cadre a notamment la responsabilité d’assurer la mise en place d’un programme d’assurance qualité et de coordonner chacun des audits, y compris la reddition de comptes, les signatures de registres et de rapports, et la supervision des mesures correctrices. La gestion du programme est informatisée sur une plateforme exclusive (LBXwebMD)9. En terme de volume d’activité, les laboratoires se comparent davantage au département de pharmacie; le cadre-conseil supervise un total de huit laboratoires différents, chacun ayant des normes ou des lois particulières à suivre (p. ex. : banque de sang, laboratoire de biochimie).
Ces constats ont mis en évidence la possibilité de regrouper sous un même titre d’emploi l’ensemble des responsabilités concernant la gestion de la qualité et des risques en pharmacie d’établissement. À cet effet, nous avons recensé les titres d’emploi relatifs à la gestion de la qualité et des risques à partir de la nomenclature des titres d’emploi du réseau de la santé et des services sociaux du Québec10,11. En recherchant le mot « qualité » dans cette nomenclature, on retrouve 22 titres d’emploi (p. ex. : spécialiste clinique en biologie médicale, coordonnateur technique en inhalothérapie, chargé clinique de sécurité transfusionnelle, conseiller en soins infirmiers).
Cependant, ce terme regroupe des titres d’emploi très différents, qui font référence à plusieurs aspects de la qualité. Les titres d’emploi qui font allusion à la qualité des soins sont le plus souvent cités. Ces titres d’emploi touchent plusieurs domaines et professions du système de santé, de l’administration générale aux services cliniques, en passant par les secteurs médicaux-techniques. Force est de constater qu’aucun titre d’emploi existant ne convient parfaitement aux rôles et responsabilités propres à la gestion de la qualité et des risques spécifiques au domaine de la pharmacie. Si cette tâche peut être confiée à un pharmacien ou à un assistant technique expérimenté en pharmacie (voire à un assistant technique en pharmacie), nous pensons qu’il est préférable d’utiliser un titre d’emploi distinct, afin d’éviter l’effet domino inhérent au partage du même titre d’emploi entre collègues, notamment en cas d’absentéisme (c.-à-d. pour éviter que le gestionnaire de la qualité et des risques ne serve qu’à remplacer les collègues absents). Ce nouveau titre d’emploi serait un poste de cadre, placé sous la responsabilité de l’adjoint au chef de département pour les services pharmaceutiques. Nous avons donc recherché des cursus d’études différents, qui pourraient mener à un titre de gestionnaire de la qualité et des risques en pharmacie d’établissement.
En recherchant le terme qualité dans l’ensemble des formations disponibles sur le site Internet de l’Université de Montréal, on retrouve 43 formations. Nous avons exclu 22 formations qui abordaient la recherche qualitative et non la qualité, ainsi que huit autres formations appartenant à différentes disciplines sans lien avec la qualité en santé. En ce qui concerne les 13 programmes restants, il nous est impossible à cette étape de notre réflexion de déterminer avec certitude la liste des programmes à cibler pour un poste de gestionnaire de la qualité et des risques en pharmacie. Nous pensons toutefois qu’il serait bon d’explorer la pertinence d’embaucher des candidats ayant obtenu le baccalauréat en sciences biopharmaceutiques de la Faculté de pharmacie de l’Université de Montréal. Même si nous croyons qu’une formation universitaire est préférable étant donné les responsabilités envisagées, il existe peut-être des formations collégiales appropriées, que des cours universitaires de gestion pourraient améliorer.
Un programme cohérent, réaliste et continu de gestion de la qualité et des risques repose sur les principes directeurs suivants : a) s’arrimer au cadre normatif et au calendrier de visites des organismes externes (p. ex. : visite d’Agrément Canada); b) intégrer à ce programme les normes de pratique pour les pharmaciens et le personnel technique de l’OPQ; c) englober l’ensemble des étapes du circuit du médicament, particulièrement celles qui ne comportent pas de critères normatifs établis par d’autres organismes; d) allouer suffisamment de temps à la mise en place de plans pour effectuer des mesures correctrices et pas seulement du temps consacré aux audits et aux observations directes; e) assurer la mise en place d’un processus légitime, objectif, transparent et collégial.
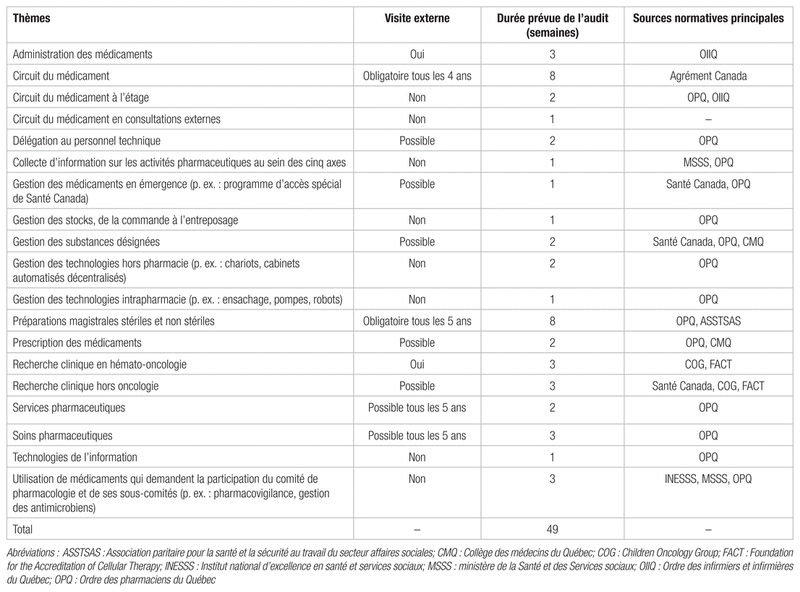
À partir des exigences d’Agrément Canada, des standards de pratique et des normes 2012.01, 2014.01 et 2014.02 de l’OPQ12–14 ainsi que des diverses lois qui s’appliquent, nous avons établi une liste des audits pertinents pour un programme de gestion de la qualité et des risques en pharmacie d’établissement. Nous avons détaillé ces audits, notamment le thème, les critères, la nature de la visite externe, la durée totale anticipée, y compris les observations directes, les analyses rétrospectives et prospectives, la détermination des écarts et des mesures correctrices, et les organismes responsables des sources normatives. Le tableau I présente un résumé des thèmes proposés.
Tableau I Profil des audits pertinents pour un programme de gestion de la qualité et des risques en pharmacie d’établissement
Pour chaque audit, nous avons créé une procédure d’audit qui précise notamment le lieu de l’audit, les personnes ressources, le processus audité, les critères de conformité, les méthodes d’observation et les outils. Par ailleurs, une grille personnalisée pour chaque audit et un rapport à destination du personnel audité ont été créés (figure 1).
|
|
||
|
Figure 1 Exemple des documents utilisés pour la réalisation d’un audit |
||
L’intranet du département de pharmacie comporte une section consacrée à la gestion de la qualité et des risques, dont une page par audit pour y noter les observations et recommandations. En outre, nous évaluerons la possibilité d’utiliser un outil Web de gestion des audits (p. ex. : Omni-assistant).
Il existe peu de données sur l’encadrement à donner en gestion de la qualité et des risques en pharmacie. Cet article met en évidence la pertinence de créer un titre d’emploi propre à cette gestion, particulièrement au sein des départements de santé de taille importante, et d’établir un programme structuré d’évaluation.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflit d’intérêts potentiel. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
1. Bussières JF, Tanguay C. Perspective québécoise et canadienne de la pratique en établissement de santé – 2011–2012. Pharmactuel 2013;46:112–42.
2. Phillips MS, Chisholm-Burns MA. Chapitre 14 : Quality Improvement. Dans : Chisholm-Burns MA, Vaillancourt AM, Shepherd M. Pharmacy management, leadership, marketing, and finance. 2e éd. Burlington : Jones & Bartlett Learning; 2014. p. 216–34.
3. Baker KR. The Basics of Managing Risk, Chaptitre 20 : The Basics of Managing Risk. Dans : Chisholm-Burns MA, Vaillancourt AM, Shepherd M. Pharmacy management, leadership, marketing, and finance. 2e éd. Burlington : Jones & Bartlett Learning; 2014. p. 339–51.
4. Sporull B. The Ultimate Improvement Cycle— Maximizing Profits through the Integration of Lean, Six Sigma, and the Theory of Constraints. Boca Raton : CRC Press; 2009. 250 p.
5. Nightingale DJ, Srinivasan J. Beyond the Lean Revolution—Achieving Successful and Sustainable Enterprise Transformation. New York : AMACOM; 2011. 270 p.
6. Manasse HR, Thompson KK. Medication Safety: A Guide for Health Care Facilities. Bethesda; American society of Health-System Pharmacists; 2005. 380 p.
7. Cohen MR. Medication Errors. 2e éd. Washington : American Pharmacists Association; 2007. 680 p.
8. United States Pharmacopeial Convention. General chapter <800> Hazardous drugs – handling healthcare settings. [en ligne] http://www.usp.org/usp-nf/notices/general-chapter-hazardousdrugs-handling-healthcare-settings (site visité le 30 décembre 2014).
9. Lbxweb. [en ligne] http://lbxweb.com/fr/index.php (site visité le 25 avril 2014).
10. Comité patronal de négociation du secteur de la santé et des services sociaux. Nomenclature des titres d’emploi, des libellés, des taux et des échelles de salaire du réseau de la santé et des services sociaux. Mise à jour du 13 février 2014. [en ligne] http://www.cpnsss.gouv.qc.ca/index.php?titres-demploi-salaires-et-primes (site visité le 13 mars 2014).
11. Ballandras C, Lebel D, Atkinson S, Simard M, Bussières JF. Qualité et risques en santé : à qui en confier la gestion au sein des unités fonctionnelles? Annales de l’Unité de recherche en pratique pharmaceutique 2014; 25 septembre : 1–27. [en ligne] http://indicible.ca/urpp/20140925_QUALITE1_Annales.pdf (site visité le 30 décembre 2014).
12. Ordre des pharmaciens du Québec. Préparations magistrales non stériles en pharmacie – norme 2012.01. [en ligne] http://www.opq.org/cms/Media/1088_38_fr-CA_0_Norme_2012_01_magistrales_non_steriles.pdf (site visité le 30 décembre 2014).
13. Ordre des pharmaciens du Québec. Préparations de produits stériles non dangereux en pharmacie – norme 2014.01. [en ligne] http://www.opq.org/cms/Media/1827_38_fr-CA_0_Norme_2014_01.pdf (site visité le 30 décembre 2014).
14. Ordre des pharmaciens du Québec. Préparations de produits stériles dangereux en pharmacie – norme 2014.02. [en ligne] http://www.opq.org/cms/Media/1847_38_fr-CA_0_Norme_2014_02.pdf (site visité le 30 décembre 2014).
PHARMACTUEL, Vol. 48, No. 1, 2015