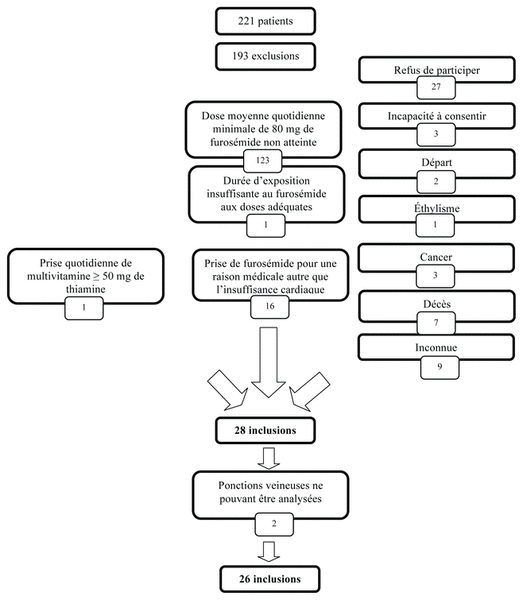
Figure 1 Schéma d’inclusion et raisons d’exclusion des patients de l’étude
Amélie Fournier1,2, B.Pharm., M.Sc., Maude Blanchet2, B.Pharm., M.Sc., Sarah Lessard2, B.Pharm., M.Sc., Paul Poirier3,4, M.D., Ph.D.
Reçu le 22 juillet 2014: Accepté après révision par les pairs le 06 novembre 2014
Résumé
Objectif : Évaluer la prévalence et les conséquences d’une carence en thiamine chez des patients insuffisants cardiaques prenant quotidiennement du furosémide.
Mise en contexte : Une grave carence en thiamine peut provoquer une symptomatologie similaire à celle de l’insuffisance cardiaque et être ainsi un facteur potentiellement aggravant de cette maladie.
Résultats : Les 26 patients inclus dans l’étude prenaient une dose moyenne quotidienne de furosémide de 144 ± 69,6 mg. Aucun patient ne présentait de carence plasmatique en thiamine (concentration plasmatique moyenne de 40,8 ± 21,7 nmol/l). La fraction d’éjection ventriculaire gauche des patients ayant un taux de thiamine plasmatique inférieur à la médiane de l’échantillon (35 nmol/l; p = 0,13) n’était pas significativement inférieure. L’alimentation de trois patients était carencée en thiamine. Les patients ayant un taux de thiamine plasmatique supérieur ou égal à 35 nmol/l tendaient à avoir une meilleure qualité de vie (p = 0,06).
Discussion : La prise quotidienne d’un diurétique de l’anse de Henlé devrait être considérée comme un facteur de risque de carence en thiamine, et ce, indépendamment de la dose reçue. Les résultats obtenus semblent indiquer que la diminution du taux de thiamine plasmatique entraîne une dégradation cliniquement significative de la qualité de vie.
Conclusion : Les données sont insuffisantes pour conclure à un lien entre la prise d’une forte dose de furosémide et une prédisposition à une carence en thiamine plasmatique.
Mots clés : Carence, fraction d’éjection du ventricule gauche, furosémide, insuffisance cardiaque, qualité de vie, thiamine
Abstract
Title : Evaluation of the prevalence of thiamine deficiency in heart failure patients receiving long-term furosemide therapy
Objective : To evaluate the prevalence and impact of thiamine deficiency in hospitalized heart failure patients taking daily furosemide.
Background : Severe thiamine deficiency can cause a symptomatology similar to that of heart failure and can therefore be an exacerbating factor of this disease.
Results : The mean daily dose of furosemide in the 26 patients was 144 ± 69.6 mg. None of the patients had thiamine deficiency (mean: 40.8 ± 21.7 nmol/L). Left ventricular ejection fraction was not significantly lower in the patients with a thiamine level < 35 nmol/L, the sample median (p = 0.13). Three patients had a diet deficient in thiamine. The quality of life of the patients with a thiamine level ≥ 35 nmol/L tended to be better (p = 0.06).
Discussion : Daily dosing with a loop diuretic should be considered a risk factor for thiamine deficiency, regardless of the dose. The results of the evaluation of quality of life in relation to the thiamine level seem to indicate a clinically significant impact.
Conclusion : The data are insufficient to conclude that there is a link between high-dose furosemide and a predisposition to thiamine deficiency.
Keywords : Deficiency, furosemide, heart failure, left ventricular ejection fraction, quality of life, thiamine
L’insuffisance cardiaque (IC) touche 1 à 2 % de la population canadienne, soit plus de 400 000 individus1,2. Malgré les avancées thérapeutiques, le taux de mortalité lié à l’IC dépasse 50 % après cinq ans, et l’incidence de la maladie ne cessera de croître au rythme du vieillissement de la population2,3. Cette maladie représente la première cause d’hospitalisation des patients de plus de 65 ans, et les coûts associés à cette maladie sont un sujet de préoccupation constant3,4. Une relation inverse existe entre la fraction d’éjection du ventricule gauche (FEVG) et le taux de mortalité5. Le but des thérapies reconnues par les lignes directrices canadiennes est donc d’améliorer la fonction cardiaque ainsi que la symptomatologie des patients. Cependant, d’autres solutions permettant une prise en charge optimale des patients atteints d’IC sont à l’étude.
Un lien entre les taux sanguins de micronutriments et la fonction cardiaque est connu depuis une soixantaine d’années6. Une grave carence en thiamine, notamment, peut provoquer une symptomatologie similaire à celle de l’IC et être ainsi un facteur potentiellement aggravant de cette maladie. En effet, une carence en thiamine peut mener à une rétention hydrosodée, une vasodilatation périphérique, une fatigue, des palpitations, une dyspnée, un œdème et une atteinte neurologique7. En outre, les patients atteints d’IC sont plus susceptibles de présenter une carence en thiamine en raison non seulement de leur médication, mais également de leur âge avancé, de leur fonction rénale souvent diminuée ainsi que de leur apport alimentaire limité tant en raison de l’anorexie engendrée par l’augmentation de la surcharge liquidienne que par les restrictions alimentaires imposées par leur état de santé6.
La prise de diurétiques, traitement symptomatique fondamental de l’IC, entraîne une augmentation de l’excrétion urinaire de la thiamine chez le rat8,9. La prévalence de la carence en thiamine est de 3 à 96 % dans des populations de patients insuffisants cardiaques10. Cette variabilité s’explique par l’utilisation de techniques de dosage différentes, la petite taille des échantillons, l’état nutritionnel variable des patients, la présence de comorbidités diverses, la diversité de la médication concomitante (y compris les doses et les types de diurétiques utilisés) ainsi que la sous-déclaration de l’usage de suppléments vitaminiques10.
En 2006, Hanninen et coll. ont publié une étude observationnelle menée auprès de 100 patients insuffisants cardiaques hospitalisés. De ces patients, 33 % présentaient une carence en thiamine, comparativement à 12 % dans le groupe témoin11. L’effet d’une supplémentation en thiamine demeure toutefois à définir, quoique quelques petites études aient démontré une amélioration de la FEVG allant jusqu’à 22 % en seulement six semaines avec un traitement de suppléance en thiamine12,13. Devant ces résultats, d’autres études sont requises.
L’objectif principal de l’étude est d’évaluer la prévalence de la carence en thiamine chez des patients adultes insuffisants cardiaques qui reçoivent une dose moyenne quotidienne de furosémide supérieure ou égale à 80 mg depuis au moins trois mois. Les objectifs secondaires visent à évaluer s’il existe un lien entre la carence en thiamine et la dose moyenne quotidienne de furosémide, la FEVG, la classe fonctionnelle NYHA (New York Heart Association), la qualité de vie (QdV) et la durée d’utilisation du diurétique. Un autre objectif secondaire consiste à déterminer l’effet de différents facteurs confondants potentiels sur le taux plasmatique en thiamine, tels que l’âge, la prise d’une multivitamine, l’association de diurétiques, la présence de diabète, le taux de magnésium sanguin, la fonction rénale ou la prise de digoxine.
L’étude présentée est une étude unicentrique, descriptive et transversale. Les échantillons plasmatiques sont recueillis prospectivement. À la fin de la période de sélection des participants, un envoi commun achemine ces échantillons à In-Common Laboratories Inc. (Toronto, Ontario, Canada) aux fins d’analyse rétrospective.
Cette étude cible les patients atteints d’IC systolique ou diastolique utilisant du furosémide à une dose moyenne minimale quotidienne de 80 mg. Les patients ont été identifiés à l’aide d’une revue de l’utilisation du furosémide au sein de l’unité de cardiologie de l’Hôpital de l’Enfant-Jésus, effectuée grâce au logiciel GESPHARX8MD (CGSI@solution-TI INC, Québec, Canada). La collaboration de l’infirmière de pratique spécialisée en cardiologie, travaillant à la clinique externe des maladies cardiaques subaigües, a également été précieuse pour identifier les patients lors des suivis quotidiens auprès des patients insuffisants cardiaques qui lui sont adressés. Enfin, la collaboration du cardiologue, du pharmacien clinicien et de l’assistante infirmière chef en cardiologie a été requise pour l’identification des candidats potentiels lors de leur admission.
Pour être inclus dans cette étude, les patients devaient être âgés d’au moins 18 ans et avoir reçu un diagnostic d’IC systolique ou diastolique. De plus, ils devaient être traités avec du furosémide à domicile à une dose moyenne quotidienne supérieure ou égale à 80 mg, pour une durée minimale de trois mois. Tous devaient fournir leur consentement libre et éclairé. Afin d’être comparable à celle des études déjà publiées sur le sujet, la taille de l’échantillon a été estimée à un minimum de 60 patients.
Les critères d’exclusion étaient ceux qui pouvaient affecter le métabolisme de la thiamine ou en limiter l’apport exogène. Ainsi, les patients étaient exclus s’ils consommaient régulièrement de l’alcool éthylique (un maximum de trois consommations par jour en moyenne sur sept jours), ou s’ils présentaient un état hypermétabolique (p. ex. : néoplasie active, infection générale grave, infection par le virus d’immunodéficience humaine)14. Les autres facteurs d’exclusion étaient une suppléance rénale, des antécédents de chirurgie bariatrique et la prise régulière d’une multivitamine contenant de la thiamine à une dose égale ou supérieure à 50 mg6.
La collecte des données s’est effectuée de façon prospective, du 29 octobre 2012 au 28 février 2013, à l’aide de trois outils regroupant toutes les variables pertinentes. L’outil principal contenait les données anthropométriques, médicales, biochimiques, diététiques et pharmacologiques du patient. Elles incluaient les facteurs confondants potentiels, soit l’âge, la prise d’une multivitamine, la prise de diurétiques concomitants, la présence de diabète, le taux de magnésium sanguin, la fonction rénale et la prise de digoxine. La collecte de ces données était à visée prospective lors du recueil des antécédents pharmacothérapeutiques. Le calcul de la dose moyenne quotidienne de furosémide reçue par le patient depuis les trois derniers mois s’est effectué à partir d’un recensement de toutes les doses reçues et de la durée d’exposition respective, selon le dossier pharmacologique de la pharmacie privée. L’intervalle normal attendu pour la concentration plasmatique en thiamine était de 7 à 44 nmol/l, soit l’intervalle suggéré par le laboratoire.
Le second outil a été réalisé avec l’aide de la nutritionniste afin de faciliter la mise en évidence d’une carence alimentaire quotidienne en thiamine. La carence alimentaire en thiamine était définie comme un apport inférieur à la quantité quotidienne minimale recommandée par le Guide alimentaire canadien, soit 1,2 mg pour les hommes et 1,1 mg pour les femmes. La nutritionniste a analysé tous les questionnaires alimentaires. Le troisième outil utilisé est le questionnaire Minnesota Living with Heart Failure (MLHFQ), qui concerne la qualité de vie. Ce questionnaire de 21 questions permet d’évaluer dans quelle mesure les symptômes cardiaques du patient nuisent à la réalisation des activités quotidiennes. Ce questionnaire a été validé pour une population atteinte d’insuffisance cardiaque15.
Le projet a reçu l’approbation du comité d’éthique de la recherche du Centre hospitalier affilié de Québec. En raison du caractère prospectif de l’étude et du prélèvement d’échantillons biologiques aux fins d’analyse, chaque patient inclus dans l’étude (ou son curateur lorsque le patient était inapte à donner son consentement) a reçu et signé librement un formulaire d’information et de consentement.
L’analyse des variables quantitatives, tant discrètes que continues, s’est effectuée à l’aide de mesures de tendance centrale (moyennes, médianes) et de mesures de dispersion (écarts-types, étendue). Les variables qualitatives ont été analysées en termes de proportions. Le test de corrélation de Pearson a permis de mesurer le lien entre la gravité de la carence en thiamine et les différentes variables mesurées. En cas d’absence de deux variables quantitatives respectant une loi normale, nous avons utilisé le test de corrélation de Spearman. Une comparaison statistique entre le groupe ayant un taux plasmatique en thiamine inférieur à la médiane et le groupe ayant un taux supérieur ou égal à la médiane devait être effectuée à l’aide d’un test du Khi carré. De plus, dans le cas d’un petit échantillon, le test de Fisher exact a été utilisé, alors que le test t de Student était utilisé dans le cas de comparaison de moyennes. Toutes les valeurs de p étaient bilatérales, et le seuil de signification a été fixé à une valeur inférieure à 5 %.
Des 221 dossiers consultés, nous en avons sélectionné 28, dont 17 (60,7 %) de patients hospitalisés. La raison principale de l’exclusion de 123 patients (63,7 %) est due au fait qu’ils n’avaient pas reçu la dose de furosémide quotidienne moyenne minimale requise de 80 mg sur une période de trois mois. De plus, 27 patients ont refusé de participer au projet de recherche. Parmi ces derniers, 18 (66,7 %) provenaient de la clinique externe des maladies cardiaques subaigües. Nous avons exclu un patient, car il prenait une multivitamine contenant 250 mg de thiamine. Nous avons exclu deux des 28 patients enrôlés en raison de l’impossibilité d’analyser leur échantillon sanguin. Par conséquent, la population étudiée est composée de 26 patients. Le schéma d’inclusion et de la répartition des patients exclus est présenté à la figure 1. Le tableau I présente les caractéristiques détaillées des patients à l’étude.
|
|
||
|
Figure 1 Schéma d’inclusion et raisons d’exclusion des patients de l’étude |
||
Tableau I Caractéristiques des patients à l’étude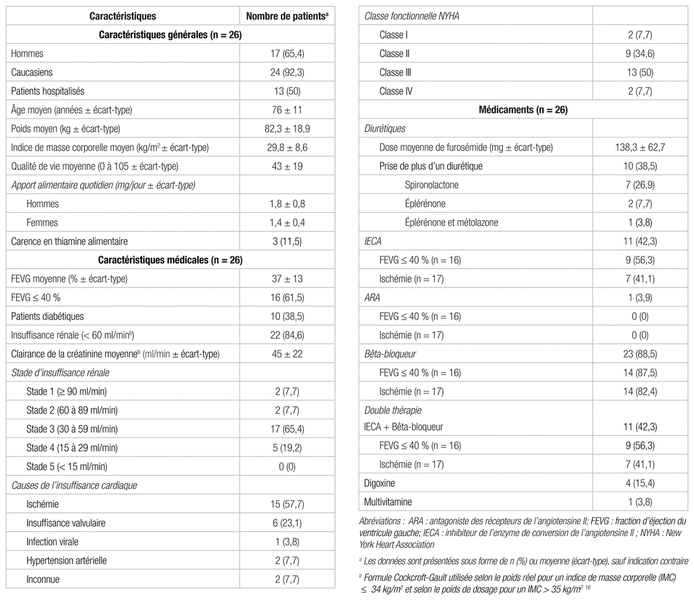
Aucun des 26 dosages de thiamine plasmatique n’est inférieur à 7 nmol/l (moyenne de 40,8 ± 21,7 nmol/l). La médiane se situe à 35 nmol/l avec une étendue de 15 à 111 nmol/l. En l’absence de patients présentant une carence en thiamine plasmatique, nous avons créé deux groupes au sein de l’échantillon, à partir de la valeur médiane. Les résultats sont présentés dans le tableau II.
Tableau II Caractéristiques des patients en fonction de leur taux plasmatique de thiamine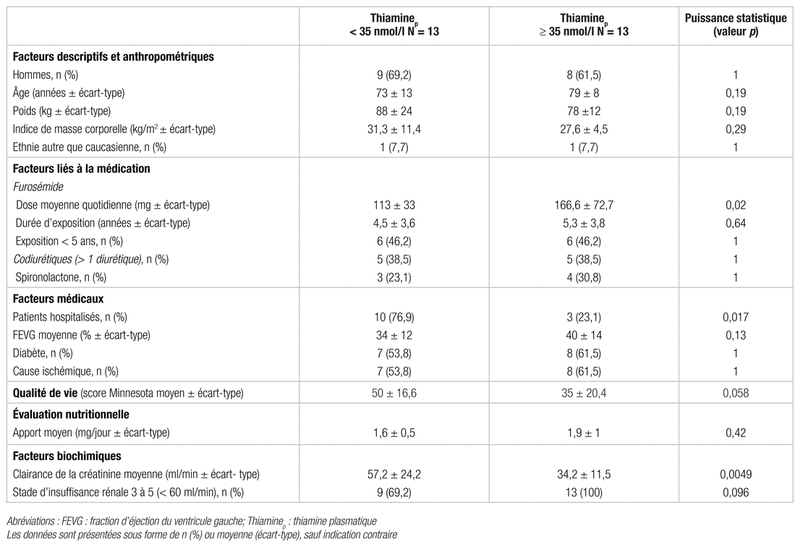
Les patients hospitalisés ont des taux plasmatiques inférieurs à ceux suivis en clinique externe à la limite de la différence statistique (32,6 ± 15,6 nmol/l contre 48,9 ± 24,4 nmol/l, p = 0,05). En outre, les autres caractéristiques anthropométriques, telles que le sexe, l’âge, le poids et l’indice de masse corporelle (IMC) n’influencent pas de façon statistiquement significative les taux de thiamine plasmatique. Comme seulement deux patients sont d’une origine autre que nord-américaine, nous n’avons pu mener aucune analyse en fonction de ce facteur. Parmi les données biochimiques, nous avons observé une différence statistiquement significative de la clairance à la créatinine. En effet, cette dernière est plus importante dans le groupe ayant un taux de thiamine plasmatique inférieur à 35 nmol/l que dans le groupe ayant un taux de thiamine plasmatique minimal de 35 nmol/l (57,2 ± 24,2 contre 34,2 ± 11,5 ml/min, p = 0,0049). Enfin, le dosage des ions collectés, notamment du magnésium et du potassium, a révélé des valeurs normales au moment de la sélection des patients, ce qui limite donc une telle analyse.
La dose de furosémide moyenne quotidienne est la seule variable liée à la prise de médication pour laquelle une différence entre les deux groupes est statistiquement significative. En effet, la dose est supérieure dans le groupe ayant un taux de thiamine plasmatique supérieur ou égal à 35 nmol/l (166,6 ± 72,7 mg contre 113,0 ± 33,0 mg, p = 0,02). La comparaison des deux groupes en ce qui concerne la durée d’exposition au furosémide ainsi que la prise de diurétiques supplémentaires, tels que la spironolactone (n = 7), l’éplérénone (n = 3), la métolazone (n = 1) ou une association d’agents (n = 10), ne montre pas de différences statistiquement significatives (respectivement p = 0,82 et p = 0,64). Les patients exposés à la médication pendant une période de plus de cinq ans n’avaient pas de taux plasmatiques de thiamine statistiquement inférieurs à ceux y étant exposés depuis moins longtemps (33,1 ± 13,1 nmol/l contre 46,4 ± 26,2 nmol/l, p = 0,12).
Parmi les facteurs médicaux pouvant influencer la prévalence d’une carence en thiamine, une IC de cause ischémique ou un diabète ne sont pas associés à une baisse du taux de thiamine plasmatique (p = 1 dans les deux cas). De plus, ni la FEVG ni la classe fonctionnelle NYHA n’influencent de manière statistiquement significative les concentrations plasmatiques de thiamine des patients (respectivement p = 0,13 et p = 0,39).
L’évaluation nutritionnelle indique que la prise alimentaire quotidienne de thiamine est adéquate chez 88,5 % des patients. Le groupe ayant un taux de thiamine plasmatique inférieur à la valeur médiane de l’échantillon, soit 35 nmol/l n’a pas un apport exogène quotidien estimé en thiamine inférieur à celui du groupe dont le taux de thiamine plasmatique est supérieur ou égal à 35 nmol/l (1,6 ± 0,5 mg contre 1,9 ± 1,0 mg, p = 0,42). Deux des trois patients présentant une carence alimentaire en thiamine font partie du premier groupe, avec des taux respectifs de thiamine plasmatique de 15 et 29 nmol/l.
En outre, nous avons évalué la qualité de vie de chacun des patients. Ceux ayant un taux de thiamine plasmatique inférieur à 35 nmol/l obtiennent un score plus élevé selon le MLHFQ que ceux dont le taux plasmatique est plus élevé, soit un résultat à la limite de la différence statistique (50 ± 16,6 contre 35 ± 20,4, p = 0,06). Rappelons que plus le score se rapproche du maximum théorique (105 points), plus la qualité de vie est mauvaise.
Cette étude fait suite à quelques petites études publiées sur le sujet, ayant démontré des prévalences de carence en thiamine très variables (entre 3 et 96 %) dans des populations atteintes d’IC. De plus, cette étude est la première à s’intéresser au lien potentiel entre une carence en thiamine et une diminution de la qualité de vie. Malgré les quelques lacunes de la méthode utilisée et les embûches rencontrées, notamment la complexité administrative entourant la gestion des dosages en dehors de la province, la petite taille de l’échantillon et les multiples intervenants ayant participé à la cueillette de données, la principale force de cette étude est son protocole prospectif nécessaire à l’évaluation de la qualité de vie. En effet, bien qu’ils ne répondent pas aux attentes initiales, les résultats présentés et discutés ci-dessus sont bien appuyés par une collecte de données exhaustive. Enfin, notre méthode est comparable à celles des diverses études consultées sur le sujet, tant par la nature des variables recueillies que par les analyses statistiques menées, ce qui permet ainsi une analyse comparative des résultats.
Premièrement, aucun patient ne s’est avéré carencé en thiamine, selon le seuil prédéterminé de 7 nmol/l. Ce résultat va à l’encontre de l’hypothèse initiale consistant à observer une prévalence de carence en thiamine d’environ 33 % au sein de l’échantillon. Cette divergence s’explique principalement par la non atteinte d’une puissance statistique suffisante. De plus, en l’absence de patients présentant une carence en thiamine plasmatique, une analyse de stratification des taux de thiamine plasmatique a permis de classifier les patients. Nous n’avons pas recensé une telle procédure dans les textes consultés. Ainsi, l’interprétation des dosages en thiamine plasmatique est limitée au seuil fixé par le laboratoire ontarien ayant effectué les dosages. Par contre, bien que la moyenne des taux de thiamine plasmatiques se situe à 40,8 nmol/l, ces taux varient de 15 à 111 nmol/l, ce qui laisse présager l’existence de certains facteurs qui peuvent expliquer un tel écart entre les patients.
Les caractéristiques des patients sélectionnés reflètent bien la population insuffisante cardiaque17–20. En effet, l’IC est une maladie qui prévaut dans une population âgée, majoritairement masculine et ayant de multiples comorbidités4. De plus, les caractéristiques de l’échantillon se comparent bien à celles de l’étude menée par Hanninen et coll., à l’exception de l’âge moyen de la population, plus élevé dans notre échantillon (76 ans) que dans celui de l’étude de Hanninen et coll. et d’autres études portant sur l’IC11,19,21,22. Cependant, cette valeur reflète bien le type de patients hospitalisés à l’unité de cardiologie ou suivis en clinique externe des maladies cardiaques subaigües de l’Hôpital de l’Enfant-Jésus, soit des patients davantage gériatriques et ayant une IC de stade plus avancé11,21,22. Différentes références traitant de la thiamine et des facteurs de risque d’une carence de cette vitamine mentionnent que l’âge peut augmenter la prévalence d’une carence chez les patients hospitalisés ou résidant dans les centres de soins de longue durée10,23. Cependant, l’étude actuelle n’a pu établir de corrélation similaire de façon significative. Elle montre même des patients légèrement plus âgés dans le groupe, ayant un taux de thiamine plasmatique supérieur ou égal à la médiane (p = 0,19).
Le seul élément distinguant notre échantillon de celui des études menées dans le domaine de l’IC est la présence d’un IMC moyen plus élevé, soit 29,8 kg/m218,19. Une étude menée sur les facteurs de risque de dénutrition parmi les patients IC hospitalisés a obtenu, sur un échantillon de 666 patients, un IMC moyen de 27,7 kg/m224. Il est possible que dans notre échantillon, le poids des patients hospitalisés en phase aigüe de décompensation de leur IC ait été surévalué, en raison d’une surcharge liquidienne ou d’un oedème important. De plus, puisque la majorité de nos patients (88,5 %) n’ont pas présenté de carence alimentaire, il est possible que leur alimentation puisse compenser les pertes urinaires substantielles en thiamine engendrées par la prise de diurétiques par des patients ayant conservé l’appétit.
Un seul des patients inclus dans l’étude prenait quotidiennement une multivitamine contenant 1,2 mg de thiamine. Bien qu’il ait été exposé à une moyenne quotidienne de 160 mg de furosémide, en plus de 75 mg de spironolactone, sa concentration en thiamine plasmatique était de 111 nmol/l, soit la valeur maximale observée dans notre échantillon. De plus, ce patient avait conservé l’appétit, et son apport alimentaire quotidien dépassait la valeur minimale requise par jour. Ces observations laissent entendre que la prise quotidienne d’une très petite quantité de thiamine, tant alimentaire que par la prise d’une multivitamine, peut prévenir efficacement une carence tant alimentaire que secondaire à la prise d’un diurétique.
Enfin, 56,3 % et 87,5 % des 16 patients sélectionnés ayant une FEVG inférieure ou égale à 40 % prenaient respectivement un inhibiteur de l’enzyme de conversion de l’angiotensine II (IECA) et un bêtabloqueur à domicile. Lorsque nous comparons nos résultats avec ceux des dernières études menées dans le domaine de l’IC, nous observons que les taux de prise de ces médicaments à domicile ne sont pas optimaux. À noter que pour cette étude, nous n’avons compilé aucune information sur la tolérance ou les diverses contre-indications aux médicaments.
Plusieurs tests sont disponibles sur le marché afin de mesurer les concentrations en thiamine, soit sérique, érythrocytaire, plasmatique, urinaire ou par évaluation de l’activité de la transkétolase érythrocytaire. Ce dernier test a été majoritairement utilisé dans les études similaires à la nôtre, afin de mieux caractériser la carence par un pourcentage de la fonction érythrocytaire suivant un apport exogène en thiamine. Cependant, ce test demeure non spécifique et peut être influencé par l’apport oral de thiamine. Le test permettant le mieux d’évaluer une carence en thiamine est l’analyse de la concentration sérique ou érythrocytaire en thiamine, qui reflète davantage les réserves corporelles totales (80 %) et est peu influencée par les apports oraux2,10. Le dosage de la thiamine plasmatique est un test d’analyse discutable pour stratifier, voire même diagnostiquer une carence en thiamine. En effet, la thiamine plasmatique représente 20 % de la concentration sanguine de la vitamine, et son taux est fortement affecté par l’apport alimentaire récent, tout comme la thiamine urinaire. Cependant, comme aucun test de mesure du taux de thiamine n’est disponible au Québec et que nous voulions avoir recours à un test abordable et accessible, nous avons choisi, pour cette étude, de mesurer les concentrations en thiamine plasmatique.
L’exposition à une dose moyenne quotidienne de 138 mg de furosémide est légèrement inférieure aux moyennes et écarts observés dans différentes études21,22. Nous avons déterminé le seuil initial de 80 mg de furosémide en tenant compte des résultats des études de Zenuk et coll. et de Brady et coll., qui ont observé respectivement une carence en thiamine chez 96 % et 21 % des patients recevant une dose quotidienne de furosémide supérieure ou égale à 80 mg. Plus précisément, Zenuk et coll. ont mené leur étude auprès de 32 patients, en comparant un groupe prenant plus de 80 mg de furosémide par jour à un groupe en prenant 40 mg par jour, et ont démontré que les patients prenant une plus forte dose de furosémide étaient plus susceptibles de développer une grave carence en thiamine (96 % contre 57 %; RC:18,0; IC 95 % :1,1 à 601,3). Hanninen et coll. ont inclus des patients prenant divers diurétiques, dont 80 % prenaient du furosémide à domicile (dose médiane de 60 mg par jour). Par conséquent, l’exclusion des patients prenant une dose inférieure à 80 mg de furosémide nous semblait essentielle pour l’obtention de résultats significatifs. Par contre, 63 % des exclusions de notre étude s’expliquent par la non atteinte du seuil minimal de furosémide requis, ce qui en fait une limite majeure de l’étude.
Cependant, la technique de dosage de thiamine effectuée dans les études de Zenuk et coll. et Hanninen et coll., soit l’analyse de l’activité de la transkétolase érythrocytaire, permettait une meilleure évaluation de la carence en thiamine que le dosage plasmatique utilisé dans notre étude, ce qui pourrait expliquer la prévalence plus importante de carences en thiamine observée dans ces études. De plus, les résultats de la présente étude contredisent les résultats précédemment cités, puisque la dose moyenne quotidienne de furosémide est supérieure dans le groupe ayant un taux de thiamine plasmatique élevé (p = 0,02). Le simple fait de prendre quotidiennement un diurétique de l’anse de Henlé, tel que le furosémide, serait alors à considérer comme facteur de risque de carence en thiamine, indépendamment de la dose reçue (figure 2). Bien qu’il soit contre-intuitif de conclure à une association allant en ce sens, un tel résultat appuie la conclusion émise par Hanninen et coll., soit qu’il n’y a pas de relation entre une forte dose de furosémide et une plus grande carence en thiamine. De plus, contrairement aux résultats présentés par Hanninen et coll., voulant que la prise de spironolactone soit associée à une maladie plus avancée, ce qui prédit une carence en thiamine, l’usage de codiurétiques (réparti de façon égale dans les deux groupes), n’est pas un élément prédictif d’une carence en thiamine plasmatique9.
|
|
||
|
Figure 2 Répartition des sujets selon leur classe fonctionnelle NYHA, la dose de furosémide quotidienne moyenne prise à domicile et leur concentration plasmatique en thiamine |
||
Par ailleurs, nous n’avons démontré aucune relation entre la durée d’exposition au furosémide et le taux plasmatique de thiamine. Dans l’étude menée par Hanninen et coll., l’exposition moyenne au furosémide était de 14 mois, soit une exposition de loin inférieure à celle observée dans la présente étude (58,8 mois). Cependant, les chercheurs ontariens n’ont pas analysé les conséquences de la durée d’exposition sur les taux sériques de thiamine. Zenuk et ses collaborateurs, pour leur part, n’ont observé aucune corrélation entre la durée d’exposition et une carence en thiamine chez les patients exposés depuis plus de trois mois au furosémide, quelle que soit la dose quotidienne reçue21. Les résultats de notre étude, bien qu’ils soient limités par un accès restreint à l’information et un très petit échantillon, correspondent donc à ceux obtenus par Zenuk et coll.
À l’instar des trois études citées précédemment, nous observons une tendance se dessiner entre une baisse du taux de thiamine plasmatique et une diminution de la FEVG. En effet, bien que la valeur p ne soit pas statistiquement significative, les chiffres absolus démontrent une différence en faveur de l’hypothèse initiale, à savoir que le groupe montrant une baisse du taux de thiamine plasmatique a une plus faible FEVG que le groupe ayant un taux de thiamine plasmatique supérieur à la médiane (33,8 ± 12,2 % contre 40,3 ± 13,8 %, p = 0,13). Par ailleurs, le fait d’avoir une IC de cause ischémique qui soit indépendante de la FEVG ne semble pas être un élément prédicteur d’une carence en thiamine (p = 1), un point qui n’a pas été soulevé par les autres études menées sur le sujet. En outre, les patients ayant une classe fonctionnelle NYHA supérieure ou égale à III sont exposés à des doses de furosémide plus élevées que ceux des classes NYHA inférieures et ont dans une plus grande proportion un taux de thiamine plasmatique inférieur à 35 nmol/l. Ceci appuie l’hypothèse initiale que les patients qui prennent de fortes doses quotidiennes de furosémide et qui présentent une baisse du taux de thiamine plasmatique voient leur capacité davantage diminuée à l’effort.
Par ailleurs, la qualité de vie est plus faible dans le groupe ayant une concentration en thiamine plasmatique inférieure à 35 nmol/l (50 points contre 35 points au MLHFQ, p = 0,057), bien que la différence ne soit pas statistiquement significative15. En 2003, dans le cadre d’une étude comparant différents questionnaires sur la qualité de vie, Bennett et coll. ont statué que la différence minimale cliniquement significative relative au MLHFQ est de 5 points25. Ainsi, bien que ce résultat puisse être attribué à la chance, la différence de 15 points observée dans la présente étude peut être qualifiée de cliniquement significative, à défaut de pouvoir démontrer une différence statistique entre les deux groupes. Cependant, il est impossible de déterminer si la carence en thiamine a des conséquences directes sur la qualité de vie ou si l’association observée est due aux multiples facteurs confondants, dont principalement la présence de comorbidités, telles les maladies respiratoires et l’insuffisance vasculaire, qui n’ont pas été recensées dans la présente étude. Conséquemment, aucun un lien de cause à effet ne peut être mis en évidence dans l’étude actuelle. Il s’agit, par contre, de la première description d’un lien cliniquement significatif faite et quantifiée par une étude, bien que le lien entre la qualité de vie et une baisse du taux de thiamine plasmatique soit non statistiquement significatif.
De tous les facteurs confondants potentiels, seuls deux sont confirmés par les résultats de cette étude. Premièrement, les patients hospitalisés semblent être plus susceptibles de présenter une carence en thiamine, ce qui a déjà été démontré par le passé dans d’autres études2,10,26,27. En effet, en contexte de soins aigus, le corps est en état d’hypermétabolisme. Il est soumis à un stress, à une diminution de l’appétit et à une restriction des apports alimentaires. De plus, l’usage de furosémide intraveineux, souvent à dose élevée, permet d’accroître l’efficacité du diurétique pris par voie orale, dont l’absorption intestinale est limitée par l’ascite et l’oedème. Il en résulte donc une perte majorée de thiamine par voie urinaire. Deuxièmement, on observe une nette différence de la fonction rénale entre les deux groupes de concentration en thiamine plasmatique. En effet, la baisse de la fonction rénale est un facteur protecteur contre l’hypovitaminose; cela s’explique par une diminution de l’excrétion urinaire de la thiamine. Ceci avait été souligné dans l’étude d’Hanninen et coll. ainsi que dans divers textes traitant de la thiamine2,10,11. Ce résultat est d’autant plus intéressant que la différence a pu être détectée au sein d’un petit échantillon de 26 patients. Tous les autres facteurs confondants potentiels (le diabète, l’âge, l’IMC, un déficit ionique) n’ont pu être associés à une diminution du taux plasmatique de thiamine. La prise de digoxine, pour sa part, bien qu’elle soit sous-représentée dans l’échantillon actuel, s’est avérée être associée à une baisse du taux de thiamine plasmatique pour deux patients. L’un des deux dosages de digoxine était à un niveau suprathérapeutique (3,6 nmol/l) et associé à un taux de thiamine plasmatique de 18 nmol/l, ce qui appuie l’hypothèse émise par Zangen et coll. que la prise de ce médicament, en association avec un diurétique de l’anse de Henlé, peut influencer à la baisse les réserves en thiamine corporelle28. Enfin, l’apport alimentaire en thiamine était proche de l’apport quotidien minimal pour trois patients, ce qui n’a pas permis d’analyses statistiques compte tenu de la petite taille de ce sous-groupe.
La principale limite de ce projet de recherche vient de la petite taille de l’échantillon. L’objectif initial étant l’inclusion d’un minimum de 60 patients, la puissance obtenue avec 26 patients est insuffisante pour détecter une prévalence de 33 % de patients présentant une carence en thiamine. Une dose seuil inférieure à 80 mg de furosémide par jour aurait permis d’inclure un plus grand nombre de patients, sans pour autant détecter davantage de patients carencés, vu leur faible exposition aux diurétiques. La seconde limite de l’étude est le test utilisé pour le dosage de la thiamine, qui a entraîné une perte de précision dans l’analyse et l’interprétation du taux plasmatique. Ce dernier ne représente que 20 % de la réserve corporelle en thiamine et il est fortement influencé par les apports oraux récents. L’analyse de l’apport alimentaire et de l’appétit ainsi que des autres apports oraux (multivitamine) a été prise en considération, ce qui a diminué l’effet de ces facteurs sur l’analyse globale. Cependant, nous n’avons pas analysé le temps écoulé entre le dernier apport alimentaire et la prise de sang.
La durée de conservation de l’information dans les pharmacies du secteur privé est un biais d’information présent dans cette étude. Selon les logiciels utilisés, la majorité de ces pharmacies conservent les données pendant cinq ans. Ainsi, on a probablement sous-estimé le nombre de patients ayant reçu du furosémide depuis plus de cinq ans.
Enfin, un biais de confusion engendré par la présence de multiples comorbidités chez des patients âgés aux prises avec des symptômes pulmonaires ou des limitations physiques n’étant pas en relation avec l’IC a pu affecter l’évaluation de la qualité de vie et la classe fonctionnelle. Cependant, l’utilisation de questionnaires standardisés et validés pour cette population a diminué les conséquences de ce biais sur les résultats présentés15.
Les données sont insuffisantes pour conclure à un lien entre une forte dose de furosémide et une prédisposition à une carence en thiamine plasmatique. Cependant, cette étude invite à étudier sur un plus grand nombre de patients le lien entre la qualité de vie et une baisse du taux de thiamine plasmatique. C’est la première fois que l’on souligne un lien possible entre ces deux variables. De plus, cette étude appuie les données antérieurement observées, liant le taux de thiamine plasmatique à la FEVG et à la classe fonctionnelle. Cependant, avant de pousser davantage les recherches sur les micronutriments dans l’objectif de favoriser la prise en charge globale des patients insuffisants cardiaques, il serait important d’évaluer l’offre de services et le suivi effectué auprès de patients hospitalisés à l’Hôpital de l’Enfant-Jésus en cardiologie et suivis à la clinique externe d’IC subaigüe afin que les thérapies ayant fait leurs preuves quant à l’amélioration de la survie en IC soient utilisées de façon optimale.
Les auteurs ont reçu un financement de Sandoz Canada, de Servier Canada et de Boehringer Ingelheim pour effectuer cette étude.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflit d’intérêts potentiel. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
1. Chow CM, Donovan L, Manuel D, Johansen H, Tu JV. Regional variation in self-reported heart disease prevalence in Canada. Can J Cardiol 2005;21:1265–71.
2. Wooley JA. Characteristics of thiamin and its relevance to the management of heart failure. Nutr Clin Pract 2008;23:487–93.

3. Johansen H, Strauss B, Arnold JM, Moe G, Liu P. On the rise: the current and projected future burden of congestive heart failure hospitalization in Canada. Can J Cardiol 2003;19:430–5.
4. Lepage S. Acute decompensated heart failure. Can J Cardiol 2008;24(suppl. B):6B–8B.


5. Solomon SD, Anavekar N, Skali H, McMurray JJ, Swedberg K, Yusuf S et coll. Influence of ejection fraction on cardiovascular outcomes in a broad spectrum of heart failure patients. Circulation 2005;112:3738–44.

6. Sriram K, Manzanares W, Joseph K. Thiamine in nutrition therapy. Nutr Clin Pract 2012;27:41–50.

7. Lonsdale D. Thiamin(e): the spark of life. Subcell Biochem 2012;56:199–227.
8. Yui Y, Itokawa Y, Kawai C. Furosemide-induced thiamine deficiency. Cardiovasc Res 1980;14:537–40.

9. Lubetsky A, Winaver J, Seligmann H, Olchovsky D, Almog S, Halkin H et coll. Urinary thiamine excretion in the rat: effects of furosemide, other diuretics, and volume load. J Lab Clin Med 1999;134:232–7.

10. Sica DA. Loop diuretic therapy, thiamine balance, and heart failure. Congest Heart Fail 2007;13:244–7.

11. Hanninen SA, Darling PB, Sole MJ, Barr A, Keith ME. The prevalence of thiamin deficiency in hospitalized patients with congestive heart failure. J Am Coll Cardiol 2006;47:354–61.

12. Shimon I, Almog S, Vered Z, Seligmann H, Shefi M, Peleg E et coll. Improved left ventricular function after thiamine supplementation in patients with congestive heart failure receiving long-term furosemide therapy. Am J Med 1995;98:485–90.

13. Schoenenberger AW, Schoenenberger-Berzins R, der Maur CA, Suter PM, Vergopoulos A, Erne P. Thiamine supplementation in symptomatic chronic heart failure: a randomized, doubleblind, placebo-controlled, cross-over pilot study. Clin Res Cardiol 2012;101:159–64.
14. Rabi DM, Daskalopoulou SS, Padwal RS, Khan NA, Grover SA, Hackam DG et coll. The 2011 Canadian Hypertension Education Program recommendations for the management of hypertension: blood pressure measurement, diagnosis, assessment of risk, and therapy. Can J Cardiol 2011;27:415–33.

15. Rector TS, Cohn JN. Assessment of patient outcome with the Minnesota Living with Heart Failure questionnaire: reliability and validity during a randomized, double-blind, placebo-controlled trial of pimobendan. Pimobendan Multicenter Research Group. Am Heart J 1992;124:1017–25.

16. Lessard S, Blanchet M, Morin N, Lefebvre J. Votre expérience avec l’estimation de la fonction rénale selon différentes formules mathématiques. Pharmactuel 2012;45:43–51.
17. Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE Jr, Drazner MH et coll. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines. Circulation 2013:128:e240–327.

18. Damy T, Ghio S, Rigby AS, Hittinger L, Jacobs S, Leyva F et coll. Interplay between right ventricular function and cardiac resynchronization therapy: an analysis of the CARE-HF trial (Cardiac Resynchronization-Heart Failure). J Am Coll Cardiol 2013;61:2153–60.

19. Swedberg K, Zannad F, McMurray JJ, Krum H, van Veldhuisen DJ, Shi H et coll. Eplerenone and atrial fibrillation in mild systolic heart failure: results from the EMPHASIS-HF (Eplerenone in Mild Patients Hospitalization And SurvIval Study in Heart Failure) study. J Am Coll Cardiol 2012;59:1598–603.

20. Cohn JN, Archibald DG, Ziesche S, Franciosa JA, Harston WE, Tristani FE et coll. Effect of vasodilator therapy on mortality in chronic congestive heart failure. Results of a Veterans Administration Cooperative Study. N Engl J Med 1986;314:1547–52.

21. Brady JA, Rock CL, Horneffer MR. Thiamin status, diuretic medications, and the management of congestive heart failure. J Am Diet Assoc 1995;95:541–4.

22. Zenuk C, Healey J, Donnelly J, Vaillancourt R, Almalki Y, Smith S. Thiamine deficiency in congestive heart failure patients receiving long term furosemide therapy. Can J Clin Pharmacol 2003;10:184–8.
23. Wilkinson TJ, Hanger HC, George PM, Sainsbury R. Is thiamine deficiency in elderly people related to age or co-morbidity? Age Ageing 2000;29:111–6.

24. Aziz EF, Javed F, Pratap B, Musat D, Nader A, Pulimi S et coll. Malnutrition as assessed by nutritional risk index is associated with worse outcome in patients admitted with acute decompensated heart failure: an ACAP-HF data analysis. Heart Int 2011;6:e2.


25. Bennett SJ, Oldridge NB, Eckert GJ, Embree JL, Browning S, Hou N et coll. Comparison of quality of life measures in heart failure. Nurs Res 2003;52:207–16.

26. Blanc P, Boussuges A. Une supplémentation en thiamine est-elle nécessaire chez les insuffisants cardiaques? Ann Cardiol Angeiol 2001;50:160–8.
27. Silva LD. Micronutrient support in heart failure: the role of thiamin, magnesium, and vitamin D. Topics Clin Nutr 2010;25:302–12.
28. Zangen A, Botzer D, Zangen R, Shainberg A. Furosemide and digoxin inhibit thiamine uptake in cardiac cells. Eur J Pharmacol 1998;361:151–5.

PHARMACTUEL, Vol. 48, No. 1, 2015