Claudine Cardin-Tremblay1,2, B.Pharm., Anne-Claude Dufour1,2, B.Pharm., M.Sc., Sabine Matar1,2,3, B.Pharm., M.Sc., Noémie-Charbonneau-Séguin2,4, B.Pharm., M.Sc., BCOP, Philippe Bouchard2,4,, B.Pharm., M.Sc., BCOP
Reçu le 18 septembre 2014; Accepté après révision par les pairs le 30 décembre 2014
Résumé
Objectif : Décrire le cas d’une jeune patiente présentant le syndrome de l’homme rouge accompagné de symptômes neurologiques lors de perfusions intraveineuses répétées de vancomycine.
Résumé du cas : Il s’agit d’une patiente de 32 ans prenant de la vancomycine intraveineuse pour traiter une neutropénie fébrile persistante après une greffe de cellules hématopoïétiques. La patiente présentait des rougeurs, un prurit, des tremblements et des paresthésies au cours des perfusions d’antibiotique. Les symptômes persistaient malgré la diminution de la vitesse de perfusion et l’administration d’une prémédication.
Discussion : Les effets indésirables de la patiente sont probablement liés à la prise de vancomycine. Certains facteurs de risque, le lien temporel entre l’administration de l’antibiotique et l’apparition des symptômes, l’exclusion des autres causes possibles et la présence de quelques cas rapportés dans la documentation scientifique appuient cette association.
Conclusion : Ce cas démontre que le syndrome de l’homme rouge peut s’accompagner de symptômes neurologiques et être réfractaire à une prise en charge rapide. La vigilance est donc de rigueur lorsque des effets secondaires rares se manifestent durant la prise de médicaments couramment utilisés.
Mots clés : Intolérance, paresthésie, perfusion, prurit, rougeurs, syndrome de l’homme rouge, tremblements, vancomycine
Abstract
Objective : To describe the case of a 32-year-old woman with red man syndrome accompanied by neurological symptoms during repeated intravenous infusions of vancomycin.
Case summary : The patient received intravenous vancomycin for the treatment of persistent febrile neutropenia following a hematopoietic cell transplant. She presented with flushing, pruritus, tremors and paresthesia during the infusions of the antibiotic. The symptoms persisted despite decreasing the infusion rate and administering premedication.
Discussion : The patient’s adverse effects were probably associated with the use of vancomycin. Certain risk factors, the temporal link between the administration of the antibiotic and the appearance of the symptoms, the exclusion of other possible causes, and the fact that a few cases have been reported in the scientific literature support this association.
Conclusion : This case shows that red man syndrome can be accompanied by neurological symptoms and be refractory to prompt management. Vigilance should therefore be exercised when rare adverse effects occur during the administration of commonly used medications.
Keywords : Flushing, infusion, intolerance, paresthesia, pruritus, red man syndrome, tremors, vancomycin
La vancomycine est un antibiotique couramment utilisé. Elle possède une action bactéricide contre un large éventail de micro-organismes aérobies et anaérobies à Gram positif1. Des réactions à la perfusion de cet antibiotique sont possibles mais sont habituellement faciles à gérer avec la diminution de la vitesse de perfusion et l’utilisation de prémédications appropriées2,3. Ces réactions ne constituent pas de véritables allergies à la vancomycine, qui sont très rares. Plusieurs cas d’intolérance typique à la vancomycine sont rapportés dans la documentation scientifique. Toutefois, à notre connaissance, seulement deux cas d’atteintes neurologiques associées à l’utilisation de vancomycine ont été publiés : l’un se manifestait par des paresthésies sans réaction cutanée, l’autre par des tremblements4,5. Nous rapportons ici une intolérance grave à la perfusion de vancomycine, avec la présence de symptômes neurologiques et d’une réaction cutanée qui ne correspondent pas au tableau clinique habituel et qui ont persisté malgré l’administration d’une prémédication et le ralentissement de la perfusion.
Une patiente caucasienne de 32 ans, pesant 68 kg et ne présentant aucune allergie médicamenteuse ni aucun antécédent médical pertinent hormis un asthme allergique, a été admise à l’unité de greffe de cellules hématopoïétiques. Quatre mois avant cette admission, la patiente se plaignait de fatigue et d’ecchymoses. Des examens hématologiques avaient permis de poser un diagnostic de leucémie aiguë lymphoblastique. Une rémission complète a été obtenue après un traitement d’induction consistant en quatre cycles de chimiothérapie de type hyperCVAD (cyclophosphamide hyperfractionnée, vincristine, doxorubicine, dexaméthasone). Les analyses cytogénétiques ont révélé l’absence du chromosome de Philadelphie, mais la présence d’un réarrangement du gène MML (mixed lineage leukemia) représentait un risque élevé de récidive de la leucémie. Une greffe de cellules hématopoïétiques a alors été recommandée avec le concours d’un donneur non apparenté, la patiente n’ayant pas de donneur compatible dans sa fratrie. Le régime de conditionnement utilisé a été l’association de cyclophosphamide à haute dose et de radiothérapie pancorporelle. À l’admission de la patiente pour la greffe, les analyses suivantes étaient normales : fonctions rénales (créatinine : 62 μmol/l), hépatiques (bilirubine totale : 5 μmol/l; alanine aminotransférase : 5 U/l; aspartate aminotransférase : 13 U/l) et hématologiques (globules blancs : 4,1 × 109/l; neutrophiles : 2,4 × 109/l; plaquettes : 236 × 109/l; hémoglobine : 122 g/l).
Cinq jours après la transplantation du greffon, la patiente a connu un épisode de fièvre à 38,2 °C accompagné de céphalées et de rhinorrhée avec des sécrétions purulentes sans être neutropénique. On a alors entamé un traitement intraveineux par pipéracilline-tazobactam (3,375 g toutes les six heures) en raison de la mise en cause d’une sinusite aiguë. Pour pouvoir commencer cette antibiothérapie à large spectre, la patiente a arrêté son traitement à la ciprofloxacine qu’elle recevait en prévention des infections bactériennes durant la période de neutropénie postérieure à la greffe. Les symptômes de sinusite se sont aggravés au cours des deux jours suivants, et une scanographie du massif facial a révélé un comblement presque total des sinus ethmoïdes. Le radiologiste a diagnostiqué une sinusite aiguë sur foyer chronique. Le lendemain, au jour huit après la greffe, la patiente présentait une récidive de fièvre de 38 °C et était neutropénique (globules blancs : 0,1 × 109/l; neutrophiles : 0 × 109/l). On a augmenté la dose de pipéracilline-tazobactam (4,5 g par voie intraveineuse toutes les six heures, conformément aux recommandations de traitement de la neutropénie fébrile). On a procédé à l’ajout empirique de vancomycine intraveineuse (1 g dans 290 ml de soluté en perfusion d’une heure, toutes les huit heures, à une dose d’environ 15 mg/kg/dose) pour élargir le spectre antimicrobien6. Au moment de commencer l’administration de vancomycine, la patiente avait un taux de créatinine de 46 μmol/l et ne présentait aucun signe de toxicité neurologique liée à la chimiothérapie reçue précédemment. Il s’agissait de la première exposition de la patiente à la vancomycine.
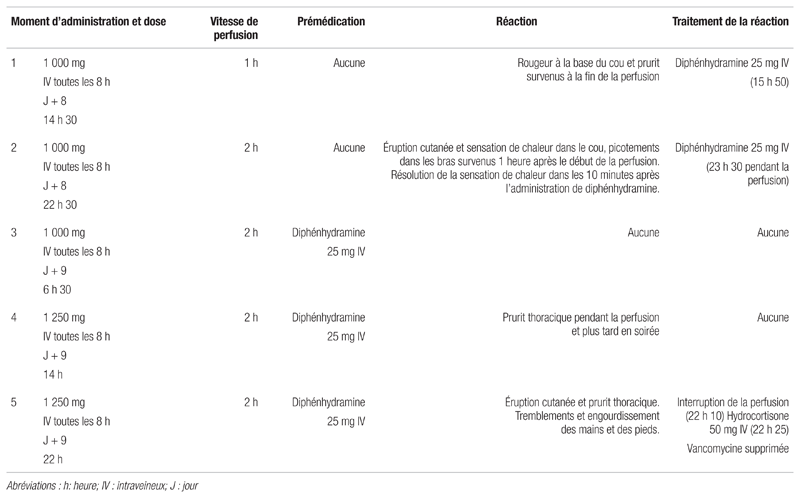
Durant la première perfusion de vancomycine, la patiente a développé des rougeurs et un prurit. Malgré le ralentissement de la vitesse de perfusion et l’administration d’une prémédication, ces phénomènes ont persisté, avec l’apparition de tremblements et d’un engourdissement des extrémités. Le tableau I décrit la dose de vancomycine et la vitesse de perfusion, la prémédication, ainsi que les réactions présentées par la patiente lors de chaque perfusion. Aucune hypotension n’a été signalée durant le traitement à la vancomycine.
Tableau I Tableau schématique des doses de vancomycine et des réactions du patient
Au jour neuf, un dosage de vancomycine effectué avant l’administration de la troisième dose a révélé une concentration sérique de 7,6 mg/l. La dose de vancomycine a été augmentée à 1,25 g dans 293 ml de soluté toutes les huit heures. On a retiré la vancomycine le lendemain, en raison d’une intolérance de la patiente, après l’administration de quatre doses complètes et d’une cinquième dose incomplète. Les symptômes de la patiente en réaction à la perfusion de vancomycine disparaissaient entre les perfusions. Au jour dix, soit 12 heures après la dernière réaction, on n’a observé aucun signe ou symptôme de réaction. Ces derniers ne sont pas réapparus durant l’hospitalisation.
On a utilisé la daptomycine en remplacement de la vancomycine jusqu’à l’obtention de cultures excluant la présence de bactéries résistantes et jusqu’à l’évolution favorable de l’état de la patiente (récupération de la fonction hématologique, absence de fièvre et résolution des symptômes de sinusite). Le tableau II présente les médicaments concomitants reçus par la patiente durant la période qui a suivi la greffe.
Tableau II Posologie des médicaments administrés durant la période postérieure à la greffe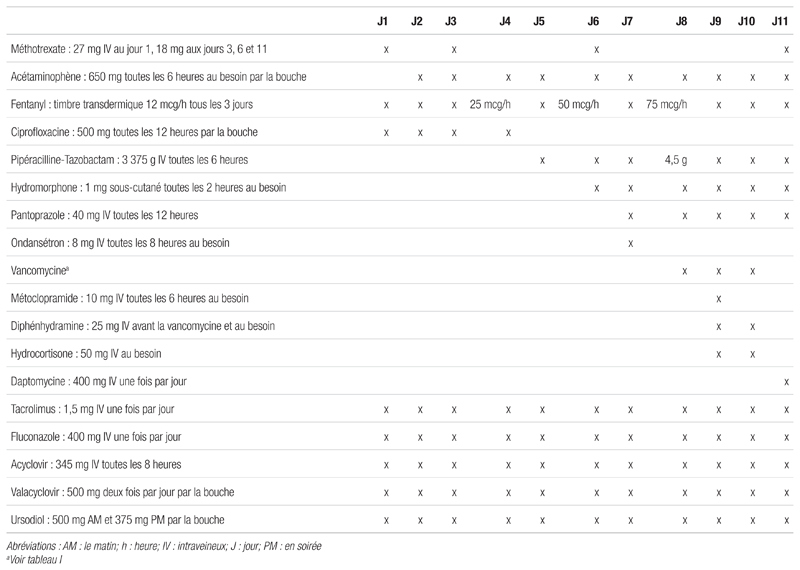
Les réactions liées à la perfusion de vancomycine sont bien décrites dans la documentation scientifique. La forme la plus fréquente est le syndrome de l’homme rouge, également appelé syndrome du cou rouge7,8. Cette pseudo-allergie a été décrite comme allant de simples éruptions érythémateuses, principalement localisées au visage, au cou, au thorax et aux membres supérieurs, jusqu’à une hypotension grave, des douleurs thoraciques et un arrêt cardiorespiratoire9–11. Le syndrome de l’homme rouge surviendrait chez 5 à 50 % des patients hospitalisés, mais sa fréquence réelle reste inconnue12,13, notamment en raison de l’absence d’une définition claire et unique de ce syndrome12. Typiquement, la réaction survient quelques minutes après le début de la perfusion, mais dans certains cas, elle s’est manifestée une fois l’administration de l’antibiotique terminée10,14.
L’apparition du syndrome de l’homme rouge était attribuée autrefois aux impuretés présentes dans la préparation5,8,13. Toutefois, le syndrome persistait malgré la purification de la préparation et l’amélioration des procédés de synthèse8,13. On sait maintenant que le syndrome de l’homme rouge résulte de l’activation des mastocytes par la vancomycine et de la libération d’histamine qui en découle5,9,11,12,15. Les niveaux sériques d’histamine ne corrèlent cependant pas toujours avec la gravité des symptômes, ce qui laisse penser que d’autres médiateurs participent à l’apparition de ce syndrome8,12. Cette manifestation ne constitue pas une véritable allergie, puisqu’aucun phénomène immunologique n’est en cause, mais il s’agit plutôt d’une réaction de type anaphylactoïde9,10,11,15.
L’utilisation concomitante d’agents pouvant activer la dégranulation des mastocytes, tels les opiacés, les agents de contraste et certains anesthésiques, augmente la probabilité d’une réaction liée à la perfusion9,14. Certains antibiotiques, comme la ciprofloxacine, l’amphotéricine B, la rifampicine et la teicoplanine ont également été associés à la libération d’histamine et peuvent ainsi précipiter l’apparition du syndrome de l’homme rouge14. La dose utilisée ainsi que la vitesse de perfusion sont des facteurs de risque bien décrits11,15. Ainsi, la fréquence d’apparition de ce syndrome est d’autant plus élevée que la durée de la perfusion est courte9–11,15. Les sujets dont l’âge est égal ou inférieur à 40 ans seraient également plus à risque13.
L’étude rétrospective multicentrique de Myers et coll. a récemment défini les facteurs de risque favorisant l’apparition du syndrome de l’homme rouge dans les populations adulte et pédiatrique12. Il importe de mentionner que les sujets étaient âgés de six mois à 21 ans, les patients plus âgés n’étant pas représentés. Les auteurs ont ainsi révélé que le fait d’être caucasien, d’être d’un âge supérieur ou égal à deux ans, d’avoir des antécédents de syndrome de l’homme rouge, d’utiliser une dose de vancomycine supérieure ou égale à 10 mg/kg, d’utiliser une préparation dont la concentration est supérieure ou égale à 5 mg/ml ou d’avoir utilisé antérieurement un antihistaminique (quelles que soient l’indication thérapeutique et la durée de traitement) étaient associés à la survenue du syndrome. Les auteurs n’ont trouvé aucune explication plausible à l’augmentation de la fréquence du syndrome de l’homme rouge après la prise d’un antihistaminique12.
Il est important de se rappeler qu’une allergie anaphylactique due aux IgE pourrait avoir un tableau clinique similaire11,13. Toutefois, contrairement au syndrome de l’homme rouge, une telle allergie nécessite une exposition préalable à l’agent causal et ne peut donc survenir au cours de la toute première perfusion9,15.
La probabilité de présenter le syndrome de l’homme rouge étant inversement proportionnelle à la durée de la perfusion, la prévention la plus efficace consiste à respecter une durée de perfusion d’au moins 60 minutes7,8,10.
L’administration prophylactique d’une prémédication pourrait permettre de limiter la manifestation de ce syndrome. Il n’existe toutefois pas de consensus sur l’agent, la dose et la voie d’administration à préconiser. On a rapporté l’utilisation d’un antihistaminique par voie orale ou intraveineuse, comme l’hydroxyzine (50 mg par voie orale) ou la diphénhydramine (1 mg/kg par voie intraveineuse ou 50 mg par voie orale)9,10. Les données concernant l’efficacité de l’ajout d’un antagoniste des récepteurs à l’histamine de type 2 (anti-H2) sont contradictoires, mais on peut tenter cette option lorsqu’une perfusion rapide est requise9,17. En effet, dans le cadre de leur étude à répartition aléatoire, Renz et coll. ont pu administrer une perfusion de 1 g de vancomycine en dix minutes à 89 % des sujets ayant reçu préalablement une association d’antihistaminiques par voie intraveineuse (diphénhydramine, 1 mg/kg, et cimétidine, 4 mg/kg)17. Il faut noter que dans cette étude, la perfusion n’était interrompue qu’en cas de diminution de la pression artérielle d’au moins 20 % ou de prurit intolérable17. D’autres auteurs mentionnent l’utilisation d’une association de diphénhydramine (25 à 50 mg par voie intraveineuse), d’hydrocortisone (100 mg par voie intraveineuse) et d’acétaminophène (650 mg par voie orale)15. La prémédication choisie devra être administrée 45 à 60 minutes avant le début de la perfusion d’antibiotique9. De façon générale, on utilisera une prophylaxie si un débit rapide est nécessaire ou si le patient a des antécédents de syndrome de l’homme rouge8,17.
Il n’existe pas de consensus clair sur le traitement optimal du syndrome de l’homme rouge. Cependant, il faut cesser la perfusion dès les premiers signes de réaction14. Les manifestations légères (rougeurs discrètes n’occasionnant pas de désagrément) passeront souvent inaperçues et se résoudront après l’arrêt de la perfusion8. Les atteintes plus graves (prurit et éruption cutanée occasionnant un malaise) nécessiteront quant à elles l’administration rapide d’un antihistaminique (diphénhydramine, 50 mg par voie orale ou intraveineuse)9,14. Une fois les symptômes résolus, on pourra reprendre la perfusion en ralentissant le débit de perfusion9,14. Healy et coll. recommandent de doubler le temps de perfusion pour les sujets ayant eu une réaction lors de l’administration de vancomycine en 60 minutes3. En présence d’instabilité hémodynamique, il faudra également envisager un apport en fluides ou tout autre traitement de soutien14. Une prophylaxie devra précéder l’administration des doses subséquentes de vancomycine9.
Il est concevable de tenter la désensibilisation des patients ayant une réaction récurrente malgré l’utilisation d’une prémédication et le ralentissement du débit de perfusion, et pour lesquels un traitement par un autre antibiotique est impossible9,13.
Il existe dans la documentation scientifique deux cas d’atteintes neurologiques rapportés avec l’utilisation de vancomycine4,5.
D’une part, des paresthésies ont été décrites en 1988 chez une femme de 36 ans hémodialysée et traitée pour une infection du cathéter à Staphylococcus epidermidis4. La dose initiale de vancomycine était de 1 g dans 250 ml d’une solution de dextrose à 5 %, perfusée durant la dernière heure de dialyse de façon hebdomadaire (vitesse de perfusion : 16,7 mg/minute). La première dose a été bien tolérée. Toutefois, les deuxième, troisième et quatrième doses ont entraîné des engourdissements, des picotements ainsi qu’une douleur lombaire cinq à dix minutes après le début de la perfusion. Le traitement était identique durant ces trois événements : l’arrêt immédiat de l’antibiotique a conduit à la disparition des symptômes; ensuite la perfusion a pu reprendre et elle a été tolérée après la diminution de la vitesse de perfusion à 5,6 mg/minute ainsi que le ralentissement du débit sanguin qui est passé de 200 ml/minute à 75–100 ml/minute4.
D’autre part, on a rapporté des tremblements intenses chez une femme de 69 ans traitée pour une endocardite sur une valve prosthétique et souffrant initialement de tremblements essentiels. Le traitement empirique consistait en une association de vancomycine (1 g par voie intraveineuse toutes les huit heures), de gentamicine (60 mg par voie intraveineuse toutes les huit heures) et de rifampicine (300 mg par voie orale toutes les 12 heures). On a remplacé la gentamicine par de la ceftriaxone après sept jours en raison d’une détérioration de la fonction rénale. Deux semaines après le début du traitement, au cours de la perfusion de vancomycine, la patiente a manifesté des tremblements de grande amplitude atteignant les quatre membres au repos. L’arrêt immédiat de la perfusion a entraîné la disparition des symptômes en 30 minutes. L’essai subséquent de deux doses supplémentaires s’est soldé par la réapparition des tremblements. Les creux sériques sont demeurés en tout temps dans l’intervalle thérapeutique. L’administration de diphénhydramine et de lorazépam n’a pas permis de prévenir cette réaction ou d’en contrôler les symptômes. Il a fallu éliminer définitivement la vancomycine et la remplacer par la daptomycine5.
Bien qu’à notre connaissance seuls ces deux cas aient fait l’objet d’une publication, une recherche dans la base de données en ligne des effets indésirables collectés par Santé Canada met en évidence 36 cas de paresthésies et quatre cas de tremblements signalés avec l’utilisation de vancomycine au Canada sur la période du 1er janvier 1965 au 31 décembre 201318.
Le score d’imputabilité de sept obtenu selon l’algorithme de Naranjo indique une relation « probable » entre l’administration de vancomycine et les effets ressentis par la patiente16. L’association ne peut être qualifiée de « certaine », puisque les concentrations plasmatiques de vancomycine n’étaient pas toxiques (7,6 mg/l). Cependant, cet élément de l’algorithme de Naranjo ne s’applique pas aux réactions de type anaphylactoïde, telles que celle présentée dans cet article. Le syndrome de l’homme rouge n’est pas associé à une concentration toxique de vancomycine, mais dépend plutôt de la dose administrée et de la vitesse de perfusion. De plus, les effets indésirables n’ont pas été confirmés par des données objectives. En effet, les manifestations du syndrome de l’homme rouge ainsi que les tremblements ont été décrits par l’équipe médicale, mais les paresthésies n’ont pas été objectivées. Il semble pourtant que la patiente ait développé le syndrome de l’homme rouge. Les rougeurs au cou et le prurit sont survenus dans les 60 à 90 minutes après le début des perfusions, lors de l’administration de quatre des cinq doses, ce qui renforce la suspicion d’une réaction à la perfusion de vancomycine3. De plus, la patiente présentait plusieurs facteurs de risque associés à ce syndrome : elle recevait des opiacés de façon concomitante, à savoir du fentanyl, dont la dose a triplé entre les jours 4 et 8, et de l’hydromorphone sous-cutanée au besoin; elle était d’origine caucasienne et âgée de moins de 40 ans; elle recevait une dose de vancomycine supérieure à 10 mg/kg, ce qui a pu contribuer à précipiter la réaction14.
Dans les cas du syndrome de l’homme rouge modéré, une diminution de la vitesse de perfusion et l’administration d’une prémédication sont généralement suffisantes pour faire disparaître les symptômes3,14. Dans le cas présent, la durée de perfusion initiale était celle préconisée (tableau III). En raison de l’apparition d’une réaction, on a doublé la durée de perfusion d’une à deux heures3. Cependant, la prolongation de la perfusion ainsi que l’utilisation d’une prémédication (diphénhydramine) n’ont pas diminué l’intensité de la réaction, sauf lors de l’administration de la troisième dose de vancomycine, qui n’a engendré aucune réaction.
Tableau III Durée d’administration recommandée en fonction de la dose de vancomycine intraveineuse7
En ce qui concerne les autres effets signalés après la perfusion, à savoir les paresthésies et les tremblements, nous n’avons déterminé aucune cause ayant une corrélation temporelle, outre l’administration de vancomycine. En effet, la patiente n’a reçu aucun nouveau médicament en concomitance durant cette période, exception faite des agents utilisés pour le traitement de la réaction à la perfusion, soit la diphénhydramine et l’hydrocortisone. Le reste du traitement médicamenteux a démarré durant la chimiothérapie ou pendant la greffe, soit au moins sept jours avant le début des paresthésies et des tremblements. Seule l’association de pipéracilline-tazobactam a été administrée pour la première fois deux jours avant la prise de vancomycine, mais son administration s’est poursuivie durant et après la réaction. Par la suite, la patiente a d’ailleurs continué à prendre la totalité de la médication, sans réapparition d’effets indésirables.
D’autres agents, comme le tacrolimus, la ciprofloxacine et le métoclopramide, auraient potentiellement pu causer ces symptômes neurologiques. D’abord, la prise de tacrolimus entraîne des tremblements posturaux et d’intention chez environ 40 % des personnes traitées19. Ces tremblements sont légers à modérés, surviennent de façon aiguë et corrèlent souvent avec une concentration sérique élevée du médicament20. Cependant, la patiente a continué sans problème son traitement au tacrolimus pendant et même après l’apparition des symptômes neurologiques. De plus, un dosage sérique de tacrolimus effectué au commencement du traitement à la vancomycine a révélé un taux de 11,1 mcg/l, ce qui exclut une toxicité au tacrolimus, puisque les concentrations visées après une greffe de moelle osseuse sont de 5 à 15 mcg/l21.
Ensuite, la ciprofloxacine a été associée à deux cas de dysesthésies douloureuses et à un cas de neuropathie périphérique22. Le premier cas de dysesthésie était lié à une administration intraveineuse de l’antibiotique, puisque les douleurs ont disparu avec l’administration du médicament par voie orale. Le deuxième cas décrit une femme de 30 ans, sans antécédents médicaux, qui a présenté des symptômes pseudo-grippaux avec la prise orale de ciprofloxacine. Deux mois plus tard, lors du deuxième contact de la patiente avec cet agent (500 mg deux fois par jour par voie orale), des dysesthésies persistantes ont débuté 90 minutes après la première dose et ont disparu neuf heures après l’arrêt de la prise de l’antibiotique. En ce qui concerne le cas clinique qui nous concerne, il est peu probable que cet antibiotique soit responsable des effets secondaires en question, puisque la patiente avait cessé de le prendre trois jours avant le début de la réaction. La patiente suivait également un traitement chronique à la ciprofloxacine (500 mg deux fois par jour) depuis plus d’un mois avant la greffe, sans avoir manifesté de complications.
Enfin, le métoclopramide, un inhibiteur des récepteurs dopaminergiques à action centrale, est connu pour provoquer des tremblements de repos. Il est l’une des causes les plus fréquentes de parkinsonisme provoqué par les médicaments. Cet effet indésirable survient surtout chez les personnes âgées et celles atteintes d’insuffisance rénale, en raison de leur plus grande sensibilité aux effets centraux20. Dans le cas clinique présent, on a administré une seule dose de métoclopramide le lendemain de l’apparition des symptômes de réaction à la perfusion. Une corrélation est donc peu plausible. La patiente avait cependant reçu à plusieurs reprises de l’ondansétron et du métoclopramide durant les hospitalisations pour sa chimiothérapie sans manifester de réaction. Les autres médicaments reçus par la patiente ne semblent pas être à l’origine de la réaction, puisque leur administration s’est poursuivie pendant l’hospitalisation et que la réaction n’est jamais réapparue après l’arrêt de la vancomycine.
Nous excluons le fait que l’état pathologique de la patiente puisse être responsable des symptômes, puisque ces derniers ont disparu sans rechute ni persistance de la leucémie. La patiente ayant subi une greffe de moelle osseuse, il aurait été possible de soupçonner une réaction du greffon contre l’hôte (GCH). La GCH est la principale complication de la greffe allogénique de cellules souches. Elle se définit comme une réaction immunitaire des lymphocytes T du donneur contre les organes du receveur. Une GCH cutanée aiguë peut provoquer des rougeurs et un prurit, mais non des tremblements et de l’engourdissement23. De plus, la résolution de la neutropénie est une condition essentielle à l’apparition d’une GCH23. Dans le cas présent, la réaction est apparue alors que la patiente était neutropénique, et elle a disparu le lendemain de l’arrêt de la vancomycine, soit plusieurs jours avant que la patiente ne sorte de l’aplasie. Ces observations indiquent donc que la GCH ne peut pas être en cause.
Il faut noter que les paresthésies et les tremblements ressentis par la patiente ne semblent pas être associés à une toxicité de la vancomycine. En effet, la concentration plasmatique de vancomycine au creux précédant la troisième dose était sous-thérapeutique (taux de 7,6 mg/l, par rapport à la valeur cible de 15 à 20 mg/l). Aucun autre dosage n’a été effectué pendant le traitement. La dose de 1 gramme de vancomycine toutes les huit heures correspond à la dose habituelle de départ utilisée dans l’unité d’hématologie pour les patients dont l’âge est égal ou inférieur à 60 ans, d’après une étude de pharmacocinétique de la vancomycine réalisée dans cette population24.
Enfin, l’apparition et la disparition des effets indésirables coïncident aussi bien avec le moment d’administration de la vancomycine qu’avec la durée du traitement. Ces effets indésirables ont débuté une heure après l’administration de la première dose de vancomycine intraveineuse et ont disparu le lendemain de l’administration de la dernière dose.
Le syndrome de l’homme rouge est une réaction pseudoallergique caractérisée par des éruptions érythémateuses principalement localisées au visage, au cou, au thorax et aux membres supérieurs. Des atteintes neurologiques peuvent s’ajouter aux manifestations classiques, même si les cas rapportés dans la documentation scientifique sont rares. Le cas clinique présenté fait état du syndrome de l’homme rouge avec paresthésies et tremblements, ayant persisté malgré l’administration d’une prémédication (diphénhydramine, 25 mg par voie intraveineuse) et un ralentissement de la vitesse de perfusion (sur deux heures). L’optimisation des mesures thérapeutiques aurait pu être envisagée, comme l’augmentation de la dose de diphénhydramine intraveineuse à 50 mg, l’ajout d’un anti-H2 ou encore la diminution, une fois de plus, de la vitesse de perfusion. Toutefois, c’est le changement d’antibiotique qui a été préconisé. Ainsi, la vancomycine a été définitivement supprimée et remplacée par la daptomycine.
Ce cas clinique souligne l’importance de la vigilance face à la présence de nouveaux effets indésirables, afin que la prise en charge thérapeutique soit rapide et adéquate. La déclaration de ces effets secondaires rares à Santé Canada est indispensable pour permettre leur description et ainsi les faire connaître.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts actuel ou potentiel en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université de Montréal. Les auteurs en remercient les responsables et les collaborateurs pour leurs commentaires lors de la rédaction de cet article. Une autorisation écrite a été obtenue de ces personnes.
1. Gilbert D, Moellering R, Eliopoulos G, Chambers H, Saag M. The Sanford guide to antimicrobial therapy. 43e éd. Sperryville : Antimicrobial Therapy Inc.; 2013. 236 p.
2. Wallace MR, Mascola JR, Oldfield EC. Red man syndrome: incidence, aetiology and prophylaxis. J Infect Dis 1991;164:1180–5.
3. Healy DP, Sahai JV, Fuller SH, Polk RE. Vancomycin-induced histamine release and ‘red man syndrome’: comparison of 1- and 2-hour infusions. Antimicrob Agents Chemother 1990;34:550–4.

4. Cohen LG, Souney PF, Taylor SJ. Paresthesia and back pain in a patient receiving vancomycin during hemodialysis. Drug Intel Clin Pharm 1988;22:784–5.
5. Benoit L, Gray MH, Sligl WI. Severe tremor due to vancomycin therapy: a case report and literature review. Int J Infect Dis 2012;16:e636–7.
6. Freifeld AG, Bow EJ, Sepkowitz KA, Boeckh MJ, Ito JI, Mullen CA et coll. Clinical Practice Guideline for the Use of Antimicrobial Agents in Neutropenic Patients with Cancer: 2010 Update by the Infectious Diseases Society of America. Clin Infect Dis 2011;52:e56–93.
7. Bédard M, Massicotte A, Prasad S. Manuel sur la pharmacothérapie parentérale. 33e éd. Ottawa : Hôpital d’Ottawa; 2012.
8. Wilson APR. Comparative safety of teicoplanin and vancomycin. Int J Antimicrob Agents 1998;10:143–52.
9. Wazny LD, Daghigh B. Desensitization protocols for vancomycin hypersensitivity. Ann Pharmacother 2001;35:1458–63.
10. Association des pharmaciens du Canada. Compendium des produits et spécialités (e-CPS). Monographie de la vancomycine. [en ligne] http://www.e-therapeutics.ca/ (site visité le 7 juin 2014).
11. Gadot A, Derharoutunian C, Daumont M, Normand I, Roubille R, Galtier H. Allergie croisée aux glycopeptides? À propos d’un cas. Pharmactuel 2005;38:24–8.
12. Myers AL, Gaedigk A, Dai H, James LP, Jones BL, Neville KA. Defining risk factors for red man syndrome in children and adults. Pediatr Infect Dis J 2012;31:464–8.

13. Korman T, Turnidge J, Grayson M. Risk factors for cutaneous reactions associated with intravenous vancomycin. J Antimicrob Chemother 1997;39:371–81.
14. Sivagnanam S, Deleu D. Redman syndrome. Crit Care 2003;7:119–20.

15. Sylvia L. Drug allergy, pseudoallergy and cutaneous disease. Dans : Tisdale J, Miller D. Drug-induced diseases: prevention, detection, and management. 2e éd. Bethesda : American society of health-system pharmacists; 2010:51–97.
16. Naranjo CA, Busto U, Sellers EM, Sandor P, Ruiz I, Roberts E et coll. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther 1981;30:239–45.
17. Renz CL, Thurn JD, Finn HA, Lynch JP, Moss J. Clinical investigations: Antihistamine prophylaxis permits rapid vancomycin infusion. Crit Care Med 1999;27:1732–7.
18. Santé Canada. Base de données en ligne des effets indésirables de Canada Vigilance. [en ligne] http://www.hc-sc.gc.ca/dhp-mps/medeff/data-basdon/index-fra.php (site visité le 7 juin 2014).
19. Micromedex Healthcare Series. Monographie du tacrolimus. Thomson Micromedex, 1974–2014. [en ligne] http://www.thomsonhc.com (site visité le 9 juin 2014).
20. Morgan JC. Drug-induced tremors. Lancet Neurol 2005;4:866–76.
21. Yanik G, Levine JE, Ratanatharathorn V, Dunn R, Ferrara J, Hutchinson RJ. Tacrolimus (FK506) and methotrexate as prophylaxis for acute graft-versus-host disease in pediatric allogeneic stem cell transplantation. Bone Marrow Transplant 2000;26:161–7.
22. Zehnder D, Hoigne R, Neftel KA, Seber R. Painful dysaesthesia with ciprofloxacin. BMJ 1995;311:1204.

23. Filipovich AH, Weidsorf D, Pavletic S, Socie G, Wingard JR, Lee SF et coll. National institues of health consensus development project on criteria for clinical trials in chronic graft-versus-host disease: I. Diagnosis and staging working group report. Biol Blood Marrow Transplant 2005;11:945–55.
24. Brisebois A, Desgroseilliers M, Léger GA, Vadnais B, Savoie M, Bouchard P. Impact of an increased initial dosing of vancomycin on the achievement of pharmacokinetic targets in patients hospitalized in hematology-oncology. Présentation de poster. 53rd Interscience Conference on Antimicrobial Agents and Chemotherapy, Denver, Colorado, 10–13 sept 2013.
PHARMACTUEL, Vol. 48, No. 2, 2015