Fanny Courtemanche1,2, Pharm.D., Béatrice Benoit-Pépin2,3, Pharm.D.
Reçu le 18 septembre 2014: Accepté après révision par les pairs le 27 novembre 2014
Titre : Sequential versus triple therapy for the first-line treatment of Helicobacter pylori: a multicenter, open-label, randomised trial. Lancet 2013;381:205-131.
Commanditaires : L’étude a été financée par le National Taiwan University Hospital et le National Science Council, qui n’ont eu aucun autre rôle à jouer dans l’étude.
Cadre de l’étude : Pourquoi s’intéresser à une étude portant sur le traitement de l’Helicobacter pylori (H. pylori) alors que cette infection est relativement peu fréquente dans les grands centres urbains au Canada2,3? L’argument réside dans le fait que la résistance croissante aux antibiotiques de la bactérie rend son élimination de plus en plus difficile. Alors que la résistance de l’H. pylori au métronidazole semble stable au Canada (environ 20–25 %), la résistance de la bactérie à la clarithromycine a augmenté en flèche, atteignant les 15 % au début des années 20004. Ainsi, des efforts de recherche sont déployés afin de trouver de nouvelles stratégies de traitement. Cependant, peu d’études évaluent de façon adéquate la résistance de cette bactérie aux antibiotiques5. Les initiatives scientifiques dans ce domaine étant peu nombreuses au Canada, les professionnels de la santé doivent se tourner vers la littérature scientifique internationale. Les Taïwanais se sont penchés sur la question en menant la première étude comparant l’efficacité d’une thérapie séquentielle de 10 ou 14 jours à la thérapie triple classique comme traitement de première intention pour l’éradication de l’H. pylori.
Méthode : Il s’agit d’une étude ouverte, contrôlée, multicentrique, avec répartition aléatoire, offrant des analyses en intention de traiter et per protocole. La sélection des participants s’est effectuée dans des services de gastroentérologie de six centres médicaux taïwanais.
Patients : Les patients dont l’âge était égal ou supérieur à 20 ans, souffrant d’une infection à l’H. pylori pouvaient participer à l’étude. Ceux ayant déjà reçu un traitement d’éradication de l’H. pylori, ayant un antécédent de gastrectomie ou ayant utilisé des antibiotiques dans les quatre semaines précédant l’étude en étaient exclus. Les femmes enceintes ou qui allaitaient, les patients ayant un antécédent de réaction allergique aux médicaments à l’étude et ceux ayant un cancer ou une comorbidité importante en étaient également exclus.
Pour être sélectionnés, les patients chez qui on soupçonnait une infection à l’H. pylori devaient obtenir au moins deux résultats positifs aux examens diagnostiques utilisés, soit la culture, l’histologie, la sérologie ou le test rapide à l’uréase. Pour les patients asymptomatiques subissant un dépistage de cancer, la seule exigence pour leur inclusion dans l’étude était un résultat positif au test respiratoire à l’urée marquée au carbone 13 (13C). Pour éviter les interactions entre le test respiratoire à l’urée marquée au 13C et les médicaments réduisant l’acidité gastrique (inhibiteurs de la pompe à proton [IPP] et antagonistes des récepteurs à l’histamine 2 [anti-H2]), le patient devait cesser de prendre ces médicaments au moins deux semaines avant le test diagnostique.
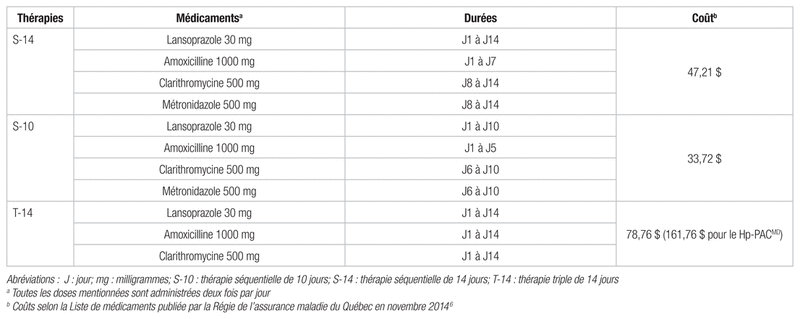
Interventions : Les patients étaient répartis de façon aléatoire dans trois groupes de traitement (voir tableau I) : une thérapie séquentielle de 14 jours (S-14), une thérapie séquentielle de 10 jours (S-10) ou une thérapie triple de 14 jours (T-14).
Tableau I Traitements d’éradication de l’H. pylori utilisés dans l’étude
Une entrevue standardisée à la fin du traitement a permis d’évaluer le degré de tolérance et d’adhésion des patients au traitement. Une période d’au moins six semaines après l’achèvement du traitement devait s’écouler avant que les patients ne subissent un test confirmant l’éradication de la bactérie.
Points évalués : L’objectif primaire évalué était le taux d’éradication de l’H. pylori après le traitement de première intention, déterminé par le test respiratoire à l’urée marquée au 13C. Les objectifs secondaires étaient l’innocuité du traitement et l’adhésion au traitement (définie comme la prise d’au moins 80 % des comprimés). Les patients avaient reçu de l’information sur les effets indésirables communs potentiels et ils étaient tenus de les consigner dans un journal tout au long du traitement.
Pour comparer les groupes de traitement, l’étude a mesuré les covariables suivantes : l’âge, le statut tabagique, la consommation d’alcool, la présence d’ulcère gastroduodénal, l’indice de masse corporelle, le génotypage du cytochrome P450 2C19 (CYP2C19), le génotypage de certaines mutations de l’H. pylori et la résistance aux antibiotiques.
Résultats : Au total, l’étude a sélectionné 900 patients, qu’elle a répartis dans les groupes de traitement (voir figure 1). Le taux d’éradication d’H. pylori en traitement de première intention était supérieur parmi les patients ayant reçu le S-14 par rapport à ceux ayant reçu le T-14 (90,7 % contre 82,3 %, p = 0,003) (voir tableau II). Ainsi, le nombre nécessaire à traiter est 12, c’est-à-dire que seulement 12 personnes doivent être traitées pour éviter un échec au traitement (intervalle de confiance à 95 % [IC 95 %] 7,2–34,5; p = 0,003). Aucune différence statistiquement significative n’a été relevée entre le S-14 et le S-10 (90,7 % contre 87,0 %) et entre le S-10 et le T-14 (87,0 % contre 82,3 %). Aucune différence statistiquement significative n’a été notée entre les trois groupes concernant les effets indésirables ou l’adhésion au traitement.
|
|
||
|
Figure 1 Schéma de l’étude. |
||
Tableau II Efficacité du traitement de première intention pour l’éradication de l’H. pylori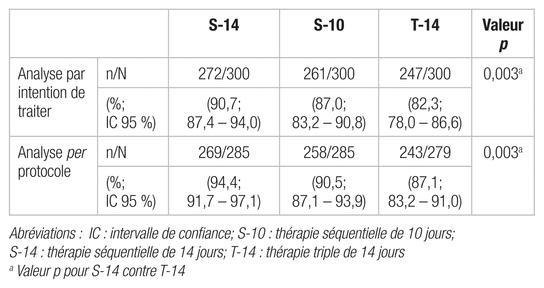
La régression logistique effectuée par les auteurs pour les 552 patients dont les données de sensibilité aux antibiotiques étaient connues a révélé que pour tous les traitements, la résistance à la clarithromycine influençait le taux d’éradication de l’H. pylori et que la résistance au métronidazole affectait plutôt le taux d’éradication associé au S-14 et au S-10. Selon les analyses de sensibilité, le S-14 serait le traitement le plus efficace pour éradiquer l’H. pylori, comparé au S-10 ou au T-14, sauf lorsque les patients habitent dans des régions ayant un faible taux de résistance à la clarithromycine (inférieur à 5 %) et un très haut taux de résistance au métronidazole (supérieur à 80 %). Selon ces mêmes analyses, dans les régions où la résistance au métronidazole est inférieure à 40 %, le S-10 semblerait être plus efficace que le T-14.
Il est légitime de se demander pour quelles raisons l’H. pylori est si difficile à éradiquer : les raisons évoquées incluent notamment la charge bactérienne élevée, la forme dormante de la bactérie et le fait que cette dernière a tendance à se loger à de multiples endroits de l’estomac (dans le mucus, à la surface de l’épithélium ou à l’intérieur des cellules épithéliales)8. Étant donné que l’une des plus importantes variables prédictives de l’échec du traitement de l’H. pylori est la résistance de la bactérie aux antibiotiques, il convient ici d’aborder cette problématique8,9. Le métronidazole est l’antibiotique ayant la plus haute prévalence de résistance10. Cependant, une telle résistance peut partiellement se contrer par une augmentation de la dose du médicament et une prolongation de la durée du traitement8. La résistance à la clarithromycine, quoique de prévalence moindre, demeure problématique puisque de telles stratégies ne permettent pas de la surmonter8. La lévofloxacine, quant à elle, utilisée surtout pour les cas réfractaires, pose le même problème, et le taux de résistance de H. pylori à cet antibiotique augmente rapidement11. La résistance de la bactérie à l’amoxicilline ou à la tétracycline demeure rare en Amérique du Nord et aucune résistance au bismuth n’a été rapportée8,10.
Il existe une théorie qui explique l’efficacité de la thérapie séquentielle. Lors de la première moitié du traitement, l’effet délétère de l’amoxicilline sur la paroi de la bactérie serait mis à contribution. En effet, il empêcherait la synthèse des pompes à efflux, un mécanisme de résistance potentiel contre la clarithromycine9. Cela aurait ainsi pour effet d’améliorer l’efficacité du doublet d’antibiotiques (métronidazole plus clarithromycine) pendant la seconde moitié de la thérapie9,12.
Il est possible à présent de mentionner les forces et les limites de l’étude analysée. La taille de l’échantillon de cette étude était plus importante que celle des autres études dans ce domaine5. La répartition aléatoire a permis d’obtenir trois groupes équilibrés pour la majorité des caractéristiques. Cependant, comme les résultats des tests de sensibilité aux antibiotiques n’étaient connus que pour 61 % des patients, il est difficile de savoir si ce facteur était bien réparti entre les groupes. Malgré une apparente différence entre les groupes en ce qui concerne la proportion de patients métabolisateurs lents, qui semble favoriser l’éradication dans le groupe S-14 (plus de métabolisateurs lents), les analyses montrent que le génotype du CYP2C19 n’a pas eu d’effet sur l’éradication de l’H. pylori. Une méta-analyse a également démontré que le polymorphisme de ce cytochrome n’a pas d’influence sur l’efficacité des thérapies utilisant le lansoprazole13.
Les critères d’exclusion de l’étude étaient peu restrictifs, et la faible proportion de patients exclus de la population source confirme ce fait. Cependant, un des critères d’exclusion n’était pas défini par les auteurs : les patients atteints d’une comorbidité importante. Nous ne savons pas exactement combien de patients ont été exclus pour cette raison, mais il est certain que cela représentait moins de 6 % des patients évalués. Le suivi était d’une durée assez longue, équivalente dans tous les groupes et il y a eu peu de pertes au suivi.
Le choix du comparateur était adéquat. Les médicaments et les doses correspondent à ce qui est recommandé au Canada en traitement de première intention14,15. Cependant, la durée de traitement du comparateur est plus longue que celle recommandée au Canada14. Selon les lignes directrices internationales, le prolongement de 7 à 10 voire à 14 jours de la thérapie triple augmente le taux d’éradication respectivement de 4 % ou de 5–6 %11. Ainsi, le comparateur utilisé dans l’étude serait plus efficace pour l’éradication de l’H. pylori que la pratique actuelle au Canada. Les traitements concomitants permis pendant l’étude n’était pas connus, alors que certains (comme le bismuth) auraient pu avoir un effet sur l’éradication de l’H. pylori.
L’adhésion au traitement semble avoir été bonne au cours de cette étude et similaire pour tous les groupes (environ 96 % des patients ont pris au moins 80 % des comprimés). Cependant, les auteurs ne mentionnent pas la manière dont ils l’ont évaluée. De plus, le conditionnement des comprimés et les conseils donnés aux patients ne sont pas décrits alors qu’ils peuvent avoir une influence sur l’adhésion, particulièrement pour le traitement de l’H. pylori16,17.
Le caractère ouvert de l’étude en représente sa principale limite. Cependant, l’évaluation de l’objectif primaire faisait appel à des tests diagnostiques, ce qui permettait de réduire le biais d’information. Il était adéquat d’utiliser le test respiratoire à l’urée pour déterminer le taux d’éradication de l’H. pylori six semaines après la fin du traitement7,18,19. Les IPP et les anti-H2 ont été retirés au moins deux semaines avant ce test. Cependant, il était impossible de savoir si certains patients avaient pris du bismuth ou des antibiotiques dans les quatre semaines précédant le test d’éradication, ce qui aurait pu causer des faux négatifs et créer ainsi un biais d’information19.
Il est possible que le lecteur se pose les questions suivantes : quelles sont les différences – sur le plan de l’efficacité, de l’innocuité et de l’adhésion au traitement – entre la thérapie séquentielle et la quadruple thérapie à base de bismuth (combinaison d’un IPP, du métronidazole, de la tétracycline et du subsalicyclate de bismuth)? Est-ce qu’une thérapie concomitante, d’apparence plus simple, qui comprend les mêmes médicaments que la thérapie séquentielle, mais administrés simultanément pendant 5 à 10 jours, serait préférable?
Selon une récente méta-analyse comparant l’efficacité des thérapies pour l’éradication de l’H. pylori, la thérapie séquentielle sur 10 jours serait supérieure à la thérapie triple de 7 ou 10 jours, mais elle serait équivalente à la thérapie triple sur 14 jours, à la quadruple thérapie à base de bismuth et à la thérapie concomitante20. Il faut cependant demeurer vigilant vis-à-vis de ces conclusions, puisque les résultats de la plupart des comparaisons ont été combinés, malgré la présence d’hétérogénéité. Bien que le pharmacien canadien soit rarement confronté dans sa pratique à l’H. pylori, on prévoit aujourd’hui que cette bactérie sera de plus en plus difficile à éradiquer avec la thérapie triple de sept à dix jours proposée par les lignes directrices nationales14. Ce phénomène est en partie lié à la résistance du microorganisme à la clarithromycine, à un point tel que la fréquence d’une telle résistance dans une région donnée pourrait guider le choix du traitement initial. En effet, selon les lignes directrices internationales, en présence d’une prévalence supérieure à 20 % de résistance à la clarithromycine il faut considérer d’autres options thérapeutiques, comme la thérapie séquentielle ou la quadruple thérapie, pour réussir à atteindre un taux d’éradication souhaité supérieur à 80 %11,19. Encore faut-il avoir accès à ces données de résistances et que cellesci soient régulièrement mises à jour. Bien que le Canada ne semble pas encore avoir franchi ce cap, il ne faudrait pas s’étonner de voir émerger, d’ici quelques années seulement, d’autres thérapies pour remplacer la thérapie triple4. Une étude est d’ailleurs en cours aux États-Unis pour déterminer l’efficacité de la thérapie séquentielle pour une population nord-américaine21.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université de Montréal. Les auteurs en remercient les responsables et collaborateurs. Une autorisation écrite a été obtenue de ces personnes.
1. Liou JM, Chen CC, Chen MJ, Chen CC, Chang CY, Fang YJ et coll. Sequential versus triple therapy for the first-line treatment of Helicobacter pylori: a multicentre, open-label, randomised trial. Lancet 2013;381:205–13.
2. Goodman K, Jacobson K, Veldhuyzen van Zanten S. Helicobacter pylori infection in Canadian and related Arctic Aboriginal populations. Can J Gastroenterol 2008;22:289–95.

3. Loo VG, Fallone CA, De Souza E, Lavallée J, Barkun AN. In-vitro susceptibility of Helicobacter pylori to ampicillin, clarithromycin, metronidazole and omeprazole. J Antimicrobial Chemother 1997;40:881–3.
4. Morse AL, Goodman KJ, Munday R, Chang H-J, Morse J, Keelan M et coll. A randomized controlled trial comparing sequential with triple therapy for Helicobacter pylori in an Aboriginal community in the Canadian North. Can J Gastroenterol 2013;27:701–6.

5. Yoon H, Lee DH, Kim N, Park YS, Shin CM, Kang KK et coll. Meta-analysis: is sequential therapy superior to standard triple therapy for Helicobacter pylori infection in Asian adults? J Gastroenterol Hepatol 2013;28:1801–9.
6. Régie de l’assurance maladie du Québec. Liste de médicaments, édition d’octobre 2014. [en ligne] http://www.ramq.gouv.qc.ca/ (site visité le 20 novembre 2014).
7. McColl KEL. Helicobacter pylori infection. N Engl J Med. 2010;362:1598–604.
8. Graham DY, Fischbach L. Helicobacter pylori treatment in the era of increasing antibiotic resistance. Gut 2010;59:1143–53.
9. Francesco VD, Zullo A, Hassan C, Giorgio F, Rosania R, Ierardi E. Mechanisms of Helicobacter pylori antibiotic resistance: an updated appraisal. World J Gastrointest Pathophysiol 2011;2:35–41.

10. Wu W, Yang Y, Sun G. Recent insights into antibiotic resistance in Helicobacter pylori eradication. Gastroenterol Res Pract 2012;723183.

11. Malfertheiner P, Megraud F, O’Morain CA, Atherton J, Axon AT, Bazzoli F et coll. Management of Helicobacter pylori infection—the Maastricht IV/Florence consensus report. Gut 2012;61:646–64.
12. De Francesco V, Margiotta M, Zullo A, Hassan C, Troiani L, Burattini O et coll. Clarithromycin-resistant genotypes and eradication of Helicobacter pylori. Ann Intern Med 2006;144:94–100.
13. Padol S, Yuan Y, Thabane M, Padol IT, Hunt RH. The effect of CYP2C19 polymorphisms on H. pylori eradication rate in dual and triple first-line PPI therapies: a meta-analysis. Am J Gastroenterol 2006;101:1467–75.
14. Hunt R, Fallone C, Veldhuyzan van Zanten S, Sherman P, Smaill F, Flook N et coll. Canadian Helicobacter study group consensus conference: update on the management of Helicobacter pylori—an evidence-based evaluation of six topics relevant to clinical outcomes in patients evaluated for H. pylori infection. Can J Gastroenterol 2004;18:547–54.
15. Veldhuyzen van Zanten SJ, Bradette M, Chiba N, Armstrong D, Barkun A, Flook N et coll. Evidence-based recommendations for short- and long-term management of uninvestigated dyspepsia in primary care: an update of the Canadian Dyspepsia Working Group (CanDys) clinical management tool. Can J Gastroenterol 2005;19:285–303.
16. Al-Eidan FA, McElnay JC, Scott MG, McConnell JB. Management of Helicobacter pylori eradication—the influence of structured counselling and follow-up. Br J Clin Pharmacol 2002;53:163–71.

17. Lee M, Kemp JA, Canning A, Egan C, Tataronis G, Farraye FA. A randomized controlled trial of an enhanced patient compliance program for Helicobacter pylori therapy. Arch Intern Med 1999;159:2312–6.
18. Garza-González E, Perez-Perez GI, Maldonado-Garza HJ, Bosques-Padilla FJ. A review of Helicobacter pylori diagnosis, treatment, and methods to detect eradication. World J Gastroenterol 2014;20:1438–49.

19. Chey WD, Wong BC. American college of gastroenterology guideline on the management of Helicobacter pylori infection. Am J Gastroenterol 2007;102:1808–25.
20. Gatta L, Vakil N, Vaira D, Scarpignato C. Global eradication rates for Helicobacter pylori infection systematic review and meta-analysis of sequential therapy. BMJ 2013; 347:f4587.
21. US National Institute of Health. Standard triple therapy vs. sequential therapy in treatment of H. Pylori infection (ClinicalTrials.gov Identifier: NCT01723059). [en ligne] http://clinicaltrials.gov/ct2/show/NCT01723059 (site visité le 22 novembre 2014).
PHARMACTUEL, Vol. 48, No. 1, 2015